Method Article
Ingegneria Cell-permeabile proteine
In questo articolo
Riepilogo
Trasduzione proteina consente la fornitura diretta di proteine biologicamente attive nelle cellule. A differenza dei metodi tradizionali come la transfezione di DNA o di trasduzione virale questo non invasivo consente paradigma altamente efficiente manipolazione cellulare in modo titolabile eludere tossicità cellulare e il rischio di trasformazione oncogena permanente da modificazione genetica.
Abstract
La tecnica di trasduzione proteina consente la fornitura diretta di materiale biologicamente attivo nelle cellule dei mammiferi [per una rassegna vedi 1,2]. Per questo si può fare uso delle capacità translocating dei cosiddetti peptidi cellula penetrando (CPP), designato anche come domini di trasduzione delle proteine (PTDs). La TAT-CPP derivati dal virus dell'immunodeficienza umana di tipo 1 (HIV-1) Tat (trans-attivatore della trascrizione), proteina è stato ampiamente utilizzato. La carica positiva TAT promuove la permeabilità cellulare superando così le barriere della membrana cellulare per endocitosi o / e la penetrazione diretta della membrana 2. In combinazione con un segnale di localizzazione nucleare (NLS), proteine di fusione sono in grado di entrare nel nucleo funzionalità espositiva. La nostra presentazione video dimostra, come esemplificazione per l'ingegneria delle cellule permeabili le proteine, la costruzione, la produzione e l'applicazione di una cellula-permeabile versione del DNA modificanti enzima Cre.
Cre è una ricombinasi sito-specifiche in grado di riconoscere e ricombinare base di 34 siti loxP coppia in cellule di mammifero in vitro e in vivo. Pertanto, il Cre / loxP sistema è ampiamente utilizzato per indurre condizionalmente mutazioni nel genoma delle cellule viventi 3,4. La consegna dei attivo Cre ricombinasi alle cellule, tuttavia, rappresenta una limitazione.
Noi descriviamo il sistema vettore pSESAME, che permette un inserimento diretto del gene d'interesse e offre una piattaforma per clonare rapidamente domini diversi e tag utilizzati all'interno del vettore in maniera comoda e standardizzata. Riorganizzazione dei tag diversi ha dimostrato di modificare le proprietà biochimiche delle proteine di fusione che fornisce la possibilità di ottenere una maggiore resa e una migliore solubilità. Dimostriamo come esprimere e purificare cellule ricombinanti permeanti proteine e da E. coli. La funzionalità della proteina ricombinante Cre è finalmente convalidato nelle cellule in coltura per valutare la sua attività intracellulare ricombinasi.
Protocollo
Costruzione del vettore di espressione e di espressione:
Il pSESAME Cre-vettore di espressione è stato costruito inserendo un frammento di Cre-codifica in pSESAME tramite siti di restrizione AvrII e NheI utilizzando metodi standard di clonazione. pSESAME codifica per una proteina di fusione costituita da una istidina-tag, TAT-dominio, la sequenza NLS e Cre, abbreviato HTNCre. A manifestare HTNCre la pSESAME-Cre è stato trasformato in TUNER (DE3) pLacI e utilizzato per preparare uno stock di glicerolo.
- Un over-notte della cultura è stato inoculato con una punta di pipetta rivestito con batteri trasformati dallo stock glicerolo. La cultura durante la notte consisteva di LB mezzi di comunicazione integrata con 0,5% di glucosio [v / v] e carbenicillina ad una concentrazione finale di 50 mg / ml ed è stato permesso di crescere a 37 ° C per 16 ore.
- Il giorno dopo la densamente cresciuto durante la notte della cultura è stata utilizzata per inoculare la cultura espressione di un rapporto di 1 a 40 e è stato messo in incubatrice a 37 ° C. Cultura espressione consisteva di mezzi TB integrata con 0,5% di glucosio [v / v] e ampicillina ad una concentrazione finale di 100 mg / ml.
- Ad un OD 595 di 1,5 cultura espressione è stata indotta con IPTG 0,5 mm per 1 h.
- Successivamente i batteri sono stati raccolti per centrifugazione a 5000 rpm per 10 minuti in un rotore SLA3000.
- Pellet di batteri sono stati conservati a meno 20 ° C fino alla purificazione.
Purificazione di cellule permeabili proteine:
- Pellet congelato i batteri sono stati risospesi in 10 ml di tampone di lisi per la cultura fiasco litro per 15 minuti a temperatura ambiente.
- Sospensione è stata poi incubate con 1 mg / ml di lisozima per altri 15 minuti, mescolando a temperatura ambiente.
- 25 U / mL benzonasi è stato aggiunto in seguito durante la miscelazione e incubate per 15 minuti a temperatura ambiente.
- Dopo sonicazione in ghiaccio per 1,5 minuti con 0,5 s impulsi al 45% della potenza, 1 mL di tampone a freddo sale tartarico (TSB) per mL sospensione è stata accuratamente aggiunto durante la miscelazione e incubate per 5 minuti sul ghiaccio. SDS-PAGE campione della frazione lisato (L) è stata presa.
- Lisato eliminato è stato ottenuto per centrifugazione a 4 ° C per 30 minuti a 30.000 g. SDS-PAGE di campioni delle frazioni solubili (S) e insolubili (I) sono state prese.
- Il surnatante è stato trasferito in fresco 50 ml tubi falco e ° C con 2 ml di 50% Ni-NTA liquami per ogni litro di cultura espressione iniziale. Fu poi delicatamente mescolata per 1 ora a 4
- La sospensione è confezionato in una colonna di flusso per gravità EconoPac (SDS-PAGE campione di flow-through frazione (FT) è stata scattata) e lavato due volte con 5 posti letto-volumi di tampone di lavaggio. SDS-PAGE di campioni di entrambe le frazioni di lavaggio (W1 & W2) sono stati raccolti.
- HTNCre contenenti frazioni sono stati eluiti con 3 letto volumi di tampone di eluizione del campione e della frazione di eluato (E) per SDS-PAGE analisi è stata presa.
- Imidazolo è stato rimosso dalla dialisi frazione contro il buffer di eluizione di sale due volte.
- La soluzione proteica è stata ulteriormente concentrata da dialisi contro tampone glicerolo due volte. In tutte le fasi dialisi il rapporto del buffer da campione è stato di almeno 50. Questa procedura ha portato a una soluzione madre contenente HTNCre glicerolo ad una concentrazione al solito tra i 200 e 450 micron, cioè 1 litro di cultura espressione si tradurrà in ~ 12 mg di proteina. Esempio di magazzino glicerolo (GS) per SDS-PAGE analisi sono stati raccolti. Soluzione madre HTNCre può essere conservata a meno 20 ° C.
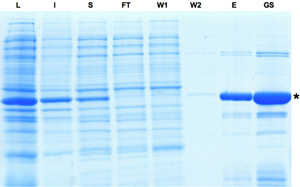
Figura 1: SDS-PAGE analisi dei campioni raccolti durante il processo di purificazione della Cre ricombinasi. Induzione di espressione Cre è indicato da banda dominante in frazione lisato. Anche se una parte della proteina è insolubile la proteina Cre può essere ulteriormente arricchito, come visto in eluato e frazioni magazzino glicerolo. L: lisato, I: Insolubile, S: supernatante, FT: flow-through, W: lavaggio, E: eluato, GS: Stock Gylcerol. Si prega di cliccare qui per vedere una versione più grande della figura 1.
Trasduzione di proteine in staminali embrionali murine (ES), le cellule:
- Cellule ES portando un condizionale β-galattosidasi giornalista 5 costruire sono state seminate come singole cellule utilizzando TrypLE ™ Express per la dissociazione di cellule aderenti. Dopo 4 a 6 ore le cellule avevano nuovamente attaccati e il mezzo è stato rimosso.
- Successivamente le cellule ES sono state incubate con HTNCre contenenti media per 16 ore.
- Una quantità adeguata di proteine HTNCre (corrispondenti a 10 micron) fuori dello stock glicerolo è stato diluito in media ES e successivamente filtrato sterile (0,22 micron).
- Dopo trasduzione medio di proteine è stato cambiato di nuovo a mezzo di crescita normale.
- Dopo due giorni le cellule sono state lavate con PBS e fissate con 4% paraformaldeide (PFA) per 10 minuti.
- Due ulteriorizionale fasi di lavaggio con PBS sono stati eseguiti prima di X-Gal colorazione è stata eseguita.
- Cellule fissate sono state coperte con uno strato di X-Gal soluzione colorante 6 e incubate per tutta la notte a 37 ° C.
Rappresentante dei risultati:
Giorno dopo X-Gal è stato aspirato soluzione colorante e le cellule sono state coperte da uno strato di PBS per l'analisi di microscopia. Dall'80 al 100% delle cellule ricombinano potrebbe essere osservate entro le cellule staminali embrionali murine giudicati da β-galattosidasi.
Discussione
Durante il processo di purificazione della proteina di fusione Cre è importante non tralasciare l'aggiunta di buffer di ghiaccio freddo TBS prima centrifugazione. Altrimenti Cre ricombinasi tende a precipitare all'interno del buffer glicerolo.
Se la frazione eluato sembra diventare torbido a causa della concentrazione di buffer di eluizione delle proteine di fusione, aggiungere fino a quando la soluzione ha eliminato di nuovo.
L'applicazione di 10 mM di proteina di fusione Cre risultati in genere in un efficienza ricombinazione tra 80 e 100%. Di siero fetale bovino (FCS) è un componente importante della media delle cellule ES inibisce fortemente trasduzione delle proteine. Pertanto alta concentrazione di Cre ricombinasi doveva essere usato. Quando si lavora nel siero senza condizioni meno proteine (0,5-2 mM) può essere utilizzato per ottenere efficienze ricombinazione simili.
Con il sistema vettoriale pSESAME a portata di mano si può applicare la tecnica di trasduzione di proteine ad altre proteine tra cui fattori di trascrizione come Oct4 e Sox2 Scl/Tal1 7 e 8.
Riconoscimenti
Ringraziamo Oliver Brüstle e tutti i membri del Gruppo Engineering Cellule Staminali, Università di Bonn, per il supporto e discussioni importanti. Ringraziamo Sabine Schenk per la preparazione di SDS-PAGE e supporto duraturo in tutto il progetto. Nicole Russ e Magerhans Anna fornito un eccellente supporto tecnico. Inoltre, vorremmo ringraziare Andreas Bär e Mertens Sheila per la produzione del film. Questo lavoro è stato supportato anche da finanziamenti della Fondazione Volkswagen (Az I/77864) e dal Ministero tedesco dell'Istruzione e della Ricerca (BMBF, 01 GN 0813).
Materiali
| Name | Company | Catalog Number | Comments |
| TUNER (DE3) pLacI | Novagen, EMD Millipore | 70625 | |
| Glycerol | Carl Roth GmbH | 3783.2 | |
| Na2HPO4 | Carl Roth Gmbh | T876.1 | |
| Trizma Base | Sigma-Aldrich | T1503 | |
| HCl | Carl Roth Gmbh | 4625.1 | |
| Imidazol | Carl Roth Gmbh | X998.4 | |
| NaCl | Carl Roth Gmbh | 9265.2 | |
| Yeast Extract | Carl Roth Gmbh | 2363.4 | |
| Trypton/Pepton | Carl Roth Gmbh | 8952.4 | |
| K2HPO4 | Carl Roth Gmbh | P749.2 | |
| KH2PO4 | Carl Roth Gmbh | 3904.1 | |
| Ampicillin | Sigma-Aldrich | A9518 | |
| Carbenicillin | Sigma-Aldrich | 6344.2 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Lysozyme | Sigma-Aldrich | 62971 | |
| Benzonase | Novagen, EMD Millipore | ||
| L-Tartaric acid, disodium salt | Sigma-Aldrich | ||
| 50% Ni-NTA slurry | Invitrogen | R901-15 | |
| EconoPac columns | Bio-Rad | 732-1010 | |
| Sterile filter 0,22μm | Whatman, GE Healthcare | ||
| Paraformaldehyde (PFA) | Sigma-Aldrich | ||
| LB medium | Yeast extract, Trypton/Pepton, NaCl | ||
| TB medium | Yeast extract, Trypton/Pepton, Glycerol, K2HPO4, KH2PO4 | ||
| Lysis Buffer | 50 mM Na2HPO4, 5 mM Tris, pH 7.8 | ||
| Tartaric Salt Buffer (TSB) | PTB containing 2 M L-Tartaric acid, disodium salt, and 20 mM Imidazol | ||
| Washing Buffer | PTB, 500 mM NaCl, 15 mM Imidazol | ||
| Elution Buffer | PTB, 500 mM NaCl, 250 mM Imidazol | ||
| High Salt Buffer | 600 mM NaCl, 20 mM HEPES, pH 7.4 | ||
| Gylcerol Buffer | 50% glycerol, 500 mM NaCl, 20 mM HEPES, pH 7.4 | ||
| TrypLE™ Express | Invitrogen | ||
| ESGRO (LIF) | EMD Millipore | ||
| NEAA | GIBCO, by Life Technologies | 11140035 | |
| L-Glutamin | GIBCO, by Life Technologies | 25030024 | |
| β-Mercapt–thanol | GIBCO, by Life Technologies | 31350010 | |
| DMEM | GIBCO, by Life Technologies | 11960044 | |
| PBS | GIBCO, by Life Technologies | ||
| Fetal Calf Serum (FCS) | PAA Laboratories | ||
| X-Gal staining solution: | 4 mM K3(FeIII(CN)6), 4 mM K4(FeII(CN)6), 2mM MgCl2 0.4 mg/mL X-Gal solved in PBS | ||
| K3(FeIII(CN)6) | Sigma-Aldrich | P-3367 | |
| K4 (FeII(CN)6) | Sigma-Aldrich | P-9387 | |
| MgCl2 | Sigma-Aldrich | M8266 | |
| X-Gal | Sigma-Aldrich | B4252 |
Riferimenti
- Gump, J. M., Dowdy, S. F. TAT transduction: the molecular mechanism and therapeutic prospects. Trends Mol Med. 13 (10), 443-448 (2007).
- Edenhofer, F. Protein transduction revisited: novel insights into the mechanism underlying intracellular delivery of proteins. Curr Pharm Des. 14 (34), 3628-3636 (2008).
- Branda, C. S., Dymecki, S. M. Talking about a revolution: The impact of site-specific recombinases on genetic analyses in mice. Dev Cell. 6 (1), 7-28 (2004).
- Nolden, L. Site-specific recombination in human embryonic stem cells induced by cell-permeant Cre recombinase. Nat Methods. 3 (6), 461-467 (2006).
- Zhang, Y. Inducible site-directed recombination in mouse embryonic stem cells. Nucleic Acids Res. 24 (4), 543-548 (1996).
- Peitz, M. Enhanced purification of cell-permeant Cre and germline transmission after transduction into mouse embryonic stem cells. Genesis. 45 (8), 508-517 (2007).
- Bosnali, M., Edenhofer, F. Generation of transducible versions of transcription factors Oct4 and Sox2. Biol Chem. 389 (7), 851-861 (2008).
- Landry, J. R. Runx genes are direct targets of Scl/Tal1 in the yolk sac and fetal liver. Blood. 111 (6), 3005-3014 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon