Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Medición de proteína de la membrana de plasma tarifas endocítica por biotinilación reversible
Resumen
Endocitosis regulado regula los niveles de expresión de la superficie celular de la mayoría de las proteínas de la membrana. Aquí se utilizan los reactivos reducible, la membrana impermeant biotinilación para medir la tasa de endocitosis del transportador de dopamina (DAT), una proteína de membrana politópica. El método facilita un método directo para medir la tasa de endocitosis de la mayoría de las proteínas de la membrana plasmática.
Resumen
Las proteínas de la membrana plasmática son un grupo grande y diverso de proteínas formado por los receptores, canales iónicos, transportadores y bombas. Actividad de estas proteínas es responsable de una variedad de importantes eventos celulares, incluyendo la entrega de nutrientes, la excitabilidad celular, y las señales químicas. Muchas proteínas de la membrana plasmática se regula de forma dinámica por el tráfico endocítica, que modula la función de proteínas mediante la alteración de la expresión de proteínas de la superficie. Los mecanismos que facilitan la endocitosis de proteínas son complejos y no son totalmente entendido por muchas proteínas de la membrana. Con el fin de entender completamente los mecanismos que controlan el tráfico endocítica de una proteína, es fundamental que la tasa de endocitosis de la proteína s medirse con precisión. Para muchos receptores, mediciones directas de la tasa de endocitosis son con frecuencia logra utilizando la etiqueta ligandos del receptor. Sin embargo, para muchas clases de proteínas de la membrana, como los transportistas, las bombas y los canales de iones, no hay ligando conveniente que puede ser usado para medir la tasa de endocitosis. En el presente informe, se describe un método reversible biotinilación que empleamos para medir el transportador de dopamina (DAT) Tasa de endocítica. Este método proporciona un método directo para medir las tasas de internalización, y puede ser fácilmente empleados para los estudios de tráfico de proteínas de membrana de la mayoría.
Protocolo
Descripción general del procedimiento:
Con este enfoque, proteínas de superficie celular son covalentemente marcado con biotina de disposición de residuos de lisina extracelular utilizando un impermeant membrana, disulfuro de acoplamiento reactivo biotinilación (sulfo-NHS-SS-biotina) en el tráfico de condiciones restrictivas (temperatura baja) (ver Fig. 1. por ejemplo). Un conjunto de células se desplaza a la trata de condiciones permisivas (37 ° C) e internalizar las proteínas con biotina. El otro conjunto de células se mantienen a baja temperatura, como los controles para: 1) la proteína de la superficie total en el momento = 0, y 2) el control de extracción. Después de un corto período de interiorización, las células se desplazan de nuevo a baja temperatura para detener la internalización, y cualquier biotina superficie residual se elimina mediante el tratamiento de células con un agente reductor, que rompe la biotina disulfuro de acoplamiento. Proteínas con biotina que surgió de la superficie celular y se internaliza están protegidos de la etapa de extracción, y será la única proteínas con biotina que quedan. Después de la lisis celular, proteínas con biotina se encuentran aisladas por estreptavidina cromatografía de afinidad y la proteína de interés se detectaron por inmunotransferencia cuantitativa. Para determinar la tasa de endocitosis, la cantidad de proteína es internalizada en comparación con el control total de la superficie de la etiqueta en el tiempo = 0. Hemos utilizado con éxito este método para medir la tasa de internalización de la norepinefrina y la dopamina neuronal 1 transportistas 1-4.
Protocolo detallado:
Día 1:
- Células de la placa en 6 y placas de tal manera que se confluente ~ 80% en el Día 2. Por otra parte, si las células transfectadas se están utilizando, transfectar a una densidad tal que van a ser confluentes ~ 80% en el momento se mide la tasa de internalización. Si las células no están fuertemente adheridas, artículos de cultivo de tejidos deben ser tratados con un sustrato de adhesión celular (por ejemplo, poli-D-lisina) para evitar la pérdida de células durante las etapas de lavado extenso.
- Para cada proteína está probando, 2 pozos de la placa en una placa para ser utilizado como la proteína de la superficie total (t = 0) y los controles de extracción. En una segunda placa, la placa de un bien para cada condición de internalización se está probando (es decir, la tasa basal endocítica vs tratadas con el medicamento).
- Prepare las siguientes soluciones y almacenar en las temperaturas indicadas para su uso en el Día 2:
- PBS 2 +: tampón fosfato salino (pH 7,4) suplementado con 1,5 mM de MgCl 2, 0,2 mM CaCl 2, (4 ° C)
- Biotinilación Quench Solución: 2 + PBS suplementado con 100 mM glicina, (4 ° C)
- NT búfer: 150 mM NaCl, 1,0 mM EDTA, 0,2% BSA, 20 mM Tris, pH 8.6, (4 ° C)
- RIPA buffer: 10 mM Tris, pH 7,4, 150 mM NaCl, 1,0 mM EDTA, SDS 0,1%, 1,0% Triton X 100, 1,0% de desoxicolato de sodio, (4 ° C)
- Sulfo-NHS-SS-biotina acciones: Se disuelven en dimetilsulfóxido (DMSO) a 200 mg / ml, (-20 ° C)
- Tris (2-carboxietil) Clorhidrato de fosfina (TCEP) Solución: 500 mm de H 2 O, (-20 ° C, cubierto de papel de aluminio para bloquear la luz)
Día 2:
- Prepare 2 + PBS suplementado con glucosa 0.18g/ml, el 0,2% de IgG / proteasa libre de albúmina de suero bovino (PBS 2 + / g / BSA). Pre-caliente esta solución a 37 ° C en un baño de agua.
- Descongelar la solución madre sulfo-NHS-SS-biotina en la parte superior del banco para fundir el DMSO. Inmediatamente antes de su uso, preparar nuevas sulfo-NHS-SS-biotina solución (2,5 mg / ml en PBS enfriado con hielo 2 +, suficiente para 0,75 ml / pocillo). Vortex vigorosamente la solución para solubilizar el DMSO. Tenga en cuenta que el reactivo NHS-biotina se hidroliza fácilmente en solución acuosa. Por lo tanto, todas las soluciones deben prepararse inmediatamente antes de su uso.
- Biotinilación: Coloque las placas en un baño de hielo en la cámara frigorífica y enjuague 3 x 2 ml con PBS enfriado con hielo 2 +. Asegúrese de que las placas son ligeramente inclinada para permitir el drenaje completo y la eliminación de la solución tampón. Añadir 0,75 ml / pocillo de la nueva sulfo-NHS-SS-biotina a cada pocillo. Incubar x 15 ', 4 ° C en el baño de hielo con agitación vigorosa. Después de la incubación, preparar otra nueva sulfo-NHS-SS-biotina solución. Reemplazar la antigua solución con la solución fresca e incubar x '15, 4 ° C.
- Enfriamiento: Es fundamental que todos los que no reaccionan NHS-biotina moléculas se apaga, por lo que no va a reaccionar con las proteínas intracelulares y biotinylate vez que las células se lisan. Lavar las células 3 x 2 ml con una solución de enfriamiento y se incuba dos veces en 2 ml de solución de enfriamiento x 15 ", 4 ° C con agitación suave.
- Internalización: Si los tratamientos de drogas están siendo probadas, añadir la concentración del fármaco apropiado para PBS 2 + / g / BSA. Mantenga el control de la placa a 4 ° C y llevar la placa de la internalización de la cámara frigorífica. Lavar 3 x 2 ml con pre-calentado PBS 2 + / g / BSA (+ / - drUGS) y dejar en las mismas soluciones (2 ml / pocillo). Rellene los pocillos vacíos con pre-calentado solución para asegurar una temperatura de toda la placa. Transferencia de las células a una incubadora a 37 ° C durante 10 '. Inmediatamente antes de la final de 37 ° C de incubación, preparar nuevas soluciones 50 mM en tampón TCEP NT que se utilizará para el paso extracción y almacenamiento en hielo. Prepare la cantidad suficiente para 1,0 ml / pocillo.
- Stripping: Inmediatamente placa de transferencia (s) de baño de hielo y volver a la cámara frigorífica. Lavarse rápidamente las células con helada NT buffer, 3 x 2 ml para detener la endocitosis. También lave las tiras de control de los pozos de 3 x 2 ml con tampón NT. Añadir 1,0 ml de solución fresca despojar a cada pocillo. Incubar en hielo, 15, 4 ° C con agitación suave. Vuelva a colocar los pozos con solución removedora fresco e incubar otros 15 ", 4 ° C en hielo.
- Lisis: Lave todos los pozos que fueron expuestos a la solución de extracción, 3 x 2 ml NT buffer. A continuación, lavar los pocillos (incluidos los controles en total) con 3 x 2 ml de PBS 2 +. Lisis en 300μl/well RIPA buffer (buffer de lisis o otros compatibles con la proteína de interés) que contienen inhibidores de la proteasa fresca (1,0 mM PMSF, 1,0 mg / ml leupeptina, aprotinina y pepstatina). Lyse agitando x 20 ", 4 ° C. Transferencia a los tubos de microcentrífuga y los restos celulares por centrifugación claro 18.000 xg, 10, 4 ° C.
- Determinación de concentración de proteínas: Utilice un ensayo de la proteína compatible con sus condiciones de lisis (por ejemplo, ensayo de proteínas DC, Bio-Rad) para determinar la concentración de proteínas de los lisados en comparación con un estándar de la curva de BSA.
- Estreptavidina cromatografía de afinidad: los tubitos de microcentrífuga con cantidades equivalentes de proteína para cada muestra. Añadir tampón de lisis para llevar el volumen final de cada muestra de 200μl. Vortex la estreptavidina perlas de agarosa con fuerza para llevar a una suspensión uniforme. Utilizando una pipeta 200μl con la punta cortada, cuentas de pipeta en cada tubo. Recomendado 20μl beads/50 lisado mg. Incubar toda la noche, 4 ° C en un rotor de tubo.
Día 3:
- Lavado de esferas: las muestras de centrífuga, 18.000 xg, 2 'para recoger perlas. Aspirar de lisado, teniendo cuidado de no acercarse a bolas de pellets con aspirador. Utilice una punta de pipeta de plástico en el extremo del aspirador para un mejor control. Añadir 0,75 ml de solución amortiguadora de lisis a cada tubo y agitar para lavar cuentas. Centrifugue las muestras, 18.000 xg, 2 'para recoger los granos y repetir la aspiración y lavado dos veces (tres lavados en total). Después del último lavado, aspirado, como gran parte de la memoria intermedia como sea posible sin perturbar el precipitado de cuentas. De inflexión de la trompa hacia el aspirador ayuda con este paso.
- Elución de la muestra: Agregar 20-25μl 2x tampón de muestra Laemmli (reducir) a cada tubo. El agente reductor se unirá el enlace disulfuro NHS-SS-biotina, la liberación de las proteínas aisladas en la solución. La mayoría de las proteínas de membrana son muy vulnerables a la agregación cuando se hierve, y no debe ser calentado antes de ser cargados en geles de SDS-PAGE. Determinar la sensibilidad al calor de la proteína de interés antes de realizar estos experimentos. Si la proteína no puede tolerar el calor de ebullición /, se incuban en un rotor, 30 ', la temperatura ambiente antes de su análisis por SDS-PAGE. Esto es suficiente para romper los enlaces disulfuro y eluir las proteínas.
- SDS-PAGE e inmunoblotting: proteínas separadas por SDS-PAGE. Para cada muestra, lo más fácil es ejecutar los ejemplos en el siguiente orden: la superficie total (tiempo = 0), la tira, la condición internalización # 1, Condición # 2, etc transferencia a la membrana de inmunotransferencia y borrar con el anticuerpo adecuado para su proteína de interés. La captura de bandas inmunorreactivas mediante un sistema de gel CCD de la cámara de documentación, con la certeza de que no hay píxeles saturados. Cuantificar la densidad de cada banda utilizando gel de análisis / densitometría software.
Los resultados representativos:
Un resultado inmunoblot representativo se muestra en la Figura 2A. La señal más fuerte es en el "total" de carril (T), que es la cantidad total de proteína de la superficie antes de la internalización. La "tira" de control (S), debe cerca de blanco, lo que demuestra que la banda era eficiente para el experimento. La eficiencia de banda se calcula mediante la comparación de la densidad de la "tira" de carril a la de la "total" de carril (por ejemplo, proteínas que se biotinilado en paralelo con la banda, pero no se calentó a 37 ° C, ni expuestos a la solución de extracción). La siguiente fórmula se utiliza:
[1 - (tira / total)] * 100%
Utilizando esta fórmula, la tira en la Figura 2 fue del 99,8% de eficiencia. Finalmente, podrás ver las bandas de menor intensidad que el total en el carril de la internalización (s) (I). En el ejemplo (Figura 2), las células tratadas fueron tratados con vehículo o con 1μM acetato de forbol miristato (PMA) en un 10 'tasas de internalización de la internalización y el transportador de dopamina se midieron en un 10' período de internalización inicial. La tasa se calcula como la internalizaciónsiguiente manera:
internalizado / total * 100
Como se observa en la Figura 2B, el 10,4% de la superficie DAT interiorizado más de 10 'en los vehículos tratados con condiciones. PMA tratamiento aumentó las tasas de DAT internalización al 23,2% de la superficie total de DAT.
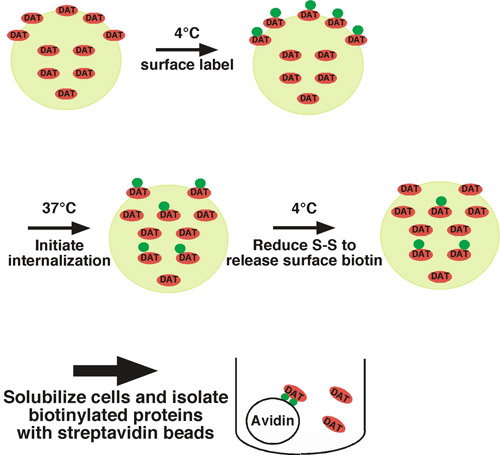
Figura 1. Las células ilustración protocolo. Biotina son a 4 ° C para marcar exclusivamente la población de la superficie, y se desplazan a 37 ° C para iniciar la internalización. Después de la internalización, las células se enfría rápidamente para detener los procesos de endocitosis y la biotina superficie residual es eliminado por el tratamiento de células con un agente reductor. Las proteínas sólo con biotina que permanecen son aquellos que surgieron desde la superficie en t = 0 y se internaliza, lo cual les protege del tratamiento de extracción. Proteínas con biotina se encuentran aisladas por cromatografía de afinidad por lotes con cuentas estreptavidina y la proteína de interés se detectaron por inmunotransferencia.
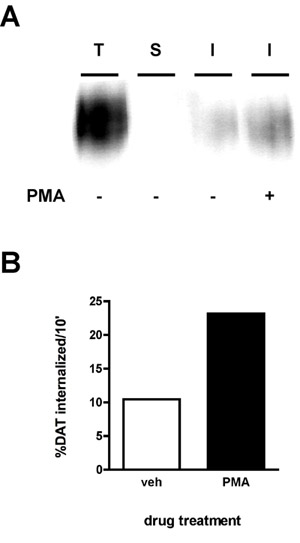
Figura 2. Activación de la PKC aumenta la tasa de DAT endocítica. Internalización de ensayo. PC12 células que expresan establemente DAT se biotina, 4 ° C como se describe en "protocolo detallado". Las células se calienta rápidamente a 37 ° C ± 1 M y se incubaron PMA "10, 37 ° C. Biotina residual fue despojado por la reducción, las células fueron lisadas y las proteínas con biotina se aislaron por cromatografía de afinidad estreptavidina. (A) inmunoblot Representante mostrando DAT superficie total en t = 0 (T), tira de control (S), e internalizado DAT (I) en las condiciones indicadas. (B) Las bandas fueron capturadas con una cámara CCD y se cuantifica con la cantidad de datos de software (Bio-Rad). Los datos se expresan como% total min DAT internalized/10.
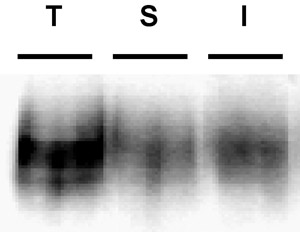
Figura 3. Inmunoblot ejemplo que representa una mala banda de biotina. Internalización de ensayo. PC12 células que expresan establemente DAT se biotina, 4 ° C como se describe en "protocolo detallado". Las células se calienta rápidamente a 37 ° C y se incubaron '10, 37 ° C. Biotina residual fue despojado por la reducción, las células fueron lisadas y las proteínas con biotina se aislaron por cromatografía de afinidad estreptavidina. La inmunotransferencia muestra DAT superficie total en t = 0 (T), tira de control (S), e internalizado DAT (I). Nota de la banda visible en el carril de la tira de control, lo que indica la eficiencia de la tira pobres.
Discusión
Los problemas más comunes: El problema más común que surge en estos experimentos es la eficiencia tira pobres. La eficiencia de la tira es fundamental para poder interpretar los resultados. A menos que la tira fue muy eficiente, no es posible concluir que todas las proteínas con biotina en los carriles de interiorización, de hecho, interiorizado de la superficie. Tiras de la eficiencia ≥ 90% son óptimas, y descartamos cualquier resultado si la tira cae por debajo de este nivel. Un ejemplo de una banda de ...
Agradecimientos
Este trabajo fue financiado por el NIH subvención # DA15169 de HEM
Referencias
- Holton, K. L., Loder, M. K., Melikian, H. E. Nonclassical distinct endocytic signals dictate constitutive and PKC-regulated neurotransmitter transporter internalization. Nat Neurosci. 8, 881-888 (2005).
- Boudanova, E., Navaroli, D. M., Melikian, H. E. Amphetamine-induced decreases in dopamine transporter surface expression are protein kinase C-independent. Neuropharmacology. 54, 605-612 (2008).
- Boudanova, E., Navaroli, D. M., Stevens, Z., Melikian, H. E. Dopamine transporter endocytic determinants: carboxy terminal residues critical for basal and PKC-stimulated internalization. Mol Cell Neurosci. 39, 211-217 (2008).
- Loder, M. K., Melikian, H. E. The dopamine transporter constitutively internalizes and recycles in a protein kinase C-regulated manner in stably transfected PC12 cell lines. J Biol Chem. 278, 22168-22174 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados