Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesure du taux plasmatique des protéines membranaires par endocytique Biotinylation réversible
Dans cet article
Résumé
Endocytose régulée régit les niveaux de surface des cellules d'expression de la majorité des protéines membranaires. Ici, nous utilisons réductible, réactifs à membrane biotinylation imperméants pour mesurer le taux d'endocytose du transporteur de la dopamine (DAT), une protéine membranaire polytopique. La méthode facilite une approche simple pour mesurer le taux d'endocytose de la plupart des protéines de la membrane plasmique.
Résumé
Protéines membranaires sont d'un grand groupe diversifié de protéines composé de récepteurs, canaux ioniques, les transporteurs et les pompes. Activité de ces protéines est responsable d'une variété de clés des événements cellulaires, y compris la livraison des nutriments, l'excitabilité cellulaire, et la signalisation chimique. Beaucoup de protéines membranaires sont réglementés de façon dynamique par le trafic endocytaire, qui module la fonction des protéines en modifiant l'expression des protéines de surface. Les mécanismes qui facilitent l'endocytose des protéines sont complexes et ne sont pas pleinement compris pour des protéines membranaires nombreuses. Afin de bien comprendre les mécanismes qui contrôlent le trafic endocytaire d'une protéine donnée, il est essentiel que le taux de la protéine S endocytose être mesurés avec précision. Pour de nombreux récepteurs, des mesures directes de taux d'endocytose sont souvent obtenus en utilisant des ligands de récepteurs marqués. Cependant, pour plusieurs classes de protéines membranaires, comme les transporteurs, les pompes et les canaux ioniques, il n'ya pas de ligand pratique qui peut être utilisé pour mesurer le taux d'endocytose. Dans le présent rapport, nous décrivons une méthode biotinylation réversibles que nous utilisons pour mesurer le transporteur de la dopamine (DAT) Taux endocytose. Cette méthode offre une approche simple pour mesurer les taux d'internalisation, et peut facilement être employée pour des études de trafic plupart des protéines membranaires.
Protocole
Présentation de la procédure:
En utilisant cette approche, protéines de surface cellulaire sont marqués à la biotine de façon covalente sur les résidus lysine disponibles extracellulaire en utilisant une membrane imperméants, réactif biotinylation disulfure couplé (sulfo-NHS-SS-biotine) sous des conditions restrictives du trafic (c'est à dire à basse température) (voir Fig 1. pour l'illustration). Un ensemble de cellules est déplacé à la traite des conditions permissives (37 ° C) et des protéines biotinylées intérioriser. L'autre série de cellules sont maintenus à basse température que les contrôles pour 1) la protéine de surface totale au temps = 0, et 2) le contrôle de décapage. Après une courte période d'internalisation, les cellules sont décalées de retour à basse température pour arrêter l'internalisation, et tout biotine résiduelle de surface est enlevé en traitant les cellules avec un agent réducteur, qui clive la biotine couplée disulfure. Protéines biotinylées qui découlent de la surface cellulaire et ont été intériorisées sont protégés de l'étape d'extraction, et seront les seules protéines biotinylées qui restent. Après la lyse des cellules, des protéines biotinylées sont isolés par chromatographie d'affinité et la streptavidine la protéine d'intérêt est détectée par immunoblot quantitatif. Pour déterminer le taux d'endocytose, la quantité de protéines intériorisées est comparée à la surface totale de contrôle étiquetés au temps = 0. Nous avons utilisé avec succès cette approche pour mesurer le taux d'internalisation de la noradrénaline et la dopamine neuronale 1 1-4 transporteurs.
Protocole détaillé:
Jour 1:
- Cellules de la plaque en plaque de 6 puits de telle sorte qu'ils seront confluentes à 80% le jour 2. Alternativement, si les cellules transfectées sont utilisées, transfecter à une densité telle qu'ils seront confluentes ~ 80% à la fois le taux d'internalisation seront mesurés. Si les cellules ne sont pas fortement adhérente, articles de culture de tissus doivent être traitées avec un substrat d'adhésion cellulaire (par exemple, la poly-D-lysine) pour prévenir la perte cellulaire durant les étapes de lavage extensif.
- Pour chaque protéine testée, plaque 2 puits sur une plaque à être utilisé comme la protéine de surface totale (t = 0) et les commandes de décapage. Sur une seconde plaque, la plaque d'un puits pour chaque condition de l'internalisation testé (ie taux basal endocytose vs traités par le médicament).
- Préparer les solutions suivantes et conserver à la température indiquée pour une utilisation sur Jour 2:
- PBS 2 +: tampon phosphate salin (pH 7,4) additionné de 1,5 mM de MgCl2, 0,2 mM CaCl 2, (4 ° C)
- Biotinylation Quench Solution: 2 + PBS supplémenté avec 100 mM de glycine, (4 ° C)
- NT tampon: NaCl 150 mM, 1,0 mM EDTA, 0,2% de BSA, Tris 20 mM, pH 8,6, (4 ° C)
- Tampon RIPA: Tris 10 mM, pH 7,4, NaCl 150 mM, 1,0 mM EDTA, 0,1% SDS, 1,0% de Triton X 100, le désoxycholate de sodium 1,0%, (4 ° C)
- Solution stock sulfo-NHS-SS-biotine: Dissoudre dans du diméthylsulfoxyde (DMSO) à 200 mg / ml, (-20 ° C)
- Tris (2-carboxyéthyl) phosphine Hydrochloride solution mère (PTCE): 500 mm H 2 O, (-20 ° C, couvert de papier d'aluminium pour bloquer la lumière)
Jour 2:
- Préparer PBS 2 + supplémenté en glucose 0.18g/ml, 0,2% d'IgG / protéase sans sérum albumine bovine (PBS + 2 / g / BSA). Préchauffer cette solution à 37 ° C au bain-marie.
- Dégeler la solution stock sulfo-NHS-SS-biotine sur la paillasse pour faire fondre le DMSO. Immédiatement avant utilisation, préparer fraîche sulfo-NHS-SS-biotine solution (2,5 mg / ml dans PBS glacé 2 +, suffisante pour 0,75 ml / puits). Vortex la solution vigoureusement pour solubiliser le DMSO. Notez que le réactif NHS-biotine est facilement hydrolysé en solution aqueuse. Par conséquent, toutes les solutions doivent être préparées immédiatement avant leur utilisation.
- Biotinylation: plaques Placer sur un bain de glace dans la chambre froide et rincez 3 x 2 ml avec PBS glacé 2 +. Soyez certains que les plaques sont légèrement inclinés pour permettre le drainage et l'enlèvement de la solution tampon. Ajouter 0,75 ml / puits de la fraîcheur sulfo-NHS-SS-biotine solution à chaque puits. Incuber x 15 ', 4 ° C sur le bain de glace avec une agitation vigoureuse. Après l'incubation est terminée, préparer une autre frais sulfo-NHS-SS-biotine solution. Remplacer l'ancienne solution avec la solution douce et incuber x 15 ', 4 ° C.
- Trempe: Il est essentiel que tous les non-réagir NHS-biotine molécules sont trempés, de sorte qu'ils ne réagissent pas avec et biotinyler protéines intracellulaires fois que les cellules sont lysées. Laver les cellules de 3 x 2 ml avec une solution de trempe et incuber deux fois dans une solution à 2 ml étancher x 15 ', 4 ° C en agitant doucement.
- Internalisation: Si les traitements médicamenteux sont à l'essai, ajoutez la concentration du médicament approprié pour PBS 2 + / g / BSA. Gardez plaque de contrôle à 4 ° C et mettre la plaque d'internalisation de la chambre froide. Laver 3 x 2 ml avec du PBS préchauffé 2 + / g / BSA (+ / - drUGS) et laisser dans les mêmes solutions (2 ml / puits). Remplir les puits vides avec préchauffé solution pour assurer une température uniforme dans toute la plaque. Transférer les cellules à un incubateur à 37 ° C pendant 10 '. Immédiatement avant la fin de l'incubation à 37 ° C, de préparer une nouvelle solution PTCE 50 mM dans un tampon de NT à être utilisé pour l'étape de décapage et de stocker sur la glace. Préparer une quantité suffisante pour 1,0 ml / puits.
- Décapage: plaque de transfert Immédiatement (s) au bain de glace et revenir à une chambre froide. Rapidement laver les cellules avec du tampon glacée NT, 3 x 2 ml pour arrêter l'endocytose. Lavez aussi bande de contrôle des puits 3 x 2 ml avec du tampon NT. Ajouter 1,0 ml de solution fraîche de décapage à chaque puits. Incuber dans la glace, 15 ', 4 ° C avec agitation douce. Remplacer les puits avec la solution de décapage frais et incuber un supplément de 15 ', 4 ° C sur la glace.
- Lysis: Laver tous les puits qui ont été exposés à la solution de décapage, 3 x 2 ml de tampon NT. Puis, lavez tous les puits (y compris les contrôles au total) avec 3 x 2 ml de PBS 2 +. Lyse de 300μl/well tampon RIPA (ou un tampon de lyse d'autres compatibles pour la protéine d'intérêt) contenant des inhibiteurs de protéase frais (1,0 mM PMSF, 1,0 ug / ml chacun leupeptine, aprotinine et pepstatine). Lyse en secouant x 20 ', 4 ° C. Transfert à microtubes de clair et de débris cellulaires par centrifugation 18 000 xg, 10 ', 4 ° C.
- Détermination de la concentration de protéines: Utiliser un dosage de protéines compatible avec vos conditions de lyse (dosage de la protéine par exemple, DC, Bio-Rad) pour déterminer la concentration en protéines des lysats par rapport à une courbe standard de BSA.
- Streptavidine chromatographie d'affinité: Préparer avec les microtubes de quantités équivalentes de protéines pour chaque échantillon. Ajouter un tampon de lyse pour apporter volume final de chaque échantillon à 200 pl. Vortex la streptavidine billes d'agarose vigoureusement à apporter à une suspension uniforme. Aide d'une pipette 200 pl avec le bout coupé, perles pipette dans chaque tube. Recommandée 20 pi beads/50 lysat ug. Incuber une nuit à 4 ° C sur un agitateur de tube.
Jour 3:
- Laver perle: Centrifuger les échantillons, 18000 xg, 2 'pour collecter des perles. Aspirer lysat, en faisant attention de ne pas s'approcher perles culot avec un aspirateur. Utiliser un embout de pipette en plastique à l'extrémité de l'aspirateur pour un meilleur contrôle. Ajouter 0,75 ml de tampon de lyse dans chaque tube, et le vortex de se laver les perles. Centrifuger les échantillons, 18000 xg, 2 'pour collecter des perles et des aspirations de répétition et laver deux fois (trois lavages au total). Après le lavage final, aspirer autant de la mémoire tampon que possible, sans perturber le culot de billes. Tipping the tube vers l'aspirateur aide à cette étape.
- Élution de l'échantillon: 20-Ajouter 25 pi de tampon d'échantillon de Laemmli 2x (réduction) à chaque tube. L'agent réducteur sera cliver la liaison disulfure NHS-SS-biotine, libérant les protéines isolées en solution. La plupart des protéines membranaires sont très vulnérables à l'agrégation une fois bouillie, et ne doit pas être chauffé avant le chargement sur des gels pour SDS-PAGE. Déterminer la sensibilité thermique de votre protéine d'intérêt avant de procéder à ces expériences. Si la protéine ne peut pas tolérer de chauffage bouillante /, incuber sur un agitateur, 30 ', la température ambiante avant l'analyse par SDS-PAGE. Cela est suffisant pour cliver la liaison disulfure et éluer les protéines.
- SDS-PAGE et immunoblot: séparer les protéines par SDS-PAGE. Pour chaque échantillon, il est plus facile d'exécuter les échantillons dans l'ordre suivant: la surface totale (temps = 0), la bande, l'état de l'internalisation # 1, # 2 Condition, etc Transfert à membrane pour immunoblot et épongez avec un anticorps approprié pour votre protéine d'intérêt. Capturez des bandes immunoréactives à l'aide d'un système de caméra CCD gel de la documentation, étant certain qu'il n'ya pas de pixels saturés. Quantifier chacun densité de la bande en utilisant un gel d'analyse / densitométrie logiciel.
Les résultats représentatifs:
Un résultat immunoblot représentatif est montré dans la figure 2A. Le signal le plus fort est dans le «total» Lane (T), qui est le montant total de la protéine de surface avant de l'internalisation. La "bande" de contrôle (S) devrait idéalement être proche de vide, ce qui démontre que la bande a été efficace pour l'expérience. L'efficacité de bande est calculée en comparant la densité de la "bande" voie à celle de la "totale" Lane (protéines par exemple qui a été biotinylé en parallèle avec la bande, mais ne fut ni chauffé à 37 ° C, ni exposés à la solution de décapage). La formule suivante est utilisée:
[1 - (bande / total)] * 100%
En utilisant cette formule, la bande à la figure 2 était de 99,8% d'efficacité. Enfin, vous pourrez voir des bandes de moindre intensité que le total dans la voie de l'internalisation (s) (I). Dans l'exemple (figure 2), les cellules traitées ont été traités soit avec un véhicule ou d'acétate de phorbol myristate 1 uM (PMA) au cours d'un 10 'taux d'internalisation et de la dopamine internalisation du transporteur ont été mesurés pour un 10' période d'intériorisation initiale. Le taux est calculé comme intériorisationsuit:
intériorisé / total * 100
Comme le montre la figure 2B, la surface de 10,4% DAT intériorisé plus de 10 'sous le véhicule traités conditions. PMA un traitement a augmenté les taux d'internalisation DAT à 23,2% de la surface totale DAT.
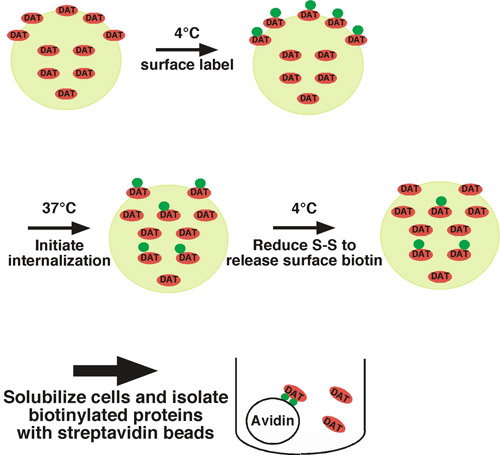
Figure 1. Cellules illustration Protocole. Biotinylés sont à 4 ° C à l'étiquette exclusivement la population de surface, et sont décalés à 37 ° C pour initier l'internalisation. Après internalisation, les cellules sont rapidement refroidis pour arrêter les processus d'endocytose et la biotine de surface résiduelle est dépouillé en traitant les cellules avec un agent réducteur. Les seules protéines biotinylées qui restent sont ceux qui découlent de la surface à l'instant t = 0 et ont été intériorisées, les protégeant ainsi du traitement de décapage. Protéines biotinylées sont isolés par chromatographie d'affinité par lots avec des perles de streptavidine et la protéine d'intérêt est détectée par immunoblot.
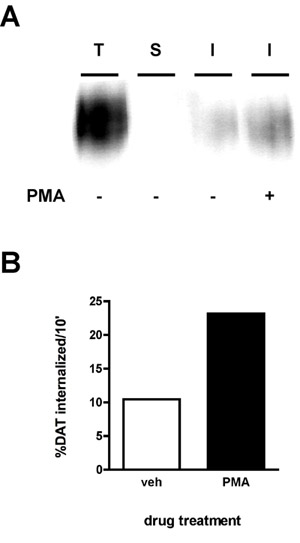
Figure 2. Activation des PKC augmente la DAT taux d'endocytose. Dosage de l'internalisation. Les cellules PC12 exprimant de façon stable DAT ont été biotinylées, 4 ° C comme décrit dans "Protocole détaillé». Les cellules ont été rapidement chauffé à 37 ° C ± 1 uM PMA et incubés 10 ', 37 ° C Biotine résiduel a été dépouillé par la réduction, les cellules ont été lysées et les protéines biotinylées ont été isolés par chromatographie d'affinité streptavidine. (A) immunoblot montrant Représentant DAT surface totale à l'instant t = 0 (T), bande de contrôle (S), et internalisée DAT (I) dans les conditions indiquées. (B) bandes ont été capturées avec une caméra CCD et quantifiés avec quantité de données du logiciel (Bio-Rad). Les données sont exprimées en% total DAT min internalized/10.
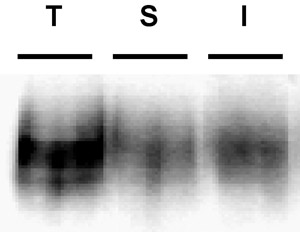
Figure 3. Exemple illustrant immunoblot une bande mauvaise biotine. Internalisation dosage. Les cellules PC12 exprimant de façon stable DAT ont été biotinylées, 4 ° C comme décrit dans "Protocole détaillé». Les cellules ont été rapidement chauffé à 37 ° C et incubés 10 ', 37 ° C Biotine résiduel a été dépouillé par la réduction, les cellules ont été lysées et les protéines biotinylées ont été isolés par chromatographie d'affinité streptavidine. L'immunoblot montre DAT surface totale à l'instant t = 0 (T), bande de contrôle (S), et internalisée DAT (I). Notez la bande visible dans la voie de bande de contrôle, indicative de l'efficacité de bande pauvres.
Discussion
Les problèmes courants: Le problème le plus fréquent qui se pose dans ces expériences est l'efficacité de bande pauvres. L'efficacité de la bande est essentiel d'être capable d'interpréter les résultats. Sauf si la bande a été très efficace, il n'est pas possible de conclure que toutes les protéines biotinylées dans les ruelles internalisation ont été, en fait, intériorisé de la surface. Bandes d'efficacité ≥ 90% sont optimales, et nous jetez aucun résultat, si la ban...
Remerciements
Ce travail a été financé par le NIH octroi # DA15169 à HEM
Références
- Holton, K. L., Loder, M. K., Melikian, H. E. Nonclassical distinct endocytic signals dictate constitutive and PKC-regulated neurotransmitter transporter internalization. Nat Neurosci. 8, 881-888 (2005).
- Boudanova, E., Navaroli, D. M., Melikian, H. E. Amphetamine-induced decreases in dopamine transporter surface expression are protein kinase C-independent. Neuropharmacology. 54, 605-612 (2008).
- Boudanova, E., Navaroli, D. M., Stevens, Z., Melikian, H. E. Dopamine transporter endocytic determinants: carboxy terminal residues critical for basal and PKC-stimulated internalization. Mol Cell Neurosci. 39, 211-217 (2008).
- Loder, M. K., Melikian, H. E. The dopamine transporter constitutively internalizes and recycles in a protein kinase C-regulated manner in stably transfected PC12 cell lines. J Biol Chem. 278, 22168-22174 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon