É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Taxas de medição de plasma Proteína de membrana endocítica por Biotinilação reversível
Resumo
Endocitose regulada governa o celular níveis de expressão de superfície da maioria das proteínas da membrana. Aqui nós utilizamos redutível, membrana reagentes Biotinilação impermeant para medir a taxa endocítica do transportador de dopamina (DAT), uma proteína de membrana politópica. O método facilita uma abordagem simples para medir a taxa de proteínas mais endocítica membrana plasmática.
Resumo
Proteínas da membrana plasmática são um grupo grande e diverso de proteínas composta de receptores, canais iônicos, transportadores e bombas. Atividade dessas proteínas é responsável por uma série de eventos-chave de celulares, incluindo a entrega de nutrientes, excitabilidade celular e sinalização química. Muitas proteínas da membrana plasmática são dinamicamente reguladas, por tráfico endocítica, que modula a função das proteínas, alterando a expressão de proteínas de superfície. Os mecanismos que facilitam a endocitose de proteínas são complexos e não são totalmente compreendidos por proteínas da membrana muitos. A fim de compreender totalmente os mecanismos que controlam o tráfico endocítica de uma determinada proteína, é fundamental que a taxa de endocítica a proteína s ser medido com precisão. Para muitos receptores, direta medições taxa endocítica são freqüentemente alcançados utilizando ligantes receptores rotulados. No entanto, para muitas classes de proteínas da membrana, como os transportadores, bombas e canais iônicos, não há ligante conveniente que pode ser usado para medir a taxa de endocítica. No presente relatório, nós descrevemos um método reversível Biotinilação que nós empregamos para medir o transportador de dopamina (DAT) taxa de endocítica. Este método fornece uma abordagem simples para medir as taxas de internalização, e pode ser facilmente empregada para estudos de tráfico de proteínas mais de membrana.
Protocolo
Resumo procedimento:
Usando essa abordagem, proteínas de superfície celular são covalentemente marcado com biotina na extracelular resíduos de lisina disponível usando um impermeant membrana, dissulfeto-coupled reagente Biotinilação (sulfo-NHS-SS-biotina), sob o tráfico de condições restritivas (ou seja, de baixa temperatura) (ver Fig. 1. para ilustração). Um conjunto de células é deslocado para o tráfico de condições permissivas (37 ° C) e proteínas biotiniladas internalizar. O outro conjunto de células são mantidos em baixas temperaturas como controles para 1) proteína de superfície do total em tempo = 0, e 2) controle de stripping. Após um curto período de interiorização, as células são transferidas de volta para baixa temperatura para parar de internalização, biotina e qualquer superfície residual é retirado por tratar células com um agente redutor, que cliva a biotina dissulfeto-coupled. Proteínas biotiniladas que surgiu a partir da superfície da célula e foram internalizadas são protegidos da etapa de decapagem, e será a única proteínas biotiniladas que permanecem. Após a lise celular, proteínas biotiniladas são isolados por cromatografia de afinidade e estreptavidina a proteína de interesse é detectada por immunoblotting quantitativa. Para determinar a taxa endocítica, a quantidade de proteína internalizada é comparado com o controle de superfície total rotulados em tempo = 0. Temos utilizado com sucesso esta abordagem para medir a taxa de internalização da norepinefrina e dopamina neuronal 1 1-4 transportadores.
Protocolo detalhado:
Dia 1:
- Células em placa de 6 placas bem como de que eles serão confluentes ~ 80% no Dia 2. Alternativamente, se as células transfectadas estão sendo usados, transfecção com uma densidade de tal forma que eles serão confluentes ~ 80% no momento a taxa de internalização será medido. Se as células não são fortemente aderente, utensílios de cultura de tecidos devem ser tratados com um substrato de adesão celular (por exemplo, poli-D-lisina) para evitar a perda de células durante as etapas de lavagem extensiva.
- Para cada proteína que está sendo testado, placa de 2 poços em uma placa para ser usada como a proteína de superfície total (t = 0) e controles de stripping. Em uma segunda placa, placa de um poço para cada condição de interiorização que está sendo testado (taxa basal ou seja endocítica vs tratados com o fármaco).
- Prepare as seguintes soluções e armazenar à temperatura indicada para uso no dia 2:
- PBS 2 +: Solução tampão de fosfato (pH 7,4) suplementado com 1,5 mM MgCl 2, 0,2 mM CaCl 2, (4 ° C)
- Biotinilação Quench Solução: 2 + PBS suplementado com 100 mM de glicina, (4 ° C)
- NT buffer: 150 mM NaCl, 1,0 mM EDTA, 0,2% BSA, 20 mM Tris, pH 8,6, (4 ° C)
- RIPA buffer: 10 mM Tris, pH 7,4, 150 mM NaCl, 1,0 mM EDTA, 0,1% SDS, 1,0% Triton X 100, desoxicolato de sódio 1,0%, (4 ° C)
- Sulfo-NHS-SS-biotina solução estoque: dissolver em dimetilsulfóxido (DMSO) a 200 mg / ml, (-20 ° C)
- Tris (2-Carboxietil) Cloridrato de fosfina solução-mãe (TCEP): 500 mm de H 2 O, (-20 ° C, coberto de papel alumínio para bloquear a luz)
Dia 2:
- Prepare PBS 2 + suplementado com glucose 0.18g/ml, 0,2% IgG / protease livre de albumina sérica bovina (PBS 2 + / g / BSA). Pré-aquecer esta solução a 37 ° C em banho-maria.
- Descongelar a solução estoque sulfo-NHS-SS-biotina na bancada para derreter o DMSO. Imediatamente antes de usar, preparar solução sulfo-NHS-SS-biotina frescos (2,5 mg / ml em PBS gelado 2 +, suficientes para 0,75 ml / poço). Vortex vigorosamente a solução para solubilizar o DMSO. Note-se que o reagente NHS-biotina é facilmente hidrolisado em solução aquosa. Portanto, todas as soluções devem ser preparadas imediatamente antes do uso.
- Biotinilação: placas Coloque em um banho de gelo na sala fria e enxágüe 3 x 2 ml com PBS gelado 2 +. Esteja certo de que as placas são ligeiramente inclinado para permitir a drenagem completa e remoção da solução tampão. Adicionar 0,75 ml / poço da solução sulfo-NHS-SS-biotina fresco a cada poço. Incubar x 15 ", 4 ° C em banho de gelo com agitação vigorosa. Após a incubação é completa, prepare outra solução sulfo-NHS-SS-biotina fresco. Substituir a solução antiga com a nova solução e incubar x 15 ', 4 ° C.
- Têmpera: É fundamental que todos os não-reagir NHS-biotina moléculas são extinto, de modo que eles não vão reagir com e biotinylate proteínas intracelulares uma vez que as células são lisadas. Lave as células 3 x 2 ml com solução de têmpera e incubar duas vezes em 2 ml solução saciar x 15 ", 4 ° C, agitando suavemente.
- Interiorização: Se os tratamentos de drogas estão sendo testadas, adicione a concentração de fármaco adequado para PBS 2 + / g / BSA. Manter controle de placa a 4 ° C e trazer placa internalização fora da sala fria. Lavar 3 x 2 ml com PBS pré-aquecido 2 + / g / BSA (+ / - drUGS) e deixar em soluções de mesma (2 ml / poço). Preencher qualquer vazio, com poços pré-aquecido solução para garantir até mesmo a temperatura ao longo da placa. Transferência das células para a 37 ° C incubadora por 10 '. Imediatamente antes da final de 37 ° C de incubação, preparar solução TCEP fresco 50 mM em tampão NT a ser utilizado para a etapa de decapagem e armazenar no gelo. Preparar a quantidade suficiente para 1,0 ml / poço.
- Stripping: Imediatamente placa de transferência (s) para banho de gelo e voltar para o quarto frio. Lavar rapidamente as células com gelado NT buffer, 3 x 2 ml para parar endocitose. Também lavar faixa de controle de poços 3 x 2 ml com tampão NT. Adicionar 1,0 ml solução fresca stripping a cada poço. Incubar no gelo, 15 ', 4 ° C, agitando suavemente. Substituir os poços com solução de stripping fresco e incubar mais 15 ", 4 ° C no gelo.
- Lise: Lave todos os poços que foram expostas a solução de decapagem, 3 x 2 ml NT buffer. Em seguida, lavar os poços (incluindo controles total) com 3 x 2 ml PBS 2 +. Lyse em 300μl/well RIPA buffer (tampão de lise ou outros compatíveis para a proteína de interesse) contendo inibidores da protease frescos (1,0 mM PMSF, 1,0 mg / ml cada leupeptin, aprotinina e pepstatin). Lyse agitando x 20 ", 4 ° C. Transferência para tubos de microcentrífuga e restos celulares claro por centrifugação 18.000 xg, 10 ', 4 ° C.
- Determinação da concentração de proteína: Use um ensaio de proteína compatível com suas condições de lise (por exemplo, ensaio de proteína DC, Bio-Rad) para determinar a concentração de proteína do lisados em comparação com uma curva padrão de BSA.
- Estreptavidina cromatografia de afinidade: Prepare os tubos de microcentrífuga com quantidades equivalentes de proteína para cada amostra. Adicionar tampão de lise para trazer volume final de cada amostra de 200μl. Vortex as contas estreptavidina agarose vigorosamente para levar a uma suspensão mesmo. Usando um pipetador 200μl com a ponta cortada, contas pipeta em cada tubo. Recomenda 20μl lisado mg beads/50. Incubar overnight, a 4 ° C em um tubo de rotator.
Dia 3:
- Lavar talão: Centrifugar amostras, 18.000 xg, 2 'para coletar pérolas. Aspirar off lisado, tomando cuidado para não se aproximar talão pellet com aspirador. Use uma ponteira de plástico na ponta do aspirador para um melhor controle. Adicionar 0,75 ml de tampão de lise cada tubo, e vortex para lavar contas. Amostras centrífuga, 18.000 xg, 2 'para coletar pérolas e aspiração e lavagem repetir duas vezes (três lavagens em total). Após a lavagem final, aspirar o máximo do buffer quanto possível, sem perturbar o sedimento talão. Tombamento do tubo em direção ao aspirador ajuda com esta etapa.
- Eluição da amostra: Adicionar 20-25μl tampão de amostra Laemmli 2x (reduzir) a cada tubo. O agente redutor irá decompor a ligação dissulfeto-SS NHS-biotina, liberando as proteínas isoladas em solução. A maioria das proteínas da membrana são altamente vulneráveis à agregação quando cozidos, e não deve ser aquecida antes de carregar em gel de SDS-PAGE. Determine sensibilidade ao calor de sua proteína de interesse antes de se realizar esses experimentos. Se a proteína não pode tolerar aquecimento ebulição /, incubar em um rotador, 30 ', temperatura ambiente antes da análise por SDS-PAGE. Isto é suficiente para decompor o dissulfeto de títulos e eluir as proteínas.
- SDS-PAGE e immunoblotting: proteínas separadas por SDS-PAGE. Para cada amostra, é mais fácil executar os exemplos na seguinte ordem: superfície total (tempo = 0), tiras, condição internalização # 1, # 2 Condição, etc Transferência para membrana de blot e immunoblotting com anticorpo apropriado para sua proteína de interesse. Captura de bandas imunorreativas usando uma câmera CCD-sistema de documentação de gel, sendo certo que não existem pixels saturados. Quantificar cada densidade banda usando software de análise de gel / densitometria.
Resultados representativos:
Um resultado immunoblot representativa é mostrado na Figura 2A. O sinal mais forte é na pista "total" (T), que é a quantidade total de proteínas da superfície antes de internalização. O "strip" de controle (S) devem, idealmente, estar perto de branco, o que demonstra que a faixa foi eficiente para o experimento. A eficiência tira é calculada comparando a densidade do "strip" para que a pista da pista "total" (proteína por exemplo, que foi biotinilado em paralelo com o strip, mas não era nem aquecido a 37 ° C, nem exposta a uma solução stripping). A seguinte fórmula é usada:
[1 - (tira / total)] * 100%
Usando esta fórmula, a tira na Figura 2 foi 99,8% eficiente. Finalmente, você vai ver bandas de menor intensidade do que o total na pista internalização (s) (I). No exemplo (Figura 2), as células tratadas foram tratados com veículo ou acetato de forbol miristato 1 Hm (PMA), durante a 10 'taxas de internalização internalização e transportador de dopamina foram medidos para a 10 "período de interiorização inicial. A taxa de interiorização é calculado comoseguinte forma:
internalizada / total * 100
Como visto na Figura 2B, 10,4% da superfície DAT internalizados ao longo de 10 'sob o veículo-tratados condições. PMA tratamento aumentou as taxas de internalização DAT para 23,2% de DAT superfície total.
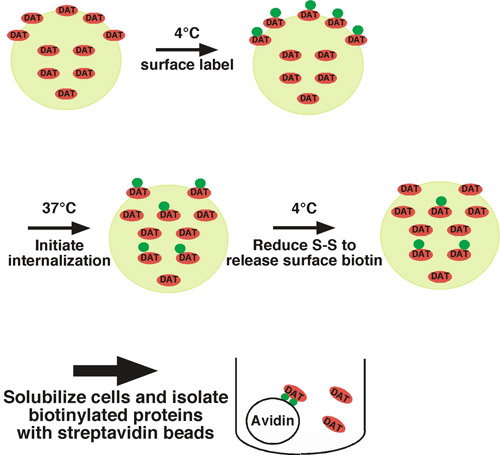
Figura 1. Células protocolo de ilustração. Biotinilado são a 4 ° C a etiqueta exclusivamente a população de superfície, e são transferidas para 37 ° C para iniciar internalização. Após a internalização, as células são rapidamente resfriados para parar processos endocítica e biotina superfície residual é retirado por tratar células com um agente redutor. As proteínas só biotinilado que permanecem são aquelas que surgiram a partir da superfície em t = 0 e foram internalizadas, protegendo-os do tratamento stripping. Proteínas biotiniladas são isolados por lote cromatografia de afinidade com miçangas e estreptavidina a proteína de interesse é detectada por immunoblotting.
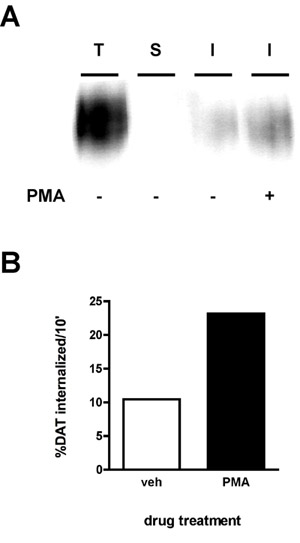
Figura 2. Ativação da PKC aumenta a taxa de DAT endocítica. Internalização ensaio. PC12 expressando estavelmente células DAT foram biotinilado, 4 ° C, conforme descrito no "Protocolo detalhado". As células foram rapidamente aquecidas a 37 ° C ± 1 mM PMA e incubadas 10 ', 37 ° C. Biotina residual foi despojado, reduzindo, as células foram lisadas e as proteínas biotiniladas foram isoladas por cromatografia de afinidade da estreptavidina. (A) immunoblot Representante mostrando DAT superfície total em t = 0 (T), faixa de controle (S), e internalizada DAT (I), nas condições indicadas. (B) Bandas foram capturadas com uma câmera CCD e quantificadas com quantidade de dados software (Bio-Rad). Dados estão expressos em min% total internalized/10 DAT.
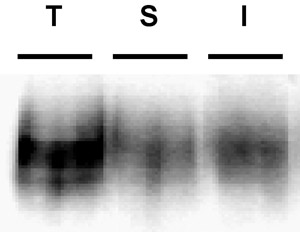
Figura 3. Immunoblot exemplo que descreve um strip biotina pobres. Internalização ensaio. PC12 expressando estavelmente células DAT foram biotinilado, 4 ° C, conforme descrito no "Protocolo detalhado". As células foram rapidamente aquecidas a 37 ° C e incubados 10 ', 37 ° C. Biotina residual foi despojado, reduzindo, as células foram lisadas e as proteínas biotiniladas foram isoladas por cromatografia de afinidade da estreptavidina. O immunoblot mostra DAT superfície total em t = 0 (T), faixa de controle (S), e internalizada DAT (I). Observe a banda visível na faixa de controle strip, indicativo de eficiência strip pobres.
Discussão
Problemas comuns: O problema mais comum que surge nesses experimentos é a eficiência strip pobres. A eficiência da tira é fundamental para ser capaz de interpretar os resultados. A menos que a faixa foi altamente eficiente, não é possível concluir que todas as proteínas biotiniladas nas pistas internalização foram, de fato, internalizados a partir da superfície. Tiras ≥ 90% de eficiência são ótimas, e descartar qualquer resultado, se a tira cair abaixo deste nível. Um exemplo de uma tira de pobre...
Agradecimentos
Este trabalho foi financiado pelo NIH concede # DA15169 a HEM
Referências
- Holton, K. L., Loder, M. K., Melikian, H. E. Nonclassical distinct endocytic signals dictate constitutive and PKC-regulated neurotransmitter transporter internalization. Nat Neurosci. 8, 881-888 (2005).
- Boudanova, E., Navaroli, D. M., Melikian, H. E. Amphetamine-induced decreases in dopamine transporter surface expression are protein kinase C-independent. Neuropharmacology. 54, 605-612 (2008).
- Boudanova, E., Navaroli, D. M., Stevens, Z., Melikian, H. E. Dopamine transporter endocytic determinants: carboxy terminal residues critical for basal and PKC-stimulated internalization. Mol Cell Neurosci. 39, 211-217 (2008).
- Loder, M. K., Melikian, H. E. The dopamine transporter constitutively internalizes and recycles in a protein kinase C-regulated manner in stably transfected PC12 cell lines. J Biol Chem. 278, 22168-22174 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados