Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Cómo construir un láser Speckle de imagen de contraste (LSCI) del sistema para monitorizar el flujo sanguíneo
En este artículo
Resumen
Este video muestra cómo construir un láser Speckle contraste de imagen (LSCI), sistema que puede ser usado para monitorear el flujo de sangre.
Resumen
Laser Speckle contraste de imagen (LSCI) es una técnica sencilla pero potente que se utiliza para todo el campo de la imagen del flujo sanguíneo. La técnica de análisis de las fluctuaciones en una dinámica moteado para detectar el movimiento de las partículas de forma similar a como láser Doppler analiza los cambios de frecuencia para determinar la velocidad de las partículas. Debido a que puede ser usado para monitorear el movimiento de las células rojas de la sangre, LSCI se ha convertido en una herramienta popular para medir el flujo sanguíneo en los tejidos como la retina, la piel y el cerebro. Se ha convertido en especialmente útil en la neurociencia, donde los cambios del flujo sanguíneo durante los eventos fisiológicos como la activación funcional, derrame cerebral, y la despolarización de la difusión se puede cuantificar. LSCI también es atractivo, ya que proporciona una excelente resolución espacial y temporal durante el uso de instrumentos de bajo costo que se puede combinar fácilmente con otras modalidades de imágenes. Aquí se muestra cómo construir una instalación LSCI y demostrar su capacidad para controlar los cambios del flujo sanguíneo en el cerebro durante un experimento con animales.
Protocolo
1. Imágenes de instalación
- Una cámara con un zoom macro debe ser montado en una placa vertical o un microscopio quirúrgico (en lugar de una lente de zoom macro, un objetivo de microscopio y la lente o un simple sistema de dos lentes podrían ser utilizados en función de la ampliación deseada).
- Descargar el software necesario en nuestro sitio web para controlar la cámara ( http://bach.bme.utexas.edu/mediawiki/index.php/Software ).
- El software de la cámara debe ser utilizado para confirmar un objeto está enfocado a la altura deseada
- Un diodo láser con un kit de colimación debe entonces ser configurado de forma que la luz láser ilumina el objeto divergentes.
- Baje / apagado toda la luz ambiente para confirmar que la luz del láser es uniforme iluminando todo el campo de visión de la cámara.
- En este ejemplo, el rojo la luz del láser se utilizó porque era más fácil de demostrar cómo construir el sistema, pero la luz láser infrarrojo igualmente podría ser utilizado y tendría la ventaja, además, de penetrar más profundamente en el tejido. Además, con los filtros adecuados frente a la cámara para bloquear la luz visible, luz infrarroja, podría ser utilizado con las luces del cuarto de.
2. Preparación quirúrgica
- Esta es una cirugía no la supervivencia, aunque el experimento se puede hacer de forma crónica en un estudio de supervivencia mediante el uso de una ventana de la cámara.
- Anestesiar a los animales y el lugar en un marco estereotáxico.
- Quitar la piel y el tejido que rodea el cráneo.
- Usando un taladro dental, delgada del cráneo en la región del cerebro a la transparencia deseada, teniendo cuidado de lavar la superficie con una solución salina con frecuencia con el fin de evitar daños en el cerebro.
- El uso de cemento dental para crear un pozo en la región deseada y luego se coloca una gota de aceite mineral o gel de silicona en el pozo para mejorar la visibilidad.
- Por otra parte, el cráneo puede ser removido y una ventana de la cámara podría ser creado aquí.
3. Recopilación de datos
- Utilice el software de la cámara para obtener imágenes y calcular también los valores de contraste de manchas.
- Colocar el animal en el campo de visión de la cámara y ajustar la altura de la cámara o la lente de enfoque hasta que las imágenes claras de los vasos se ven.
- Asegúrese de que la luz del láser es suficiente llegar a la cámara sin saturarla. Cómo usar el histograma de la imagen, ajustar la potencia del láser para asegurar la mayoría de los píxeles de la cámara muy contentos de la mitad de su capacidad.
- Seleccione el número de imágenes que desea adquirir y la cantidad promedio que hacer antes de comenzar el experimento.
- Una vez que comienza el experimento, los cambios del flujo sanguíneo puede ser fácilmente controlada por la selección de las regiones de interés o mediante la generación de una imagen del flujo sanguíneo relativo.
4. Resultados representante
La figura 1 muestra un ejemplo de un típico moteado prima la imagen y un contraste de la imagen convertida moteado que se debe generar al utilizar el software para examinar el flujo sanguíneo en el cerebro. Para visualizar los cambios en el flujo sanguíneo, es más fácil para que el software generar mapas relativa del flujo sanguíneo. La figura 2 muestra una serie típica de relativa imágenes del flujo sanguíneo durante un aumento transitorio en el flujo de sangre que viaja a través del campo de visión. El color rojo representa un aumento del flujo sanguíneo, mientras que el color azul muestra una disminución. El color verde indica que no hay ningún cambio en el flujo sanguíneo en relación con un punto de referencia dado.
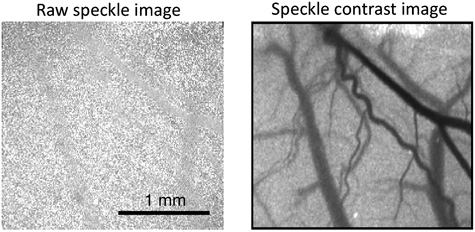
Figura 1. Ejemplo de una prima de manchas de la imagen (izquierda) y el moteado de contraste de imagen (derecha).
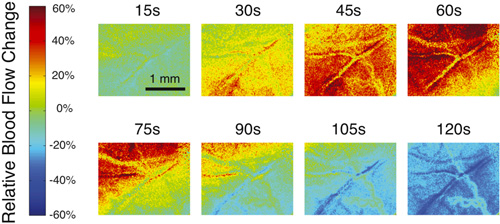
Figura 2. Ejemplo de varias imágenes relativas del flujo sanguíneo en diferentes momentos durante un aumento transitorio en el flujo sanguíneo seguido por una disminución en el flujo sanguíneo.
Discusión
En este video nos han demostrado lo fácil que es crear y utilizar un láser de manchas de imágenes con contraste (LSCI) del sistema para observar los cambios en el flujo sanguíneo. LSCI se desarrolló en la década de 1980 como una forma de generar mapas de flujo sanguíneo en la retina 1. Aunque todavía se utiliza la imagen de la perfusión de la retina y la piel, se ha convertido en muy popular como una técnica de imagen para el flujo de sangre en el cerebro 2. Esto se debe principalmente a ...
Divulgaciones
Agradecimientos
Los autores agradecen el apoyo de la Asociación Americana del Corazón (0735136N), la Fundación Dana, National Science Foundation (CBET/0737731), y la Fundación Coulter.
Materiales
La técnica es lo suficientemente versátil para ser utilizado con una amplia gama de equipos. Lo único necesario para realizar el experimento es una cámara compatible con una lente, un diodo láser de cualquier tipo con un controlador y el software suministrado. Una tabla de los equipos específicos utilizados en el vídeo se incluye arriba.
Una lista completa de piezas adicionales que se pueden utilizar en este experimento se encuentra en nuestro sitio web, http://bach.bme.utexas.edu/mediawiki/index.php/Hardware
Referencias
- Briers, J. D., Fercher, A. F. Retinal blood-flow visualization by means of laser speckle photography. Invest. Ophthalmol. Vis. Sci. 22, 255-259 (1982).
- Boas, D. A., Dunn, A. K. Laser speckle contrast imaging in biomedical optics. J. Biomed. Opt. 15, 011109-011109 (2010).
- Dunn, A. K. Simultaneous imaging of total cerebral hemoglobin concentration, oxygenation, and blood flow during functional activation. Opt Lett. 28, 28-30 (2003).
- Devor, A. Coupling of the cortical hemodynamic response to cortical and thalamic neuronal activity. Proc Natl Acad Sci U S A. 102, 3822-3827 (2005).
- Ayata, C. Pronounced hypoperfusion during spreading depression in mouse cortex. J Cereb Blood Flow Metab. 24, 1172-1182 (2004).
- Jones, P. Simultaneous multispectral reflectance imaging and laser speckle flowmetry of cerebral blood flow and oxygen metabolism in focal cerebral ischemia. J. Biomed. Opt. 13, (2008).
- Dunn, A. K., Bolay, H., Moskowitz, M. A., Boas, D. A. Dynamic imaging of cerebral blood flow using laser speckle. J Cereb Blood Flow Metab. 21, 195-201 (2001).
- Dunn, A. K., Devor, A., Dale, A. M., Boas, D. A. Spatial extent of oxygen metabolism and hemodynamic changes during functional activation of the rat somatosensory cortex. Neuroimage. 27, 279-290 (2005).
- Farkas, E., Bari, F., Obrenovitch, T. P. Multi-modal imaging of anoxic depolarization and hemodynamic changes induced by cardiac arrest in the rat cerebral cortex. Neuroimage. 51, 734-742 (2010).
- Sakadzic, S. Simultaneous imaging of cerebral partial pressure of oxygen and blood flow during functional activation and cortical spreading depression. Appl. Opt. 48, (2009).
- Ponticorvo, A., Dunn, A. K. Simultaneous imaging of oxygen tension and blood flow in animals using a digital micromirror device. Opt Express. 18, 8160-8170 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados