Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Как построить лазерной спекл Контрастность изображения (LSCI) системы мониторинга кровотока
В этой статье
Резюме
Это видео демонстрирует, как построить лазерной спекл Контрастность изображения (LSCI), которая может быть легко использована для контроля кровотока.
Аннотация
Лазерный спекл Контрастность изображения (LSCI) является простой, но мощный метод, который используется для всего месторождения визуализации кровотока. Техника анализа колебаний динамических спекл-картины для обнаружения движения частиц подобно тому, как лазерного доплеровского сдвига частоты анализы, чтобы определить скорость частицы. Потому что он может быть использован для мониторинга движения красных кровяных клеток, LSCI стала популярным инструментом для измерения кровотока в тканях, таких как сетчатка, кожи и головного мозга. Это стало особенно полезным в области неврологии, где изменения кровотока в физиологических событий, как функциональная активация, инсульта, а также распространение деполяризации поддается количественной оценке. LSCI также привлекательны, поскольку она обеспечивает отличное пространственное и временное разрешение при использовании недорогих приборов, которые могут легко быть объединены с другими методами визуализации. Здесь мы покажем, как построить установку LSCI и продемонстрировать свою способность контролировать изменения кровотока в головном мозге во время животное эксперимент.
протокол
1. Установка изображений
- Камера с макро зум-объектив должен быть установлен в вертикальное сцене или операционного микроскопа (Вместо макрообъектив зум, цель микроскопа и объектива или простой две системы линз могут быть использованы в зависимости от желаемого увеличения).
- Скачать соответствующее программное обеспечение с нашего сайта для управления камерой ( http://bach.bme.utexas.edu/mediawiki/index.php/Software ).
- Программное обеспечение камеры должны быть использованы для подтверждения объект находится в центре внимания на нужную высоту
- Лазерный диод с коллимации комплект должен быть настроен так, что расходящиеся лазерного света освещает объект.
- Выключите / выключить все рассеянный свет, чтобы подтвердить, что лазерный свет равномерно освещает все поле зрения камеры.
- В этом примере, красный свет лазера был использован потому что это было легче продемонстрировать, как построить систему, но инфракрасного лазерного излучения может так же легко использовать и он будет иметь дополнительно благо проникая глубоко в ткань. Кроме того, с соответствующими фильтрами перед камерой, чтобы блокировать видимый свет, инфракрасный свет может быть использован с комнате свет.
2. Хирургическая подготовка
- Это не является выживание операции, хотя эксперимент можно было бы сделать хронически в исследовании выживаемости при использовании камеры окна.
- Обезболить животное и поместить его в стереотаксической раме.
- Удалить кожу и ткани, окружающей черепа.
- Использование бормашины, тонкий череп над желаемой области мозга к прозрачности будьте осторожны, чтобы очистить поверхность с солевым часто, чтобы избежать повреждения мозга.
- Использование стоматологического цемента для создания и вокруг желаемый регион, а затем поместить каплю минерального масла или силиконового геля в колодец, чтобы улучшить видимость.
- Кроме того, череп может быть удален и камеры окна могут быть созданы здесь.
3. Сбор данных
- Используйте программное обеспечение камеры для получения изображений, а также вычислить спекл отличие значения.
- Место животное в поле зрения камеры и отрегулируйте высоту камеры или фокусировки на объективе, пока четкие изображения сосудистой видны.
- Убедитесь в наличии достаточного лазерного света достигает камеры без насыщения ее. Использование гистограммы изображения, корректировать мощность лазера, чтобы обеспечить большинство пикселей камера рады около половины мощностей их.
- Выберите количество изображений, которые хотели бы приобрести, и сколько усреднения делать перед началом эксперимента.
- Как только начинается эксперимент, изменения кровотока может быть легко контролируется выборе регионов интересов или путем создания образа относительный поток крови.
4. Представитель Результаты
На рисунке 1 показан пример типичного сырья спекл-изображений и спекл преобразованы контраст изображения, которые должны быть получены при использовании программного обеспечения для изучения кровотока в мозге. Для визуализации изменений в кровоток, что легче иметь программное обеспечение, генерировать относительный карты кровотока. На рисунке 2 показан типичный ряда относительных изображения кровотока во время переходных увеличение кровотока, который путешествует по всему полю зрения. Красный цвет означает увеличение кровотока в то время как синий цвет указывает на снижение. Зеленый цвет означает, что нет никаких изменений в кровотоке относительно данного исследования.
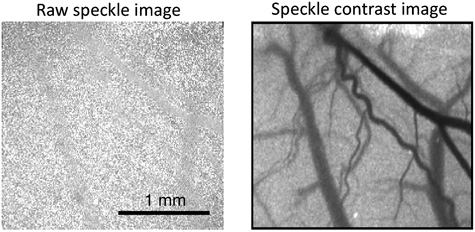
Рисунок 1. Пример сырья спекл изображения (слева) и спекл-контрастное изображение (справа).
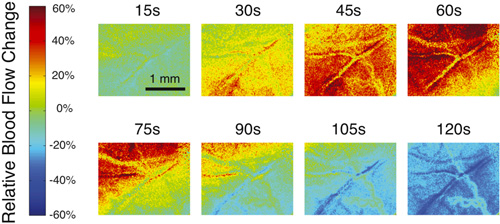
Рисунок 2. Пример нескольких относительных кровотока изображений в различные моменты времени, в течение переходного увеличение кровотока последующим снижением кровотока.
Обсуждение
В этом видео мы продемонстрировали, как легко создавать и использовать лазерной спекл контрастность изображения (LSCI) систему, чтобы смотреть на изменения в кровотоке. LSCI был разработан в 1980-х годов как способ создания карт кровотока в сетчатке 1. Хотя до сих пор используется для из...
Раскрытие информации
Благодарности
Авторы выражают благодарность поддержке Американской Ассоциации Сердца (0735136N), Дана фонда, Национального научного фонда (CBET/0737731), а Coulter Foundation.
Материалы
Техника достаточно универсален для использования с широким спектром оборудования. Единственные вещи, необходимые для выполнения эксперимента совместимая камера с линзой, лазерный диод любого типа с контроллером, а прилагаемое программное обеспечение. Таблица конкретных оборудование, используемые в видео включено выше.
Полный список дополнительных частей, которые могут быть использованы в этом эксперименте найти на нашем сайте, http://bach.bme.utexas.edu/mediawiki/index.php/Hardware
Ссылки
- Briers, J. D., Fercher, A. F. Retinal blood-flow visualization by means of laser speckle photography. Invest. Ophthalmol. Vis. Sci. 22, 255-259 (1982).
- Boas, D. A., Dunn, A. K. Laser speckle contrast imaging in biomedical optics. J. Biomed. Opt. 15, 011109-011109 (2010).
- Dunn, A. K. Simultaneous imaging of total cerebral hemoglobin concentration, oxygenation, and blood flow during functional activation. Opt Lett. 28, 28-30 (2003).
- Devor, A. Coupling of the cortical hemodynamic response to cortical and thalamic neuronal activity. Proc Natl Acad Sci U S A. 102, 3822-3827 (2005).
- Ayata, C. Pronounced hypoperfusion during spreading depression in mouse cortex. J Cereb Blood Flow Metab. 24, 1172-1182 (2004).
- Jones, P. Simultaneous multispectral reflectance imaging and laser speckle flowmetry of cerebral blood flow and oxygen metabolism in focal cerebral ischemia. J. Biomed. Opt. 13, (2008).
- Dunn, A. K., Bolay, H., Moskowitz, M. A., Boas, D. A. Dynamic imaging of cerebral blood flow using laser speckle. J Cereb Blood Flow Metab. 21, 195-201 (2001).
- Dunn, A. K., Devor, A., Dale, A. M., Boas, D. A. Spatial extent of oxygen metabolism and hemodynamic changes during functional activation of the rat somatosensory cortex. Neuroimage. 27, 279-290 (2005).
- Farkas, E., Bari, F., Obrenovitch, T. P. Multi-modal imaging of anoxic depolarization and hemodynamic changes induced by cardiac arrest in the rat cerebral cortex. Neuroimage. 51, 734-742 (2010).
- Sakadzic, S. Simultaneous imaging of cerebral partial pressure of oxygen and blood flow during functional activation and cortical spreading depression. Appl. Opt. 48, (2009).
- Ponticorvo, A., Dunn, A. K. Simultaneous imaging of oxygen tension and blood flow in animals using a digital micromirror device. Opt Express. 18, 8160-8170 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены