Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Wie man einen Laser bauen Speckle Contrast Imaging (LSCI) System, um den Blutfluss überwachen
In diesem Artikel
Zusammenfassung
Dieses Video zeigt, wie ein Laser bauen Speckle Contrast Imaging (LSCI) System, das problemlos eingesetzt werden können, um den Blutfluss zu überwachen.
Zusammenfassung
Laser Speckle Contrast Imaging (LSCI) ist eine einfache, aber wirkungsvolle Technik, die für Full-Field-Imaging des Blutflusses verwendet wird. Die Technik analysiert Fluktuationen in einem dynamischen Speckle-Muster, um die Bewegung von Partikeln ähnlich wie Laser-Doppler-Analysen Frequenzverschiebungen zu Partikelgeschwindigkeit bestimmen zu erkennen. Weil es verwendet werden, um die Bewegung der roten Blutkörperchen zu überwachen, hat LSCI sich zu einem beliebten Werkzeug für die Messung des Blutflusses in Geweben wie der Retina, Haut und Gehirn. Es hat sich besonders in den Neurowissenschaften, wo Veränderungen des Blutflusses während der physiologischen Ereignisse wie funktionelle Aktivierung, Schlaganfall und Verbreitung Depolarisation quantifiziert werden können. LSCI ist auch attraktiv, weil sie hervorragende räumliche und zeitliche Auflösung bietet, während Sie preiswerte Instrumente, die leicht mit anderen bildgebenden Verfahren können kombiniert werden. Hier zeigen wir, wie man ein LSCI Setup aufbauen und zeigen seine Fähigkeit, Veränderungen des Blutflusses im Gehirn während eines Tierversuchs zu überwachen.
Protokoll
1. Imaging-Setup
- Eine Kamera mit einer Makro-Zoom-Objektiv sollte, um eine vertikale Bühne oder Operationsmikroskop montiert werden (statt eines Makro-Zoom-Objektiv, ein Mikroskop-Objektiv und Linse oder ein einfaches Zwei-Objektiv-System könnte in Abhängigkeit von den gewünschten Vergrößerung werden).
- Laden sie die entsprechende Software von unserer Website, um die Kamera (Kontrolle http://bach.bme.utexas.edu/mediawiki/index.php/Software ).
- Die Kamera-Software sollte verwendet werden, um zu bestätigen ein Objekt im Fokus liegt auf der gewünschten Höhe werden
- Eine Laserdiode mit einer Kollimation Kit sollte dann so eingestellt werden, so dass divergierende Laserlicht beleuchtet das Objekt.
- Turn down / off all das Umgebungslicht, um zu bestätigen, dass das Laserlicht wird gleichmäßig beleuchtet das gesamte Sichtfeld der Kamera.
- In diesem Beispiel wurde rotes Laserlicht verwendet, weil es einfacher war es zu zeigen, wie das System zu bauen, aber infrarotes Laserlicht könnte genauso gut verwendet werden und würde die zusätzlich zugute dringt tiefer im Gewebe haben. Auch mit geeigneten Filtern vor der Kamera für sichtbares Licht blockieren, könnte Infrarotlicht mit der Raumbeleuchtung auf verwendet werden.
2. OP-Vorbereitung
- Dies ist eine Nicht-Überleben der Operation, obwohl das Experiment könnte chronisch in einen Überlebensvorteil Studie durchgeführt werden, indem eine Kammer Fenster.
- Anesthetize das Tier und legen Sie sie in einen stereotaktischen Rahmen.
- Entfernen Sie die Haut und das Gewebe rund um den Schädel.
- Mit Hilfe eines zahnärztlichen Bohrers, dünne Schädel über der gewünschten Region des Gehirns, um die Transparenz zu achten, die Oberfläche mit Kochsalzlösung spülen häufig, um zu vermeiden das Gehirn schädigen.
- Verwenden Sie Zahnzement ein gut um die gewünschte Region zu erstellen und dann einen Tropfen Mineralöl oder Silikon-Gel in den Brunnen, um die Sichtbarkeit zu verbessern.
- Alternativ könnte der Schädel entfernt und eine Kammer-Fenster könnte hier entstehen.
3. Sammeln von Daten
- Verwenden Sie die Kamera-Software, um Bilder zu erwerben und auch berechnen, Speckle-Kontrast-Werte.
- Legen Sie das Tier in das Blickfeld der Kamera und stellen Sie die Kamera hoch oder das Objektiv scharf, bis klare Bilder des Gefäßsystems zu sehen sind.
- Stellen Sie sicher, dass genügend Laserlicht erreicht die Kamera ohne Sättigung es. Mit dem Histogramm des Bildes, passen Sie die Laserleistung, um sicherzustellen, die Mehrheit der Kamera Pixel auf etwa die Hälfte ihrer Kapazität angeregt werden.
- Wählen Sie die Anzahl der Bilder, die Sie erwerben möchten und wie viel Mittelung, der vor Beginn des Experiments zu tun.
- Nachdem das Experiment beginnt, können Veränderungen des Blutflusses leichter, indem Sie Regionen von Interesse oder durch die Erzeugung eines Bildes des relativen Blutflusses überwacht werden.
4. Repräsentative Ergebnisse
Abbildung 1 zeigt ein Beispiel für eine typische rohe Speckle-Bild und einem umgebauten Speckle kontrastreiches Bild, das entsteht, wenn die Verwendung der Software, um den Blutfluss im Gehirn untersuchen sollte. Zur Visualisierung Veränderungen im Blutfluss, ist es einfacher, die Software zu generieren relativen Karten des Blutflusses. Abbildung 2 zeigt eine typische Reihe von relativen Blutfluss Bilder, die während einer vorübergehenden Erhöhung der Durchblutung, die über das Sichtfeld bewegt. Die rote Farbe entspricht einer Steigerung des Blutflusses während die blaue Farbe zeigt einen Rückgang. Die grüne Farbe zeigt an, dass es keine Veränderung des Blutflusses in Bezug auf einen bestimmten Ausgangswert.
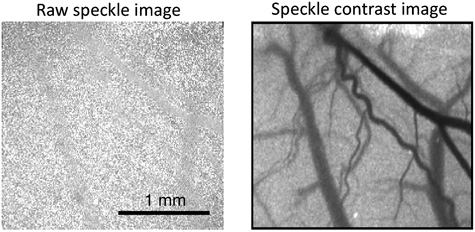
Abbildung 1. Beispiel für eine rohe Speckle-Bild (links) und Speckle kontrastreiches Bild (rechts).
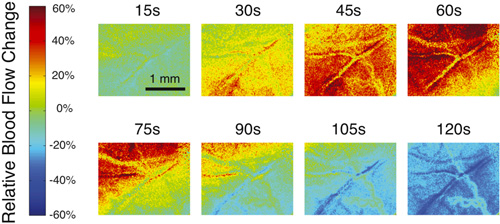
Abbildung 2. Beispiel für mehrere relative Blutfluss Bilder zu unterschiedlichen Zeitpunkten während eines vorübergehenden Anstieg des Blutflusses durch eine Abnahme des Blutflusses gefolgt.
Diskussion
In diesem Video haben wir gezeigt, wie einfach es ist, zu bauen und mit einem Laser-Speckle-Kontrast-Bildgebung (LSCI)-System auf Veränderungen im Blutfluss aussehen wird. LSCI wurde in den 1980er Jahren als eine Möglichkeit, Karten des Blutflusses in der Netzhaut 1 erzeugen entwickelt. Während noch zur Abbildung der Netzhaut und die Hautdurchblutung, hat es extrem populär geworden als eine Technik zum Bild des Blutflusses im Gehirn 2. Dies ist im Wesentlichen auf die hervorragende räumliche u...
Offenlegungen
Danksagungen
Die Autoren danken der American Heart Association (0735136N), Dana Foundation, National Science Foundation (CBET/0737731), und die Coulter-Stiftung.
Materialien
Die Technik ist vielseitig genug, um mit einer breiten Palette von Geräten eingesetzt werden. Das einzige, was notwendig, das Experiment durchzuführen sind eine kompatible Kamera mit einer Linse, einer Laserdiode jeglicher Art mit einem Controller, und die mitgelieferte Software. Eine Tabelle der spezifischen Geräte in dem Video verwendet wird oben enthalten.
Eine vollständige Liste der zusätzlichen Teile, die in diesem Experiment verwendet werden kann, ist auf unserer Website gefunden http://bach.bme.utexas.edu/mediawiki/index.php/Hardware
Referenzen
- Briers, J. D., Fercher, A. F. Retinal blood-flow visualization by means of laser speckle photography. Invest. Ophthalmol. Vis. Sci. 22, 255-259 (1982).
- Boas, D. A., Dunn, A. K. Laser speckle contrast imaging in biomedical optics. J. Biomed. Opt. 15, 011109-011109 (2010).
- Dunn, A. K. Simultaneous imaging of total cerebral hemoglobin concentration, oxygenation, and blood flow during functional activation. Opt Lett. 28, 28-30 (2003).
- Devor, A. Coupling of the cortical hemodynamic response to cortical and thalamic neuronal activity. Proc Natl Acad Sci U S A. 102, 3822-3827 (2005).
- Ayata, C. Pronounced hypoperfusion during spreading depression in mouse cortex. J Cereb Blood Flow Metab. 24, 1172-1182 (2004).
- Jones, P. Simultaneous multispectral reflectance imaging and laser speckle flowmetry of cerebral blood flow and oxygen metabolism in focal cerebral ischemia. J. Biomed. Opt. 13, (2008).
- Dunn, A. K., Bolay, H., Moskowitz, M. A., Boas, D. A. Dynamic imaging of cerebral blood flow using laser speckle. J Cereb Blood Flow Metab. 21, 195-201 (2001).
- Dunn, A. K., Devor, A., Dale, A. M., Boas, D. A. Spatial extent of oxygen metabolism and hemodynamic changes during functional activation of the rat somatosensory cortex. Neuroimage. 27, 279-290 (2005).
- Farkas, E., Bari, F., Obrenovitch, T. P. Multi-modal imaging of anoxic depolarization and hemodynamic changes induced by cardiac arrest in the rat cerebral cortex. Neuroimage. 51, 734-742 (2010).
- Sakadzic, S. Simultaneous imaging of cerebral partial pressure of oxygen and blood flow during functional activation and cortical spreading depression. Appl. Opt. 48, (2009).
- Ponticorvo, A., Dunn, A. K. Simultaneous imaging of oxygen tension and blood flow in animals using a digital micromirror device. Opt Express. 18, 8160-8170 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten