Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Cultura rebanada de organotípicos que expresan GFP embriones de ratón de imágenes en tiempo real al crecimiento excesivo de Nervio Periférico
En este artículo
Resumen
Se presenta un método para preparar cortes organotípicos de embriones de ratón mitad de la gestación para el cultivo y la imagen de lapso de tiempo de extensión del nervio periférico.
Resumen
Para muchos fines, el cultivo de embriones de ratón ex vivo como rebanadas organotípicos es deseable. Por ejemplo, contamos con una línea de ratones transgénicos (tauGFP) en la que es exclusivamente la versión mejorada de la proteína verde fluorescente (EGFP) se expresa en todas las neuronas del sistema nervioso en desarrollo de una central y periférico, lo que permite la posibilidad de tanto en cine como la inervación de las patas delanteras y de manipular este proceso con las técnicas farmacológicas y genéticas 2. El parámetro más importante en el cultivo exitoso de las culturas rebanada tal es el método por el cual los cortes están preparados. Después de extensas pruebas de una variedad de métodos, hemos encontrado que un vibratomo es el mejor dispositivo posible para cortar los embriones de forma que de manera rutinaria como resultado una cultura que muestra la viabilidad en un período de varios días, y lo más importante, se desarrolla en una época de manera específica. Para mediados de la gestación de embriones, lo que incluye la consecuencia normal de los nervios espinales de la médula espinal y los ganglios de la raíz dorsal de sus objetivos en la periferia y la correcta determinación de tejido óseo y muscular.
En este trabajo se presenta un método para el procesamiento de embriones todo el día embrionario (E) E10 a E12 en 300 a 400 rebanadas micrómetro para el cultivo en un estándar de cultivo de tejidos incubadora, que pueden ser estudiados por hasta dos días después de la preparación rebanada. Fundamental para el éxito de este enfoque es el uso de un vibratome para cortar cada embrión de agarosa embebidos. Esto es seguido por el cultivo de los cortes en la cultura inserta Millicell membrana colocada sobre un pequeño volumen de medio, lo que resulta en una técnica de cultivo de la interfaz. Una camada con un promedio de siete embriones habitualmente produce por lo menos 14 sectores (2-3 porciones de la región extremidad anterior por embrión), que varía ligeramente debido a la edad de los embriones, así como el grosor de las rodajas. Alrededor del 80% de las rebanadas de cultivo muestran consecuencia del nervio, que puede ser medido througout el período de cultivo 2. Los resultados representativos utilizando la línea de ratón tauGFP se demuestran.
Protocolo
Parte 1: Preparación para el corte y el cultivo.
- Prepare 10 cm placas de cultivo con corte medio (DMEM, 25% 1x HBSS, el 25% de suero fetal bovino, 0,5% de glucosa, 1 mM de glutamina, 2,5 mM HEPES, pH 7,3) y de 3 cm Millicell-CM-cultura 0.4 micras inserta la membrana y mantener en la incubadora a 37 ° C y 5% de CO 2.
- Calentar el 4% de bajo punto de fusión de agarosa en PBS en el microondas y mantenerlo en la placa de calefacción para que quede aproximadamente a 37 ° C.
- Llenar 10 cm bacteriológicas placas de Petri con PBS (140 mM NaCl, 2,7 mM KCl, 10 mM Na 2 HPO 4, 1,8 mm de KH 2 PO 4) y el lugar en el hielo.
- Configure el dispositivo de refrigeración microtomo o asegurarse de que la bandeja de amortiguación y de refrigeración los elementos se almacenan en el congelador para pre-enfriar.
Parte 2: La inclusión de embriones.
- Diseccionar embriones del útero y las examinan con un microscopio invertido fluorescentes para detectar la expresión de GFP.
- Embriones en lugar de un plato invertido 10 cm Petri y orientarlos con tiras de papel Whatman para eliminar exceso de PBS.
- Aplicar agarosa en el embrión para fijarlo en esa posición. Vamos agarosa solidifique.
- Límite de la zona que rodea el embrión mediante el corte con una cuchilla de afeitar.
- Gire el embrión embebido hacia el otro lado.
- Aplicar más de agarosa en el tejido embrionario para asegurarse de que el embrión está plenamente integrado.
- Prepare bloque de agarosa con bordes limpios y de montaje en vibratome plato con Loctite 406, un pegamento especial similar a la "Krazy Glue".
Parte 3: Cortar procedimiento.
- Configure la bandeja de buffer pre-enfriado y el disipador de calor.
- Inserte el mandril con el tejido pegado y añade 1x HBSS (Ca 2 +-Mg 2 + libre de HBSS, 10 mM HEPES pH 7,3, 500 U / ml de penicilina / estreptomicina) hasta que esté cubierto.
- Insertar y fijar un precleaned (70% etanol) hoja de microtomo.
- Preparar 350 a 450 micras rodajas y transferirlos con pipetas Pasteur de vidrio acortado en placas de cultivo de tejidos se mantienen en hielo.
- Con un par de pinzas, retire con cuidado de cada rebanada de agarosa y transferencia a membranas Millicell cultura. Aproximadamente 4 rebanadas pueden ser cultivadas en una membrana de tejido en una placa de 10 cm de cultura llena de 6 mL de medio de cultivo.
- Incubar cortes a 37 ° C y 5% de CO 2 (medio de cultivo: DMEM, 25% 1x HBSS, el 25% de suero fetal bovino, 0,5% de glucosa, 1 mM glutamina, 2,5 mM HEPES, pH 7,3). Si uno realiza un lapso de tiempo la serie de imágenes se debe mantener el volumen de medio de constantes. En el caso de series de tiempo de imágenes para un corto período de tiempo es suficiente para dejar el medio como es. Para períodos más largos cultura cambia después de 12-20 horas se recomienda.
Parte 4: fruto de imágenes del nervio espinal en el microscopio.
- Imagen de los nervios raquídeos a la colocación de una placa de tejido de 10 cm de la cultura, que contiene las membranas Millicell la cultura con las rebanadas, con un microscopio fluorescente en posición vertical.
- Etiqueta de la orientación de las membranas de la cultura Millicell en platina del microscopio para posicionar correctamente en el punto de imagen la próxima vez.
- Consecuencia la imagen del nervio espinal utilizando 4x (apertura numérica [NA] 0,1), 10x (NA 0,3) o 20x (NA 0.5) objetivos.
La figura 1 muestra una serie de imágenes que representan el fruto del nervio espinal durante 20 horas de cultura con los objetivos de 4x y 10x.
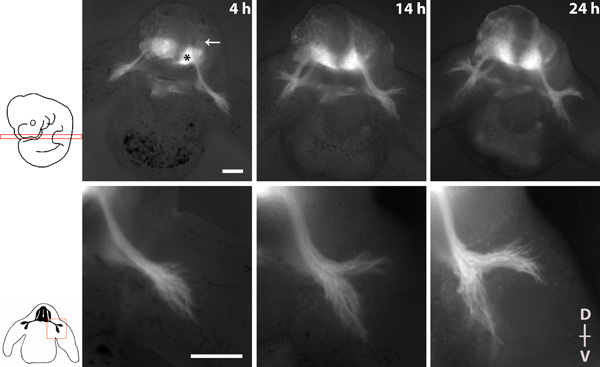
Figura 1 Imagen serie de consecuencia del nervio espinal en un corte transversal de un embrión tauGPF homocigotos. * = Neuronas motoras de la médula espinal ventral, flecha = DRG. El dorsal (D)-ventral (V), el eje de la rebanada se indica. Scalebars: 200 micras.
Access restricted. Please log in or start a trial to view this content.
Discusión
En una amplia comparación de los métodos para preparar cultivos de embriones rebanada de embriones de ratón mitad de la gestación (E10 - E12), hemos observado que un vibratomo produce sin lugar a dudas los resultados más confiables con respecto tanto a la viabilidad general de las culturas y la reproducibilidad de los los patrones de derivación del nervio. Por el contrario, las rebanadas de preparados con un helicóptero del tejido McIlwain 3 resultó ser completamente inviable. Lo que originalmente se ...
Access restricted. Please log in or start a trial to view this content.
Agradecimientos
Los autores reconocen la fuente original de la idea de llevar a cabo la cultura rebanada en cinco embriones de ratón. Queremos agradecer a Joachim Kirsch por su generoso apoyo científico y Degen Anna para que actúen como nuestros gofer durante el rodaje. Este trabajo fue financiado por la Fundación Alemana de Investigación (Deutsche Forschungsgemeinschaft: Sonderforschungsbereich 488, Teilprojekt B7/B9) y la Universidad de Heidelberg (Excelencia racimo redes celulares).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| HBSS 10x | GIBCO, by Life Technologies | 14180 | |
| Dissection tools | Fine Science Tools | various | |
| L.M.P. agarose | Invitrogen | 15517-022 | |
| Whatmann paper | Whatman, GE Healthcare | 3030917 | |
| Shortened firepolished pipettes | |||
| DMEM | GIBCO, by Life Technologies | 41966 | |
| FBS | GIBCO, by Life Technologies | 10270-106 | |
| Pen Strep | GIBCO, by Life Technologies | 15140 | |
| L-glutamine 100x | GIBCO, by Life Technologies | 25030 | |
| Vibratome | Microm International | HM 650 V | |
| Fluorescent microscope | Olympus Corporation | BX61WI | |
| analySIS | Soft Imaging System | ||
| Millicell-CM inserts | EMD Millipore | PICMORG 50 | |
| 10 cm culture plates | Greiner Bio-One | 633171 | |
| LOCTITE 406 | Henkel Corp | 142580 | |
| Razor blades | Thermo Fisher Scientific, Inc. | none | |
| Dissecting microscope | Nikon Instruments | SMZ800 | |
| HEPES | Carl Roth Gmbh | 9105.2 | |
| Glucose | Sigma-Aldrich | G7021 | |
| x4 objective | Olympus Corporation | PL series | |
| x10 objective | Olympus Corporation | UPLFL –PH series | |
| Filter | Olympus Corporation | U-MNIBA2 | |
| CCD camera | Soft Imaging System | SIS F-View II | |
| Equipment for heated chamber | Leica Microsystems | CTI-Controller 3700 and incubator S #11531171 |
Referencias
- Tucker, K. L., Meyer, M., Barde, Y. A. Neurotrophins are required for nerve growth during development. Nat Neurosci. 4, 29-37 (2001).
- Brachmann, I., Jakubick, V. C., Shaked, M., Unsicker, K., Tucker, K. L. A simple slice culture system for the imaging of nerve development in embryonic mouse. Dev Dyn. 236, 3514-3523 (2007).
- Collingridge, G. L. The brain slice preparation: a tribute to the pioneer Henry McIlwain. Journal of neuroscience methods. 59, 5-9 (1995).
- Katz, L. C. Local circuitry of identified projection neurons in cat visual cortex brain slices. J Neurosci. 7, 1223-1249 (1987).
- Hotary, K. B., Landmesser, L. T., Tosney, K. W. Embryo slices. Methods Cell Biol. 51, 109-124 (1996).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados