このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
末梢神経突起伸長のリアルタイムイメージングのためのGFP発現マウス胚の器官型スライス培養
要約
我々は、末梢神経突起伸長の栽培とタイムラプスイメージングのための妊娠中期のマウス胚の器官型スライスを準備する方法を提示する。
要約
多くの目的のために、器官型スライスなどのマウス胚のex vivoでの栽培が望ましいです。例えば、我々は両方のフィルムの神経支配の可能性をできるように、緑色蛍光タンパク質(EGFP)の拡張版を独占的に開発し、中枢および末梢神経系1のすべてのニューロンに発現するトランスジェニックマウスのライン(tauGFP)を採用前肢および薬理学的および遺伝学的手法2でこのプロセスを操作する。このようなスライス培養の成功した栽培で最も重要なパラメータは、スライスが準備される方法です。種々の方法の広範なテストの後、我々は、ビブラトームは、彼らが日常的に数日間の期間にわたって実行可能性を示す文化につながるような胚をスライスする最良のデバイスであり、そして最も重要なことは、年齢で発症することを見出した固有の方法。妊娠中期胚の場合、これは脊髄および後根神経節から周囲と骨格と筋肉組織の適切な決定で、その目標への脊髄神経の正常な伸長を含みます。
スライス標本の後二日するまで学ぶことができる標準的な組織培養インキュベーター、栽培は400マイクロメートルのスライス - この作品では、我々は300に(E)E10 E12に日胚の全胚を処理するための手法を提案する。このアプローチの成功のための重要な各アガロース包埋の胚をスライスするビブラトームを使用することがあります。これは、インタフェースの培養技術で、その結果中小の小さな体積に課せMillicell文化膜インサート、時のスライスの栽培が続いている。 7胚の平均で一リットルは、日常的にわずかに胚の年齢までだけでなく、スライスの厚さにより変動する少なくとも14スライス(胚あたりの前肢地域の2-3スライス)を生成する。培養スライスの約80%が培養期間2 througout測定可能な神経突起伸長を、示す。 tauGFPのマウスラインを用いて代表的な結果が実証されています。
プロトコル
パート1:スライスと培養のための準備。
- 培地(DMEM、25%1X HBSS、25%ウシ胎児血清、0.5%グルコース、1mMのグルタミン、2.5mMのHEPES、pH7.3)に、3 cmのMillicell - CM 0.4 -μmの文化をスライスして10cmの組織培養プレートを準備します。膜インサートと37℃のインキュベーター内で維持℃、5%CO 2。
- それは約37にとどまるように電子レンジでPBS中4%低融点アガロースを加熱し、加熱板上でそれを維持℃に
- PBS(140mMのNaCl、2.7 mMのKCl、10mMののNa 2 HPO 4、1.8mmのKH 2 PO 4)と氷上の場所で10cmの細菌シャーレを埋める。
- ミクロトームの冷却装置を設定するか、そのバッファのトレイと冷却要素がそれより前のクールに冷凍庫に保存されていることを確認してください。
パート2:胚の埋め込み。
- 子宮から胚を摘出し、GFPの発現を確認するために倒立蛍光顕微鏡でそれらを調べる。
- 過度のPBSを除去するワットマン濾紙片を使用して反転10センチのシャーレと向き、それらの上に置いて胚。
- この位置でそれを修正するために胚のアガロースを適用します。アガロースが固化してみましょう。
- かみそりの刃で切断して胚を囲む領域を制限する。
- その反対側に埋め込まれた胚を回転させる。
- 胚が完全に埋め込まれていることを保証するために胚組織に追加のアガロースを適用します。
- クリーンなエッジを持つアガロースブロックを準備し、ロックタイト406"クレイジー接着剤"に似た特殊な接着剤を使用してビブラトームチャック上にマウント。
パート3:手順をスライス。
- あらかじめ冷却したバッファートレイと冷却要素を設定します。
- 接着組織でチャックを挿入し、カバーまで、1X HBSSを( のCa 2 +とMg 2 +フリーHBSS、10mMのHEPES緩衝液、pH7.3、500 U / mlペニシリン/ストレプトマイシン)を追加。
- precleaned(70%エタノール)ミクロトームの刃を挿入し、固定する。
- 450μmのスライスと氷上に置き、組織培養プレートに短縮ガラスパスツールピペットを用いてそれらを転送する - 350を準備します。
- ピンセットを使用して、慎重に各スライスからアガロースを削除し、Millicellの文化膜に移す。約4スライスは、培養液6 mLで満たされた10cmの組織培養プレートの1つの膜上で培養することができる。
- 37スライスをインキュベート℃、5%CO 2(培養培地:DMEM、25%1X HBSS、25%ウシ胎児血清、0.5%グルコース、1mMのグルタミン、2.5mMのHEPES、pHは7.3)。いずれかのタイムラプスイメージング系列1を実行する場合媒質定数の体積を保持する必要があります。短い時間枠のための時限イメージングシリーズのケースでは、そのままメディアを残すのに十分です。より長い培養期間のために12〜20時間後の変更は推奨されています。
パート4:顕微鏡でイメージング脊髄神経突起伸長。
- 直立蛍光顕微鏡下でのスライス、とMillicell培養膜を含む、10cmの組織培養プレートを配置し、画像脊髄神経。
- 次の撮影時間の時点の間に正しく配置するために顕微鏡のステージ上Millicellの文化膜の方向にラベルを付けます。
- 4 × 10倍(開口数[NA] 0.1)、(NA 0.3)、または20倍(NA 0.5)の目標を使用してイメージ脊髄神経突起伸長。
図1は、4倍、10倍の目標と文化の20時間の間に脊髄神経の伸長を描いたイメージングシリーズを示しています。
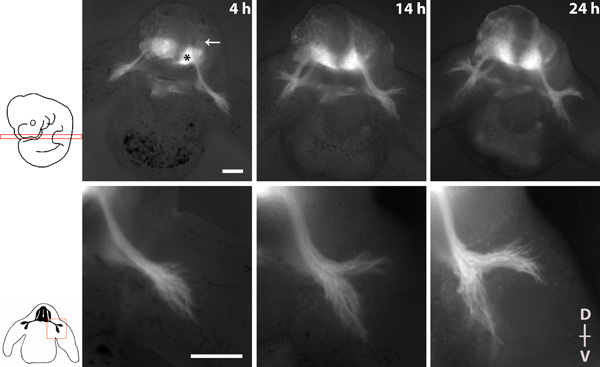
ホモ接合tauGPFの胚の横スライスで脊髄神経の突起伸長の図1イメージングシリーズ。腹側脊髄の* =運動ニューロン、矢印= DRG。スライスの背側(D) - 腹側(V)軸が示されています。スケールバー:200μmの。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
妊娠中期のマウス胚の胚切片培養(E10 - E12)を調製する方法の広範な比較では、我々はビブラトームは質問なしでの文化の全体的な実行可能性との再現性の両方に関して最も信頼性の高い結果を生じることを観察した神経突起伸長のパターン。対照的に、マッキルウェーン組織チョッパ3を用いて調製したスライスは、完全に生存不能であることが判明した。私たちは、もともと?...
Access restricted. Please log in or start a trial to view this content.
謝辞
著者らは、マウス胚5時切片培養を行うためにアイデアの元のソースを認めます。私たちは、撮影中に私たちの使い走りとして機能するために寛大な科学的なサポートとアンナデジャンためのヨアヒムキルシュに感謝します。とハイデルベルク大学(エクセレンスクラスターセルラーネットワーク):この作品は、ドイツ研究協会(Sonderforschungsbereich 488、Teilprojekt B7/B9ドイツ学術振興)によって賄われていた。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| HBSS 10x | GIBCO, by Life Technologies | 14180 | |
| Dissection tools | Fine Science Tools | various | |
| L.M.P. agarose | Invitrogen | 15517-022 | |
| Whatmann paper | Whatman, GE Healthcare | 3030917 | |
| Shortened firepolished pipettes | |||
| DMEM | GIBCO, by Life Technologies | 41966 | |
| FBS | GIBCO, by Life Technologies | 10270-106 | |
| Pen Strep | GIBCO, by Life Technologies | 15140 | |
| L-glutamine 100x | GIBCO, by Life Technologies | 25030 | |
| Vibratome | Microm International | HM 650 V | |
| Fluorescent microscope | Olympus Corporation | BX61WI | |
| analySIS | Soft Imaging System | ||
| Millicell-CM inserts | EMD Millipore | PICMORG 50 | |
| 10 cm culture plates | Greiner Bio-One | 633171 | |
| LOCTITE 406 | Henkel Corp | 142580 | |
| Razor blades | Thermo Fisher Scientific, Inc. | none | |
| Dissecting microscope | Nikon Instruments | SMZ800 | |
| HEPES | Carl Roth Gmbh | 9105.2 | |
| Glucose | Sigma-Aldrich | G7021 | |
| x4 objective | Olympus Corporation | PL series | |
| x10 objective | Olympus Corporation | UPLFL –PH series | |
| Filter | Olympus Corporation | U-MNIBA2 | |
| CCD camera | Soft Imaging System | SIS F-View II | |
| Equipment for heated chamber | Leica Microsystems | CTI-Controller 3700 and incubator S #11531171 |
参考文献
- Tucker, K. L., Meyer, M., Barde, Y. A. Neurotrophins are required for nerve growth during development. Nat Neurosci. 4, 29-37 (2001).
- Brachmann, I., Jakubick, V. C., Shaked, M., Unsicker, K., Tucker, K. L. A simple slice culture system for the imaging of nerve development in embryonic mouse. Dev Dyn. 236, 3514-3523 (2007).
- Collingridge, G. L. The brain slice preparation: a tribute to the pioneer Henry McIlwain. Journal of neuroscience methods. 59, 5-9 (1995).
- Katz, L. C. Local circuitry of identified projection neurons in cat visual cortex brain slices. J Neurosci. 7, 1223-1249 (1987).
- Hotary, K. B., Landmesser, L. T., Tosney, K. W. Embryo slices. Methods Cell Biol. 51, 109-124 (1996).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved