Method Article
Emparejados grabaciones patch clamp de neurona motora y el músculo esquelético de destino en el pez cebra
En este artículo
Resumen
Las larvas de pez cebra representan el sistema de vertebrados primer modelo que permite la grabación simultánea de patch clamp de una neurona motora espinal y el objetivo del músculo esquelético. Este video muestra los métodos microscópicos para identificar un CaP segmentaria neurona motora y las células diana muscular, así como las metodologías para la grabación de cada tipo de célula.
Resumen
Las larvas de pez cebra representan el sistema de vertebrados primer modelo que permite la grabación simultánea de patch clamp de una neurona motora espinal y los músculos objetivo. Esto es una consecuencia directa de la accesibilidad a ambos tipos de células y su capacidad para distinguir visualmente el único de la PAC segmental neuronal motor sobre la base de la morfología y localización. Este video muestra los métodos microscópicos para identificar un CaP neurona motora y las células diana muscular, así como las metodologías para la grabación de cada tipo de célula. Identificación de la PAC neurona motora tipo se confirma mediante la cumplimentación tinte sea o por las características biofísicas, como forma de onda del potencial de acción y resistencia de entrada de la célula. Neurona motora grabaciones habitualmente duran una hora que permita a largo plazo a partir de múltiples grabaciones de las diferentes células del músculo blanco. El control sobre el patrón de activación neuronal motor permite realizar mediciones de la frecuencia de la dependencia de la transmisión sináptica en la unión neuromuscular. Debido al gran tamaño cuántico y el bajo nivel de ruido proporciona sujeción total voltaje de la célula, todos los eventos unitarios se pueden resolver en el músculo. Esta característica permite el estudio de las propiedades básicas sináptica como propiedades de liberación, reciclaje de vesículas, así como la depresión sináptica y la facilitación. Las ventajas que ofrece esta preparación en vivo eclipse de anteriores modelos de sistemas neuromuscular en la que estudiaron las neuronas motoras son generalmente estimuladas por electrodos extracelulares y los músculos son demasiado grandes para la abrazadera de toda mancha de la célula. La preparación del pez cebra puede ser objeto de combinar el análisis electrofisiológico con una amplia gama de enfoques, incluyendo las líneas transgénicas, caída morfolino, la intervención farmacológica y de imágenes in vivo. Estos enfoques, junto con el creciente número de modelos de enfermedad neuromuscular proporcionada por líneas mutantes de pez cebra, abrir la puerta a una nueva comprensión de los derechos humanos trastornos neuromusculares.
Protocolo
1. Preparación de los peces para grabaciones de pares
- Antes de comenzar el procedimiento, preparar cinco soluciones clave, que incluyen: solución de baño, baño de solución con tricaína (MS222), solución de baño con formamida, la solución de las neuronas internas y la solución de los músculos internos.
- A continuación, se recoge una sola larva del pez cebra entre las edades de 72 a 96 horas y el lugar en la solución de baño con tricaína. Dentro de un minuto de exposición a la anestesia, los peces no responden al tacto.
- Coloque el pescado en la parte superior de un plato de plástico y, utilizando un microscopio estereoscópico, decapitar con una hoja de doble filo de la navaja.
- La transferencia de los peces a una cámara de grabación de vidrio recubierto con Sylgard y lleno de solución del baño. Fijar en cada extremo mediante la inserción de electrólisis afilada pines de tungsteno a través de la notocorda.
- Crear un colgajo de piel cerca del extremo rostral del pez con un alfiler que proporcionan un agarre adecuado para un par de pinzas finas. Retire la piel que lo recubre por agarrarlo cerca del pin rostral con un par de pinzas finas. Pele lentamente en dirección caudal para eliminar la piel.
- Tratar a los peces con 3 ml de solución del baño con formamida durante 3-5 minutos para bloquear las contracciones musculares que pueden interferir con las grabaciones. Lavar 5 veces con solución de baño normal. Eliminar parte de la capa superficial de los músculos durante 5 a 6 segmentos con cuidado el desguace con el lado de un alfiler de tungsteno.
- La transferencia de los peces a un microscopio vertical situado en una jaula de Faraday para proteger el ruido eléctrico. El microscopio está equipado con un escenario fijo, larga distancia de trabajo objetivo de 40x y zoom de 0,5 a 4 veces. El microscopio está montado en una etapa de traducción XY motorizado con el fin de mover la preparación entre el nervio y el músculo con alta potencia. El uso de la óptica de contraste de interferencia diferencial ayuda a visualizar las neuronas.
- Por debajo de 0,5 x zoom, use un amplio diámetro de 15 micras pipeta para retirar el músculo que recubre y exponer la médula espinal. La presión negativa es aplicada a través de una jeringa de 3 ml desechables y las células musculares son eliminados uno por uno. Este procedimiento se repite de 5 a 6 segmentos dorsal del músculo esquelético. La misma variedad pipeta diámetro se utiliza para eliminar también las dos capas superiores de los músculos ventrales para obtener objetivos del músculo esquelético rápido.
- Esto completa la preparación para las grabaciones de pares y el zoom microscopio se aumenta a aproximadamente 1,6 veces.
2. Grabaciones pares de CaP neurona motora y las células del músculo blanco
- Los segmentos de limpieza son escaneados para localizar las neuronas CaP. Cada hemi-segmento de la médula espinal contiene un gran diámetro, de 10 micras, Cap neurona motora. Este soma en forma de lágrima se encuentra superficialmente bajo la duramadre espinal, cerca del extremo más caudal de la frontera segmentaria. Una neurona de la PAC es elegido para la grabación y el músculo ventral en el segmento adyacente caudal se analiza para comprobar la integridad.
- Dos electrodos se colocan parches para la grabación, uno para la neurona y una segunda para el músculo. El electrodo superior tiene una inclinación profunda de la penetración de la dura dura espinal y apertura de la punta de aproximadamente 2 micras. El electrodo inferior tiene una inclinación más pronunciada para la grabación de la abrazadera de baja resistencia a la tensión de los músculos esqueléticos
- La posición del electrodo de la neurona en un ángulo de aproximadamente 30 grados para penetrar en la duramadre espinal, cerca de la mitad del segmento rostral a la neurona CaP seleccionado. Avanzar en el electrodo con un manipulador de accionamiento axial mientras se aplica una suave presión positiva continua de aproximadamente 60 milímetros de mercurio. A medida que el electrodo se rompe a través de la duramadre, la PAC, las neuronas pueden ser desplazados por la perfusión de los electrodos, lo que requiere un reajuste de la atención.
- Cuando el electrodo toca la tapa de presión soma neuronal positiva se libera y por lo general resulta en la formación inmediata de un sello gigaohm. Sin embargo, en algunos casos en los que el sello no se forma, se hace necesario aplicar una suave presión negativa. Después de la formación del sello, el potencial del electrodo se ajusta a 80 mV y la aplicación de presión negativa se rompe la membrana celular. La neurona CaP se caracteriza por una resistencia de entrada de 140 a 180 Mega-ohmios y un potencial de acción que rebasa 40 milivoltios. Esta es la prueba mediante la inyección aumentando gradualmente los pasos de despolarización en pinza de corriente hasta que el potencial de acción se suscitó.
- A continuación, el microscopio se traslada a los músculos ventrales con el traductor XY motorizado con alta potencia. Una célula de músculo rápido se elige en el campo de destino.
- El electrodo del músculo se avanza hacia la célula del músculo blanco bajo presión positiva, que al ser liberado, forma un sello gigaohm. El potencial del electrodo se ajusta a -50 milivoltios para inactivar los canales de sodio y bajo succión suave de la membrana celular se rompió. Una caída en la resistencia de 100 a 200 Mega-ohmios y la repentina aparición de los grandes transitorios capacitivos entrada señales.
- Para poner a pruebapara el registro de parejas, el motor de la neurona se despolariza por medio de inyecciones progresivamente mayor de la corriente hasta un potencial de acción se suscitó. En este punto, una corriente de placa terminal debe ser obtenido en el músculo. Fomento permanente de la motorneuron a 1 Hertz resultados en las corrientes de placa terminal sin fallos. A medida que la frecuencia del estímulo se incrementa a 100 Hertz las corrientes de placa terminal fluctúan en amplitud y se someten a reducción funcional dentro de los 10 segundos de estimulación.
3. Resultados representante
Normalmente, la grabación de las neuronas es estable durante un máximo de una hora, pero las células musculares se deterioran como se refleja en un aumento de la resistencia en serie. Cuando esto ocurre, el experimento está bien terminado o de otra célula muscular es el parche una vez montado. Todas las grabaciones debe ser completado en una hora.
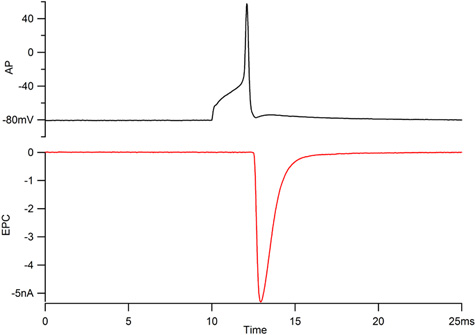
Figura 1. Grabaciones del potencial de acción motorneuron (AP, arriba) y la placa terminal muscular asociada actual (EPC, abajo). El potencial de acción de una neurona de la PAC debería sobrepasar 40 mV y el EPC debería aumentar a 300 microsegundos y la decadencia a lo largo de un curso de tiempo exponencial con una constante de tiempo menor de 1 mseg.
| Nombre | Receta |
| Solución de baño (en mM) | 134 NaCl, 2,9 KCl, 2,1 CaCl 2, 1,2 MgCl 2, 10 glucosa, 10 Na-HEPES, pH 7,8 |
| Baño de solución con tricaína | Baño de solución que contiene 0,02% tricaína |
| Baño de solución con formamida | Baño de solución que contiene 2 millones de formamida |
| Neurona interna de la solución (en mM) | 115 K-gluconato, 15 KCl, 2 MgCl 2, 10 K-HEPES, 5 K-EGTA, 4 Mg-ATP, pH 7,2 |
| Los músculos internos de la solución (en mM) | 120 KCl, 10 K-HEPES, 5 BAPTA, pH 7,4 |
Tabla 1. Solutions.
Discusión
Hemos estado utilizando el pez cebra grabaciones pares (Wen y Brehm, 2005), principalmente para estudiar los procesos de liberación de la vesícula y el reciclaje durante la estimulación de alta frecuencia. Este proceso se interrumpe en los mutantes de la motilidad en el que la transmisión sináptica normal se ve comprometida debido a mutaciones puntuales en los principales componentes sináptica. Por ejemplo, las mutaciones que alteran los agregados postsináptica de los receptores (Ono et al., 2001, 2002, 2004) y la síntesis del transmisor de pre-sináptica (Wang et al., 2008) como resultado de las Naciones Unidas coordinado natación. Grabaciones de pares de proporcionar la información que puede identificar la fuente del defecto funcional, vinculando así el comportamiento, genética y fisiología. Ahora debería ser posible diseccionar los procesos subyacentes a la transmisión sináptica a través de la expresión transitoria de la PAC motor neuronas usando promotores juiciosa. De esta manera genes dominantes negativos o mutados pueden ser expresados específicamente en las neuronas y se determinó tanto las consecuencias del comportamiento y electrofisiológicos. La ventaja adicional que ofrece la configuración de célula entera permite la diálisis de la soma de la PAC con los agentes que potencialmente pueden alterar reciclaje de vesículas, como las toxinas clostridiales y los buffers de calcio. Debido a la corta distancia entre el soma y el músculo, la difusión debe ocurrir dentro del marco de tiempo de las grabaciones. El potencial de esta preparación ha comenzado a ser explotado. La transparencia de los peces en este lugar la edad y superficial de las sinapsis también facilita el uso de herramientas ópticas (Fletcho y O'Malley, 1997; Fletcho y Higashijima, 2004). Hemos tenido mucho éxito en la medición de endo y exocitosis en los peces que viven con tintes FM y los indicadores genéticos, como Synaptophluorin (Li et al., 2003). Además, las toxinas conjugado fluorescente se puede utilizar para etiquetar las proteínas sinápticas de imágenes de peces vivos (Ibáñez-Tallon et al., 2004). Dada la simplicidad de esta preparación es una gran promesa para el futuro estudio.
Divulgaciones
Agradecimientos
Financiado por el NIH (NS-18205).
Materiales
| Name | Company | Catalog Number | Comments |
| Pneumatic transducer tester | Fluke Biomedical | DPM1B | |
| 0.002 x 3 inch tungsten rod | A-M Systems | 715000 | |
| Sylgard 184 Elastomer | Dow Corning | The thickness of application will affect the DIC optics |
Referencias
- Fetcho, J. R., O'Malley, D. Imaging neuronal networks in behaving animals. Current Opinion in Neurobiology. 7, 832-838 (1997).
- Fetcho, J. R., S, H. i. g. a. s. h. i. j. i. m. a. Optical and genetic approaches toward understanding neuronal circuits in zebrafish. Integr Comp Biol. 44, 57-70 (2004).
- Ibañez-Tallon, I., Wen, H., Miwa, J., Xing, J., Aslantas-Tekinay, A., Ono, F., Brehm, P., Heintz, N. Tethering naturally occurring peptide toxins for cell autonomous modulation of ion channels and receptors in vivo. Neuron. 43, 305-311 (2004).
- Li, W., Ono, F., Brehm, P. Optical measurements of presynaptic release in mutant zebrafish lacking postsynaptic receptors. J. Neuroscience. , 23-10467 (2003).
- Ono, F., Mandel, G., Brehm, P. Acetylcholine receptors direct rapsyn clusters to the neuromuscular synapse in zebrafish. J. Neuroscience. 24, 475-5481 (2004).
- Ono, F., Shcherbatko, A., Higashijima, S., Fetcho, J., Mandel, G., Brehm, P. Paralytic zebrafish lacking ACh receptors fail to localize rapsyn clusters to the synapse. J. Neuroscience. 21, 5439-5448 (2001).
- Ono, F., Shcherbatko, A., Higashijima, S., Mandel, G., Brehm, P. The zebrafish motility mutant twitch once reveals new roles for rapsyn in synaptic function. J. Neuroscience. 22, 6491-6498 (2002).
- Wang, M., Wen, H., Brehm, P. Function of neuromuscular synapses in the zebrafish choline-acetyltransferase mutant bajan. J Neurophysiol. , 100-104 (2008).
- Wen, H., Brehm, P. Paired motor-neuron muscle recordings in zebrafish test the receptor blockade model for shaping synaptic current. J. Neuroscience. 25, 8104-8111 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados