Method Article
Jumelés Recordings Patch Clamp du motoneurone et de muscle ciblé squelettiques chez le poisson zèbre
Dans cet article
Résumé
Les larves de poisson zèbre constituent le système de premier vertébré modèle pour permettre l'enregistrement simultané de patch-clamp à partir d'un motoneurone spinal et de cibler des muscles squelettiques. Cette vidéo illustre les méthodes microscopiques utilisées pour identifier un CAP segmentaire motoneurone et les cellules musculaires cibles ainsi que les méthodologies pour l'enregistrement de chaque type de cellule.
Résumé
Les larves de poisson zèbre constituent le système de premier vertébré modèle pour permettre l'enregistrement simultané de patch-clamp à partir d'un motoneurone spinal et de cibler des muscles. Ceci est une conséquence directe de l'accessibilité pour les deux types de cellules et la capacité de distinguer visuellement la PAC seule segmentaire motoneurone sur la base de la morphologie et la localisation. Cette vidéo illustre les méthodes microscopiques utilisées pour identifier un CAP motoneurone et les cellules musculaires cibles ainsi que les méthodologies pour l'enregistrement de chaque type de cellule. Identification de la PAC de type motoneurone est confirmée par le remplissage de teinture soit ou par les caractéristiques biophysiques comme forme d'onde du potentiel d'action et de résistance d'entrée cellulaire. Motoneurone enregistrements régulièrement dernière pendant une heure permettant à long terme des enregistrements de plusieurs différentes cellules du muscle cible. Le contrôle sur le modèle de mise à feu du neurone moteur permet des mesures de la fréquence-dépendance de la transmission synaptique à la jonction neuromusculaire. Grâce à une grande taille quantique et le faible niveau de bruit fournies par la cellule de tension pince ensemble, tous les événements unitaires peuvent être résolus dans le muscle. Cette fonctionnalité permet d'étudier les propriétés de base synaptiques tels que les propriétés de libération, le recyclage des vésicules, ainsi que la dépression synaptique et la facilitation. Les avantages offerts par cette in vivo la préparation précédente éclipse les systèmes modèles étudiés neuromusculaire où les neurones moteurs-sont généralement stimulé par des électrodes extracellulaires et les muscles sont trop gros pour pince cellules correctif ensemble. La préparation de poisson zèbre se prête à une analyse électrophysiologique combinant avec un large éventail d'approches, notamment des lignées transgéniques, knockdown morpholino, pharmacologiques et d'imagerie in vivo. Ces approches, couplé avec le nombre croissant de modèles de maladies neuromusculaires fournies par lignées mutantes du poisson zèbre, ouvrir la porte à une nouvelle compréhension de l'humain des troubles neuromusculaires.
Protocole
1. Préparation des poissons pour les enregistrements appariés
- Avant de commencer la procédure, préparer cinq solutions clés, qui comprennent: Solution de bain, la solution de bain avec tricaïne (MS222), solution du bain avec le formamide, Neuron interne Solution et Solution musculaire interne.
- Ensuite, recueillir une seule larve de poisson zèbre âgés de 72 à 96 heures et le placer dans la solution de bain avec tricaïne. En une minute d'exposition à l'anesthésie, le poisson ne répond pas à toucher.
- Placer le poisson sur le dessus d'un plat de plastique et, en utilisant un microscope stéréoscopique, décapiter avec une lame de rasoir à double tranchant.
- Transférer le poisson à une chambre d'enregistrement de verre revêtu d'Sylgard et rempli avec la solution de bain. Fixer à chaque extrémité en insérant broches de tungstène électrolytiquement aiguisé par la notochorde.
- Créer un lambeau de peau à proximité de la fin rostrale du poisson avec une épingle qui offrira une adhérence suffisante pour une paire de pinces fines. Retirez la peau recouvrant en le saisissant à proximité de la broche rostrale avec une paire de pinces fines. Peler lentement dans la direction caudale pour enlever la peau.
- Traiter le poisson avec 3 ml de solution du bain avec le formamide pendant 3-5 minutes pour bloquer les contractions musculaires qui pourraient interférer avec les enregistrements. Laver 5 fois avec la solution de bain normal. Retirer une partie de la couche superficielle des muscles pendant 5 à 6 segments par un léger casse avec le côté d'une épingle de tungstène.
- Transférer le poisson à un microscope droit situé dans une cage de Faraday pour protéger du bruit électrique. Le microscope est équipé d'une scène fixe, longue distance de travail objective 40x et zoom de 0,5 à 4x. Le microscope est monté sur une platine motorisée XY de traduction afin de déplacer la préparation entre le nerf et le muscle sous haute puissance. L'utilisation de l'optique interférence différentielle de contraste permet de visualiser les neurones.
- Moins de 0.5 x zoom, utilisez un large alésage 15 microns pipette pour retirer les muscles sus-et exposer la moelle épinière. Une pression négative est appliquée à travers une seringue de 3 cc jetables et les cellules musculaires sont enlevés un par un. Cette procédure est répétée pour 5 à 6 segments dorsaux du muscle squelettique. La même largeur alésage pipette est utilisée aussi enlever les deux couches supérieures du muscle ventral pour obtenir cibles muscle rapide du squelette.
- Ceci achève la préparation pour les enregistrements appariés et le zoom microscope est porté à environ 1.6x.
2. Enregistrements paires de CaP motoneurone et les cellules musculaires cibles
- Les segments nettoyées sont scannés pour localiser les neurones de la PAC. Chaque hémi-segment de la moelle épinière contient un grand diamètre de 10 microns, Cap motoneurone. Cette forme de larme Soma est situé superficiellement sous la mère spinale à proximité de l'extrémité la plus caudale de la frontière segmentaire. Un neurone PAC est choisi pour l'enregistrement et du muscle cible ventrale dans le segment adjacent caudale est scanné pour vérifier l'intégrité.
- Deux électrodes de patch sont positionnés pour l'enregistrement, un pour le neurone et un second pour le muscle. L'électrode supérieure a un cône peu profonde pour la pénétration de la dure-mère spinale et l'ouverture de pointe d'environ 2 microns. L'électrode inférieure a une pente plus conique pour l'enregistrement de la résistance pince basse tension du muscle squelettique
- Position de l'électrode neurone à un angle de 30 degrés environ pour pénétrer le spinale, environ un demi-segment rostrale au neurone CaP sélectionnés. Advance l'électrode à l'aide d'un manipulateur d'entraînement axial tout en appliquant une légère pression positive continue d'environ 60 millimètres de mercure. Comme l'électrode à travers les pauses-mère, le neurone CAP peuvent être déplacées par la perfusion de l'électrode, nécessitant un réajustement de la mise au point.
- Quand l'électrode touche la PAC neurone Soma pression positive est libéré et se traduit généralement par la formation immédiate d'un sceau gigaohm. Toutefois, dans certains cas où un joint ne se forme, il devient nécessaire d'appliquer une pression douce négative. Après la formation du joint, le potentiel de l'électrode est ajustée à 80 mV et l'application d'une pression négative des ruptures de la membrane cellulaire. Le neurone PAC est caractérisée par une résistance d'entrée de 140 à 180 méga-ohms et un potentiel d'action que les dépassements 40 millivolts. Cela a été testé en injectant progressivement croissante étapes de dépolarisation sous pince de courant jusqu'à ce que le potentiel d'action est déclenchée.
- Ensuite, le microscope est relocalisé au muscle ventral à l'aide du traducteur XY motorisée de moins de puissance élevée. Une cellule de muscle rapide est choisi parmi le champ cible.
- L'électrode de muscle est avancé vers la cellule musculaire cible sous pression positive, qui, lorsqu'il est libéré, forme un joint gigaohm. Le potentiel d'électrode est ajustée à -50 millivolts pour inactiver les canaux sodiques et sous aspirer doucement la membrane cellulaire est rompue. Une baisse de la résistance de 100 à 200 méga-ohms et l'apparition soudaine de la grande entrée de signaux transitoires capacitifs.
- Pour testerpour l'enregistrement couplé, le motoneurone est dépolarisée par des injections progressivement plus de courant jusqu'à ce qu'un potentiel d'action est déclenchée. A ce moment un courant plaque motrice devrait être obtenue dans le muscle. Une stimulation continue de la motoneurones au 1 résultats Hertz dans les courants de plaque motrice sans échec. Comme la fréquence de stimulation est augmentée à 100 Hertz plaque motrice des courants fluctuent en amplitude et en subissent l'épuisement fonctionnels dans les 10 secondes de stimulation.
3. Les résultats représentatifs
Généralement, l'enregistrement neurone est stable jusqu'à une heure, mais les cellules musculaires se détériorent comme en témoignent comme une augmentation de la résistance série. Lorsque cela se produit l'expérience est terminée soit ou d'une autre cellule musculaire est serré correctif. Tous les enregistrements doivent être terminées dans une heure.
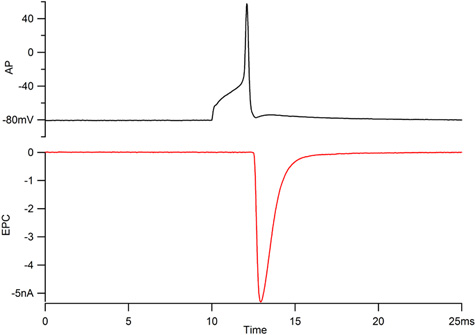
Figure 1. Enregistrements du potentiel d'action des motoneurones (AP, en haut) et le plateau vertébral musculaire associée actuelle (EPC, en bas). Le potentiel d'action pour un neurone PAC devrait dépassement 40 mV et l'EPC devrait augmenter à moins de 300 msec et la décomposition le long d'un cours à temps exponentiel avec une constante de temps de moins de 1 ms.
| Nom | Recette |
| Solution de bain (en mM) | 134 NaCl, KCl 2,9, CaCl 2 2,1, 1,2 MgCl 2, 10 de glucose, 10 Na-HEPES, pH 7,8 |
| Solution de bain avec tricaïne | Solution bain contenant 0,02% tricaïne |
| Solution de bain avec le formamide | Solution bain contenant 2M formamide |
| Neuron interne de la solution (en mM) | 115 K-gluconate, 15 KCl, MgCl 2 2, 10 K-HEPES, 5 K-EGTA, 4 Mg-ATP, pH 7,2 |
| Solution musculaire interne (en mM) | 120 KCl, 10 K-HEPES, 5 BAPTA, pH 7,4 |
Tableau 1. Solutions.
Discussion
Nous avons utilisé le poisson-zèbre enregistrements appariés (Wen et Brehm, 2005) principalement à étudier les processus de libération des vésicules et de recyclage lors de la stimulation à haute fréquence. Ce processus est perturbé en mutants motilité où la transmission synaptique normale est compromise en raison de mutations ponctuelles dans les principaux composants synaptiques. Par exemple, les mutations qui perturbent les agrégats des récepteurs post-synaptiques (Ono et al., 2001, 2002, 2004) et la synthèse de l'émetteur présynaptique (Wang et al., 2008) résulte de la non-coordination de natation. Enregistrements appariés de fournir les informations qui peuvent identifier la source de l'anomalie fonctionnelle, reliant ainsi le comportement, la génétique et la physiologie. Il devrait maintenant être possible de disséquer les processus qui sous-tendent la transmission synaptique par des moyens d'expression transitoire de la PAC à moteur neurones en utilisant des promoteurs judicieux. De cette façon dominante négative ou gènes mutés peuvent être spécifiquement exprimée dans les neurones et les deux conséquences comportementales et électrophysiologiques déterminée. L'avantage supplémentaire offert par la configuration cellule entière permet de dialyse du soma PAC avec des agents qui peuvent potentiellement modifier le recyclage des vésicules, comme les toxines clostridiales et les tampons de calcium. En raison de la courte distance entre le soma et le muscle, la diffusion devrait se produire ainsi dans le délai d'enregistrements. Le potentiel de cette préparation a seulement commencé à être exploitées. La transparence du poisson à cet endroit âge et superficielle des synapses facilite également l'utilisation d'outils optiques (Fetcho et O'Malley, 1997; Fetcho et Higashijima, 2004). Nous avons eu beaucoup de succès dans la mesure de l'endo et d'exocytose dans les poissons qui vivent avec des teintures FM et indicateurs génétiques comme Synaptophluorin (Li et al., 2003). En outre, les toxines fluorescents conjugués peuvent être utilisés pour étiqueter les protéines synaptiques pour l'imagerie de poissons vivants (Ibanez-Tallon et al., 2004). Compte tenu de la simplicité de cette préparation, il est très prometteur pour des études futures.
Déclarations de divulgation
Remerciements
Financé par le NIH (NS-18205).
matériels
| Name | Company | Catalog Number | Comments |
| Pneumatic transducer tester | Fluke Biomedical | DPM1B | |
| 0.002 x 3 inch tungsten rod | A-M Systems | 715000 | |
| Sylgard 184 Elastomer | Dow Corning | The thickness of application will affect the DIC optics |
Références
- Fetcho, J. R., O'Malley, D. Imaging neuronal networks in behaving animals. Current Opinion in Neurobiology. 7, 832-838 (1997).
- Fetcho, J. R., S, H. i. g. a. s. h. i. j. i. m. a. Optical and genetic approaches toward understanding neuronal circuits in zebrafish. Integr Comp Biol. 44, 57-70 (2004).
- Ibañez-Tallon, I., Wen, H., Miwa, J., Xing, J., Aslantas-Tekinay, A., Ono, F., Brehm, P., Heintz, N. Tethering naturally occurring peptide toxins for cell autonomous modulation of ion channels and receptors in vivo. Neuron. 43, 305-311 (2004).
- Li, W., Ono, F., Brehm, P. Optical measurements of presynaptic release in mutant zebrafish lacking postsynaptic receptors. J. Neuroscience. , 23-10467 (2003).
- Ono, F., Mandel, G., Brehm, P. Acetylcholine receptors direct rapsyn clusters to the neuromuscular synapse in zebrafish. J. Neuroscience. 24, 475-5481 (2004).
- Ono, F., Shcherbatko, A., Higashijima, S., Fetcho, J., Mandel, G., Brehm, P. Paralytic zebrafish lacking ACh receptors fail to localize rapsyn clusters to the synapse. J. Neuroscience. 21, 5439-5448 (2001).
- Ono, F., Shcherbatko, A., Higashijima, S., Mandel, G., Brehm, P. The zebrafish motility mutant twitch once reveals new roles for rapsyn in synaptic function. J. Neuroscience. 22, 6491-6498 (2002).
- Wang, M., Wen, H., Brehm, P. Function of neuromuscular synapses in the zebrafish choline-acetyltransferase mutant bajan. J Neurophysiol. , 100-104 (2008).
- Wen, H., Brehm, P. Paired motor-neuron muscle recordings in zebrafish test the receptor blockade model for shaping synaptic current. J. Neuroscience. 25, 8104-8111 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon