Method Article
モーターニューロンとターゲットゼブラフィッシュの骨格筋からの対のパッチクランプ記録
要約
幼虫ゼブラフィッシュは、脊髄運動ニューロンとターゲット骨格筋からの同時パッチクランプ記録を可能にした最初の脊椎動物のモデルシステムを表す。このビデオでは、分節キャップ運動ニューロンと標的筋細胞と同様に各セルのタイプから録音するための方法論を識別するために使用される微細な方法を示しています。
要約
幼虫ゼブラフィッシュは、脊髄運動ニューロンとターゲットの筋肉からの同時パッチクランプ記録を可能にした最初の脊椎動物のモデルシステムを表す。これは、両方の細胞型と視覚的形態と位置に基づいて、単一のセグメントCAPモータニューロンを区別する能力へのアクセシビリティの直接の帰結です。このビデオでは、CAPモータニューロンと標的筋細胞と同様に各セルのタイプから録音するための方法論を識別するために使用される微細な方法を示しています。キャップ運動ニューロン型の識別は、染料の充填によって、またはそのような活動電位波形と、セルの入力抵抗のような生物物理的特徴によって確認されています。一時間に複数の異なるターゲットの筋細胞から長期的な録音を可能にするため日常的に最後のモーターニューロン記録。モーターニューロンの発火パターンの制御は、神経筋接合部におけるシナプス伝達の周波数依存性の測定を可能にします。大規模量子サイズと全体のセル電圧のクランプが提供する低ノイズのおかげで、単一のイベントのすべては筋肉で解決することができます。この機能は、リリースのプロパティ、小胞のリサイクルだけでなく、シナプス抑制や促進などの基本的なシナプスの特性の調査を可能にします。 in vivoでの準備日食直前の神経筋モデル系でこのことによってもたらされる利点は、モータニューロンは通常、細胞外電極で刺激し、筋肉が全細胞パッチクランプを行うには大きすぎるしている特徴と研究。ゼブラフィッシュの準備は、トランスジェニック系統、モルホリノノックダウン、薬理学的介入とin vivoイメージングを含めたアプローチの広い範囲で電気生理学的解析を組み合わせることに従順です。これらのアプローチは、ゼブラフィッシュの突然変異系統から提供された神経筋疾患のモデルが増えていると相まって、人間の神経筋疾患の新しい理解のためにドアを開きます。
プロトコル
1。ペア録音のための魚の準備
- 浴溶液、Tricaine(MS222)で浴溶液、ホルムアミド、ニューロンの内部ソリューションと筋肉内部ソリューションと浴溶液を:手順を開始する前に、含まれて5つの主要ソリューションを、準備する。
- 次に、72〜96時間の年齢とTricaineと浴溶液内の場所間の単一の幼虫のゼブラフィッシュを収集する。麻酔薬への曝露の1分以内に、魚はタッチに反応しません。
- プラスチック製の皿の上に魚を置くと、実体顕微鏡を使用して、ダブルエッジのカミソリの刃で首を切る。
- sylgardでコーティングし、浴溶液で満たされたガラスの録音室に魚を移す。脊索を通して電解シャープタングステンピンを挿入して、各端に固定します。
- 微細な鉗子のペアのための十分なグリップを提供するピンと魚の吻側端付近の皮膚のフラップを作成します。細かいピンセットで吻側ピンの近くでそれをつかんで覆っている皮膚を取り除きます。ピールゆっくり尾の方向に皮膚を除去する。
- レコーディングに干渉する可能性のある筋肉の収縮をブロックするために3-5分のためのホルムアミドと浴溶液の3のMLSで魚を扱う。通常の浴溶液で5回洗浄する。静かにタングステンピンの側で廃棄を5〜6セグメント上筋の表層の部分を削除します。
- 電気的ノイズを遮蔽するためにファラデーケージに位置する正立顕微鏡に魚を移す。顕微鏡は、長距離40倍目標と4倍まで0.5のズームを作業、固定ステージを装備しています。顕微鏡は、高電力下神経と筋肉の間に準備を移動するために電動XY移動ステージにマウントされています。微分干渉コントラスト光学系の使用は、神経細胞を可視化するのに役立ちます。
- 0.5 ×ズームの下に、上を覆う筋肉を除去し、脊髄を露出するために広い口径15ミクロンのピペットを使用してください。負圧は、3 ccの使い捨て注射器と筋細胞を介して適用される一つずつ削除されます。この手順は、骨格筋の5〜6背のセグメントごとに繰り返されます。同じワイドボアピペットは、ターゲット速い骨格筋を得るために腹側筋肉の上位2層を除去するために使用されます。
- これは、ペアの録音の準備を完了し、顕微鏡のズームは、約1.6倍に増加しています。
2。 CAPモーターニューロンとターゲットの筋細胞のペア録音
- 洗浄セグメントは、CAPの神経細胞を見つけるためにスキャンされます。脊髄の各半セグメントは一つの大きな、10ミクロンの直径、キャップモータニューロンが含まれています。このティアドロップ形の細胞体は、分節境界の尾ほとんど終わり近くに脊髄硬膜の下に表面的に位置しています。 CAPのニューロンは、隣接する尾側セグメントでの録音と腹側のターゲットの筋肉のために選ばれている整合性をチェックするためにスキャンされます。
- 2つのパッチ電極は、記録、ニューロンと筋肉のための秒のいずれかに配置されている。上部電極は、約2ミクロンのタフな脊髄硬膜と先端開口部の浸透のための浅いテーパーを持っています。下部電極は、骨格筋の低抵抗の電圧クランプ記録のための急なテーパーを持っています
- 脊髄硬膜を貫通して約30度の角度でニューロンの電極を置き、約1選択されたCAPのニューロンへの吻側半セグメント。約60ミリメートルの水銀の優しい持続陽圧をかけながら軸方向駆動のマニピュレータを用いて電極を進める。硬膜貫通電極の区切りとして、CAPのニューロンは、フォーカスの再調整を必要とする、電極から灌流によって置換されることがあります。
- 電極が接触したときCAPニューロン相馬正圧が解放され、gigaohmシールの直接の形成における通常の結果です。しかし、シールを形成するために失敗するいくつかのケースで、それは穏やかな負圧を適用するために必要となる。シール形成後、電極電位は- 80mVの調整と負圧のアプリケーションでは、細胞膜を破壊している。 CAPのニューロンは、140から180メガオームの入力抵抗と活動電位そのシュート40ミリボルトが特徴です。これは、活動電位が誘発されるまで電流クランプの下に段階的に増加し脱分極ステップを注入することによってテストされています。
- 次に、顕微鏡は、高電力下XY電動トランスレータを使用して、腹側筋肉に再配置されます。速筋細胞は、ターゲットフィールドから選択されます。
- 筋肉の電極は解放されると、gigaohmシールを形成する正の圧力下で標的筋細胞に向かって進んでいる。電極電位は、ナトリウムチャネルを不活性化を-50 mVに調整され、穏やかな吸うの下に細胞膜が破壊される。 100から200メガオームの抵抗と大容量過渡信号のエントリの突然の出現の低下。
- テストへ活動電位が誘発されるまで、ペアの記録のために、モーターニューロンは、現在の段階的大きい注射による脱分極である。この時点で、終板電流が筋肉に誘発されるべきである。失敗せずにエンドプレートの電流で1ヘルツ結果でmotorneuronの継続的な刺激。刺激周波数が100ヘルツに増加するにつれ、エンドプレート電流は振幅で変動し、刺激の10秒以内に機能的な枯渇を受ける。
3。代表的な結果
一般的に、ニューロンの記録では最大1時間までは安定であるが、筋細胞は、直列抵抗の増加として反映悪化。これが発生すると実験のいずれか終了するか、別の筋細胞では、パッチがクランプされています。すべての記録は一時間以内に終了してください。
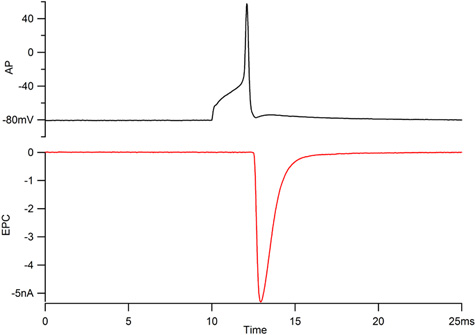
図1。motorneuronの活動電位(AP、上)と現在関連付けられている筋肉のエンドプレート(EPC、底部)の録音。 CAPのニューロンのための活動電位は、オーバーシュート40 mVおよびEPCは、1ミリ秒の下に時定数で指数関数時間の経過に沿って300μ秒と崩壊の中で立ち上がるようにしてください。
| の名前 | レシピ |
| 浴溶液(mMで) | 134のNaCl、2.9 KClを、2.1のCaCl 2、1.2のMgCl 2、10グルコース、10のNa - HEPES、pH7.8の |
| Tricaineと浴溶液 | 0.02パーセントtricaineを含む浴溶液 |
| ホルムアミドと浴溶液 | 2Mホルムアミドを含む浴溶液 |
| ニューロン内部の溶液(mMで) | 115 K -グルコン酸、15のKCl、2のMgCl 2、10 K-HEPES、5 K - EGTA、4のMg - ATP、pH 7.2の |
| 筋肉内部溶液(mMで) | 120のKCl、10 K-HEPES、5 BAPTA、pH7.4の |
表1。ソリューション。
ディスカッション
我々は、高頻度刺激時に小胞放出とリサイクルの過程を研究するために主に(温とブレーム、2005)ゼブラフィッシュペアの録音を使用している。このプロセスは、重要なシナプス成分に起因する点変異する危険にさらされている通常のシナプス伝達を特徴と運動性の突然変異体で中断されます。たとえば、シナプス後受容体の凝集体(小野ら 、2001、2002、2004)とシナプス前トランスミッタの合成(Wang ら 、2008)非協調水泳で結果を混乱させる突然変異。ペアの録音は、このように行動、遺伝学と生理学をつなぐ、機能的な欠陥の原因を特定できる情報を提供しています。それは、現在、さらに賢明なプロモーターを使用してCAPのモーターニューロンの一過性発現によりシナプス伝達の根底にあるプロセスを解明することができるはずです。この方法では、ドミナントネガティブまたは変異遺伝子は、特にこれらのニューロンに発現しており、両方の行動や電気生理学的影響は決定することができます。全体のセル構成で提供される付加的な利点は、潜在的にそのようなクロストリジウム毒素やカルシウムのバッファとして小胞のリサイクルを、変えることができる薬剤とCAPの相馬の透析が可能になります。細胞体と筋肉の間の短い距離のために、拡散は、レコーディングの時間枠内でよく発生する必要があります。この準備の可能性は盗聴されるようになっています。この年齢で魚の透明性とシナプスの表面的な場所でも、光のツールの使用(; Fetchoと東島、2004 Fetchoとオマリー、1997)が容易になります。我々は、FM色素などSynaptophluorin(Li ら 、2003)などの遺伝的指標を用いて生きている魚のエンドとエキソサイトーシスの測定で非常に成功している。さらに、蛍光共役毒素は生きた魚(アイバニーズ-タロンら 、2004)のイメージングのためのシナプスタンパク質を標識するために使用することができます。この準備のシンプルさを考えるとそれは、今後の大きな可能性を秘めています。
開示事項
謝辞
NIH(NS - 18205)によって資金を供給。
資料
| Name | Company | Catalog Number | Comments |
| Pneumatic transducer tester | Fluke Biomedical | DPM1B | |
| 0.002 x 3 inch tungsten rod | A-M Systems | 715000 | |
| Sylgard 184 Elastomer | Dow Corning | The thickness of application will affect the DIC optics |
参考文献
- Fetcho, J. R., O'Malley, D. Imaging neuronal networks in behaving animals. Current Opinion in Neurobiology. 7, 832-838 (1997).
- Fetcho, J. R., S, H. i. g. a. s. h. i. j. i. m. a. Optical and genetic approaches toward understanding neuronal circuits in zebrafish. Integr Comp Biol. 44, 57-70 (2004).
- Ibañez-Tallon, I., Wen, H., Miwa, J., Xing, J., Aslantas-Tekinay, A., Ono, F., Brehm, P., Heintz, N. Tethering naturally occurring peptide toxins for cell autonomous modulation of ion channels and receptors in vivo. Neuron. 43, 305-311 (2004).
- Li, W., Ono, F., Brehm, P. Optical measurements of presynaptic release in mutant zebrafish lacking postsynaptic receptors. J. Neuroscience. , 23-10467 (2003).
- Ono, F., Mandel, G., Brehm, P. Acetylcholine receptors direct rapsyn clusters to the neuromuscular synapse in zebrafish. J. Neuroscience. 24, 475-5481 (2004).
- Ono, F., Shcherbatko, A., Higashijima, S., Fetcho, J., Mandel, G., Brehm, P. Paralytic zebrafish lacking ACh receptors fail to localize rapsyn clusters to the synapse. J. Neuroscience. 21, 5439-5448 (2001).
- Ono, F., Shcherbatko, A., Higashijima, S., Mandel, G., Brehm, P. The zebrafish motility mutant twitch once reveals new roles for rapsyn in synaptic function. J. Neuroscience. 22, 6491-6498 (2002).
- Wang, M., Wen, H., Brehm, P. Function of neuromuscular synapses in the zebrafish choline-acetyltransferase mutant bajan. J Neurophysiol. , 100-104 (2008).
- Wen, H., Brehm, P. Paired motor-neuron muscle recordings in zebrafish test the receptor blockade model for shaping synaptic current. J. Neuroscience. 25, 8104-8111 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved