Method Article
La criopreservación de tejido cortical Bloques para la generación de cultivos neuronales altamente enriquecido
En este artículo
Resumen
Aquí se describe un método eficiente para la criopreservación y descongelación de bloques de corteza de tejido cerebral para generar altamente enriquecido cultivos neuronales. Este sencillo protocolo proporciona flexibilidad para la generación posterior de cultivos de células neuronales, astrocitos, y precursoras neuronales.
Resumen
En este estudio, se describe un protocolo estandarizado para la criopreservación exitosa y descongelación de bloques de corteza de tejido cerebral para generar altamente enriquecido cultivos neuronales. Para este protocolo el medio de congelación utilizado es del 10% dimetilsulfóxido (DMSO) diluido en solución salina tamponada de Hank (HBSS). Los bloques de tejido cortical se transfieren a crioviales que contiene el medio de congelación lenta y congelados a -1 ° C / min en un recipiente de congelación de velocidad controlada. Después de la descongelación de procesamiento y la disociación de los bloques de tejido congelado producido constantemente neuronal enriquecido con las culturas que mostraron un crecimiento neurítico rápido durante los primeros 5 días de la cultura y la significativa expansión de la red neuronal dentro de 10 días. Tinción inmunocitoquímica con el marcador de astrocitos proteína glial fibrilar ácida (GFAP) y el marcador neuronal beta-tubulina III clase, reveló un gran número de neuronas y astrocitos en los cultivos. Generación de células precursoras neuronales culturas después de la disociación del tejido bloque resultó en rápida expansión neuroesferas, que produjo un gran número de neuronas y astrocitos en condiciones de diferenciar. Este protocolo de crioconservación simple permite la conservación es rápido, eficaz y de bajo costo de los bloques de tejido cerebral cortical, que otorga una mayor flexibilidad para la última generación de cultivos de células neuronales, astrocitos, y precursoras neuronales.
Protocolo
1. La criopreservación de tejido cortical bloques
Preparación de materiales
- Preparar buffer 1X Hank solución de sal (HBSS) diluyendo en solución madre 10 veces en agua estéril (1:9). HBSS almacenar a 4 ° C.
- Prepare un 10% medio de congelación DMSO mediante la dilución de DMSO en HBSS (1:9). El medio de congelación debe ser fresca antes de la crioconservación y se almacenan a 4 ° C hasta que se enfríe.
- Una hoja de afeitar de acero se utiliza para la tala sistemática de los tejidos. Antes de su uso, la hoja de afeitar se esteriliza por inmersión en etanol al 70% durante 2 horas. Inmediatamente antes de la elaboración del tejido, enjuagar la cuchilla con agua estéril tres veces. Evite dejar la navaja en agua estéril para una cantidad excesiva de tiempo, ya que es propensa a la oxidación.
- Un contenedor de congelación Nalgene se carga con crioviales (2,5 ml) y luego llevados a un gabinete biológicos estériles. 1 ml de medio de congelación frío se añade a cada vial. El contenedor de congelación se coloca a 4 ° C durante al menos 2 horas.
Limpieza, picado, congelación y
- El tejido cerebral para ser congelados se limpia de la membrana de las meninges y los vasos sanguíneos. Use puntas aguja estéril para retirar cuidadosamente los restos de los tejidos mientras se trabaja en la parte superior de una bolsa de hielo. Tejido limpiados deben ser enjuagados con un poco de HBSS frío y trasladado a una nueva placa de Petri para picar.
- Trabajo en la parte superior de una bolsa de hielo, use una hoja de afeitar esterilizada para cortar rápidamente los tejidos en aproximadamente 1 mm a 3 cuadras. Trabajar con pequeñas porciones de tejido limpiado en un tiempo resulta en un mejor control sobre el procedimiento de cortar, lo que resulta en tamaños de bloque más uniforme.
- Agregue lentamente el tejido cortado en 50 ml de HBSS en un tubo cónico de 50 ml. Enjuague suavemente la placa de Petri con HBSS para recoger los bloques de tejido restante. Permita que los bloques de tejido para descender al fondo del tubo, la creación de un tejido muy apretadas bloque de pellets.
- Mientras que el tejido es la solución, poner el contenedor de congelación previamente enfriada y crioviales en la cabina de seguridad biológica. Destapa todos los crioviales para acelerar el proceso de adición de tejido.
- Después de todos los bloques de tejido se han asentado, Aspire con cuidado el exceso de HBSS, dejando una capa muy fina de los medios de comunicación por encima de la pastilla. Centrifugación se recomienda, ya que hará que los bloques de tejido se adhieran unas a otras, disminuyendo significativamente la eficiencia de la congelación.
- Poco a poco recolectar 200 l de la parte inferior del bloque de pellets sueltos tejido mediante el uso de punta de la pipeta con orificios de ancho (corte la punta con unas tijeras estériles). Transferir el material a un criovial y pasar a los tejidos próximos, de nuevo, recogiendo la parte inferior de la pastilla. Es esencial que el procedimiento de asignación de todo el tejido no toma más de 3-4 minutos por cada contenedor de congelación. Esto asegura que el tejido se expone a DMSO por sólo un corto período de tiempo antes de la congelación. Después de transferir el tejido de los viales, coloque el recipiente de congelación en un congelador de-80oC durante al menos 4 horas. Por otra parte, el contenedor de congelación se puede dejar toda la noche a -80 oC. Repita este proceso para todos los contenedores de congelación restantes.
- Transferir el crioviales desde el contenedor de congelación (s) a una Caja criogénica y el lugar en un tanque de nitrógeno líquido para su almacenamiento a largo plazo.
2. Descongelación y cultivo de bloques congelados de tejido cortical
Preparación de materiales
- Un día antes de descongelar las muestras de tejido, poli-L-lisina recubierto Petri / cubreobjetos está preparado. En general, para las neuronas corticales que la preparación de platos recubiertos con 500 mg / ml o 1 mg / ml. Agregue suficiente ácido poli-L-lisina solución (hecho en tampón borato) para cubrir completamente el fondo del plato. Si cubreobjetos de vidrio es necesario, asegúrese de que estén completamente sumergidos en la solución de poli-L-lisina. Incubar durante al menos 12 horas. Antes de usarlo, enjuague los platos con una cantidad abundante de agua estéril 3 veces, 5 minutos cada uno.
- HBSS caliente se utiliza para limpiar el tejido descongelado, así como para disociar el tejido en suspensiones celulares. El volumen de HBSS necesario variará en función de la cantidad de tejido para ser descongelados, pero por lo general un criovial va a diluir en 50 ml de HBSS y se disocia en 10 ml de HBSS.
- Modificado por Dulbecco medio de Eagle con 10% suplementado con hierro de suero bovino ternero (EBS) y el 1% antibiótico / antimicótico (AA) mezcla (DMEM (++)) debe ser colocado en un baño de agua 37 ° C.
- Medio chapado (NB (+++)) debe ser fresca antes de su uso. Este medio se prepara añadiendo 1% antibiótico / antimicótico más B27 y los suplementos de N2.
Nota: Los nombres de los medios de comunicación adjunta con cruces (+) indican la inclusión de aditivos a la base de la composición de los medios de comunicación. En este texto, DMEM (+ +) denota DMEM más 10% de EBS más el 1% de AA, mientras que denota (+++) NB NB plnos del 1% de AA, además B27 además de N2.
Descongelación y cultivo
- Retire la crioviales del tanque de nitrógeno líquido y descongelación rápida a 37 º C al baño maría hasta sólo una pequeña bolita de hielo es observado dentro de los contenidos vial.
- Suavemente transferir el contenido del vial de 50 ml de HBSS caliente en un tubo cónico. Utilice una punta de orificio amplio para desalojar suavemente cualquier resto de los bloques de tejido atrapado en el criovial. Invierta el tubo 3-4 veces y permitir que el tejido de recoger poco a poco en la parte inferior. Tejidos deben resolver rápidamente, pero si los bloques son demasiado pequeños como este no puede ocurrir y la luz centrifugación (~ 200 x g) se recomienda.
- Aspirar HBSS exceso.
- Agregar 10 ml de HBSS caliente al precipitado de tejido y 300 L de 0,25% de tripsina y 50 L de ADNasa. Incubar en un baño de agua 37 ° C durante 5 minutos, luego coloque en un agitador orbital conjunto de 80 rpm y 37 ° C durante 5 min.
- Después de este período, traer los bloques de tejido en una cabina de seguridad biológica y la utilización de una pipeta 10 ml de agitar cuidadosamente los bloques de tejido hasta obtener una suspensión de células se forma nubes. Desactivar la tripsina mediante la adición de 10 ml de agua tibia DMEM (+ +) a la suspensión celular.
- Centrifugar las células disociadas a 1200 x g por 5 min. Aspirar y desechar el sobrenadante, resuspender el botón celular en 10 ml de agua tibia DMEM (+ +) y cuantificar el número de células con un hemocitómetro.
- Células de la placa de poli-L-lisina platos recubiertos. Por lo general, un plato de 60 mm será plateado con 1x10 6 células.
- Permitir que las células se adhieren a la placa / cubreobjetos durante aproximadamente 1 hora en el cultivo de tejidos incubadora. Se recomienda monitorear el progreso del archivo adjunto en una placa cada 10 minutos hasta que adjunto efectiva que se observa. Entonces, suavemente reemplazar el medio con DMEM fresco (++).
- Después de 24 horas, cambie el DMEM (+ +) con agua tibia (+++). NB Cambios parciales de media (50%) se llevan a cabo cada 5 días con nuevas (+++). NB Culturas saludables por lo general muestran signos de diferenciación y el crecimiento de los procesos después de 24 hrs. En estas condiciones, y realizar cambios parciales de medio cada 4-5 días, los cultivos se pueden mantener por periodos prolongados de tiempo de hasta 4-6 semanas.
- Para la generación de células precursoras neuronales (CPN), un protocolo similar se utiliza con la excepción de que después de la centrifugación, DMEM sin EBS se utiliza. Las células se colocan en el T-25 frascos en DMEM/F12 (01:03), complementado con B27 y EGF (20 ng / mL) para permitir la formación de neuropheres. Para diferenciar los NPCs, neuroesferas se colocan en laminina (10 ug / mL) en cubreobjetos recubiertos DMEM/F12 (1:3) suplementado con N2.
3. Resultados representante
Culturas sano muestra un importante crecimiento y la diferenciación de los 5 días post-descongelación y por lo general se estabiliza en su crecimiento por 10 días (Figura 1). Tinción Immuncocytochemical de estas culturas revela numerosos astrocitos (Figura 2A) y neuronas (Figura 2B) para los humanos y de rata cultivos neuronales primarios. Este protocolo también es adecuado para la generación de NPCs como de libre flotación neuroesferas (Figura 3), que en condiciones de diferenciación, el resultado en las culturas mixtas de alta calidad (Figura 3 B, C).
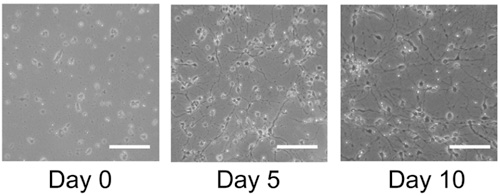
Figura 1. Los cultivos de células congeladas de tejido cortical humano. Bloques congelados de tejido cortical humano se descongelan y se sembraron en poli-lisina cubreobjetos recubiertos y crecido durante 10 días. El día 5 la expansión celular es evidente y el día 10 de confluencia se logra. Barra de escala: 100 micras.
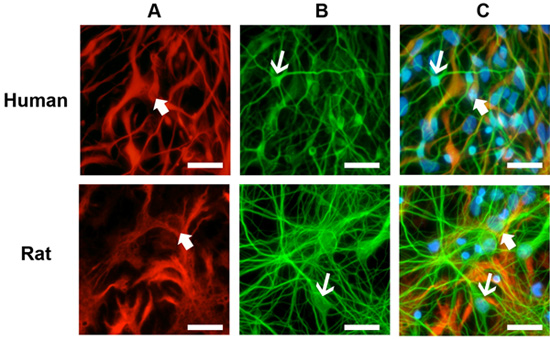
Figura 2. Inmuno tinción de los cultivos celulares. (A) los cultivos fueron teñidas con el marcador de proteína glial fibrilar glial ácida (GFAP, flechas gruesas). (B) Las neuronas se detectaron con el marcador neuronal beta-tubulina III (TIII, flechas delgadas). (C) Los dos humanos y las culturas de ratas muestran células gliales y las neuronas abundantes después de 10 días de cultivo. Anticuerpos primarios: el ratón anti-GFAP (1:1000) y el conejo anti-TIII (1:1000). Secundaria de anticuerpos: anti-ratón Alexa 594 (1:500) y anti-conejo Alexa 488 (1:500). Tinción de los núcleos: Hoestch azul (1:1000). Barra de escala: 50 micras.
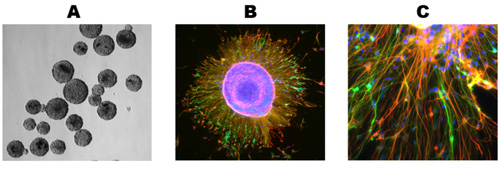
Figura 3. Generación de neuroesferas. (A) El tejido congelado fue procesada como se describió anteriormente y se permite que se propagan como neuroesferas. (B) neuroesferas se cultivaron en cubreobjetos de vidrio en condiciones de diferenciar y crecido durante 10 días, dando lugar a células que migran fuera de la neuroesfera. (C) Tanto las neuronas y los astrocitos están presentes en la periferia en expansión de una neuroesfera diferenciador. Contratinción nuclear, los anticuerpos primarios y secundarios utilizados como en la figura 2.
Discusión
Criopreservación ofrece la oportunidad de banco preciosas muestras de tejido cerebral para uso futuro. Aquí se describe un protocolo sencillo pero eficaz para generar tanto neuronas enriquecido las culturas y las células precursoras neuronales a partir de bloques congelados de tejido cerebral. Este procedimiento evita los costos económicos de las técnicas de criopreservación tradicionales que utilizan más caro velocidad controlada congeladores. El protocolo permite la generación de cultivos neuronales viable después de la descongelación, proporcionando un medio rápido pero efectivo para congelar bloques de tejido. El proceso de congelación completa puede tomar tan poco como 20 minutos. Además de los cultivos primarios de neuronas, usando este método de bloques de tejido también se pueden descongelar para generar NPCs crecido como neuroesferas libre flotación. En este sentido, la falta de suero en nuestro medio de congelación asegura que las células se conservan en un estado indiferenciado. En condiciones de diferenciación, neuroesferas producido a partir de la expansión del tejido congelado y las tasas muestran una diferenciación muy comparable a la generada a partir de neuroesferas tejido fresco.
Divulgaciones
Agradecimientos
Esta investigación fue financiada por becas de la Investigación de Pregrado Programa de Oportunidades de la UCI (AR y SP) y las subvenciones del Estado de California Iniciativa de Enfermedades de Alzheimer y los Institutos Nacionales de Salud de subvención no. HD38466, y el Centro de Investigación de la Enfermedad de Alzheimer no se conceda ninguna. AG16573 (JB)
Materiales
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium (DMEM) | Invitrogen | 11995-073 | High gluclose 1X |
| Bovine calf serum supplemented | Hyclone | SH30072.03 | For culture medium |
| Neurobasal-A Medium (1X), liquid | Invitrogen | 1088-022 | |
| B27 Supplement | Invitrogen | 17504-044 | Supplement for Neurobasal medium |
| N2 Supplement | Invitrogen | 17502-048 | Supplement for Neurobasal medium |
| Trypsin (10X) | Cellgro | 25-054CI | Tissue dissociation |
| Deoxyribonuclease 1 from bovine pancreas (DNase) | Sigma-Aldrich | D4527-30KU | Tissue dissociation |
| Hanks Balanced Salt Solution (HBSS) (10X) | GIBCO, by Life Technologies | 14065 | Cleaning tissue, washes, and freezing medium |
| Poly-L-Lysine- 500mg | Invitrogen | P2636 | Substrate for adhesion of neuronal cells |
| antibiotic-antimycotic (100X), liquid | Invitrogen | 15240-062 | To prevent contamination |
| Large orifice pipette Tips (1-200 ul) | Fisher Scientific | 02-681-141 | To prevent shear stress to cells |
| Graduated pipette tips (101-1000 ul) | USA Scientific, Inc. | 1111-2721 | |
| 21 G1 precision guide needles | BD Biosciences | 305165 | To clean tissue |
| 10 ml pipette | USA Scientific, Inc. | 1071-0810 | Individually wrapped |
| 50 ml tubes | USA Scientific, Inc. | 926-9-04 | |
| Single edge razor blade | Smith & Nephew Inc. | 67-0238 | To chop tissue |
| 60 x 15 mm polystyrene petri dish | USA Scientific, Inc. | 8609-0160 | For general culture |
| 100 x 15 mm polystyrene petri dish | USA Scientific, Inc. | 8609-0010 | For cleaning tissue |
| Cryogenic box | Nalge Nunc international | 5026-1010 | |
| Freezing container | Nalge Nunc international | 5100-0001 | "Mr. Frosty" |
| 2.0 ml cryogenic vials | Nalge Nunc international | 5012-0020 | |
| DMSO | Fisher Scientific | D128-500 | For freezing medium |
| Ethanol 200 proof | Sigma-Aldrich | E7023 | For sterilizing razor blade |
Referencias
- Robbins, R. J. Cryopreservation of human brain tissue. Exp Neurol. 107, 208-213 (1990).
- Ware, C. B., Nelson, A. M., Blau, C. A. Controlled-rate freezing of human ES cells. Biotechniques. 38, 879-880 (2005).
- Paynter, S. J. Principles and practical issues for cryopreservation of nerve cells. Brain Res Bull. 75, 1-14 (2008).
- Thirumala, S., Gimble, J. M., Devireddy, R. V. Cryopreservation of stromal vascular fraction of adipose tissue in a serum-free freezing medium. J Tissue Eng Regen Med. 4, 224-232 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados