Method Article
Kryokonservierung von kortikalen Gewebes Bausteine für die Generierung von hoch angereichertem neuronalen Kulturen
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine Methode zur effizienten Kryokonservierung und Auftauen der kortikalen Hirngewebe Blöcke zu hoch angereicherten neuronalen Kulturen zu generieren. Dieses einfache Protokoll bietet Flexibilität für die spätere Generation von neuronalen, Astrozyten und neuronalen Vorläuferzellen Zellkulturen.
Zusammenfassung
In dieser Studie skizzieren wir ein standardisiertes Protokoll für die erfolgreiche Kryokonservierung und Auftauen der kortikalen Hirngewebe Blöcke zu hoch angereicherten neuronalen Kulturen zu generieren. Aus diesem Protokoll das Einfrieren Medium verwendet wird 10% Dimethylsulfoxid (DMSO) in Buffered Salz Hanks Solution (HBSS) verdünnt. Blocks der kortikalen Gewebe sind Kryoröhrchen mit dem Einfrieren Medium überführt und langsam bei -1 ° C / min in einer Rate-kontrollierten Einfrieren Behälter eingefroren. Post-Tau-Verarbeitung und Dissoziation von gefrorenen Gewebe-Blöcke konsequent produziert neuronalen angereicherte Kulturen, die eine schnelle neuritischen Wachstum in den ersten 5 Tagen in Kultur und wesentliche Erweiterung des neuronalen Netzwerks ausgestellt innerhalb von 10 Tagen. Immunzytochemische Färbung mit den Astrozyten-Marker sauren Gliafaserproteins (GFAP) und die neuronalen Marker beta-Tubulin-Klasse III zeigte eine hohe Zahl von Neuronen und Astrozyten in den Kulturen. Generierung von neuralen Vorläuferzellen Zellkulturen nach Gewebe blockieren Dissoziation führte rasch expandierenden Neurosphären, die eine große Anzahl von Neuronen und Astrozyten differenzieren unter Bedingungen hergestellt. Diese einfache Kryokonservierung Protokoll ermöglicht die schnelle, effiziente und kostengünstige Erhaltung der kortikalen Hirngewebe Blöcke, die mehr Flexibilität für die spätere Generation von neuronalen, Astrozyten und neuronalen Vorläuferzellen Zellkulturen gewährt.
Protokoll
1. Kryokonservierung von kortikalen Gewebes Blocks
Materialvorbereitung
- Bereiten 1X Hanks Salzlösung (HBSS) durch Verdünnung mit 10X-Stammlösung in sterilem Wasser (1:9). Shop HBSS bei 4 ° C.
- Bereiten Sie 10% DMSO Einfriermedium durch Verdünnen DMSO in HBSS (1:9). Das Einfriermedium sollte frisch zubereitet werden, bevor die Kryokonservierung und Lagerung bei 4 ° C bis gekühlt.
- Ein Stahl Rasierklinge ist für die systematische Zerkleinerung von Gewebe verwendet. Vor der Anwendung wird die Rasierklinge durch Eintauchen in 70% Ethanol für 2 h sterilisiert. Unmittelbar vor dem Gewebe Verarbeitung, spülen Sie die Rasierklinge mit sterilem Wasser 3-mal. Vermeiden Sie den Rasierer in sterilem Wasser für eine übermäßige Menge an Zeit, da sie anfällig für Oxidation ist.
- Ein Nalgene Gefrierbehälter ist mit Kryoröhrchen (2,5 ml) geladen und brachte dann in eine sterile biologische Schrank. 1 ml gekühltem Einfriermedium ist jedem Fläschchen gegeben. Das Einfrieren Container wird dann bei 4 ° C für mindestens 2 Stunden platziert.
Reinigung, Schneidebrett und Gefrieren
- Das Hirngewebe eingefroren werden ist der meningealen Membran und Blutgefäße zu reinigen. Verwenden Sie sterile Nadel Tipps sorgfältig entfernen Schmutz aus dem Gewebe während der Arbeit auf der einen Eisbeutel. Gereinigt Gewebe sollte leicht mit kaltem HBSS gespült werden und in eine neue Petrischale für das Hacken.
- Arbeiten auf der einen Eisbeutel, verwenden Sie eine sterilisierte Rasierklinge schnell hacken das Gewebe in etwa 1 mm 3 Blocks. Arbeiten mit kleinen Portionen von gereinigten Gewebe in einer Zeit, führt zu einer besseren Kontrolle über die Hacken Verfahren, wodurch eine gleichmäßigere Blockgrößen.
- Langsam gehackte Gewebe in 50 ml HBSS in einem 50 mL konischen Rohr. Vorsichtig spülen Sie die Petrischale mit HBSS, um alle verbleibenden Gewebes Blöcke zu sammeln. Lassen Sie das Gewebe Blöcke an den Boden des Röhrchens hinab, die Schaffung eines lockeren Gewebe blockieren Pellet.
- Während das Gewebe Absetzen bringen die zuvor gekühlt Gefrierbehälter und Kryoröhrchen in die biologische Sicherheitswerkbank. Uncap alle Kryoröhrchen, um den Prozess des Hinzufügens Gewebe zu beschleunigen.
- Nach all dem Gewebe blockiert niedergelassen haben, vorsichtig aspirieren das überschüssige HBSS, so dass eine sehr dünne Schicht von Medien über dem Pellet. Zentrifugation wird abgeraten, da es dafür sorgt, das Gewebe Blöcke aneinander haften, deutlich vermindert Einfrieren Effizienz.
- Langsam sammeln 200 ul von der Unterseite des lockeren Gewebes Block Pellet mit Pipettenspitze mit breiten Öffnungen (Cut-Spitze mit einer sterilen Schere). Das Material in einem Kryoröhrchen und ziehen weiter zum nächsten, wieder sammeln Gewebe von der Unterseite der Pellets. Es ist wichtig, dass das gesamte Gewebe Vergabeverfahren dauert nicht länger als 3-4 min pro Gefrierbehälter. Dadurch wird sichergestellt, dass das Gewebe zu DMSO ist nur für eine kurze Zeit vor dem Einfrieren ausgesetzt. Nach der Übertragung des Gewebes auf den Fläschchen, platzieren Sie den Gefrierbehälter in a-80 ° C Gefrierschrank für mindestens 4 Stunden. Alternativ kann das Einfrieren Behälter über Nacht bei -80 ° C belassen werden. Wiederholen Sie diesen Vorgang für alle verbleibenden Gefrierbehältern.
- Übertragen Sie die Kryoröhrchen aus dem Einfrieren Behälter (s) zu einem Kryoboxen und in einen flüssigen Stickstoff-Tank für eine langfristige Lagerung.
2. Auftauen und Kultivierung von Frozen Rindengewebe Blocks
Materialvorbereitung
- Einen Tag vor dem Auftauen Gewebeproben, Poly-L-Lysin beschichteten Petrischalen / Deckgläser sind vorbereitet. Im Allgemeinen ist für kortikalen Neuronen bereiten wir beschichtete Platten mit 500 pg / mL bzw. 1 mg / mL. Fügen Sie genug Poly-L-Lysin-Lösung (made in Boratpuffer) zur Deckung der Boden der Schale. Wenn Deckgläser erforderlich sind, sicherzustellen, dass sie vollständig unter dem Poly-L-Lysin-Lösung getaucht. Inkubieren für mindestens 12 Stunden. Vor dem Gebrauch gründlich die Gerichte mit einer liberalen Menge steriles Wasser 3-mal, jeweils 5 min.
- Warm HBSS wird verwendet, um aufgetaute Gewebe sowie Gewebe in Zellsuspensionen distanzieren reinigen. Das Volumen der HBSS benötigt wird hängt von der Menge an Gewebe aufgetaut werden, aber in der Regel 1-Kryoröhrchen werden in 50 ml HBSS verdünnt und wird in 10 ml HBSS dissoziiert.
- Dulbecco Modified Eagle Medium mit 10% Eisen-ergänzt bovinem Kälberserum (EBS) und 1% Antibiotikum / Antimykotikum (AA)-Gemisch (DMEM (++)) sollten in einem 37 ° C Wasserbad gestellt werden.
- Plating-Medium (NB (+++)) sollte frisch vor Gebrauch werden. Dieses Medium wird durch Zugabe von 1% Antibiotikum / Antimykotikum sowie B27 und N2 Ergänzungen vorbereitet.
Hinweis: Media Namen mit Kreuzen (+) angehängt zeigen die Zugabe von Additiven an der Basis Zusammensetzung der Medien. In diesem Text, DMEM (+ +) bezeichnet DMEM plus 10% EBS plus 1% AA, während NB (+++) bezeichnet NB pluns 1% AA plus B27 und N2.
Auftauen und Kultivierung
- Entfernen Sie die Kryoröhrchen aus dem flüssigen Stickstoff-Tank und schnell bei 37 ° C auftauen in einem Wasserbad, bis nur noch ein kleines Eis Pellet wird im Inneren der Flasche Inhalt beobachtet.
- Gently Transfer der Flasche Inhalt 50 ml warmem HBSS in einem konischen Rohr. Verwenden Sie eine breite Öffnung Spitze vorsichtig entfernen verbleibende Gewebe Blöcke in der Kryoröhrchen stecken. Das Röhrchen 3-4 mal und lassen das Gewebe langsam am Boden sammeln. Tissue sollte schnell einleben, aber wenn die Blöcke zu klein sind kann dies nicht eintreten und leichte Zentrifugation (~ 200 x g) wird empfohlen.
- Absaugen überschüssigen HBSS.
- Fügen Sie 10 ml warmes HBSS auf das Gewebe Pellet und 300 ul von 0,25% Trypsin und 50 ul DNAase. Inkubieren bei 37 ° C Wasserbad für 5 min, dann in einem Orbitalschüttler auf 80 rpm und 37 ° C für weitere 5 min.
- Nach Ablauf dieser Frist, bringen das Gewebe Blöcke in einem biologischen Sicherheitsschrank und Verwendung einer 10 ml Pipette vorsichtig rühren das Gewebe blockiert, bis eine trübe Zellsuspension gebildet wird. Deaktivieren Sie das Trypsin durch Zugabe von 10 ml warmes DMEM (+ +) zur Zellsuspension.
- Zentrifugieren Sie die dissoziierten Zellen bei 1200 x g für 5 min. Absaugen und den Überstand verwerfen, Zellpellet in 10 ml warmes DMEM (+ +) und zu quantifizieren Zellzahl mit einer Zählkammer.
- Platte Zellen auf Poly-L-Lysin-beschichtete Platten. Typischerweise wird eine 60-mm-Schale mit 1x10 6 Zellen plattiert werden.
- Lassen Sie die Zellen, die Schüssel / Deckgläser für ca. 1 Stunde in der Gewebekultur-Inkubator legen. Es wird empfohlen, den Fortschritt der Anlage in einer Platte Monitor alle 10 min bis gute Anbindung zu beobachten ist. Dann vorsichtig ersetzen das Medium durch frisches DMEM (++).
- Nach 24 Stunden, ersetzen Sie das DMEM (+ +) mit warmem NB (+++). Teilweise Medium ändert (50%) werden alle 5 Tage mit frischem NB (+++). durchgeführt Gesunde Kulturen in der Regel Anzeichen von Differenzierung und Wachstum von Prozessen nach 24 Stunden. Unter diesen Bedingungen und darstellende teilweise Medium wechselt alle 4-5 Tage, können die Kulturen für längere Zeit bis zu 4-6 Wochen beibehalten werden.
- Für die Erzeugung von neuronalen Vorläuferzellen (NPCs), ist ein ähnliches Protokoll mit der Ausnahme, dass nach der Zentrifugation, DMEM ohne EBS verwendet wird. Die Zellen werden in T-25 Flaschen in DMEM/F12 (1:3) mit B27 und EGF (20 ng / mL) ergänzt, um die Bildung von neuropheres ermöglichen überzogen. Zur Unterscheidung NPCs sind Neurosphären auf Laminin (10 ug / ml) beschichtete Deckgläser in DMEM/F12 (1:3)-Medium mit N2 ausplattiert.
3. Repräsentative Ergebnisse
Gesunde Kulturen wird ein deutliches Wachstum und die Differenzierung nach 5 Tagen nach dem Auftauen zu zeigen und wird in der Regel in ihrem Wachstum zu stabilisieren um 10 Tage (Abbildung 1). Immuncocytochemical Färbung dieser Kulturen offenbart zahlreiche Astrozyten (Abbildung 2A) und Neuronen (Abbildung 2B) für die Ratte und Mensch primären neuronalen Kulturen. Dieses Protokoll eignet sich auch für die Erzeugung von NPCs als frei schwebende Neurosphären (Abbildung 3A), die unter differenzierenden Bedingungen führen zu einer hohen Qualität Mischkulturen (Abb. 3B, C).
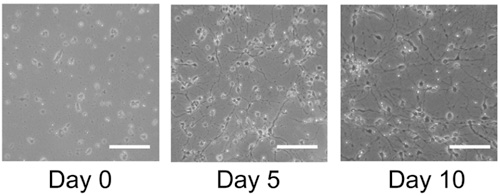
Abbildung 1. Zellkulturen von gefrorenen menschlichen kortikalen Gewebe. Gefrorene menschlichen kortikalen Gewebe blockiert werden aufgetaut und auf Poly-Lysin beschichtete Deckgläschen ausplattiert und für 10 Tage angewachsen. Am Tag 5 Zellen Expansion ist offensichtlich und von Tag 10 Konfluenz erreicht ist. Maßstab: 100 um.
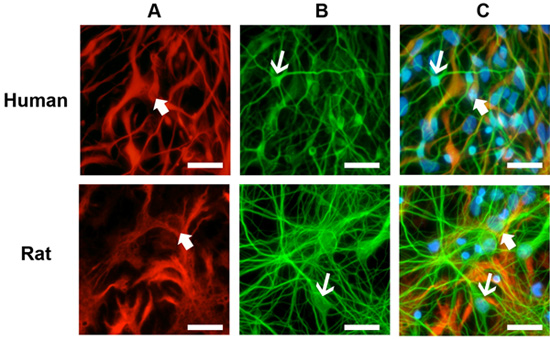
Abbildung 2. Immunzytochemische Färbung von Zellkulturen. (A) Die Kulturen wurden mit der glialen Marker sauren Gliafaserproteins (GFAP, dicke Pfeile) gefärbt. (B) Neurone wurden mit dem neuronalen Marker beta-Tubulin-III (TIII, dünne Pfeile) erkannt werden. (C) von Ratte und Mensch Kulturen zeigen reichlich Gliazellen und Neuronen nach 10 Tagen in Kultur. Primäre Antikörper: Maus-anti-GFAP (1:1000) und Kaninchen-Anti-TIII (1:1000). Sekundäre Antikörper: anti-Maus-Alexa 594 (1:500) und Anti-Kaninchen Alexa 488 (1:500). Kerne Färbung: Hoestch blau (1:1000). Maßstab: 50 pm.
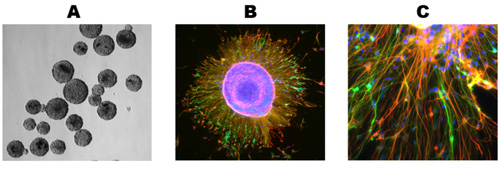
Abbildung 3. Generierung von Neurosphären. (A) Gefrierschnitte wurde wie oben beschrieben und darf als Neurosphären vermehren. (B) Neurosphären wurden auf Deckgläschen unter differenzierenden Bedingungen vernickelt gewachsen und für 10 Tage, was in den Zellen die Migration weg von der Neurosphäre. (C) Beide Neuronen und Astrozyten sind in den expandierenden Rande eines differenzierenden Neurosphäre. Nuclear Gegenfärbung, primäre und sekundäre Antikörper, wie in Abb. 2 verwendet.
Diskussion
Kryokonservierung bietet die Möglichkeit, Bank kostbaren Gehirn Gewebeproben für eine spätere Verwendung. Hier beschreiben wir eine einfache, aber effektive Protokoll sowohl Neuron-angereicherten Kulturen und neuronale Vorläuferzellen aus gefrorenem Hirngewebe Blöcke zu generieren. Dieses wirtschaftliche Verfahren vermeidet die Kosten der traditionellen Kryokonservierungstechniken, die teurer Rate-kontrollierten Tiefkühltruhen zu nutzen. Das Protokoll ermöglicht die Erzeugung von lebensfähigen neuronalen Kulturen post-Auftauen, indem sie eine schnelle, aber effektive Mittel, um Gewebe-Blöcke einfrieren. Die gesamte Einfrieren Prozess kann so wenig wie 20 Minuten. Neben primären neuronalen Kulturen, kann mit dieser Methode Gewebeblöcke auch aufgetaut NPCs als frei schwimmende Neurosphären gewachsen zu generieren. In dieser Hinsicht stellt der Mangel an Serum in unserer Einfriermedium, dass die Zellen in einem undifferenzierten Zustand erhalten bleiben. Unter differenzierenden Bedingungen produziert Neurosphären aus gefrorenem Gewebe zeigen Expansion und Differenzierung Preise sehr vergleichbar Neurosphären aus frischem Gewebe erzeugt.
Offenlegungen
Danksagungen
Diese Arbeit wurde durch Fördermittel aus dem Undergraduate Research Opportunities Program an der UCI (AR und SP) und Zuschüsse aus dem US-Bundesstaat Kalifornien Alzheimer-Initiative und die National Institutes of Health Grant No unterstützt. HD38466 und Alzheimer Research Center keinen Zuschuss. AG16573 (JB)
Materialien
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium (DMEM) | Invitrogen | 11995-073 | High gluclose 1X |
| Bovine calf serum supplemented | Hyclone | SH30072.03 | For culture medium |
| Neurobasal-A Medium (1X), liquid | Invitrogen | 1088-022 | |
| B27 Supplement | Invitrogen | 17504-044 | Supplement for Neurobasal medium |
| N2 Supplement | Invitrogen | 17502-048 | Supplement for Neurobasal medium |
| Trypsin (10X) | Cellgro | 25-054CI | Tissue dissociation |
| Deoxyribonuclease 1 from bovine pancreas (DNase) | Sigma-Aldrich | D4527-30KU | Tissue dissociation |
| Hanks Balanced Salt Solution (HBSS) (10X) | GIBCO, by Life Technologies | 14065 | Cleaning tissue, washes, and freezing medium |
| Poly-L-Lysine- 500mg | Invitrogen | P2636 | Substrate for adhesion of neuronal cells |
| antibiotic-antimycotic (100X), liquid | Invitrogen | 15240-062 | To prevent contamination |
| Large orifice pipette Tips (1-200 ul) | Fisher Scientific | 02-681-141 | To prevent shear stress to cells |
| Graduated pipette tips (101-1000 ul) | USA Scientific, Inc. | 1111-2721 | |
| 21 G1 precision guide needles | BD Biosciences | 305165 | To clean tissue |
| 10 ml pipette | USA Scientific, Inc. | 1071-0810 | Individually wrapped |
| 50 ml tubes | USA Scientific, Inc. | 926-9-04 | |
| Single edge razor blade | Smith & Nephew Inc. | 67-0238 | To chop tissue |
| 60 x 15 mm polystyrene petri dish | USA Scientific, Inc. | 8609-0160 | For general culture |
| 100 x 15 mm polystyrene petri dish | USA Scientific, Inc. | 8609-0010 | For cleaning tissue |
| Cryogenic box | Nalge Nunc international | 5026-1010 | |
| Freezing container | Nalge Nunc international | 5100-0001 | "Mr. Frosty" |
| 2.0 ml cryogenic vials | Nalge Nunc international | 5012-0020 | |
| DMSO | Fisher Scientific | D128-500 | For freezing medium |
| Ethanol 200 proof | Sigma-Aldrich | E7023 | For sterilizing razor blade |
Referenzen
- Robbins, R. J. Cryopreservation of human brain tissue. Exp Neurol. 107, 208-213 (1990).
- Ware, C. B., Nelson, A. M., Blau, C. A. Controlled-rate freezing of human ES cells. Biotechniques. 38, 879-880 (2005).
- Paynter, S. J. Principles and practical issues for cryopreservation of nerve cells. Brain Res Bull. 75, 1-14 (2008).
- Thirumala, S., Gimble, J. M., Devireddy, R. V. Cryopreservation of stromal vascular fraction of adipose tissue in a serum-free freezing medium. J Tissue Eng Regen Med. 4, 224-232 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten