Method Article
En la formación de biofilm in vitro en una diapositiva Cámara de 8 pocillos
En este artículo
Resumen
En este artículo se describe el procedimiento para la formación y la visualización de un biofilm bacteriano crecido dentro de una cámara de diapositivas 8 y
Resumen
La naturaleza crónica de muchas enfermedades se atribuye a la formación de biopelículas bacterianas que son recalcitrantes al tratamiento con antibióticos tradicionales. Los biofilms son comunidades asociadas a bacterias adheridas a una superficie y dentro de una matriz. El papel de la matriz extracelular es multifacético, que incluye facilitar la adquisición de nutrientes, y ofrece una protección significativa contra las agresiones del medio ambiente (por ejemplo, las respuestas inmunitarias del huésped). En un esfuerzo para adquirir una mejor comprensión de cómo las bacterias en un biofilm responder a las presiones ambientales se ha utilizado un protocolo en el que podemos visualizar las biopelículas bacterianas que se han formado en una diapositiva de cámara de 8 pocillos. Los biofilms se tiñeron con la BacLight Live / Dead mancha y se examina con un microscopio confocal para caracterizar el tamaño relativo de biopelículas, y la estructura en diferentes condiciones de incubación. Z-stack imágenes se recogieron a través de microscopía confocal y analizados por COMSTAT. Este protocolo se puede utilizar para ayudar a dilucidar el mecanismo y la cinética de la que forman biofilms, así como identificar los componentes que son importantes para la estructura del biofilm y la estabilidad.
Protocolo
1. En la formación de biofilm in vitro
- Colonias de bacterias (que han sido cultivados en agar apropiado durante la noche), se suspendieron en los medios de comunicación y el OD 490 se ajustó a 0,65
- La suspensión bacteriana resultante se diluyó 1:6 (1 ml de suspensión bacteriana + 5 ml pre-calentado medio) y se incuba a 37 ° C con 5% de CO 2 durante aproximadamente 3 horas para llegar a mediados de registro de fase.
- Diluir el 1:2500 crecimiento a mediados de registro de la suspensión con pre-calentado los medios de comunicación y el lugar 200 l de la dilución en cada pocillo de una diapositiva de cámara de 8 pocillos.
- Se incuba a 37 ° C con 5% de CO 2.
- Después de aproximadamente 16 horas, medio aspirado desde la esquina de cada cámara y añadir 200 l frescos, pre-calentado a medio - largo de la pared prescindir de la cámara a fin de no crear fuerzas de corte dentro de la cámara que podría interrumpir la biopelícula.
- Si la incubación de más de 24 horas, cambio de medio cada 12 horas o según sea necesario para mantener la viabilidad bacteriana.
2. Visualización de Biofilm
- Aspirar medio de cada cámara, como se describió anteriormente, y lavar biofilm residentes dos veces suavemente con solución salina estéril.
- Añadir 200 uL de BacLight Live / Dead mancha (3 l componente A + componente B 3 L por ml de solución salina) a cada pocillo e incubar a temperatura ambiente durante 15 minutos. Proteger la cultura de la luz a partir de este punto.
- Aspirar la mancha y lave dos veces suavemente con solución salina estéril como antes.
- Añadir 200 l de formalina neutra tamponada a cada pocillo e incubar durante 30 minutos a temperatura ambiente para fijar la muestra.
- Retire el fijador y como deshacerse de conformidad con las directrices institucionales.
- Lavar dos veces con solución salina y disponer de los líquidos de lavado que contienen formol que el anterior.
- Eliminar los pozos de plástico de la diapositiva, añadir una cantidad suficiente de solución salina en cada pocillo de modo que cuando un cubreobjetos se coloca en la junta, no hay burbujas de aire.
- Cubreobjetos y sellar los bordes del cubreobjetos con medio de montaje. Esmalte de uñas puede ser usado para sellar las diapositivas de las diapositivas sin embargo no será tan permanente.
- Deje que el sellador se seque por aproximadamente 1 hora antes de examinar a través de microscopía.
3. Resultados
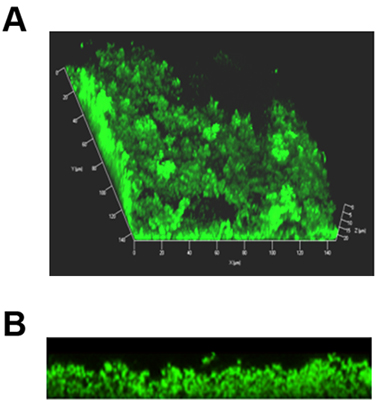
Figura 1. Representante de imágenes en 3D compuestas de una formación de biopelículas en una diapositiva de cámara de 8 pocillos. Las bacterias se marcaron con Live / Dead mancha bacterias vivas en el que las bacterias verdes fluorescentes y los muertos fluorescencia roja. (A) Imagen compuesta de biofilm completo que muestra la arquitectura distinta, con torres y canales de agua. (B) Lo mismo que en el biofilm (A), ahora se ve en sección transversal.
Discusión
Comprender el mecanismo por el cual forma biofilms, así como la caracterización de sus componentes de la matriz, es un área de gran interés. Este protocolo se puede utilizar para ayudar a identificar las proteínas u otros componentes que contribuyen a la integridad estructural de la biopelícula, así como ayudar a identificar y apuntar a las proteínas que se prestan a una aplicación terapéutica.
Los tiempos de incubación y las diluciones en el protocolo descrito anteriormente se han establecido para la formación de biofilm óptima Haemophilus influenzae no tipificable (NTHi). Un trabajo preliminar puede ser necesaria para optimizar estos pasos para otras especies bacterianas (es decir, la dilución inicial y tiempo de incubación necesario para alcanzar a mediados de registro fase de crecimiento). La dilución de 1:2500 para la siembra inicial de las cámaras fue establecido para asegurar que una biopelícula robusta que se desarrollan en la cámara se desliza como la inducida por este organismo y dentro de los tiempos de incubación indicados, sin el biofilm crecimiento excesivo de la cámara y / o agotar los nutrientes disponibles . En consecuencia, la dilución inicial y, o los tiempos de incubación puede ser necesario ajustar para otras especies bacterianas.
Divulgaciones
Agradecimientos
El trabajo fue financiado por el NIDCD / NIH R01DC003915 a LO Bakaletz.
Materiales
| Name | Company | Catalog Number | Comments |
| Chocolate II agar | Fisher Scientific | B21267X | |
| 8-well chamber slides | Fisher Scientific | 12-656-18 | |
| BacLight Live/Dead bacterial viability kit | Fisher Scientific | NC9439023 | |
| BHI | Fisher Scientific | 211059 | |
| Hemin | Sigma-Aldrich | H5533 | |
| β-NAD | Sigma-Aldrich | N7004 | |
| Permaslip mounting media | Fisher Scientific | NC9693613 |
Referencias
- Bakaletz, L. O. Bacterial biofilms in otitis media: evidence and relevance. Pediatr Infect Dis J. 26, S17-S19 (2007).
- Heydorn, A., Nielsen, A. T., Hentzer, M., Sternberg, C., Givskov, M., Ersboll, B. K., Molin, S. Quantification of biofilm structures by the novel computer program COMSTAT. Microbiology. 146, 2395-2407 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados