Method Article
Dans la formation de biofilms in vitro dans une diapositive Chambre de 8 puits
Dans cet article
Résumé
Cet article décrit la procédure pour la formation et la visualisation d'un biofilm bactérien grandi au sein d'une chambre de glisser de 8 puits
Résumé
La nature chronique de nombreuses maladies est attribué à la formation de biofilms bactériens qui sont récalcitrants à l'antibiothérapie classique. Les biofilms sont communautaires associés bactéries attachées à une surface et enfermé dans une matrice. Le rôle de la matrice extracellulaire est multiforme, notamment en facilitant l'acquisition des nutriments, et offre une protection significative contre les stress environnementaux (réponses de l'hôte, par exemple immunitaire). Dans un effort pour acquérir une meilleure compréhension de comment les bactéries dans un biofilm de répondre aux contraintes environnementales, nous avons utilisé un protocole dans lequel nous visualisons les biofilms bactériens, qui se sont formées dans une chambre de diapositives 8-même. Les biofilms ont été colorés avec du BacLight Live / Dead taches et examinés à l'aide d'un microscope confocal pour caractériser la taille du biofilm relative, et la structure sous différentes conditions d'incubation. Z-stack images ont été recueillies par microscopie confocale et analysées par COMSTAT. Ce protocole peut être utilisé pour aider à élucider le mécanisme et la cinétique par lequel former des biofilms, ainsi que d'identifier les éléments qui sont importants pour la structure du biofilm et la stabilité.
Protocole
1. Dans la formation de biofilms in vitro
- Les colonies bactériennes (qui ont été cultivés sur gélose appropriée durant la nuit), ont été suspendues dans les médias et la DO 490 a été ajusté à 0,65
- La suspension résultante bactérienne est ensuite diluée 1:6 (1 ml de suspension bactérienne + 5 ml préchauffé moyenne) et incubées à 37 ° C avec 5% de CO 2 pendant environ 3 heures pour atteindre la mi-phase log.
- Diluer le 1:2500 mi-log croissance en suspension avec des pré-chauffé les médias et le lieu 200 ul de dilution dans chaque puits d'une lame de chambre 8-même.
- Incuber à 37 ° C avec 5% de CO 2.
- Après environ 16 heures, moyenne aspirer à partir du coin de chaque chambre et ajouter 200 ul frais, pré-chauffé moyen - long dispenser paroi de la chambre afin de ne pas créer des forces de cisaillement dans la chambre qui pourrait perturber le biofilm.
- Si l'incubation de plus de 24 heures, changement de milieu tous les 12 heures ou au besoin pour maintenir la viabilité bactérienne.
2. Visualisation des biofilms
- Aspirer moyennes de chaque chambre, comme décrit ci-dessus, et laver deux fois par biofilm résidents doucement avec une solution saline stérile.
- Ajouter 200 ul de BacLight Live / Dead tache (3 uL composante A + 3 B composante ul par ml de solution saline) dans chaque puits et incuber à température ambiante pendant 15 minutes. Protéger la culture de la lumière à partir de ce point.
- Aspirer la tache et laver deux fois délicatement avec une solution saline stérile comme avant.
- Ajouter 200 ul du formol tamponné neutre à chaque puits et incuber pendant 30 minutes à température ambiante pour fixer spécimen.
- Retirer fixateur et éliminer correctement conformément aux directives institutionnelles.
- Laver deux fois avec une solution saline et d'éliminer les fluides de lavage qui contiennent du formol comme ci-dessus.
- Retirez le puits en plastique de la lame, ajouter suffisamment de solution saline pour chaque puits de sorte que quand une lamelle est placée sur le joint, pas de bulles d'air sont présents.
- Lamelle et sceller les bords de la lamelle avec un milieu de montage. Le vernis à ongles peut être utilisée pour sceller les diapositives cependant les diapositives ne seront pas aussi permanente.
- Laisser le scellant sécher pendant environ 1 heure avant d'examiner par microscopie.
3. Résultats
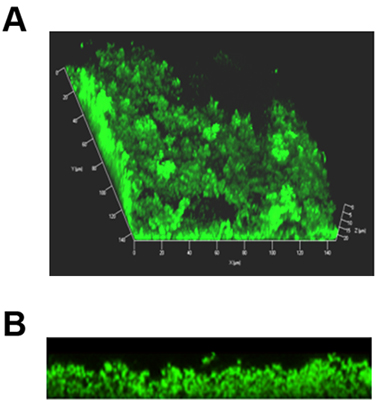
Figure 1. Représentant 3D des images composites d'un biofilm formé dans une chambre de diapositives 8-même. Les bactéries ont été marqués avec Live / Dead tache où des bactéries vivantes fluorescence verte et les bactéries mortes émettent une fluorescence rouge. (A) Image composite du biofilm ensemble montrant l'architecture distincte avec des tours et des canaux d'eau. (B) Même que dans le biofilm (A), maintenant vu en coupe transversale.
Discussion
Comprendre le mécanisme par lequel former des biofilms, ainsi que la caractérisation de leurs composants de la matrice, est un domaine d'intérêt intense. Ce protocole peut être utilisé pour aider à identifier les protéines ou d'autres constituants qui contribuent à l'intégrité structurale du biofilm, ainsi que d'identifier et de cibler des protéines qui peuvent se prêter à une application thérapeutique.
Le temps d'incubation et des dilutions dans le protocole ci-dessus décrits ont été établies pour la formation de biofilm optimale par l'Haemophilus influenzae non typables (NTHi). Certains travaux préliminaires pourraient être nécessaires afin d'optimiser ces étapes pour d'autres espèces bactériennes (ie dilution initiale et le temps d'incubation nécessaire pour atteindre la mi-log phase de croissance). La dilution 1:2500 pour l'ensemencement initial des chambres a été établi pour s'assurer que le biofilm robuste se développe dans la chambre de diapositives comme induite par cet organisme et dans le temps d'incubation a déclaré, sans le biofilm envahit la chambre et / ou épuiser les éléments nutritifs disponibles . En conséquence, la dilution initiale et ou de temps d'incubation peut être nécessaire d'ajuster pour les autres espèces bactériennes.
Déclarations de divulgation
Remerciements
Le travail a été financé par NIDCD / NIH R01DC003915 à LO Bakaletz.
matériels
| Name | Company | Catalog Number | Comments |
| Chocolate II agar | Fisher Scientific | B21267X | |
| 8-well chamber slides | Fisher Scientific | 12-656-18 | |
| BacLight Live/Dead bacterial viability kit | Fisher Scientific | NC9439023 | |
| BHI | Fisher Scientific | 211059 | |
| Hemin | Sigma-Aldrich | H5533 | |
| β-NAD | Sigma-Aldrich | N7004 | |
| Permaslip mounting media | Fisher Scientific | NC9693613 |
Références
- Bakaletz, L. O. Bacterial biofilms in otitis media: evidence and relevance. Pediatr Infect Dis J. 26, S17-S19 (2007).
- Heydorn, A., Nielsen, A. T., Hentzer, M., Sternberg, C., Givskov, M., Ersboll, B. K., Molin, S. Quantification of biofilm structures by the novel computer program COMSTAT. Microbiology. 146, 2395-2407 (2000).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon