Method Article
In-vitro-Bildung von Biofilmen in einem 8-well Chamber Slide
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt das Verfahren für die Bildung und Visualisierung eines bakteriellen Biofilms in einem 8-well Kammer schieben gewachsen
Zusammenfassung
Die chronische Charakter vieler Erkrankungen ist die Bildung von bakteriellen Biofilmen, die widerspenstigen zu herkömmlichen Antibiotika-Therapie zugeschrieben werden. Biofilme sind Gemeinde-assoziierten Bakterien an der Oberfläche und eingehüllt in eine Matrix. Die Rolle der extrazellulären Matrix ist vielfältig, einschließlich der Förderung der Nährstoff-Akquisition und bietet erheblichen Schutz gegen Umwelteinflüsse (z. B. Host-Immunantwort). In dem Bemühen um ein besseres Verständnis darüber, wie die Bakterien in einem Biofilm auf Belastungen der Umwelt haben wir ein Protokoll verwendet haben, worin wir bakterielle Biofilme, die in einem 8-well Kammer schieben gebildet haben visualisieren reagieren zu erwerben. Die Biofilme wurden mit dem Baclight Live / Dead Fleck gefärbt und mit einem konfokalen Mikroskop, um die relative Biofilm Größe und Struktur unter verschiedenen Inkubationsbedingungen zu charakterisieren. Z-Stapel-Aufnahmen wurden durch konfokale Mikroskopie gesammelt und analysiert COMSTAT. Dieses Protokoll kann verwendet werden, um den Mechanismus und die Kinetik durch die Biofilme zu bilden, zu identifizieren sowie Komponenten, die wichtig für Biofilm-Struktur und Stabilität sind.
Protokoll
1. In-vitro-Bildung von Biofilmen
- Bakterienkolonien (die auf geeigneten Agar über Nacht angebaut worden), wurden in den Medien ausgesetzt, und die OD 490 wurde auf 0,65 eingestellt
- Die daraus resultierende Bakteriensuspension wurde dann 1:6 (1 ml Bakteriensuspension + 5 ml vorgewärmten Medium) und bei 37 ° C mit 5% CO 2 für ca. 3 Stunden, um bis Mitte der log-Phase zu erreichen.
- Verdünnen Sie die Mitte der log-Wachstumsphase Federung 1:2500 mit vorgewärmten Medien und Platz 200 ul der Verdünnung in jedes Well einer 8-well Kammer schieben.
- Bei 37 ° C mit 5% CO 2.
- Nach ca. 16 Stunden, absaugen Medium Ecke jeder Kammer und 200 ul frisch, vorgewärmten Medium - verzichten entlang Wand der Kammer, um nicht Scherkräfte innerhalb der Kammer, die den Biofilm stören könnten zu schaffen.
- Wenn Inkubation länger als 24 Stunden, ändern Medium alle 12 Stunden oder nach Bedarf, um bakterielle Lebensfähigkeit zu erhalten.
2. Visualisierung von Biofilm
- Absaugen Medium aus jeder Kammer, wie oben beschrieben, und waschen Wohnsitz Biofilm zweimal vorsichtig mit steriler Kochsalzlösung.
- Add 200 ul Baclight Live / Dead Fleck (3 ul Komponente A + 3 ul Komponente B pro ml Kochsalzlösung) in jede Vertiefung und inkubieren bei Raumtemperatur für 15 Minuten. Schützen Kultur aus Licht von diesem Punkt an.
- Saugen Sie den Fleck und waschen zweimal vorsichtig mit steriler Kochsalzlösung nach wie vor.
- Add 200 ul neutral gepuffertem Formalin in jede Vertiefung und inkubieren für 30 Minuten bei Raumtemperatur auf Probe zu beheben.
- Entfernen Fixativ und ordnungsgemäß entsorgen gemäß den Richtlinien des Instituts.
- Zweimal waschen mit Kochsalzlösung und entsorgen Sie die Waschflüssigkeiten, dass Formalin wie oben enthalten.
- Entfernen Sie die Kunststoff-Brunnen aus der Folie mit ausreichend Kochsalzlösung in jede Vertiefung, so dass bei einem Deckglas auf die Dichtung gelegt wird, keine Luftblasen vorhanden sind.
- Deckglas und die Ränder des Deckglases mit Eindeckmedium. Nagellack kann verwendet werden, um die Folien Siegel jedoch die Folien werden nicht als dauerhaft sein werden.
- Lassen Sie die Versiegelung für ca. 1 Stunde trocknen, bevor über-Mikroskopie untersucht.
3. Ergebnisse
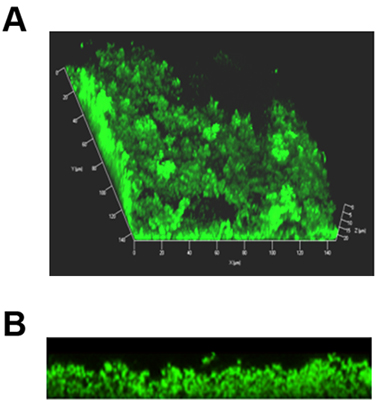
Abbildung 1. Representative 3D zusammengesetzte Bilder eines Biofilms in einem 8-well Kammer schieben gebildet. Die Bakterien wurden mit Live / Dead Fleck wobei lebende Bakterien bezeichnet fluoreszieren grün und tote Bakterien leuchten rot. (A) Zusammengesetztes Bild der gesamten Biofilm zeigt eine besondere Architektur mit Türmen und Wasserkanälen. (B) Gleiche Biofilm als in (A), jetzt im Querschnitt gesehen.
Diskussion
Das Verständnis der Mechanismen, durch die Biofilme bilden, sowie die Charakterisierung ihrer Matrix-Komponenten, ist ein Gebiet von großem Interesse. Dieses Protokoll kann verwendet werden, um zu identifizieren Proteine oder andere Bestandteile, um die strukturelle Integrität des Biofilms sowie die Identifizierung und Target-Proteine, die sich auf eine therapeutische Anwendung kann zu verleihen beizutragen.
Die Inkubationszeiten und Verdünnungen in der oben beschriebenen Protokoll sind für eine optimale Bildung von Biofilmen durch nontypeable Haemophilus influenzae (NTHI) gegründet. Einige Vorarbeiten erforderlich sein, um diese Schritte für andere Bakterienarten zu optimieren (dh erste Verdünnung und Inkubationszeit benötigt bis Mitte der log-Phase Wachstum zu erzielen). Die 1:2500 Verdünnung für die erste Aussaat der Kammern wurde gegründet, um sicherzustellen, dass eine robuste Biofilm würde in der Kammer gleitet wie durch diesen Organismus induziert und innerhalb der Inkubationszeiten angegeben entwickeln, ohne den Biofilm überwuchern die Kammer und / oder anstrengende verfügbaren Nährstoffe . Dementsprechend kann die anfängliche Verdünnung und oder Inkubationszeiten müssen für andere Bakterienarten eingestellt werden.
Offenlegungen
Danksagungen
Die Arbeit wurde von NIDCD / NIH R01DC003915 zu LO Bakaletz finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Chocolate II agar | Fisher Scientific | B21267X | |
| 8-well chamber slides | Fisher Scientific | 12-656-18 | |
| BacLight Live/Dead bacterial viability kit | Fisher Scientific | NC9439023 | |
| BHI | Fisher Scientific | 211059 | |
| Hemin | Sigma-Aldrich | H5533 | |
| β-NAD | Sigma-Aldrich | N7004 | |
| Permaslip mounting media | Fisher Scientific | NC9693613 |
Referenzen
- Bakaletz, L. O. Bacterial biofilms in otitis media: evidence and relevance. Pediatr Infect Dis J. 26, S17-S19 (2007).
- Heydorn, A., Nielsen, A. T., Hentzer, M., Sternberg, C., Givskov, M., Ersboll, B. K., Molin, S. Quantification of biofilm structures by the novel computer program COMSTAT. Microbiology. 146, 2395-2407 (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten