Method Article
El análisis del transcriptoma de células individuales
En este artículo
Erratum Notice
Resumen
En este artículo se describe un método simple para la recolección de las células individuales de rata cultivos primarios de neuronas y posterior análisis de transcriptoma utilizando la amplificación ARNA. Este enfoque es generalizable a cualquier tipo de célula.
Resumen
Muchas técnicas de análisis de expresión génica se basan en elementos aislados de poblaciones heterogéneas de células de tejido homogeneizado o células en cultivo. 1,2,3 En el caso del cerebro, en regiones como el hipocampo contienen una compleja disposición de los diferentes tipos de células, cada una con distintos perfiles de ARNm. La habilidad de cosechar las células individuales permite una investigación más profunda en las diferencias moleculares entre y dentro de las poblaciones de células. Se describe un método sencillo y rápido para la obtención de células para su posterior procesamiento. Pipetas de uso frecuente en electrofisiología se utilizan para aislar (con aspiración) una célula de interés y conveniente depositarlo en un tubo Eppendorf para su posterior procesamiento con cualquier número de técnicas de biología molecular. El protocolo puede ser modificada para la cosecha de las dendritas de cultivo de células o celdas individuales de rebanadas aguda.
También describe el método de amplificación ARNA como una de las principales aplicaciones aguas abajo de los aislamientos de células individuales. Este método fue desarrollado previamente por nuestro laboratorio como una alternativa a otras técnicas de análisis de expresión génica como la transcripción inversa o la reacción en cadena de la polimerasa (PCR). 4,5,6,7,8 Esta técnica permite la amplificación lineal de la poliadenilado ARN a partir de femtogramos sólo de materiales y que resulta en cantidades de microgramos de ARN antisentido. El material linealmente amplificado proporciona una estimación más precisa de la amplificación por PCR exponencial de la abundancia relativa de los componentes del transcriptoma de la celda de aislamiento. El procedimiento básico consiste en dos rondas de amplificación. En pocas palabras, un sitio de la RNA polimerasa T7 promotor se incorpora a doble varados cDNA creado a partir de las transcripciones de ARNm. Una noche a la mañana en la transcripción in vitro (FIV) la reacción se realiza a continuación en el que la RNA polimerasa T7 produce muchas transcripciones antisentido del cDNA de doble cadena. La segunda ronda se repite este proceso, pero con algunas diferencias técnicas, ya que el material de partida es el ARN antisentido. Es un estándar para repetir la segunda vuelta, resultando en tres rondas de amplificación. A menudo, la tercera ronda en la reacción de transcripción in vitro se realiza con los trifosfatos nucleósidos con biotina para que el ARN antisentido producido puede ser híbridas, y detectado en un microarray de 7,8.
Protocolo
1. Cultivo de células
Nuestro laboratorio utiliza cultivos primarios de neuronas de hipocampo de rata para los experimentos siguientes. A continuación se describe el protocolo modificado para Banker forma en que estos cultivos celulares se crean y mantienen. 9 Existen, por supuesto, una serie exhaustiva de las permutaciones de estas técnicas de cultivo celular y cualquier otro método establecido adaptados a las necesidades específicas de un laboratorio particular que ofrece una suministro constante de células sanas sería un sustituto adecuado.
- Cinco autoclave, redondo, 12 mm cubreobjetos se colocan en un plato de 35 mm y recubierto con 80 mg / ml de poli-D-lisina (MW 70-150,000) en tampón de borato S / N, enjuagarse con agua (grado de cultivo celular), entonces recubiertas con 1 mg / ml laminina en tampón de borato S / N, entonces enjuagarse de nuevo con agua. NG medios de comunicación (MEM con sales de Earle y Glutamax suplementado con glucosa (0,6% w / v), penicilina (100 U / ml), estreptomicina (100 mg / mL), suero de caballo (10% v / v)) y se cocina se almacenan en una incubadora (5% de CO 2 a 37 ° C). El PDL150/laminin sirve como sustrato para las neuronas aisladas de crecer en una monocapa. Los cubreobjetos se puede recubrir hasta dos semanas antes de enchapado.
- En el día de la siembra, las neuronas primarias de embrión de rata hipocampo día 18 se sembraron en los medios de comunicación NG mediante la adición de 1,5 ml de 100.000 células / ml de suspensión. Cuatro a seis horas después de la siembra, cada plato de 35 mm se trata con 0,75 l de 5 mM citosina beta-D-arabinofuranoside (ara-C) para prevenir el crecimiento de las células gliales contaminantes. Veinticuatro horas más tarde, los medios de recubrimiento se cambia al MEM con sales de Earle y L-glutamina suplementado con un 0,6% w / v de glucosa, 1 mM piruvato de sodio, y B27. Las células se les permite cultivar por lo menos dos semanas antes de su uso en cualquier experimento para permitir el desarrollo completo de los procesos.
2. Pipetas Preparación
Nota sobre RNasas: La piel, la saliva, e incluso la respiración son las principales fuentes de RNasas, enzimas que degradan el ARN. Es imperativo que RNasa libre de la técnica se observa desde este punto en el protocolo para que la muestra no se contamine con RNasas y degradar posteriormente. Esto incluye usar siempre guantes para manipular las muestras y reactivos, no hablar más de las muestras o reactivos, y el uso de las nuevas cajas de puntas de las pipetas y tubos esterilizados. A menudo, las pipetas que no están destinados exclusivamente para el trabajo de ARN se descontaminan pasándoles un trapo con una solución de tratamiento RNasa como RNasa AWAY (Bioproducts Molecular). Sin embargo, estas soluciones se inhiben las reacciones enzimáticas aguas abajo por lo que también es importante para evitar la contaminación de las muestras con estos tratamientos.
- Autoclave de 1,5 mm de diámetro exterior (OD) pipetas de vidrio.
- El uso de un extractor de micropipeta, pipetas para tirar de un diámetro adecuado para los registros electrofisiológicos, que puede variar en función de tirador, el filamento, y pipetas. 10 El tamaño del agujero no es muy crítica, ya que la punta se rompe antes de la recolección de las células.
- Guarde con cuidado las pipetas en un ambiente libre de polvo, donde las puntas se mantendrá intacto (lo ideal es utilizar un recipiente de almacenamiento micropipeta).
- Para romper la punta de una manera controlada, celebrar una Kimwipe tirante entre los dedos en una mano y muy suavemente con el cepillo de la punta de la pipeta a través del papel 1 a 2 veces. La apertura debe ser de aproximadamente 75 a 100% del tamaño de la celda de destino. Ajustar este paso hasta conseguir el resultado deseado.
3. Cultura preparación, tubos, y el microscopio
- Prepare el número deseado de 1,7 ml tubos Eppendorf. Añadir 2 l de PBS, la primera cadena de búfer si el material se va a utilizar para la amplificación de células individuales, o cualquier otra solución para el almacenamiento del material cosechado.
- Para la cosecha, se necesita un microscopio de luz con un objetivo de 40x equipado con un micromanipulador. Use un soporte de pipeta con un tubo flexible que se aleja del soporte. Colocar el tubo a una superficie estable para evitar movimientos no deseados de la pipeta durante la recolección. Al final de la tubería, inserte una aguja de modo que una jeringa de 1 ml con una conexión Luer-Lock se puede unir y cambiar entre los usuarios.
- Si se utiliza cubreobjetos, trabajar con un cubreobjetos a la vez. Si es necesario, la transferencia de un cubre solo a un plato nuevo 35 mm * PBS que contiene los medios de comunicación o de elección. Cuanto más tiempo que las células están fuera de la incubadora, más saludable y que se convertirá en el mayor de sus perfiles de ARNm se desviará a la de una célula sana. Es fundamental para preservar la salud de las células en el cubreobjetos otros por mantenerlos en la incubadora cuando no está trabajando con ellos. El trabajo lo más rápido posible con las células fuera de la incubadora.
* Con nuestra configuración, es necesario el uso de la tapa de una placa de 35 mm ya que las paredes del plato actual es demasiado alto para permitir el avance adecuado de la micropipeta hacia el coverslip.
4. Las células de cosecha
- Asegurar la micropipeta en el soporte micropipeta. Ponga micropipeta titular de la inserción en la micromanipuladores. Establecer el objetivo de 40x.
- Coloque el plato en la platina del microscopio y encontrar una región de células adecuadas para la cosecha. En el caso de los cultivos primarios de neuronas, las células deben estar relativamente aislado de sus vecinos para evitar que la cosecha de las células que rodean y / o procesos. La población de las transcripciones de ARNm entre el soma y los procesos varían, así que si está interesado en somáticas mRNAs exclusivamente, se debe tener cuidado para evitar la contaminación del soma con los procesos. Coloque la celda que desea para la cosecha en el centro del campo de visión.
- Utilice el micromanipulador para avanzar en la micropipeta hacia la solución en el plato en la trayectoria de la luz. Baje la punta de la pipeta en la solución. Aplique una presión positiva a partir de ahora soplando suavemente a través de la jeringa. Mire por el ocular. La pipeta debe aparecer como una sombra en el campo de visión. Muy por encima del plano de las células, ajustar la posición de la punta de la pipeta, hasta que se encuentra dentro del campo de visión y enfoque en la punta de la pipeta con los mandos de grueso de enfoque. En este punto, se debe valorar si el tamaño del diámetro de la pipeta es demasiado grande o demasiado pequeño. Recolección de la práctica proporcionará la capacidad de determinar si el tamaño del diámetro correcto que se ha logrado en este momento.
- Ahora, el avance de la pipeta hacia el plano de las células. Es importante que la punta no es demasiado avanzado rápidamente, causando que se rompa en la región desde la que desea recoger. Para evitar esto, utilice el enfoque aproximado para avanzar en el plano focal antes de avanzar hacia la punta de la pipeta las células utilizando el micromanipulador. Cuando usted está cerca de las células, el uso del enfoque fino hasta las células y la punta de la pipeta están en foco. Dejar de aplicar presión positiva antes de llegar al plano de las celdas para evitar que los soplan fuera del cubreobjetos.
- Utilice el micromanipulador a la posición de la punta de la pipeta de modo que está en contacto con el soma celular que desee a la cosecha.
- Mediante la jeringa, aplique una suave succión por la boca hasta que la célula entra en la punta de la pipeta. Si la célula no está entrando en la pipeta, mueva suavemente la punta más cercana a la célula y hacia abajo hasta que se levante de la cubreobjetos.
5. Ahorro de la célula
- Utilice el micromanipulador para pasar de inmediato la pipeta hacia arriba y fuera de la solución.
- Retire la pipeta del titular.
- Sostenga el tubo de Eppendorf 1,7 ml en una mano y suavemente romper la punta de la pipeta en el lado del tubo en la parte inferior. (Apunte para la marca de 0,1 ml.)
- Con la punta rota centrada en el interior del tubo, insertar una aguja a una jeringa de 3.1 ml en la abertura superior de la pipeta. Rápidamente el émbolo pasar la solución de la pipeta para rociar a cabo en el tubo. La célula debe mantenerse en la punta de la pipeta y esto debería ser suficiente para expulsar correctamente el celular. Tenga cuidado de no tocar la punta de cualquier líquido en los lados del tubo como la acción capilar traerá la parte posterior de líquido en la pipeta.
- Rápidamente girar hacia abajo el contenido del tubo con una microcentrífuga de sobremesa y congelar de inmediato (la tienda a -80 ° C) o el lugar en el hielo para su posterior procesamiento (de preferencia).
6. ARNA amplificación
- 1 ª ronda capítulo de síntesis cDNA primer lugar:
Crear ARNm / híbridos cDNA.- Por cada 5 l de volumen único de recogida de células, 1x añadir lo siguiente para el tubo de recogida (con hielo). La reacción puede ser ampliado para los volúmenes de la colección más grande (2 x 10 volúmenes de la colección de l, etc.) Crear una mezcla maestra de multiplicar los siguientes reactivos por el número de tubos de recogida de 10-20% más para tener en cuenta para pipetear error. Haga esto para todas las reacciones posteriores del procedimiento ampification ARNA.
- EN EL HIELO
- 1,2 l de dNTP (2,5 mM cada uno)
- 2,4 l buffer 5x Primer capítulo
- 0,3 l T7-oligo (dT) primer (100 ng / mL)
- 1,2 l de TDT (100 mM)
- Llevar el volumen hasta 10,25 l con agua libre de nucleasa. Mezclar con una pipeta y girar brevemente con una microcentrífuga.
- Incubar durante 5 minutos a 70 ° C para desnaturalizar cualquier estructura secundaria del ARNm. Colocar inmediatamente en hielo durante al menos 5 minutos.
- Añadir (de nuevo utilizando una mezcla maestra):
- 0.3 RNasin l (40 U / l)
- 0,45 l Superíndice III (200 U / l)
- 1 l de agua libre de nucleasa
- Pipeta de mezcla y una breve vuelta. Incubar durante 1 hora a 42 ° C.
- Se incuba a 70 ° C durante 15 minutos para inactivar el superíndice. Continuar con el siguiente paso.
- Por cada 5 l de volumen único de recogida de células, 1x añadir lo siguiente para el tubo de recogida (con hielo). La reacción puede ser ampliado para los volúmenes de la colección más grande (2 x 10 volúmenes de la colección de l, etc.) Crear una mezcla maestra de multiplicar los siguientes reactivos por el número de tubos de recogida de 10-20% más para tener en cuenta para pipetear error. Haga esto para todas las reacciones posteriores del procedimiento ampification ARNA.
- 1 ª ronda capítulo de síntesis cDNA Segundo
Crear iniciadores de ARN de la porción del ARNm del ARNm híbrido / ADN para ayudar en la síntesis of cDNA de doble cadena.- EN EL HIELO
- A los 12 l primer capítulo de la reacción, añadir:
- 8 l de agua libre de nucleasa
- 7,5 l buffer 5x segundo capítulo
- 0,75 l de mezcla de dNTP (2,5 mM cada uno)
- 0,25 l de ADN ligasa (10 U / l)
- Una ADN polimerasa l I (10 U / l)
- 0,25 l RNasa H (2 U / l)
- Agregar: 1 l de ADN polimerasa T4 (5 U / l). Mezclar con la pipeta y una breve vuelta. Incubar 10 minutos a 16 ° C.
- Limpieza de la reacción, mediante el kit Qiagen MinElute según las instrucciones del fabricante con ligeras modificaciones: 11 Lavar dos veces con 500 l de tampón de lavado en lugar de una vez con 750 mL. Eluir con agua libre de nucleasa.
- Concentrado de 4.2 l con un Speedvac o por precipitación con etanol. Para la precipitación con etanol, el glucógeno actúa como un transportador de ácidos nucleicos y se utiliza cuando se precipitan en pequeñas cantidades de ADN o ARN. El sodio de la acetato de sodio ayuda a neutralizar la carga negativa de la columna vertebral del ADN, ayudando en la precipitación. No es necesario hacer una mezcla maestra de precipitaciones de rutina.
- Añadir 29 l de agua DEPC
- 2 l de glucógeno (5mg/mL)
- 1 / 10 de volumen (3 l) de acetato de sodio 3M
- 2,5 volúmenes (~ 250 l) con etanol en frío 100%
- Centrifugar durante 20 minutos a 4 ° C.
- Eliminar el sobrenadante y lavar el precipitado con 800 l de etanol al 70%. Asegúrese de desalojar completamente el sedimento, ya sea por pipeteado o agitación para facilitar la eliminación del exceso de sal.
- Centrifugar durante 20 minutos a 4 ° C. Eliminar el sobrenadante y secar al aire durante 15-20 minutos.
- Resuspender en 4 l de agua libre de nucleasa. Almacenar a -20 o -80 ° C o continuar con el siguiente paso.
- En la 1 ª ronda de transcripción in vitro (FIV):
Sintetizar ARN antisentido del promotor T7 incorporado en el cDNA de doble cadena.- Esta reacción se realiza utilizando el Ambion MEGAscript T7 kit según las instrucciones del fabricante, salvo a escala de un l 10 en lugar de una reacción de 20 mL. 12 Es imprescindible para montar esta reacción a temperatura ambiente y mantener el tampón a temperatura ambiente durante el montaje. El buffer se precipita el ADN si es fría como el hielo. Mantenga el PNT y mezcla de enzimas en el hielo cuando no se utiliza.
- A TEMPERATURA AMBIENTE
- Transferir el cDNA de doble cadena resuspendido a un tubo de paredes delgadas PCR.
- Agregar 4 l de mezcla NTP (18,75 mM cada uno)
- Un buffer de reacción 10x l
- Una mezcla de l enzima 10x
- Incubar 14 horas a 37 ° C en un termociclador (preferible) o incubadora.
- Esta reacción se puede limpiar utilizando dos métodos diferentes, seguida de concentración de la muestra utilizando un Speedvac o precipitación con etanol. Para su limpieza mediante un kit, proceder a A. Método para la limpieza con un estándar de extracción con fenol / cloroformo, pase al método B.
- Método A:
- Limpieza de la reacción, mediante el kit de Ambion Megaclear según las instrucciones del fabricante, con cerca de 13 modificaciones: Lavar dos veces con 500 l de tampón de lavado en lugar de una vez con 750 mL. Para la etapa de elución, se añaden 50 l de agua exenta de nucleasas en el centro de la columna, se incuba a 70 ° C durante 10 minutos. Giran a 10.000 g durante 1 min. Repetir en un tubo nuevo. Combine eluidos. Concentrar la muestra a 4.2 l con un Speedvac o por precipitación con etanol.
- Para la precipitación de etanol: acetato de amonio se utiliza en lugar de acetato de sodio, en este caso porque es eficiente en la prevención de co-precipitación de nucleótidos libres con el ácido nucleico. Esto es importante debido a la alta concentración de NTP se utiliza en la reacción de formación profesional inicial, que puede inhibir las reacciones posteriores.
- Añadir 50 l de agua DEPC
- 2 glucógeno l (20 mg / mL)
- 0,6 volúmenes (37,2 l) acetato de amonio 5M
- 2,5 volúmenes (~ 180 l) etanol frío
- Precipitado a -80 ° C (30 min. A S / N) .*
- Centrifugar durante 20 minutos a 4 ° C.
- Eliminar el sobrenadante y lavar el precipitado con 800 l de etanol al 70% (en agua libre de nucleasa). Asegúrese de desalojar completamente la pastilla para eliminar toda la sal en exceso.
- Centrifugar durante 20 minutos a 4 ° C.
- Aspirar el sobrenadante y el aire seco durante 15-20 minutos.
- Resuspender el pellet en 4 l de agua libre de nucleasa.
- Método B:
- Por otra parte, el ARNA se puede limpiar con un estándar de extracción con fenol / cloroformo.
- Añadir 50 l de agua DEPC
- 2 glucógeno l (20 mg / mL)
- 0,6 volúmenes (37,2 l)Acetato de amonio 5M
- Un volumen (98 l) fenol: cloroformo: alcohol isoamílico 25:24:1 (equilibrado a un pH de 7,8 a 8,0)
- Vortex durante 15 segundos. Centrifugar durante 1,5 minutos a mitad de la velocidad máxima en una microcentrífuga de mesa. La transferencia de la capa acuosa superior a un nuevo tubo que contiene 2,5 volúmenes (245 l) de etanol frío.
- Precipitado a -80 ° C (30 min. A S / N).
- Centrifugar durante 20 minutos a 4 ° C.
- Quitar el sobrenadante y pellet lavado con 800 l de etanol al 70% (en agua libre de nucleasa). Asegúrese de desalojar completamente la pastilla para eliminar toda la sal en exceso.
- Centrifugar durante 20 minutos a 4 ° C.
- Aspirar el sobrenadante y el aire seco durante 15-20 minutos.
- Resuspender el pellet en 4 l de agua libre de nucleasa.
* La muestra se puede congelar a esta temperatura durante la incubación durante la noche. Se ha demostrado que en realidad esto puede aumentar el rendimiento de los ácidos nucleicos.
- Por otra parte, el ARNA se puede limpiar con un estándar de extracción con fenol / cloroformo.
- Esta reacción se realiza utilizando el Ambion MEGAscript T7 kit según las instrucciones del fabricante, salvo a escala de un l 10 en lugar de una reacción de 20 mL. 12 Es imprescindible para montar esta reacción a temperatura ambiente y mantener el tampón a temperatura ambiente durante el montaje. El buffer se precipita el ADN si es fría como el hielo. Mantenga el PNT y mezcla de enzimas en el hielo cuando no se utiliza.
- Ronda 2 capítulo de síntesis cDNA primer lugar
- EN EL HIELO
- Añadir un cebadores aleatorios l (0,05 mg / mL) *
- Calor a 70 ° C durante 10 minutos. Colocar inmediatamente en hielo durante al menos 5 minutos.
- Añadir 2 l buffer 5x Primer capítulo
- Un TDT l (100 mM)
- 0,5 l de dNTP (2,5 mM cada uno)
- 0.5 RNasin l (40 U / l)
- 1 l Superíndice III (200 U / l)
- Mezclar bien con la pipeta y el giro brevemente. Deje reposar a temperatura ambiente durante 10 minutos. Este paso es necesario para permitir la extensión de los cebadores aleatorios poco antes de la reacción de transcripción inversa se lleva a cabo.
- Incubar durante 30 minutos a 42 ° C.
- Calentar 5 minutos a 95 ° C para desnaturalizar el ARN en ADN / ARN híbridos. Coloque sobre hielo durante al menos 5 minutos. Almacenar a -20 ° C o -80 ° C o inmediatamente continuar con el siguiente paso.
* La concentración de los cebadores al azar es importante. Si la concentración es demasiado alta, el producto será más truncada con cada ronda de amplificación.
- Ronda 2 capítulo de síntesis cDNA Segundo
- EN EL HIELO
- Añadir 2 l T7-oligo (dT) primer (10 ng / mL) *
- Fuego durante 5 minutos a 70 ° C. Colocar inmediatamente en hielo durante al menos 5 minutos. Girar brevemente.
- Añadir 43,5 l de agua libre de nucleasa
- 15 ul buffer 5x segundo capítulo
- 1,5 l de mezcla de dNTP (2,5 mM cada uno)
- 2 ADN polimerasa l I (10 U / l)
- Mezclar bien con la pipeta y el giro brevemente. Incubar durante 2 horas a 16 ° C.
- Añadir 2 l de ADN polimerasa T4 (5 U / l)
- Mezclar bien con la pipeta y el giro brevemente. Incubar 10 minutos a 16 ° C.
- Limpieza de la reacción, mediante el kit Qiagen MinElute como en la Sección 6.2.3.
- Concentrado de 4.2 l con un Speedvac o precipitación con etanol como en las secciones 6.2.4 a 6.2.8.
* Tenga en cuenta la concentración de las diferentes T7-oligo (dT) primer en comparación con la síntesis de primera ronda de cDNA segundos.
- Round 2 En la transcripción in vitro
Realizar como en la sección 6.3.- Repita las secciones 6,4 a 6,6 el número deseado de veces. Tenga en cuenta que cada ronda posterior de los resultados de amplificación de productos más cortos ARNA. El número de rondas de amplificación debe ser limitada por esta razón. Normalmente, dos o tres rondas de amplificación son suficientes para amplificar un producto de cosecha de una sola célula para llevar a cabo análisis de microarrays. En el caso de análisis de microarrays, la reacción de la tercera ronda IVT se realiza mediante el Illumina TotalPrep Kit de amplificación de ARN de acuerdo con las instrucciones del fabricante. Este procedimiento incorpora marcado con biotina UTP en el ARNA que se utiliza para la detección en un chip microarrays.
- Medir la concentración de Arna tercera ronda con un Nanodrop o Bioanalyzer Agilent con un kit de ARN Nano.
7. Resultados representante
El éxito de la cosecha de una sola célula de cultivos primarios de neuronas se puede completar en menos de 2 minutos, dependiendo de la aptitud (ver Figura 1). Sin embargo, el tiempo de cosecha puede variar entre los sistemas y con la intervención de manipulación experimental. Someter a la célula para el procedimiento de Arna (ver figuras 4A y 4B) se traduce en cantidades de microgramos de ARNA total de amplificación y produce un pico ancho característico cuando se analiza con un Bioanalyzer (ver Figura 3). Tres rondas se puede completar en un mínimo de tres días para permitir un rápido análisis de expresión génica de células individuales.
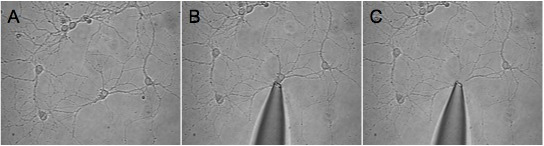
Figura 1. Se muestra un ejemplo de una buena cosecha de una neurona aislada. Nos seleDirección Ejecutiva de una región relativamente baja densidad (A) y avanzado de la punta de la pipeta hacia la celda deseada (B). La tercera imagen (C) muestra el campo de visión después de la celda había sido cosechado. Tenga en cuenta que los procesos que rodean permanecen en el cubreobjetos.
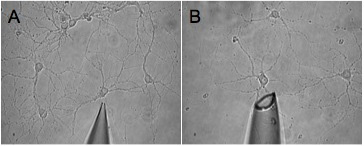
Figura 2. Se muestran dos imágenes de la punta de la pipeta, que son de un tamaño inadecuado para la recolección de efectivo. Estos consejos le conducen a la cosecha incompleta (A) y la cosecha de alrededor de medio (B), respectivamente.
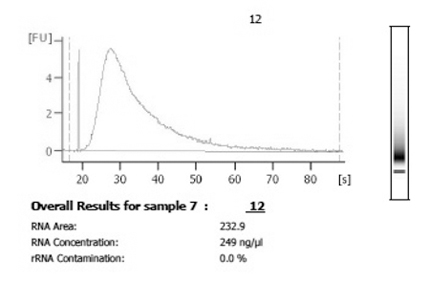
Figura 3. Después de la cosecha y el análisis de amplificación, utilizando un bioanalizador se recomienda examinar la distribución y la cantidad de ARN amplificado. Una ampliación con éxito a partir de material celular solo producirá cantidades totales de los microgramos de baja y tendrá una distribución que es suave y amplia.
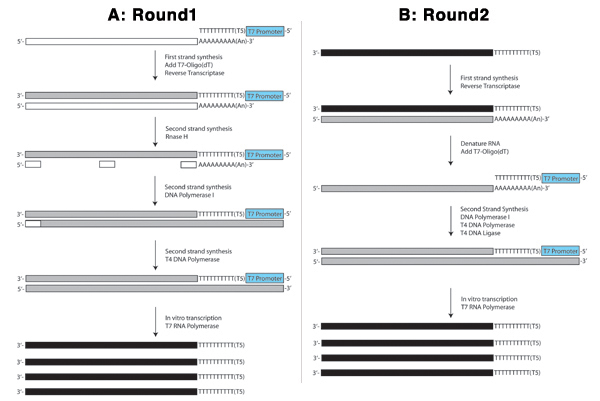
Las figuras 4. Esquema de la primera ronda (A) y la segunda (B) del procedimiento de ARNA se muestran.
Discusión
Notas y solución de problemas
- Es posible que desee tomar antes y después de las imágenes que muestran que la célula diana fue aislado y que la penumbra restante fue dejado intacto.
- Si demasiada solución es entrar en la pipeta a medida que se cosecha, se puede utilizar de 3 vías Luer-Lock accesorios y el émbolo de la jeringa para mantener la presión positiva en la tubería. El volumen deseado varía con el tipo de procesamiento, sino hasta 5 l es suficiente para la mayoría de las aplicaciones.
Consejos generales sobre técnicas de biología molecular
- Vortex los tubos de valores y el giro hacia abajo antes de añadir a una reacción. NUNCA enzimas vórtice.
- Mezclar bien las reacciones antes de añadir la enzima para asegurar que el buffer está en la concentración adecuada.
- Mantener las poblaciones de la enzima a -20 ° C, si es posible mediante el uso de un stratacooler. De lo contrario, eliminar el derecho antes de su uso, mantener en hielo, y regresar de inmediato a -20 ° C.
- Siempre hacen mezclas maestras en la preparación de más de una reacción para reducir los errores de pipeteo. Calcular el volumen requerido en función del número de muestras y añadir un 10-20%.
- Tienda de ARN a -80 ° C a la degradación de retraso. El ARN es más estable almacenada en el búfer de apurination retraso de ARN que se produce en condiciones ácidas.
Esquema general del procedimiento de ARNA
Figura 4 ilustra la primera ronda del procedimiento de ARNA. En la reacción de la primera cadena, la parte de poli-T de la T7-oligo (dT) primer selecciona para las especies de ARNm (rectángulo blanco de largo) al unirse a la cola de poliA. Algunos microARN también poliadenilado y serán capturadas por este procedimiento. Más importante, sin embargo, el ARN más abundante en la célula, ARN ribosomal, no lo hará. Este oligo actúa como un manual para la transcriptasa reversa para sintetizar una hebra complementaria de cDNA (rectángulo gris de largo) utilizando el ARNm como molde. La parte de la T7 T7-oligo (dT) primer incorpora el promotor T7 RNA polimerasa en el marco con la secuencia antisentido al ARNm de partida. Esto se utiliza posteriormente en la reacción de transcripción in vitro en.
A continuación, el ARNm en el híbrido de mRNA / ADN creado en el paso anterior es parcialmente hidrolizada por la RNasa H crear ARN "primers" (pequeños rectángulos de color blanco) similares a los fragmentos de Okazaki creado en la síntesis quedando la cadena de ADN. ADN polimerasa I utiliza los fragmentos de ARN para la síntesis del ADN con el ADN complementario al ARNm como molde. Cuando se llega al siguiente fragmento de ARN, el 5 'a 3' nucleasa elimina los ribonucleótidos y las reemplaza con desoxirribonucleótidos. ADN ligasa se añade a ligar los hilos en la sustitución de la principal línea no está completa. T4 DNA polimerasa se añade a rellenar las áreas donde los fragmentos de ARN sirve como cebadores inicial de la ADN polimerasa I la creación de un extremo romo de doble hebra de ADNc que se purifica antes de realizar la reacción de IVT.
En la reacción de IVT, T7 ARN polimerasa se une al promotor T7 incorporado en las moléculas de ADNc de doble cadena y sintetiza el ARN antisentido (largo rectángulos negro) con la cadena de sentido como una plantilla. Esto sirve como el paso de amplificación en la que miles de moléculas de ARN antisentido se producen por cada molécula de doble hebra de ADNc (Figura 4).
La segunda ronda, como se muestra en la Figura 4B, se inicia con una reacción de transcripción inversa que es ligeramente diferente de la de la primera ronda ya que el ARN antisentido de partida es (rectángulo negro sólido) y carece de la cola poliadenilado que fue objeto de la T7-oligo (dT) primer en la primera ronda. Por lo tanto, esta reacción se ceba con cebadores aleatorios (pequeños rectángulos grises) y posteriormente la desnaturalización del ARN. La reacción del segundo elemento es entonces preparado por la T7-oligo (dT) primer, que se une a la secuencia de poli-A en el extremo 3 'del ARN sentido creado en la reacción de transcripción inversa anterior. Otra reacción IVT se realiza en la misma forma que en la primera ronda. Esta segunda ronda se suele repetir al menos una vez para lograr tres rondas de amplificación de una sola célula.
Aplicaciones
Las técnicas que hemos presentado en este artículo se puede traducir en un gran número de aplicaciones. El protocolo de una sola celda de aislamiento puede ser modificado para su uso en rodajas aguda. 14 Aunque técnicamente más difícil, los mismos principios se aplican en esta preparación alternativa. Además, si el tamaño de la pipeta es un poco ajustado, las grabaciones de la fisiología de las células se pueden hacer antes de la cosecha teniendo en cuenta una investigación bien controlada de los mecanismos moleculares que subyacen a los productos fisiológicos. Otra pequeña modificación consiste en aislar los procesos, desde el soma celular. 15 Para esta aplicación, recoger los cuerpos de células con una pipeta y luego volver con una pipeta nueva y recoger 100-300 Dendrit identificadoes o axones por tubo de recolección. 16
Una vez que las células se han obtenido, la comparación de la abundancia de ARNm y las composiciones se pueden hacer entre diferentes e incluso dentro de las poblaciones de la misma célula. La incorporación de biotina-UTP en el ARNA tercera ronda permite el análisis de microarrays para determinar las abundancias relativas de ARNm. La composición de la población de ARNm original también se puede determinar después de la intervención ARNA utilizando secuenciación de próxima generación. El ARNA amplificada también se puede utilizar para confirmar la célula estudios de conversión fenotipo en el que se transfectaron un conjunto completo de los ARNm de un tipo de células en un tipo celular diferente con el fin de inducir la transición del fenotipo del tipo de célula en que esta última de la primera, un procedimiento desarrollado por el laboratorio y se conoce como TIPeR 17. Estos estudios son particularmente útiles para el estudio de los estados de enfermedad y de fenotipos de células y estos estudios están actualmente en curso en el laboratorio. RT-PCR o PCR cuantitativa se puede realizar en el material amplificado para confirmar la expresión de genes específicos de la célula. Además, las evaluaciones de la eficacia de transfección o transducción se pueden hacer en el nivel de células individuales.
Ventajas y limitaciones
Como se indica en el resumen, el aislamiento de células individuales para el análisis elimina los efectos observados con un promedio de análisis de poblaciones celulares heterogéneas. Estos efectos promedio de tergiversar la abundancia de ARNm en una sola célula por la sobre-representación de abundantes transcripciones y media de la prevención y la detección de muchos de baja abundancia transcripciones. La citometría de flujo se puede utilizar para clasificar las células individuales, pero este método requiere el conocimiento de marcadores de células específicas y equipos costosos. 18 microdisección de captura por láser o bien con UV o IR sistemas láser captura microdissection permiten célula e incluso capturar subcelular, pero requiere que las células de su interés se encuentra en la superficie de secciones muy finas. 19 Al igual que la citometría de flujo, microdisección láser de captura también se requiere un equipo caro.
Una de las principales ventajas de la técnica de electrodos colección basada descrito anteriormente es que los valiosos datos electrofisiológicos se puede obtener de la célula de interés antes de la cosecha, lo que permite el análisis funcional y transcriptoma para llevar a cabo en la misma celda. 20 Un aspecto negativo de nuestra técnica es que requiere experiencia en el uso micromanipulador. Los investigadores familiarizados con micromanipulador se encuentra esta técnica muy intuitiva, sin embargo, las personas con ninguna experiencia tendrá que sentirse cómodo con los movimientos finos necesarios.
Inherentes a cualquier técnica de amplificación es la amplificación preferencial de las transcripciones de algunas basadas en el tamaño y la composición de nucleótidos. 4,6,7 reacción en cadena de la polimerasa (PCR) basada, como la reacción de transcripción inversa en cadena de polimerasa (RT-PCR) y la rápida amplificación de cDNA extremos (RACE) resultado en la amplificación exponencial de las transcripciones, mientras que el ARNA los resultados del procedimiento de amplificación de amplificación lineal. Así, una de las principales ventajas del procedimiento de ARNA reside en su capacidad para conservar mejor la abundancia relativa de las transcripciones de ARNm por sólo linealmente amplificando los errores o sesgos que se producen en el proceso de amplificación en lugar de amplificar de manera exponencial, dijo errores y sesgos.
El procedimiento ARNA junto con el análisis de microarrays permite la comparación de las abundancias de mRNA entre las células individuales de morfología similar o diferente, tratados o sin tratar. Además, el material amplificado puede ser presentado para la secuenciación de próxima generación. 5,8 Sin embargo, se debe tener cuidado en este tipo de análisis, ya que, en contraste con el uso de cebadores aleatorios para el procedimiento, el procedimiento de oligo-dT cebado descrito anteriormente amplificación de los sesgos de la 3 'de los ARNm y por lo general resulta en un acortamiento leve de material posterior amplifica con cada ronda. Se debe tener cuidado en el análisis de los resultados de microarrays con los métodos estándar como algunas llamadas ausente falsos pueden surgir a partir de material acorta ligeramente amplificado. Además, los resultados, mientras que la secuenciación hecho, proporcionará la completa secuencia 5 'de la mayoría de los ARNm original, las secuencias 5' de algunos ARNm podría pasarse por alto. Por estas razones, el número de rondas de amplificación debe ser limitado.
Divulgaciones
Agradecimientos
Gracias a Kevin Miyashiro para la siembra y mantenimiento de cultivos de células, a la Dra. Terri Schochet para proporcionar cultivos de células de las imágenes incluidas en este documento. Además, gracias a Kevin Miyashiro, el Dr. Peter Buckley, y Pertiz Tiina para la entrada en el procedimiento de ARNA. La financiación de este trabajo fue del Instituto Nacional sobre el Envejecimiento, el Instituto Nacional de Salud Mental y los recursos humanos fondos Buscador de Hecho de la Comunidad de Pennsylvania.
Materiales
| Name | Company | Catalog Number | Comments |
| Spiegelgas coverslips | Carolina Biological | 63-3029 | |
| Nunc 35x10 mm culture dishes | Fisher Scientific | 12-565-90 | |
| Water for cell culture | Lonza Inc. | 17-724Q | For making solutions used for cell culture and rinsing coverslips |
| Poly-D-Lysine MW70-150K | Sigma-Aldrich | 6407 | |
| Laminin, ultrapure | BD Biosciences | 354239 | |
| Boric acid | Sigma-Aldrich | B0252 | |
| MEM with Earle’s salts and glutamax | Invitrogen | 41090-101 | For plating cells |
| D-glucose | Sigma-Aldrich | G8769 | |
| Penicillin-streptomycin | Invitrogen | 15140-122 | |
| Horse serum | Invitrogen | 16050 | |
| Cytosine beta-D-arabinofuranoside | Sigma-Aldrich | C1768 | |
| MEM with Earle’s salts and L-glutamine | Invitrogen | 11095-098 | For growing cells |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| B27 serum-free supplement | Invitrogen | 17504-044 | |
| Borosilicate glass capillary tubes (1.5mm O.D, 100mm length) | Kimble Chase | 34500 99 | Any borosilicate glass pipette will work as long as the proper bore size is attained. |
| HBSS | Invitrogen | 14175 | Any solution will work as long as the components won’t interfere with any future processing (i.e. no Ca2+ or Mg2+) |
| 1ml syringe | BD Biosciences | 309628 | |
| Needle | BD Biosciences | Gauge depends on the diameter of the pipettes | |
| dNTP mix | Amersham | 28-4065-51 | |
| dt-T7 oligo | Custom | Midland Certified | |
| Second strand buffer (5x) | Invitrogen | Y01129 | |
| DTT | Supplied with second strand buffer | ||
| E.coli DNA Ligase | Invitrogen | 100002324 | |
| DNA polymerase I | Invitrogen | 100004926 | |
| Rnase H | Invitrogen | 18021-071 | |
| Megascript T7 kit | Ambion | AM1334 | |
| Random primers | BMB | 11034731001 | |
| Superscript III Reverse Transcriptase | Invitrogen | 56575 | in kit (18080-044) comes with first strand buffer (Y02321) and DTT |
| MEGAclear Kit | Ambion | 1908 | |
| MinElute Reaction Cleanup Kit | Qiagen | 28206 | |
| T4 DNA polymerase | Invitrogen | 100004994 | |
| Rnasin | Promega Corp. | N251B | |
| Illumina TotalPrep RNA Amplification Kit | Ambion | AMIL1791 | |
| Flaming/Brown micropipette puller | Sutter Instrument Co. | P-87 | Sutter has many other models, many are discussed in the cookbook |
| Micromanipulator | Olympus Corporation | Many other micromanipulators will work such as the newer Eppendorf models | |
| Pipette Holder | Warner Instruments | MP-S15A | Will vary with micromanipulator and pipette O.D. |
| Bioanalyzer RNA 6000 Nano Kit | Agilent Technologies | 5067-1511 |
Referencias
- Davis, J. E., Eberwine, J. H., Hinkle, D. A., Marciano, P. G., Meaney, D. F., McIntonsh, T. K. Methodological considerations regarding single-cell gene expression profiling for brain injury. Neurochemical Research. 29, 1113-1121 (2004).
- Eberwine, J. Single-cell molecular biology. Nature Neuroscience. 4, 1155-1156 (2001).
- Kamme, F., Salunga, R., Yu, J., Tran, D., Zhu, J., Luo, J., Bittner, A., Guo, H., Miller, N., Wan, J., Erlander, M. Single-cell microarray analysis in hippocampus CA1: Demonstration and Validation of Cellular Heterogeneity. The Journal of Neuroscience. 23, 3607-3607 (2003).
- Hinkle, D., Glanzer, J., Sarabi, A., Pajunen, T., Zielinski, J., Belt, B., Miyashiro, K., McIntosh, T., Eberwine, J. Single neurons as experimental systems in molecular biology. Progress in Neurobiology. 72, 129-142 (2004).
- Ginsberg, S. D., Elarova, I., Ruben, M., Tan, F., Counts, S. E., Eberwine, J. H., Trojanowski, J. Q., Hemby, S. E., Mufson, E. J., Che, S. Single-cell gene expression analysis: Implications for Neurodegenerative and Neuropsychiatric Disorders. Neeurochemical Research. 29, 1053-1064 (2004).
- Eberwine, J., Spencer, K., Miyashirto, K., Mackler, S., Finnell, R. Complementary DNA synthesis in situ: methods and applications. Methods Enxymol. 216, 80-100 (1992).
- Eberwine, J., Yeh, H., Miyashiro, K., Cao, Y., Nair, S., Finnell, R., Zettel, M., Coleman, P. Analysis of gene expression in single live neurons. Proc. Natl. Acad. Sci. USA. 89, 3010-3014 (1992).
- Kelz, M. B., Dent, G. W., Therianos, S., Marciano, P. G., McIntosh, T. K., Coleman, P. D., Eberwine, J. H. Single-cell antisense RNA amplification and microarray analysis as a tool for studying neurological degeneration and restoration. Sci. Aging Knowledge Eviron. 1, re1-re1 (2002).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Research. 126, 397-425 (1977).
- . . P-1000 & P-97 Pipette Cookbook. , (2010).
- . . MinElute Handbook For MinElute Reaction Cleanup Kit. , 28-29 (2004).
- . . Megascript kit. , 7-8 .
- . . MEGAclear kit. , 4-5 .
- Eberwine, J., Kacharmina, J. E., Andrews, C., Miyashiro, K., McIntosh, T., Becker, K., Barrett, T., Hinkle, D., Dent, G., Marciano, P. mRNA expression analysis of tissue sections and single cells. The Journal of Neuroscience. 21, 8310-8314 (2001).
- Van Gelder, R. N., von Zastrow, M. E., Yool, A., Dement, W. C., Barchas, J. D., Eberwine, J. H. Amplified RNA synthesized from limited quantities of heterogeneous cDNA. Proc. Natl. Acad. Sci. USA. 87, 1663-1667 (1990).
- Miyashiro, K., Dichter, M., Eberwine, J. On the nature and differential distribution of mRNAs in hippocampal neuritis: Implications for neuronal functioning. Proc. Natl. Acad. Sci. USA. 91, 10800-10804 (1994).
- Sul, J., Wo, C. K., Zeng, F., Jochems, J., Lee, M. T., Kim, T. K., Peritz, T., Buckley, P., Cappelleri, D. J., Maronski, M., Kim, M., Kumar, V., Meaney, D., Kim, J., Eberwine, J. Transcriptional transfer produces a predictable cellular phenotype. Proc. Natl. Acad. Sci. USA. 106, 7624-7629 (2009).
- Sow, F. B., Gallup, J. M., Sacco, R. E., Ackerman, M. R. Laser capture microdissection revisited as a tool for transcriptomic analysis: Application of an excel-based qPCR preparation software (PREXCEL-Q). Int. J. Biomed. Sci. 5, (2010).
- Vandewoestyne, M., Deforce, D. Laser capture microdissection in forensic research: a review. Int J Legal Med. 124, (2010).
- Eberwine, J., Bartfai, T. Single cell transcriptomics of hypothalamic warm sensitive neurons that control core body temperature and fever response Signaling asymmetry and an extension of chemical neuroanatomy. Pharmacol. Ther. , (2010).
Erratum
Formal Correction: Erratum: Transcriptome Analysis of Single Cells
Posted by JoVE Editors on 11/18/2011. Citeable Link.
null
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados