Method Article
L'analyse du transcriptome des cellules isolées
* Ces auteurs ont contribué à parts égales
Dans cet article
Erratum Notice
Résumé
Dans cet article, nous décrivons une méthode simple pour la récolte des cellules isolées de rat cultures primaires de neurones et l'analyse du transcriptome en utilisant une amplification ultérieure ARNa. Cette approche est généralisable à tout type de cellule.
Résumé
Beaucoup de techniques d'analyse d'expression génique fonder sur des documents isolés de populations hétérogènes de cellules à partir d'homogénats de tissus ou cellules en culture. 1,2,3 Dans le cas du cerveau, des régions telles que l'hippocampe contient un agencement complexe de différents types de cellules, chacune avec profils ARNm distincts. La capacité à récolter des cellules individuelles permet une enquête plus approfondie sur les différences moléculaires entre et au sein des populations de cellules. Nous décrivons une méthode simple et rapide pour la récolte de cellules pour un traitement ultérieur. Pipettes souvent utilisé en électrophysiologie sont utilisées pour isoler (par aspiration) une cellule d'intérêt et idéalement de le déposer dans un tube Eppendorf pour un traitement ultérieur avec un certain nombre de techniques de biologie moléculaire. Notre protocole peut être modifié pour la récolte des dendrites partir de culture cellulaire ou même des cellules individuelles à partir de tranches aiguës.
Nous décrivons également la méthode d'amplification ARNa comme une application majeure aval des isolements seule cellule. Cette méthode a été développée précédemment par notre laboratoire comme une alternative aux autres techniques d'analyse d'expression génique tels que transcription inverse ou en temps réel la réaction en chaîne polymérase (PCR). 4,5,6,7,8 Cette technique permet l'amplification linéaire de la ARN polyadénylé en commençant par femtogrammes seulement du matériel et résultant en des quantités microgramme d'ARN antisens. Le matériel amplifié linéairement fournit une estimation plus précise que la PCR d'amplification exponentielle de l'abondance relative des composantes du transcriptome de la cellule isolée. La procédure de base se compose de deux cycles d'amplification. En bref, un site T7 RNA polymérase promoteur est incorporé dans ADNc double brin créé à partir des transcrits d'ARNm. Une nuit dans la transcription in vitro (IVT) de réaction est ensuite effectué dans laquelle T7 RNA polymérase produit de nombreux transcrits antisens de l'ADNc double brin. Le second tour répète ce processus, mais avec quelques différences techniques puisque le matériau de départ est un ARN antisens. Il est standard de répéter le second tour, résultant en trois cycles d'amplification. Souvent, la troisième ronde, en réaction de transcription in vitro est réalisée en utilisant nucléosidetriphosphates biotinylé de telle sorte que l'ARN antisens produit peut être hybridée et détectée sur une puce à 7,8.
Protocole
1. Culture de cellules
Notre laboratoire utilise des cultures primaires de rat, des neurones hippocampiques pour les expériences ci-dessous. La section suivante décrit le protocole Banker modifié pour la manière dont ces cultures de cellules sont créées et maintenues. 9 Il ya, bien sûr, un nombre exhaustif de permutations de ces techniques de culture cellulaire et toute méthode établie en fonction des besoins spécifiques d'un laboratoire particulier qui fournit un approvisionnement constamment saines des cellules serait un substitut convenable.
- Cinq autoclavés, rond, 12 mm lamelles sont placées dans un plat de 35 mm et recouvert de 80 pg / ml de poly-D-Lysine (MW 70-150,000) en tampon borate O / N, rincés à l'eau (grade culture cellulaire), puis enduits de 1 ug / ml dans laminine tampon borate O / N, puis on rince à nouveau avec de l'eau. NG médias (MEM avec sels de Earle et glutamax supplémenté en glucose (0,6% p / v), la pénicilline (100 U / ml), streptomycine (100 ug / ml), le sérum de cheval (10% v / v)) est ajouté et les plats sont stockées dans un incubateur (5% de CO 2 à 37 ° C). Le PDL150/laminin sert de substrat pour les neurones isolés de croître en tant que monocouche. Les lamelles peuvent être enduits jusqu'à deux semaines avant l'ensemencement.
- Le jour de placage, les neurones primaires de 18 jours d'embryons de rats hippocampes sont étalées dans les médias NG en ajoutant 1,5 mL d'une 100 000 cellules / mL de suspension. Quatre à six heures après placage, chacun des plats de 35 mm est traitée avec 0,75 uL de 5 mM cytosine beta-D-arabinofuranoside (Ara-C) pour empêcher la croissance de toute cellules contaminantes gliale. Vingt-quatre heures plus tard, les médias placage est changé pour MEM avec sels de Earle et de L-glutamine complété avec 0,6% p / v de glucose, pyruvate de sodium 1 mM, et B27. Les cellules sont autorisés à croître pendant au moins deux semaines avant leur utilisation dans toutes les expériences afin de permettre le développement complet du processus.
2. Pipettes Préparation
Note sur les RNases: La peau, la salive, et même la respiration sont les principales sources de RNases, des enzymes qui dégradent l'ARN. Il est impératif que la technique sans RNase être observée à partir de ce point dans le protocole afin que l'échantillon ne soit pas contaminé par des RNases et ensuite se dégrader. Cela comprend toujours porter des gants lors de la manipulation des échantillons et des réactifs, ne jamais parler au cours des échantillons ou des réactifs, et en utilisant de nouvelles boîtes de pointes de pipettes et tubes stérilisés. Souvent, des pipettes qui ne sont pas désignés exclusivement pour le travail d'ARN sont décontaminés en les essuyant avec une solution de traitement tels que la RNase RNase AWAY (bioproduits moléculaire). Cependant, ces solutions seront inhibent les réactions enzymatiques afin aval, il est également important de prévenir la contamination de vos échantillons à ces traitements.
- Autoclave de 1,5 mm de diamètre externe des pipettes en verre (DO).
- L'utilisation d'un extracteur de micropipette, pipettes tirez d'un diamètre approprié pour les enregistrements électrophysiologiques, qui peuvent varier en fonction de votre extracteur, filament, et les pipettes. 10 L'alésage n'est pas trop critique car la pointe sera rompu avant la collecte de cellules.
- Conserver soigneusement les pipettes dans un environnement exempt de poussière où les pointes restera intacte (idéalement utiliser une jarre micropipette).
- Pour briser la pointe d'une manière contrôlée, tenir une Kimwipe tendu entre vos doigts dans une main et très doucement une brosse la pointe de la pipette dans les 1 à 2 fois le papier. L'ouverture devrait être d'environ 75-100% de la taille de la cellule cible. Réglez cette étape jusqu'à obtenir le résultat souhaité.
3. Préparation de la culture, tubes, et Microscope
- Préparer nombre désiré de 1,7 ml tubes Eppendorf. Ajouter 2 ul de PBS, tampon de premier brin si le matériel doit être utilisé pour des amplifications seule cellule, ou toute autre solution pour le stockage du matériel récolté.
- Pour la récolte, vous aurez besoin d'un microscope optique avec un objectif 40x équipé d'un micromanipulateur. Utilisez un support de pipette avec tuyau flexible qui s'éloigne du titulaire. Fixez le tuyau sur une surface stable pour éviter les mouvements indésirables de la pipette lors de la collecte. A l'extrémité du tube, insérer une aiguille afin qu'une seringue de 1 ml avec une connexion Luer-Lock peut être fixé et modifié entre les utilisateurs.
- Si vous utilisez des lamelles, travailler avec une lamelle à la fois. Si nécessaire, le transfert d'une lamelle unique à une nouvelle boîte de 35 mm * contenant du PBS ou support de votre choix. Le plus les cellules sont hors de l'incubateur, le plus malsain qu'ils deviennent et plus leurs profils ARNm va s'écarter de celle d'une cellule saine. Il est essentiel pour préserver la santé des cellules sur les lamelles d'autres en les gardant dans l'incubateur lorsqu'ils ne travaillent pas avec eux. Le travail le plus rapidement possible avec des cellules en dehors de l'incubateur.
* Avec notre configuration, il est nécessaire d'utiliser le couvercle d'une boîte de 35 mm car les murs de l'antenne réels sont trop élevés pour permettre l'avancement correct du micropipette vers le coverslip.
4. Récolte des cellules
- Fixez la micropipette dans le porte micropipette. Apposez micropipette titulaire de l'insert sur la micromanipulateurs. Réglez l'objectif 40x.
- Placez le plat sur la platine du microscope et de trouver une région de cellules approprié pour la récolte. Dans le cas des cultures primaires de neurones, la cellule doit être relativement isolé de ses voisins pour empêcher la récolte des cellules environnantes et / ou procédés. La population de transcrits d'ARNm entre le soma et processus varient, donc si intéressé par somatiques ARNm exclusivement, les soins devraient être prises pour prévenir la contamination du soma avec les processus. Placez la cellule que vous souhaitez récolter dans le centre du champ de vue.
- Utilisez le micromanipulateur pour faire avancer la micropipette vers la solution dans le plat dans le chemin de la lumière. Abaissez la pointe de la pipette dans la solution. Appliquer une pression positive de ce point sur les en soufflant légèrement dans la seringue. Regardez à travers l'oculaire. La pipette doit apparaître comme une ombre dans le champ de vision. Bien au-dessus du plan des cellules, d'ajuster la position de la pointe de la pipette jusqu'à ce qu'il soit dans le champ de vision et de se concentrer sur la pointe de la pipette à l'aide des boutons grossière mise au point. À ce stade, il devrait être évalué si la taille du trou de la pipette est trop grand ou trop petit. La récolte usages fournira la capacité de déterminer si la taille correcte alésage a été atteint à ce point.
- Maintenant, l'avance de la pipette vers le plan des cellules. Il est important que la pointe est pas avancé trop rapidement, provoquant sa rupture dans la région à partir de laquelle vous souhaitez recueillir. Pour éviter cela, utilisez l'accent grossier à l'avance le plan focal avant d'avancer l'extrémité de la pipette vers les cellules en utilisant les micromanipulateurs. Lorsque vous êtes à proximité des cellules, utilisez la mise au point fine jusqu'à ce que les cellules et la pointe de la pipette sont en discussion. Cesser d'appliquer une pression positive avant que vous atteigniez le plan de cellules pour les empêcher soufflant de la lamelle.
- Utilisez le micromanipulateurs pour positionner la pointe de la pipette afin qu'il touche le corps cellulaire vous souhaitez récolter.
- Utilisation de la seringue, appliquer la succion douce par la bouche jusqu'à ce que la cellule entre l'extrémité de la pipette. Si la cellule ne pénètre pas dans la pipette, déplacez doucement le bout rapprocher de la cellule et vers le bas jusqu'à ce qu'elle se détache de la lamelle.
5. Enregistrement de la cellule
- Utilisez le micromanipulateur de déplacer immédiatement la pipette et hors de la solution.
- Retirer la pipette de titulaire.
- Tenir le tube de 1,7 ml Eppendorf dans une main et casser doucement la pointe de la pipette sur le côté du tube vers le bas. (But pour la marque de 0,1 mL).
- Avec la pointe cassée centrée à l'intérieur du tube, insérer une aiguille reliée à une seringue 1-3 ml dans l'ouverture supérieure de la pipette. Rapidement appuyer sur le piston entraînant la solution dans la pipette à pulvériser dans le tube. La cellule doit rester dans la pointe de la pipette et cela devrait être suffisant pour bien expulser la cellule. Soyez prudent de ne pas toucher la pointe d'un liquide sur les côtés du tube, comme l'action capillaire apportera le liquide dans la pipette.
- Vite spin bas le contenu du tube en utilisant une centrifugeuse de bureau et geler immédiatement (conserver à -80 ° C) ou le placer sur la glace pour un traitement ultérieur (préférable).
6. Amplification ARNa
- Ronde 1 Synthèse du premier brin d'ADNc:
Créer ARNm / ADNc hybrides.- Pour chaque 5 uL du volume cellulaire seule collection, ajoutez 1x des options suivantes pour le tube collecteur (sur glace). La réaction peut être développé pour des volumes de collecte de plus (2x pour les 10 volumes de collecte ul, etc.) Créer un master mix en multipliant les réactifs suivants par le nombre de tubes de prélèvement ainsi que de 10-20% pour tenir compte de pipetage erreur. Faites cela pour chaque réaction ultérieure dans la procédure ampification ARNa.
- ON ICE
- 1,2 uL dNTP (2,5 mM chacun)
- 2,4 uL de tampon 5x Premier volet
- 0,3 uL T7-oligo (dT) amorce (100 ng / uL)
- 1,2 uL TNT (100 mM)
- Porter le volume à 10,25 uL par la nucléase sans eau. Mélange de pipette et centrifuger brièvement l'aide d'une centrifugeuse.
- Incuber pendant 5 minutes à 70 ° C pour dénaturer toute la structure secondaire de l'ARNm. Immédiatement placer sur la glace pendant au moins 5 minutes.
- Ajouter (à nouveau en utilisant un mélange maître):
- 0,3 RNasine uL (40 U / uL)
- 0,45 uL Exposant III (200 U / uL)
- 1 ul eau sans nucléase
- Mélange de pipette et brièvement spin. Incuber pendant 1 heure à 42 ° C.
- Incuber à 70 ° C pendant 15 minutes pour inactiver l'Exposant. Continuer à l'étape suivante.
- Pour chaque 5 uL du volume cellulaire seule collection, ajoutez 1x des options suivantes pour le tube collecteur (sur glace). La réaction peut être développé pour des volumes de collecte de plus (2x pour les 10 volumes de collecte ul, etc.) Créer un master mix en multipliant les réactifs suivants par le nombre de tubes de prélèvement ainsi que de 10-20% pour tenir compte de pipetage erreur. Faites cela pour chaque réaction ultérieure dans la procédure ampification ARNa.
- Ronde 1 synthèse du second brin d'ADNc
Créer amorces d'ARN à partir d'ARNm de la partie de l'hybride ARNm / ADN afin d'aider à la synthèse of ADNc double brin.- ON ICE
- Pour les 12 brins de réaction uL d'abord, ajouter:
- 8 ul eau sans nucléase
- 7,5 uL de tampon 5x second brin
- 0,75 mélangez uL dNTP (2,5 mM chacun)
- 0,25 ADN ligase uL (10 U / uL)
- Une ADN polymérase I uL (10 U / uL)
- 0,25 uL RNase H (2 U / uL)
- Ajouter: 1 uL d'ADN T4 polymérase (5 U / uL). Mélanger à la pipette et brièvement spin. Incuber 10 minutes de plus à 16 ° C.
- Nettoyer la réaction en utilisant le kit Qiagen MinElute kit selon les instructions du fabricant avec de légères modifications: 11 Laver 2 fois avec 500 uL de tampon de lavage au lieu de 1 fois avec 750 ul. Eluer dans la nucléase l'eau libre.
- Concentré à 2-4 uL utilisant un Speedvac ou par précipitation à l'éthanol. Pour la précipitation à l'éthanol, le glycogène agit comme un transporteur d'acides nucléiques et est utilisé lorsque de petites quantités de précipitation de l'ADN ou l'ARN. Le sodium de l'acétate de sodium contribue à neutraliser la charge négative de l'épine dorsale de l'ADN, aidant dans la précipitation. Il n'est pas nécessaire de faire un master mix pour les précipitations de routine.
- Ajouter de l'eau 29 uL DEPC
- 2 glycogène uL (5mg/mL)
- 1 / 10 du volume (3 pi) d'acétate de sodium 3M
- 2,5 volumes (~ 250 uL) éthanol froid à 100%
- Centrifuger pendant 20 minutes à 4 ° C.
- Enlever le surnageant et laver le culot avec 800 uL d'éthanol à 70%. Soyez sûr de bien déloger les granulés soit par pipetage ou vortex pour aider au retrait de l'excès de sel.
- Centrifuger pendant 20 minutes à 4 ° C. Enlever le surnageant et sécher à l'air pendant 15-20 minutes.
- Remettre en suspension dans 4 pi d'eau sans nucléase. Conserver à -20 ou -80 ° C ou passez à l'étape suivante.
- Ronde 1 La transcription in vitro (IVT):
Synthétiser l'ARN antisens du promoteur T7 incorporé dans l'ADNc double brin.- Cette réaction est effectuée en utilisant les Ambion Megascript T7 kit selon les instructions du fabricant, sauf à l'échelle pour une uL 10 au lieu d'une réaction de 20 uL. 12 Il est impératif de réunir cette réaction à température ambiante et de garder la mémoire tampon à la température ambiante pendant l'assemblage. Le tampon fourni va précipiter l'ADN si elle est glacée. Gardez le PNT et mélanger l'enzyme sur la glace lorsqu'il n'est pas utilisé.
- A TEMPERATURE AMBIANTE
- Transfert de l'ADNc double brin resuspendues dans un tube PCR à paroi mince.
- Ajouter 4 ul NTP mélange (18,75 mM chacun)
- 1 pi de tampon de réaction 10x
- 1 mix uL enzyme 10x
- Incuber 14 heures à 37 ° C dans un thermocycleur (préférable) ou incubateur.
- Cette réaction peut être nettoyé en utilisant deux méthodes différentes suivies par la concentration de l'échantillon en utilisant un Speedvac ou précipitation d'éthanol. Pour le nettoyage à l'aide d'un kit, passez à la méthode A. Pour nettoyer avec une extraction standard au phénol / chloroforme, passez à la méthode B.
- Méthode A:
- Nettoyer la réaction en utilisant le kit AMBION Megaclear selon les instructions du fabricant avec quelque 13 modifications: Laver 2 fois avec 500 uL de tampon de lavage au lieu de 1 fois avec 750 ul. Pour l'étape d'élution, ajouter 50 ul de la nucléase de l'eau libre au centre de la colonne, incuber à 70 ° C pendant 10 minutes. Centrifuger à 10000 g pendant 1 min. Répéter dans un nouveau tube. Combinez éluats. Concentré de l'échantillon à 2-4 uL utilisant un Speedvac ou par précipitation d'éthanol.
- Pour précipitation à l'éthanol: acétate d'ammonium est utilisé à la place de l'acétate de sodium dans ce cas car il est efficace à prévenir la co-précipitation de nucléotides libres avec l'acide nucléique. Ceci est important en raison de la forte concentration de NTP utilisé dans la réaction d'IVT, ce qui peut inhiber les réactions en aval.
- Ajouter 50 pi d'eau DEPC
- 2 glycogène uL (20 mg / ml)
- 0,6 volumes (37,2 ul) acétate d'ammonium 5M
- 2,5 volumes (~ 180 uL) éthanol à froid
- Précipité à -80 ° C (30 min. À O / N) .*
- Centrifuger pendant 20 minutes à 4 ° C.
- Enlever le surnageant et laver le culot avec 800 uL d'éthanol à 70% (dans la nucléase sans eau). Soyez sûr de bien déloger le culot de retirer tous les excès de sel.
- Centrifuger pendant 20 minutes à 4 ° C.
- Enlever le surnageant et sécher à l'air pendant 15-20 minutes.
- Resuspendre le culot dans de l'eau nucléase 4 uL libre.
- Méthode B:
- Alternativement, le ARNa peuvent être nettoyés avec une extraction standard au phénol / chloroforme.
- Ajouter 50 pi d'eau DEPC
- 2 glycogène uL (20 mg / ml)
- 0,6 volumes (37,2 uL)L'acétate d'ammonium 5M
- 1 volume (98 uL) phénol: chloroforme: alcool isoamylique 25:24:1 (équilibré à pH de 7,8 à 8,0)
- Vortex pendant 15 secondes. Centrifuger pendant 1,5 minutes à demi-vitesse maximale dans une microcentrifugeuse de table. Transfert de la couche aqueuse supérieure dans un nouveau tube contenant 2,5 volumes (245 pi) de l'éthanol froid.
- Précipité à -80 ° C (30 min. À O / N).
- Centrifuger pendant 20 minutes à 4 ° C.
- Enlever le surnageant et laver culot avec 800 uL d'éthanol à 70% (dans la nucléase sans eau). Soyez sûr de bien déloger le culot de retirer tous les excès de sel.
- Centrifuger pendant 20 minutes à 4 ° C.
- Enlever le surnageant et sécher à l'air pendant 15-20 minutes.
- Resuspendre le culot dans de l'eau nucléase 4 uL libre.
* L'échantillon peut geler à cette température pendant les incubations pendant la nuit. Il a été démontré que cela peut effectivement augmenter le rendement des acides nucléiques.
- Alternativement, le ARNa peuvent être nettoyés avec une extraction standard au phénol / chloroforme.
- Cette réaction est effectuée en utilisant les Ambion Megascript T7 kit selon les instructions du fabricant, sauf à l'échelle pour une uL 10 au lieu d'une réaction de 20 uL. 12 Il est impératif de réunir cette réaction à température ambiante et de garder la mémoire tampon à la température ambiante pendant l'assemblage. Le tampon fourni va précipiter l'ADN si elle est glacée. Gardez le PNT et mélanger l'enzyme sur la glace lorsqu'il n'est pas utilisé.
- Round 2 Synthèse du premier brin d'ADNc
- ON ICE
- Ajouter 1 ul amorces aléatoires (0,05 mg / ml) *
- Chauffer à 70 ° C pendant 10 minutes. Immédiatement placer sur la glace pendant au moins 5 minutes.
- Ajouter 2 ul de tampon 5x Premier volet
- DTT 1 uL (100 mM)
- 0,5 ul de dNTP (2,5 mM chacun)
- 0,5 RNasine uL (40 U / uL)
- 1 ul Exposant III (200 U / uL)
- Bien mélanger par pipetage et centrifuger brièvement. Laisser reposer à température ambiante pendant 10 minutes. Cette étape est nécessaire pour permettre l'extension des amorces aléatoires courts avant la réaction de transcription inverse est effectuée.
- Incuber pendant 30 minutes à 42 ° C.
- Chauffer 5 minutes à 95 ° C pour dénaturer l'ARN en ADN / ARN hybrides. Placez-le sur la glace pendant au moins 5 minutes. Conserver à -20 ° C ou -80 ° C ou poursuivre immédiatement à l'étape suivante.
* La concentration des amorces aléatoires est importante. Si la concentration est trop élevée, le produit sera plus tronquée à chaque cycle d'amplification.
- Round 2 synthèse du second brin d'ADNc
- ON ICE
- Ajouter 2 ul T7-oligo (dT) amorce (10 ng / uL) *
- Chauffer pendant 5 minutes à 70 ° C. Immédiatement placer sur la glace pendant au moins 5 minutes. Spin brièvement.
- Ajouter 43,5 uL eau sans nucléase
- 15 ul de tampon 5x second brin
- 1,5 uL mélange de dNTP (2,5 mM chacun)
- 2 ADN polymérase I uL (10 U / uL)
- Bien mélanger par pipetage et centrifuger brièvement. Incuber pendant 2 heures à 16 ° C.
- Ajouter 2 uL polymérase ADN de T4 (5 U / uL)
- Bien mélanger par pipetage et centrifuger brièvement. Incuber 10 minutes de plus à 16 ° C.
- Nettoyer la réaction en utilisant le kit Qiagen MinElute kit comme dans la section 6.2.3.
- Concentré à 2-4 uL avec une précipitation à l'éthanol ou Speedvac que dans les sections 6.2.4 à 6.2.8.
* Note de la concentration des stocks différents de T7-oligo (dT) primer par rapport au premier synthèse du brin d'ADNc second tour.
- Round 2 La transcription in vitro
Effectuer que dans la section 6.3.- Répétez les sections 6.4 à 6.6 nombre désiré de fois. Notez que chaque cycle ultérieur de résultats d'amplification dans les produits ARNa courte. Le nombre de cycles d'amplification doivent être limitées pour cette raison. Normalement, deux à trois cycles d'amplification sont suffisantes pour amplifier le matériel de récolte d'une seule cellule pour effectuer l'analyse des microréseaux. Dans le cas de l'analyse par microréseau, la troisième ronde de réaction d'IVT est réalisée en utilisant le kit d'Illumina TotalPrep amplification de l'ARN selon les instructions du fabricant. Cette procédure intègre marqué à la biotine UTP dans le ARNa qui est ensuite utilisé pour la détection sur une puce microarray.
- Mesurer la concentration d'Arna troisième tour en utilisant un Nanodrop ou Agilent Bioanalyzer avec un kit Nano ARN.
7. Les résultats représentatifs
Succès de la récolte d'une seule cellule à partir des cultures primaires de neurones peut être complété en moins de 2 minutes, en fonction de l'aptitude (voir Figure 1). Cependant, le temps pour la récolte varie entre les systèmes et avec d'intervenir manipulation expérimentale. Soumettre la seule cellule à la procédure d'Arna (voir les figures 4A et 4B) aboutit à des montants microgramme d'Arna amplifié totale et produit un pic caractéristique large quand on l'analyse avec un bioanalyseur (voir figure 3). Trois séries peuvent être accomplies dans un minimum de trois jours, permettant une analyse rapide de l'expression génique des cellules simples.
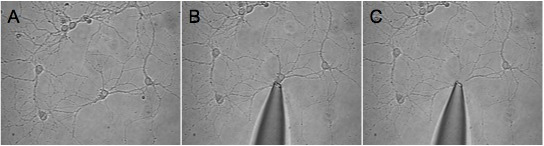
Figure 1. Montré est un exemple d'une bonne récolte d'un neurone isolé. Nous seleCTED une région relativement faible densité (A) et avancé l'extrémité de la pipette vers la cellule souhaitée (B). La troisième image (C) montre le champ de vue après la cellule avaient été récoltés. Notez que le processus entourant rester sur la lamelle.
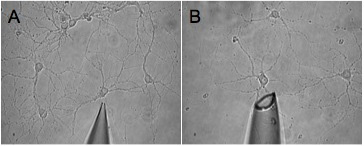
Figure 2. Illustré sont deux images de pointes de pipettes, qui sont une taille inappropriée pour la récolte efficace. Ces conseils vont conduire à la récolte incomplète (A) et la récolte du milieu environnant (B) respectivement.
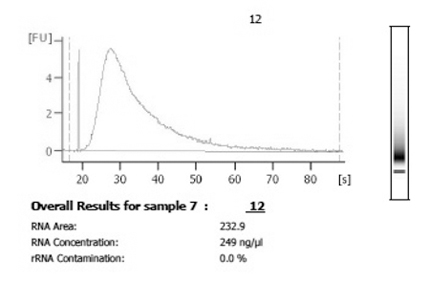
Figure 3. Après la récolte et l'amplification, l'analyse en utilisant un bioanalyseur est recommandé d'étudier la distribution et la quantité d'ARN amplifié. Une amplification réussie à partir de matériaux cellule unique donnera montants totaux dans le microgrammes bas et auront une distribution qui est lisse et large.
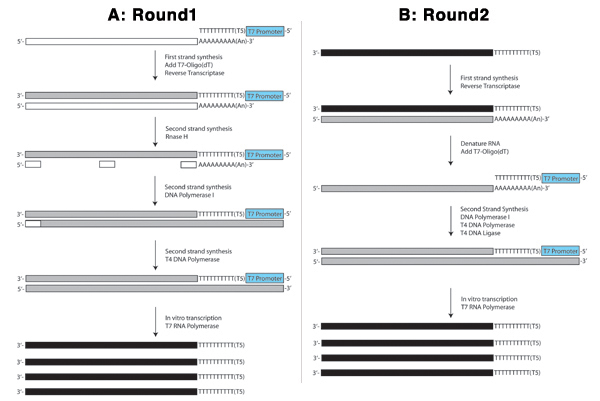
Les figures 4. Schéma de la première manche (A) et le second tour (B) de la procédure ARNa sont affichés.
Discussion
Notes et Dépannage
- Vous voudrez peut-être à prendre avant et après des images montrant que la cellule cible a été isolé et que la pénombre reste a été laissé intact.
- Si trop de solution est d'entrer la pipette que vous récoltez, vous pouvez utiliser 3 voies Luer-Lock et le piston de la seringue pour tenir la pression positive dans le tube. Le volume désiré varie avec le type de traitement, mais jusqu'à 5 ul devrait être bon pour la plupart des applications.
Conseils généraux sur les techniques de biologie moléculaire
- Vortex tous les tubes des stocks et les spin-down avant d'ajouter à une réaction. JAMAIS enzymes vortex.
- Bien mélanger avant d'ajouter les réactions de l'enzyme de s'assurer que le tampon est à la concentration appropriée.
- Maintenir les stocks d'enzymes à -20 ° C, si possible en utilisant un stratacooler. Sinon, retirez juste avant utilisation, garder sur la glace, et revenir immédiatement à -20 ° C.
- Toujours faire master mix lors de la préparation plus d'une réaction de réduire les erreurs de pipetage. Calculer le volume nécessaire en fonction du nombre d'échantillons et d'ajouter 10-20%.
- Magasin de l'ARN à -80 ° C à retarder la dégradation. L'ARN est plus stable stocké dans le tampon d'apurination retardent d'ARN qui se produit dans des conditions acides.
Aperçu général de la procédure ARNa
Figure 4A illustre le premier tour de la procédure ARNa. Dans la réaction du premier brin, la portion de poly-T de la T7-oligo (dT) primer sélectionne des espèces d'ARNm (long rectangle blanc) en se liant à la queue polyA. Certains microARN sont également polyadénylé et sera capturé par cette procédure. Plus important, cependant, les ARN les plus abondants dans la cellule, les ARN ribosomal, ne sera pas. Cet oligo agit comme une amorce pour la transcriptase inverse pour synthétiser un brin complémentaire de l'ADNc (rectangle gris de long) en utilisant l'ARNm comme un modèle. La portion de la T7 T7-oligo (dT) primer intègre le promoteur T7 RNA polymérase en phase avec la séquence antisens de l'ARNm de départ. Ceci est utilisé plus tard dans la réaction de transcription in vitro.
Ensuite, l'ARNm dans les hybrides ARNm / ADN créée à l'étape précédente est partiellement hydrolysé par la RNAse H créant ARN "amorces" (petits rectangles blancs) semblables à des fragments d'Okazaki créé dans la synthèse des brins d'ADN à la traîne. ADN polymérase I utilise des fragments d'ARN pour la synthèse d'ADN premiers en utilisant l'ADN complémentaire de l'ARNm comme un modèle. Quand il atteint le fragment suivant l'ARN, son extrémité 5 'à 3' activité nucléase supprime les ribonucléotides et les remplace par des désoxyribonucléotides. L'ADN ligase est ajoutée à ligaturer les brins où le remplacement du brin leader n'est pas complète. ADN polymérase T4 est ajouté pour combler dans les zones où des fragments d'ARN servi comme amorces initiales pour l'ADN polymérase I de créer une extrémité franche ADNc double brin qui est ensuite purifié avant d'effectuer la réaction d'IVT.
Dans la réaction d'IVT, T7 RNA polymérase se lie au promoteur T7 incorporée dans les molécules d'ADNc double brin et synthétise l'ARN antisens (longs rectangles noirs) en utilisant le brin sens comme un modèle. Cela sert l'étape d'amplification dans lequel des milliers de molécules d'ARN antisens sont produites à partir de chaque molécule ADNc double brin (figure 4A).
Le second tour, comme le montre la figure 4B, commence par une réaction de transcription inverse qui est légèrement différent de celui de la première ronde depuis les ARN antisens de départ est (solide rectangle noir) et n'a pas la queue polyadénylée qui était ciblé par la T7-oligo (dT) amorce dans le premier tour. Par conséquent, cette réaction est amorcée avec des amorces aléatoires (petits rectangles gris) et la suite dénaturé ARN. La réaction du deuxième brin est alors amorcée par la T7-oligo (dT) primer, qui se lie à la séquence poly-A à l'extrémité 3 'de l'ARN sens créé dans la réaction de transcription inverse précédent. Une autre réaction d'IVT est effectuée de la même manière que dans le premier tour. Ce second tour est habituellement répétée au moins une fois à atteindre trois cycles d'amplification d'une seule cellule.
Applications
Les techniques que nous avons présenté dans cet article peuvent être traduits dans un grand nombre d'applications. Le protocole seule cellule d'isolement peut être modifié pour une utilisation dans des tranches aiguës. 14 Bien que techniquement plus difficile, les mêmes principes s'appliquent dans cette préparation suppléant. De plus, si la taille de la pipette est légèrement ajustée, les enregistrements de la physiologie des cellules peut être faite avant la récolte permettant de mener une enquête bien contrôlée des mécanismes moléculaires à l'origine des sorties physiologiques. Une autre légère modification est d'isoler les processus du soma cellulaire. 15 Pour cette application, de recueillir les corps cellulaires avec une pipette et ensuite revenir avec une nouvelle pipette et recueillir 100-300 dendrit identifiées ou des axones par tube de collecte 16.
Une fois que les cellules ont été récoltées, les comparaisons des abondances ARNm et compositions peuvent être faites entre différents et même au sein des populations même cellule. Incorporer biotinylé-UTP dans le ARNa troisième tour permet l'analyse des microréseaux afin de déterminer ces abondances relatives d'ARNm. La composition de la population d'ARNm d'origine peut aussi être déterminé après la procédure ARNa utilisant le séquençage de nouvelle génération. Le ARNa amplifié peut également être utilisée pour confirmer les études cellulaires phénotype de conversion dans laquelle un ensemble complet d'ARNm d'un type de cellules sont transfectées dans un type cellulaire différent afin d'induire la transition du phénotype de type cellule dernier dans celui de l'ancien, une procédure développée par le laboratoire et connu sous le nom TIPER. 17 Ces études sont particulièrement utiles pour étudier les états pathologiques et les phénotypes cellulaires et des études sont actuellement en cours dans le laboratoire. RT-PCR ou PCR quantitative peut être effectuée sur le matériel amplifié pour confirmer l'expression de gènes spécifiques de la cellule. En outre, les évaluations de l'efficacité de la transfection ou la transduction peut être faite au niveau de la cellule unique.
Avantages et limites
Comme indiqué dans l'abstrait, l'isolement de cellules uniques pour l'analyse élimine les effets de la moyenne observée avec l'analyse de populations cellulaires hétérogènes. Ces effets moyenne dénaturer l'abondance d'ARNm dans une cellule unique par une sur-représentation des transcriptions abondante et une moyenne de sortir et éviter la détection de nombreux pays à faible abondance de transcriptions. La cytométrie en flux peut être utilisé pour trier des cellules individuelles, mais cette méthode nécessite la connaissance de la cellule des marqueurs spécifiques et des équipements coûteux. 18 microdissection laser, soit avec des systèmes laser UV ou IR microdissection permettent de cellule unique et même capturer subcellulaire, mais nécessite des cellules d'intérêt pour être situés à la surface des sections très minces. 19 Similaire à la cytométrie en flux, microdissection laser nécessite également un équipement coûteux.
Un des principaux avantages de la technique de collecte électrode à base décrit ci-dessus est que de précieuses données électrophysiologiques peuvent être obtenus auprès de la cellule d'intérêt avant la récolte, permettant une analyse fonctionnelle et du transcriptome à effectuer sur la même cellule. 20 Un inconvénient de notre technique est qu'elle exige une expérience en utilisant micromanipulateurs. Les enquêteurs familiers avec micromanipulateurs trouverez cette technique très intuitive, cependant, les individus qui n'ont aucune expérience de ce type devra se familiariser avec les mouvements fins requises.
Inhérentes à toute technique d'amplification est l'amplification préférentielle de certaines transcriptions basée sur la taille et la composition des nucléotides. 4,6,7 réaction en chaîne par polymérase (PCR) des techniques basées telles que transcription inverse réaction en chaîne de la polymérase (RT-PCR) et amplification rapide de l'ADNc extrémités (RACE) résulte de l'amplification exponentielle de transcriptions, tandis que les résultats ARNa procédure d'amplification de l'amplification linéaire. Ainsi, l'un des principaux avantages de la procédure ARNa réside dans sa capacité à mieux préserver l'abondance relative des transcrits d'ARNm par seulement linéairement amplifiant les erreurs ou les préjugés qui se produisent dans le processus d'amplification exponentielle par rapport à l'amplification dudit erreurs et de préjugés.
La procédure ARNa couplée à l'analyse des microréseaux permet la comparaison des abondances d'ARNm entre les cellules simples de morphologie similaire ou différente, traitée ou non traitée. En outre, les produits d'amplification peuvent être soumises pour le séquençage de nouvelle génération. 5,8 Cependant, des précautions doivent être prises dans de telles analyses, car, contrairement à l'utilisation d'amorces aléatoires pour la procédure, la procédure d'oligo-dT amorcée décrit ci-dessus l'amplification des préjugés de l' extrémités 3 'des ARNm et aboutit généralement à léger raccourcissement du matériel amplifié suite à chaque tour. Des précautions doivent être prises dans l'analyse des résultats puce à ADN avec des méthodes standard comme certains faux appels absents peuvent découler de matériel amplifié légèrement raccourcie. En outre, les résultats tout en séquençage sera en effet fournir la pleine 5 'la séquence de la plupart des ARNm d'origine, les séquences 5' de certains ARNm pourrait être manquée. Pour ces raisons, le nombre de tours d'amplifications devrait être limité.
Déclarations de divulgation
Remerciements
Merci à Kevin Miyashiro pour le placage et le maintien des cultures de cellules, le Dr Terri Schochet pour fournir des cultures de cellules pour les photos incluses dans ce document. En outre, merci à Kevin Miyashiro, le Dr Peter Buckley, et Tiina Pertiz pour l'entrée sur la procédure ARNa. Le financement de ce travail a été de l'Institut national sur le vieillissement, l'Institut national sur la santé mentale et les fonds des ressources humaines enquêteur du Commonwealth de Pennsylvanie.
matériels
| Name | Company | Catalog Number | Comments |
| Spiegelgas coverslips | Carolina Biological | 63-3029 | |
| Nunc 35x10 mm culture dishes | Fisher Scientific | 12-565-90 | |
| Water for cell culture | Lonza Inc. | 17-724Q | For making solutions used for cell culture and rinsing coverslips |
| Poly-D-Lysine MW70-150K | Sigma-Aldrich | 6407 | |
| Laminin, ultrapure | BD Biosciences | 354239 | |
| Boric acid | Sigma-Aldrich | B0252 | |
| MEM with Earle’s salts and glutamax | Invitrogen | 41090-101 | For plating cells |
| D-glucose | Sigma-Aldrich | G8769 | |
| Penicillin-streptomycin | Invitrogen | 15140-122 | |
| Horse serum | Invitrogen | 16050 | |
| Cytosine beta-D-arabinofuranoside | Sigma-Aldrich | C1768 | |
| MEM with Earle’s salts and L-glutamine | Invitrogen | 11095-098 | For growing cells |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| B27 serum-free supplement | Invitrogen | 17504-044 | |
| Borosilicate glass capillary tubes (1.5mm O.D, 100mm length) | Kimble Chase | 34500 99 | Any borosilicate glass pipette will work as long as the proper bore size is attained. |
| HBSS | Invitrogen | 14175 | Any solution will work as long as the components won’t interfere with any future processing (i.e. no Ca2+ or Mg2+) |
| 1ml syringe | BD Biosciences | 309628 | |
| Needle | BD Biosciences | Gauge depends on the diameter of the pipettes | |
| dNTP mix | Amersham | 28-4065-51 | |
| dt-T7 oligo | Custom | Midland Certified | |
| Second strand buffer (5x) | Invitrogen | Y01129 | |
| DTT | Supplied with second strand buffer | ||
| E.coli DNA Ligase | Invitrogen | 100002324 | |
| DNA polymerase I | Invitrogen | 100004926 | |
| Rnase H | Invitrogen | 18021-071 | |
| Megascript T7 kit | Ambion | AM1334 | |
| Random primers | BMB | 11034731001 | |
| Superscript III Reverse Transcriptase | Invitrogen | 56575 | in kit (18080-044) comes with first strand buffer (Y02321) and DTT |
| MEGAclear Kit | Ambion | 1908 | |
| MinElute Reaction Cleanup Kit | Qiagen | 28206 | |
| T4 DNA polymerase | Invitrogen | 100004994 | |
| Rnasin | Promega Corp. | N251B | |
| Illumina TotalPrep RNA Amplification Kit | Ambion | AMIL1791 | |
| Flaming/Brown micropipette puller | Sutter Instrument Co. | P-87 | Sutter has many other models, many are discussed in the cookbook |
| Micromanipulator | Olympus Corporation | Many other micromanipulators will work such as the newer Eppendorf models | |
| Pipette Holder | Warner Instruments | MP-S15A | Will vary with micromanipulator and pipette O.D. |
| Bioanalyzer RNA 6000 Nano Kit | Agilent Technologies | 5067-1511 |
Références
- Davis, J. E., Eberwine, J. H., Hinkle, D. A., Marciano, P. G., Meaney, D. F., McIntonsh, T. K. Methodological considerations regarding single-cell gene expression profiling for brain injury. Neurochemical Research. 29, 1113-1121 (2004).
- Eberwine, J. Single-cell molecular biology. Nature Neuroscience. 4, 1155-1156 (2001).
- Kamme, F., Salunga, R., Yu, J., Tran, D., Zhu, J., Luo, J., Bittner, A., Guo, H., Miller, N., Wan, J., Erlander, M. Single-cell microarray analysis in hippocampus CA1: Demonstration and Validation of Cellular Heterogeneity. The Journal of Neuroscience. 23, 3607-3607 (2003).
- Hinkle, D., Glanzer, J., Sarabi, A., Pajunen, T., Zielinski, J., Belt, B., Miyashiro, K., McIntosh, T., Eberwine, J. Single neurons as experimental systems in molecular biology. Progress in Neurobiology. 72, 129-142 (2004).
- Ginsberg, S. D., Elarova, I., Ruben, M., Tan, F., Counts, S. E., Eberwine, J. H., Trojanowski, J. Q., Hemby, S. E., Mufson, E. J., Che, S. Single-cell gene expression analysis: Implications for Neurodegenerative and Neuropsychiatric Disorders. Neeurochemical Research. 29, 1053-1064 (2004).
- Eberwine, J., Spencer, K., Miyashirto, K., Mackler, S., Finnell, R. Complementary DNA synthesis in situ: methods and applications. Methods Enxymol. 216, 80-100 (1992).
- Eberwine, J., Yeh, H., Miyashiro, K., Cao, Y., Nair, S., Finnell, R., Zettel, M., Coleman, P. Analysis of gene expression in single live neurons. Proc. Natl. Acad. Sci. USA. 89, 3010-3014 (1992).
- Kelz, M. B., Dent, G. W., Therianos, S., Marciano, P. G., McIntosh, T. K., Coleman, P. D., Eberwine, J. H. Single-cell antisense RNA amplification and microarray analysis as a tool for studying neurological degeneration and restoration. Sci. Aging Knowledge Eviron. 1, re1-re1 (2002).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Research. 126, 397-425 (1977).
- . . P-1000 & P-97 Pipette Cookbook. , (2010).
- . . MinElute Handbook For MinElute Reaction Cleanup Kit. , 28-29 (2004).
- . . Megascript kit. , 7-8 .
- . . MEGAclear kit. , 4-5 .
- Eberwine, J., Kacharmina, J. E., Andrews, C., Miyashiro, K., McIntosh, T., Becker, K., Barrett, T., Hinkle, D., Dent, G., Marciano, P. mRNA expression analysis of tissue sections and single cells. The Journal of Neuroscience. 21, 8310-8314 (2001).
- Van Gelder, R. N., von Zastrow, M. E., Yool, A., Dement, W. C., Barchas, J. D., Eberwine, J. H. Amplified RNA synthesized from limited quantities of heterogeneous cDNA. Proc. Natl. Acad. Sci. USA. 87, 1663-1667 (1990).
- Miyashiro, K., Dichter, M., Eberwine, J. On the nature and differential distribution of mRNAs in hippocampal neuritis: Implications for neuronal functioning. Proc. Natl. Acad. Sci. USA. 91, 10800-10804 (1994).
- Sul, J., Wo, C. K., Zeng, F., Jochems, J., Lee, M. T., Kim, T. K., Peritz, T., Buckley, P., Cappelleri, D. J., Maronski, M., Kim, M., Kumar, V., Meaney, D., Kim, J., Eberwine, J. Transcriptional transfer produces a predictable cellular phenotype. Proc. Natl. Acad. Sci. USA. 106, 7624-7629 (2009).
- Sow, F. B., Gallup, J. M., Sacco, R. E., Ackerman, M. R. Laser capture microdissection revisited as a tool for transcriptomic analysis: Application of an excel-based qPCR preparation software (PREXCEL-Q). Int. J. Biomed. Sci. 5, (2010).
- Vandewoestyne, M., Deforce, D. Laser capture microdissection in forensic research: a review. Int J Legal Med. 124, (2010).
- Eberwine, J., Bartfai, T. Single cell transcriptomics of hypothalamic warm sensitive neurons that control core body temperature and fever response Signaling asymmetry and an extension of chemical neuroanatomy. Pharmacol. Ther. , (2010).
Erratum
Formal Correction: Erratum: Transcriptome Analysis of Single Cells
Posted by JoVE Editors on 11/18/2011. Citeable Link.
null
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon