Method Article
Transkriptom-Analyse von Einzelzellen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Erratum Notice
Zusammenfassung
In diesem Artikel beschreiben wir eine einfache Methode für die Gewinnung von Einzelzellen aus der Ratte primären neuronalen Kulturen und anschließende Transkriptom-Analyse mit aRNA Verstärkung. Dieser Ansatz ist verallgemeinerbar zu jedem Zelltyp.
Zusammenfassung
Viele Genexpressionsanalyse Techniken beruhen auf Material aus heterogenen Populationen von Zellen aus dem Gewebe-Homogenate oder Zellen in Kultur isoliert. 1,2,3 Im Fall des Gehirns, Regionen wie der Hippocampus eine komplexe Anordnung von verschiedenen Zelltypen enthalten, die jeweils mit verschiedene mRNA-Profilen. Die Möglichkeit, einzelne Zellen Ernte ermöglicht eine genauere Untersuchung der molekularen Unterschiede zwischen und innerhalb von Zellpopulationen. Wir beschreiben eine einfache und schnelle Methode zur Ernte-Zellen für die weitere Verarbeitung. Pipetten oft in Elektrophysiologie werden eingesetzt, um zu isolieren (mit Aspiration) eine Zelle von Interesse und bequem hinterlegen sie in ein Eppendorf-Röhrchen für die weitere Verarbeitung mit einer beliebigen Anzahl von Techniken der Molekularbiologie. Unser Protokoll kann für die Ernte von Dendriten aus Zellkultur oder sogar einzelne Zellen aus akuten Scheiben geändert werden.
Wir beschreiben auch die aRNA Amplifikationsmethode als wichtiger nachgeschalteten Anwendung der einzelnen Zelle Isolierungen. Diese Methode wurde zuvor von unserem Labor als Alternative zu anderen Genexpressionsanalyse Techniken wie Reverse-Transkriptase-oder real-time Polymerase-Kettenreaktion (PCR) entwickelt. 4,5,6,7,8 Diese Technik sorgt für lineare Verstärkung des polyadenyliert RNA Anfang mit nur Femtogramm des Materials und die daraus resultierende in Mikrogramm-Mengen von Antisense-RNA. Die linear verstärkte Material bietet eine genauere Schätzung als PCR exponentielle Vermehrung der relativen Häufigkeit von Komponenten der Transkriptom der isolierten Zellen. Das grundsätzliche Vorgehen besteht aus zwei Runden Verstärkung. Kurz gesagt, ist ein T7-RNA-Polymerase-Promotor site in doppelsträngigen cDNA aus der mRNA-Transkripte erstellt eingearbeitet. Eine Übernachtung in vitro-Transkription (IVT) Reaktion wird dann durchgeführt, in dem T7-RNA-Polymerase produziert viele Antisense-Transkripte von der doppelsträngigen cDNA. Die zweite Runde wiederholt diesen Vorgang aber einige technische Unterschiede, da das Ausgangsmaterial Antisense-RNA. Es ist Standard in die zweite Runde zu wiederholen, was in drei Runden der Amplifikation. Oft ist die dritte Runde in vitro Transkriptions-Reaktion unter Verwendung von biotinylierten Nucleosidtriphosphate, so dass die Antisense-RNA hergestellt hybridisiert werden können und erkannt auf einem Mikroarray. 7,8
Protokoll
1. Cell Culture
Unser Labor verwendet primären neuronalen Rattenhippocampus Kulturen für die nachfolgenden Versuche. Im Folgenden werden die modifizierten Banker-Protokoll, wie diese Zellkulturen angelegt und gepflegt. 9 Es gibt natürlich maßgeschneidert eine erschöpfende Anzahl der Permutationen dieser Zellkultur-Techniken und eine etablierte Methode, um die spezifischen Bedürfnisse eines bestimmten Labor, das einen bietet konsequent gesunde Versorgung der Zellen wäre ein geeigneter Ersatz.
- Fünf autoklaviert, rund, 12 mm Deckgläschen in einer 35 mm Schale gelegt und beschichtet mit 80 ug / ml Poly-D-Lysin (MW 70-150,000) in Boratpuffer O / N, mit Wasser gespült (cell culture grade), dann beschichtet mit 1 pg / mL Laminin in Boratpuffer O / N dann nochmals mit Wasser abzuspülen. NG Medien (MEM mit Earle-Salzen und Glutamax mit Glucose (0,6% w / v) ergänzt, Penicillin (100 U / ml), Streptomycin (100 ug / mL), Pferdeserum (10% v / v)) zugegeben und Gerichte werden in einem Inkubator (5% CO 2 bei 37 ° C) gelagert. Die PDL150/laminin dient als Substrat für die isolierte Nervenzellen wachsen auf als Monolayer. Die Deckgläser können bis zu zwei Wochen überzogen werden vor dem Beschichten.
- Am Tag der Beschichtung werden die primären Neuronen aus embryonalen Tag 18 Ratte hippocampi in NG Medien durch Zugabe von 1,5 ml einer 100.000 Zellen / ml Suspension beschichtet. Vier bis sechs Stunden nach dem Ausplattieren wird jede 35 mm Schale mit 0,75 &mgr; l 5 mM Cytosin beta-D-arabinofuranosid (ara-C), um das Wachstum von kontaminierenden Gliazellen zu verhindern behandelt. Vierundzwanzig Stunden später, ist die Beschichtung Medien MEM mit Earle-Salzen und L-Glutamin mit 0,6% w / v Glucose, 1 mM Natriumpyruvat und B27 ergänzt geändert. Die Zellen sind erlaubt, für mindestens zwei Wochen vor der Verwendung in irgendwelche Experimente zu wachsen, um komplette Entwicklung von Prozessen ermöglichen.
2. Vorbereitung Pipetten
Hinweis auf RNasen: Die Haut, Speichel und sogar den Atem sind wichtige Quellen für RNasen, Enzymen, RNA abzubauen. Es ist zwingend notwendig, dass RNase-freier Technik von diesem Zeitpunkt an in das Protokoll, so dass die Probe nicht verunreinigt wird mit RNasen und anschließend abgebaut beobachtet werden. Dazu gehören immer mit Handschuhen beim Umgang mit den Proben und Reagenzien, nie reden über Proben oder Reagenzien, und mit neuen Boxen von sterilisierten Pipettenspitzen und Rohren. Oft sind Pipetten, die nicht gekennzeichnet sind ausschließlich für die RNA-Arbeit von Abreiben mit einem RNase-Behandlung Lösung wie RNase AWAY (Molecular Bioproducts) dekontaminiert. Allerdings werden diese Lösungen hemmen jegliche nachgeschaltete enzymatische Reaktionen so ist es auch wichtig, um eine Kontamination von Proben oder mit diesen Behandlungen zu vermeiden.
- Autoclave 1,5 mm Außendurchmesser (OD) Glaspipetten.
- Mit einer Mikropipette Abzieher, ziehen Pipetten zu einem Durchmesser geeignet für elektrophysiologische Ableitungen, die basierend auf Ihren Abzieher, Filament, und Pipetten variieren können. 10. Die Bohrung ist nicht allzu kritisch, da die Spitze wird vor Zellsammlung gebrochen werden.
- Sorgfältig zu verwahren die Pipetten in einem staubfreien Raum, wo die Spitzen intakt bleiben wird (idealerweise einer Mikropipette Aufbewahrungsdose).
- Um brechen die Spitze, in einer kontrollierten Art und Weise, halten Sie eine Kimwipe straff zwischen den Fingern der einen Hand und sehr vorsichtig abwaschen Spitze der Pipette über das Papier 1 bis 2 mal. Die Öffnung sollte ca. 75-100% der Zielzelle groß sein. Passen Sie diesen Schritt, bis Sie das gewünschte Ergebnis zu erzielen.
3. Vorbereiten Kultur, Tubes und Mikroskop
- Bereiten gewünschte Anzahl von 1,7 ml Eppendorf-Röhrchen. Add 2 &mgr; l PBS, Erststrang Puffer, wenn Material für einzelne Zelle Amplifikationen oder jede andere Lösung für die Lagerung des Erntegutes verwendet werden.
- Für die Ernte, benötigen Sie ein Lichtmikroskop mit einem 40x-Objektiv mit einem Mikromanipulator montiert. Verwenden Sie einen Pipettenhalter mit Schlauch führt weg von der Halterung. Befestigen Sie den Schlauch an einer stabilen Unterlage, um unerwünschte Bewegung der Pipette während der Sammlung zu verhindern. Am Ende des Schlauches, legen Sie eine Nadel, so dass eine 1 ml-Spritze mit Luer-Lock-Anschluss befestigt werden und zwischen Benutzern geändert werden.
- Bei Verwendung von Deckgläsern, mit einem Deckglas in einer Zeit zu arbeiten. Übertragen Sie gegebenenfalls einen einzigen Deckglas, um eine neue 35-mm-Teller * mit PBS oder Medium der Wahl. Je länger die Zellen außerhalb des Inkubators, desto ungesunder sie werden und je mehr ihre mRNA-Profile werden von der einer gesunden Zelle abweichen. Es ist wichtig für die Gesundheit der Zellen auf der anderen Deckgläschen, indem man sie in den Brutkasten, wenn sie nicht mit ihnen arbeiten zu bewahren. Arbeit so schnell wie möglich mit Zellen außerhalb des Inkubators.
* Mit unserem Setup ist es erforderlich, den Deckel eines 35 mm Teller zu verwenden, da die Wände des eigentlichen Gericht zu hoch, um eine ordnungsgemäße Weiterentwicklung der Mikropipette auf die coversli ermöglichen, sindSeite
4. Ernten von Zellen
- Sichern Sie die Mikropipette in die Mikropipette Inhaber. Bringen Mikropipette Halter, um den Einsatz auf der Mikromanipulatoren. Setzen Sie den 40x-Objektiv.
- Die Schale auf dem Mikroskoptisch und finden Sie einen Bereich von Zellen geeignet für die Ernte. Im Falle der primären neuronalen Kulturen, sollte die Zelle relativ isoliert von ihren Nachbarn zu ernten von umgebenden Zellen und / oder Prozesse zu verhindern. Die Bevölkerung der mRNA-Transkripte zwischen den Soma und Prozesse variieren, so dass, wenn in der somatischen mRNAs interessiert nur, darauf zu achten, um eine Verunreinigung des Soma mit Prozessen zu verhindern. Legen Sie die Zelle, die Sie wollen in die Mitte des Gesichtsfeldes zu ernten.
- Verwenden Sie den Mikromanipulator der Mikropipette auf die Lösung in der Schale in den Lichtweg Voraus. Senken Sie die Pipettenspitze in die Lösung. Bewerben Überdruck von diesem Zeitpunkt an durch Einblasen leicht durch die Spritze. Schauen Sie durch das Okular. Die Pipette sollte wie ein Schatten in das Blickfeld erscheinen. Nun oberhalb der Ebene der Zellen, die Position der Pipettenspitze, bis sie in das Blickfeld und konzentrieren sich auf die Pipettenspitze mit der Grobfokussierung Knöpfe ist. An diesem Punkt sollte es beurteilt, wenn die Bohrung der Pipette ist zu groß oder zu klein sein. Praxis der Ernte wird die Möglichkeit bieten, um festzustellen, ob die richtige Bohrung ist zu diesem Zeitpunkt erreicht worden.
- Nun, vorab der Pipette auf der Ebene der Zellen. Es ist wichtig, dass die Spitze nicht zu hastig, erweiterte so dass es in der Region, aus der Sie sammeln möchten brechen. Um dies zu verhindern, verwenden Sie den groben Fokus auf die Brennebene VOR voran die Pipettenspitze auf die Zellen unter Verwendung des Mikromanipulatoren Voraus. Wenn Sie in der Nähe der Zellen sind, verwenden Sie den feinen Fokus, bis beide den Zellen und der Pipettenspitze im Fokus sind. Stoppen Sie die Anwendung positiver Druck, bevor Sie die Ebene der Zellen zu verhindern Abblasen des Deckglases zu erreichen.
- Verwenden Sie die Mikromanipulatoren die Pipettenspitze so zu positionieren, dass es zu berühren ist die Zelle soma Sie bis zur Ernte.
- Mit der Spritze, gelten sanfte Saugwirkung durch den Mund, bis die Zelle in die Pipettenspitze. Wenn die Zelle nicht der Eingabe wird die Pipette vorsichtig bewegen die Spitze näher an die Zelle und nach unten, bis es aus dem Deckglas Aufzüge.
5. Speichern der Zelle
- Verwenden Sie den Mikromanipulator sofort bewegen Sie die Pipette auf und aus der Lösung.
- Nehmen Sie die Pipette aus der Halterung.
- Halten Sie die 1,7 ml Eppendorf-Röhrchen in einer Hand und sanft brechen die Spitze der Pipette auf der Seite der Röhre nach unten. (Ziel für die 0,1 ml-Markierung.)
- Mit den gebrochenen Spitze im Inneren des Rohres zentriert, legen Sie eine Nadel auf eine 1-3 ml Spritze in die obere Öffnung der Pipette. Schnell drücken Sie den Kolben zwingt die Lösung in die Pipette zu sprühen in die Röhre. Die Zelle sollte in der äußersten Spitze der Pipette bleiben und dies sollte ausreichen, um richtig zu vertreiben die Zelle. Achten Sie darauf, nicht an der Spitze jede Flüssigkeit Touch auf den Seiten der Röhre als Kapillarwirkung wird die Flüssigkeit wieder in die Pipette zu bringen.
- Schnell-Spin-Down der Inhalt des Röhrchens mit einem Desktop-Mikrozentrifuge und sofort einfrieren (bei -80 ° C) oder auf Eis für die weitere Verarbeitung (bevorzugt).
6. aRNA Amplification
- Round 1 Erstes cDNA-Synthese:
Erstellen mRNA / cDNA-Hybride.- Für alle 5 ul der einzelnen Zelle Auffangvolumen, fügen Sie 1x die folgenden auf die Collection-Tube (auf Eis). Die Reaktion kann bis zu größeren Sammlung Volumen skaliert werden (2x für 10 ul Sammelbände, etc.). Erstellen Sie ein Master-Mix durch Multiplikation der folgenden Reagenzien durch die Anzahl der Sammelröhrchen und 10-20% bis zum Pipettieren Fehler Konto. Tun Sie dies für jede nachfolgende Reaktion im aRNA ampification Verfahren.
- ON ICE
- 1,2 ul dNTPs (2,5 mM)
- 2,4 ul 5x Erststrang Puffer
- 0,3 ul T7-Oligo (dT) Primer (100 ng / ul)
- 1,2 ul DTT (100 mM)
- Bringen Sie die Lautstärke auf 10,25 ul mit Nuklease freiem Wasser. Pipette mischen und Spin kurz mit einer Mikrozentrifuge.
- Inkubieren für 5 Minuten bei 70 ° C keine Sekundärstruktur der mRNA denaturieren. Sofort auf Eis für mindestens 5 Minuten.
- Fügen Sie (wieder mit einem Master-Mix):
- 0,3 ul RNasin (40 U / ul)
- 0,45 ul Superscript III (200 U / ul)
- 1 ul Nuklease freiem Wasser
- Pipette mischen und Spin kurz. Inkubation für 1 Stunde bei 42 ° C.
- Inkubation bei 70 ° C für 15 Minuten auf die Superscript inaktivieren. Weiter geht es zum nächsten Schritt.
- Für alle 5 ul der einzelnen Zelle Auffangvolumen, fügen Sie 1x die folgenden auf die Collection-Tube (auf Eis). Die Reaktion kann bis zu größeren Sammlung Volumen skaliert werden (2x für 10 ul Sammelbände, etc.). Erstellen Sie ein Master-Mix durch Multiplikation der folgenden Reagenzien durch die Anzahl der Sammelröhrchen und 10-20% bis zum Pipettieren Fehler Konto. Tun Sie dies für jede nachfolgende Reaktion im aRNA ampification Verfahren.
- Runde 1 Second cDNA-Synthese
Erstellen RNA-Primer aus der mRNA Teil der mRNA / DNA-Hybrid in Synthese o Hilfef doppelsträngigen cDNA.- ON ICE
- Um die 12 ul Erststrang Reaktion hinzuzufügen:
- 8 &mgr; l Nuklease freiem Wasser
- 7,5 ul 5x Zweiter Aktionsbereich Puffer
- 0,75 ul dNTP-Mix (2,5 mM)
- 0,25 ul DNA-Ligase (10 U / ul)
- 1 ul DNA-Polymerase I (10 U / ul)
- 0,25 ul RNase H (2 U / ul)
- Add: 1 ul T4-DNA-Polymerase (5 U / mL). Mix durch Pipettieren und Spin kurz. Inkubieren weitere 10 Minuten bei 16 ° C.
- Clean up the Reaktion unter Verwendung des Qiagen MinElute Kit gemäß den Anweisungen des Herstellers mit leichten Modifikationen: 11 Wash 2 mal mit 500 ul Waschpuffer anstelle von 1-mal mit 750 ul. Eluieren in Nuklease freiem Wasser.
- Konzentrieren Sie sich auf 2-4 ul mit einem Speedvac oder durch Ethanolfällung. Für die Ethanolfällung, wirkt das Glykogen als eine Nukleinsäure Träger und wird verwendet, wenn Ausfällen kleine Mengen von DNA oder RNA. Das Natrium aus dem Natriumacetat hilft neutralisieren die negative Ladung des DNA-Rückgrats, Beihilfe im Niederschlag. Es ist nicht notwendig, um einen Master-Mix für Routine-Ausscheidungen zu machen.
- Add 29 ul DEPC-Wasser
- 2 ul Glykogen (5mg/ml)
- 1 / 10 Volumen (3 mL) 3M Natriumacetat
- 2,5 Volumen (~ 250 &mgr; l) kaltes 100% Ethanol
- Zentrifuge für 20 Minuten bei 4 ° C.
- Entfernen Sie den Überstand und wäscht das Pellet mit 800 ul 70% Ethanol. Achten Sie darauf, vollständig zu verdrängen das Pellet entweder durch Pipettieren oder Vortexen in Entfernung von überschüssigem Salz Hilfe.
- Zentrifuge für weitere 20 Minuten bei 4 ° C. Entfernen Sie den Überstand und an der Luft trocknen für 15-20 Minuten.
- Resuspendieren in 4 ul Nuklease freiem Wasser. Lagerung bei -20 oder -80 ° C oder mit dem nächsten Schritt fort.
- Runde 1 In-vitro-Transkription (IVT):
Synthesize Antisense-RNA aus dem T7-Promotors in der doppelsträngigen cDNA eingebaut.- Diese Reaktion erfolgt mit dem Ambion MEGAscript T7 Kit gemäß den Anweisungen des Herstellers außer skaliert für eine 10 l statt eines 20 ul Reaktion. 12 Es ist zwingend notwendig, um diese Reaktion bei Raumtemperatur montieren und in den Puffer bei Raumtemperatur zu halten während der Montage. Die mitgelieferte Puffer Fällung der DNA, wenn es eiskalt ist. Halten Sie die NTPs und Enzym-Mix auf Eis, wenn sie nicht in Gebrauch ist.
- BEI RAUMTEMPERATUR
- Übertragen Sie die resuspendiert doppelsträngigen cDNA zu einem dünnwandigen PCR-Röhrchen.
- Add 4 ul NTP-Mix (18,75 mM)
- 1 ul 10x Reaktionspuffer
- 1 ul 10x Enzym-Mix
- Inkubieren 14 Stunden bei 37 ° C in einem Thermocycler (bevorzugt) oder Inkubator.
- Diese Reaktion kann aufgeräumt werden mit zwei verschiedenen Methoden, die von der Probe mit einem Speedvac oder Ethanolfällung folgte. Für Aufräumarbeiten mit einem Kit mit Methode A. Für aufräumen mit einem Standard-Phenol / Chloroform-Extraktion gehen Sie mit Methode B. vor
- Methode A:
- Reinigen Sie die Reaktion mit dem AMBION Megaclear Kit gemäß den Anweisungen des Herstellers mit einigen Modifikationen 13: Wash 2 mal mit 500 ul Waschpuffer statt 1 mal mit 750 ul. Für die Elution Schritt fügen 50 ul Nuklease freiem Wasser auf der Mitte der Kolonne, bei 70 ° C für 10 Minuten inkubieren. Spin bei 10.000 g für 1 min. Wiederholen Sie in ein frisches Röhrchen. Kombinieren Sie Eluate. Konzentrieren Probe auf 2-4 ul mit einem Speedvac OR durch Ethanolfällung.
- Für Ethanolfällung: Ammonium-Acetat wird an Stelle von Natriumacetat in diesem Fall verwendet werden, weil es effizient zu verhindern Co-Fällung von freien Nukleotiden mit der Nukleinsäure ist. Dies ist wegen der hohen Konzentration von NTP in der IVT-Reaktion, die nachgeschalteten Reaktionen inhibieren können ist wichtig.
- Dann werden 50 ul DEPC-Wasser
- 2 ul Glykogen (20 mg / mL)
- 0,6 Volumina (37,2 ul) 5M Ammoniumacetat
- 2,5 Volumen (~ 180 ul) kaltem Ethanol
- Niederschlag bei -80 ° C (30 min. Zu O / N) .*
- Zentrifuge für 20 Minuten bei 4 ° C.
- Entfernen Sie den Überstand und wäscht das Pellet mit 800 ul 70% igem Ethanol (in Nuclease freies Wasser). Achten Sie darauf, vollständig zu verdrängen das Pellet für alle das überschüssige Salz zu entfernen.
- Zentrifuge für weitere 20 Minuten bei 4 ° C.
- Überstand entfernen und an der Luft trocknen 15-20 Minuten.
- Pellet in 4 ul Nuklease freiem Wasser.
- Methode B:
- Alternativ kann die aRNA mit einem Standard-Phenol / Chloroform-Extraktion gereinigt werden.
- Dann werden 50 ul DEPC-Wasser
- 2 ul Glykogen (20 mg / mL)
- 0,6 Volumina (37,2 ul)5M Ammoniumacetat
- 1 Volumen (98 ul) Phenol: Chloroform: Isoamylalkohol 25:24:1 (äquilibriert auf pH 7,8 bis 8,0)
- Vortex für 15 Sekunden. Zentrifuge für 1,5 Minuten bei halber maximaler Geschwindigkeit in einer Tischplatte Mikrozentrifuge. Übertragen Sie die obere wässrige Schicht in ein neues Röhrchen mit 2,5 Volumen (245 ul) kaltem Ethanol.
- Niederschlag bei -80 ° C (30 min. Zu O / N).
- Zentrifuge für 20 Minuten bei 4 ° C.
- Überstand entfernen und waschen Pellet mit 800 ul 70% igem Ethanol (in Nuclease freies Wasser). Achten Sie darauf, vollständig zu verdrängen das Pellet für alle das überschüssige Salz zu entfernen.
- Zentrifuge für weitere 20 Minuten bei 4 ° C.
- Überstand entfernen und an der Luft trocknen 15-20 Minuten.
- Pellet in 4 ul Nuklease freiem Wasser.
* Die Probe kann bei dieser Temperatur während über Nacht Inkubationen einfrieren. Es hat sich gezeigt, dass dies tatsächlich erhöhen Ausbeute an Nukleinsäuren.
- Alternativ kann die aRNA mit einem Standard-Phenol / Chloroform-Extraktion gereinigt werden.
- Diese Reaktion erfolgt mit dem Ambion MEGAscript T7 Kit gemäß den Anweisungen des Herstellers außer skaliert für eine 10 l statt eines 20 ul Reaktion. 12 Es ist zwingend notwendig, um diese Reaktion bei Raumtemperatur montieren und in den Puffer bei Raumtemperatur zu halten während der Montage. Die mitgelieferte Puffer Fällung der DNA, wenn es eiskalt ist. Halten Sie die NTPs und Enzym-Mix auf Eis, wenn sie nicht in Gebrauch ist.
- Round 2 Erste cDNA-Synthese
- ON ICE
- Add 1 ul Zufällige Primer (0,05 mg / mL) *
- Wärme bei 70 ° C für 10 Minuten. Sofort auf Eis für mindestens 5 Minuten.
- Add 2 ul 5x Erststrang Puffer
- 1 ul DTT (100 mM)
- 0,5 ul dNTPs (2,5 mM)
- 0,5 ul RNasin (40 U / ul)
- 1 ul Superscript III (200 U / ul)
- Gründlich mischen durch Pipettieren und Spin kurz. Lassen Sie bei Raumtemperatur für 10 Minuten sitzen. Dieser Schritt ist erforderlich, um Verlängerung der kurzen random Primer ermöglichen, bevor die Reaktion der reversen Transkription durchgeführt wird.
- Inkubieren für 30 Minuten bei 42 ° C.
- Hitze 5 Minuten bei 95 ° C, um die RNA in DNA / RNA-Hybride zu denaturieren. Auf Eis für mindestens 5 Minuten. Lagerung bei -20 ° C oder -80 ° C oder unmittelbar auf den nächsten Schritt fort.
* Die Konzentration von random Primer ist wichtig. Wenn die Konzentration zu hoch ist, wird das Produkt mehr mit jeder Runde der Verstärkung abgeschnitten.
- Round 2 Zweite cDNA-Synthese
- ON ICE
- Add 2 ul T7-Oligo (dT) Primer (10 ng / mL) *
- Hitze 5 Minuten bei 70 ° C. Sofort auf Eis für mindestens 5 Minuten. Spin kurz.
- Add 43,5 ul Nuklease freiem Wasser
- 15 ul 5x Zweiter Aktionsbereich Puffer
- 1,5 ul dNTP-Mix (2,5 mM)
- 2 ul DNA-Polymerase I (10 U / ul)
- Gründlich mischen durch Pipettieren und Spin kurz. Inkubieren für 2 Stunden bei 16 ° C.
- Add 2 ul T4-DNA-Polymerase (5 U / ul)
- Gründlich mischen durch Pipettieren und Spin kurz. Inkubieren weitere 10 Minuten bei 16 ° C.
- Clean up the Reaktion unter Verwendung des Qiagen MinElute Kit wie in Abschnitt 6.2.3.
- Konzentrieren Sie sich auf 2-4 ul mit einem Speedvac oder Ethanolfällung, wie in den Abschnitten 6.2.4 bis 6.2.8.
* Beachten Sie die unterschiedlichen Lager-Konzentration von T7-Oligo (dT)-Primer im Vergleich zur ersten Runde zweiten Strang cDNA-Synthese.
- Runde 2 In-vitro-Transkription
Führen Sie wie in Abschnitt 6.3.- Wiederholen Sie die Abschnitte von 6,4 bis 6,6 gewünschte Anzahl von Zeiten. Beachten Sie, dass jede weitere Runde der Verstärkung führt zu kürzeren aRNA Produkte. Die Anzahl der Runden der Verstärkung sollte aus diesem Grund begrenzt werden. Normalerweise sind zwei vor drei Amplifikationsrunden ausreichen, um Material aus einer einzigen Zelle zu Microarray-Analyse durchführen geerntet verstärken. Im Falle der Mikroarray-Analyse ist die dritte Runde IVT Reaktion erfolgt mit dem Illumina TotalPrep RNA Amplification Kit gemäß den Anweisungen des Herstellers. Dieses Verfahren beinhaltet Biotin-markiertem UTP in die aRNA, die dann für die Detektion auf einem Mikroarray-Chips verwendet wird.
- Messen Sie die Konzentration der dritten Runde aRNA mit einem Nanodrop oder Agilent Bioanalyzer mit einem Nano-RNA-Kit.
7. Repräsentative Ergebnisse
Erfolgreiche Ernte von einer einzelnen Zelle aus primären neuronalen Kulturen können in weniger als 2 Minuten abgeschlossen sein, je nach Eignung (siehe Abbildung 1). Allerdings wird die Zeit für die Ernte zwischen Systemen und mit dazwischenliegenden experimentelle Manipulation variieren. Unterwerfen der einzelnen Zelle bis zum aRNA Verfahren (siehe Abbildungen 4A und 4B) Ergebnisse in Mikrogramm-Mengen von insgesamt verstärkt aRNA und erzeugt einen charakteristischen breiten Peak, wenn mit einem Bioanalyzer (siehe Abbildung 3) analysiert. Drei Runden können in einem Minimum von drei Tagen abgeschlossen sein, so dass für eine schnelle Analyse der einzelnen Zelle Genexpression.
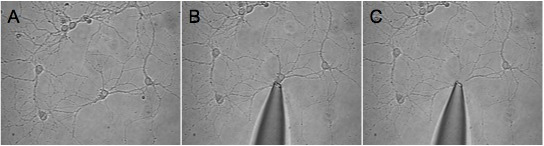
Abbildung 1. Dargestellt ist ein Beispiel für eine erfolgreiche Ernte eines isolierten Neuron. Wir selected eine relativ geringe Dichte Region (A) und erweiterte die Pipettenspitze auf die gewünschte Zelle (B). Das dritte Bild (C) zeigt das Blickfeld, nachdem die Zelle war geerntet. Beachten Sie, dass die umliegenden Prozesse auf dem Deckglas bleiben.
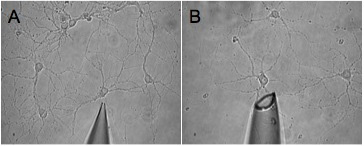
Abbildung 2. Dargestellt sind zwei Bilder von Pipettenspitzen, die eine unangemessene Größe für eine effektive Ernte sind. Diese Tipps werden auf unvollständige Ernte (A) und Ernte der umgebenden Milieu (B) bzw. führen.
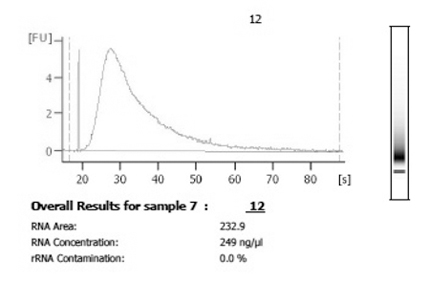
Abbildung 3. Nach der Ernte und Verstärkung, Analyse unter Verwendung eines Bioanalyzer wird empfohlen, die Verteilung und Menge der amplifizierten RNA zu untersuchen. Eine erfolgreiche Amplifikation von einzelnen Zellmaterial wird Gesamtbeträge in den niedrigen Mikrogramm-Ausbeute und eine Distribution, die glatt und breit ist zu haben.
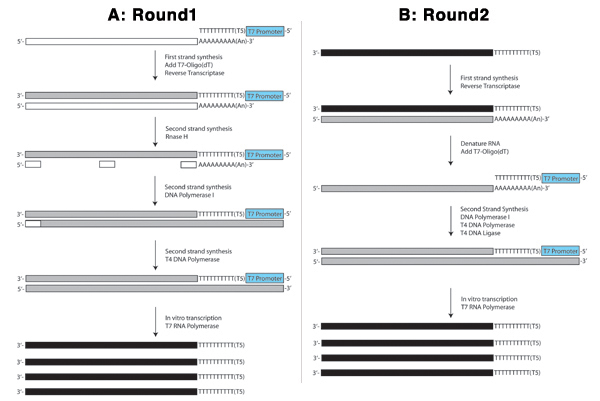
Abbildungen 4. Schematische Darstellung der ersten Runde (A) und die zweite Runde (B) der aRNA Verfahren gezeigt werden.
Diskussion
Hinweise und Problembehandlung
- Sie können vor und nach Bildern, die zeigen, dass die Zielzelle isoliert wurde und dass die verbleibenden Penumbra wurde unberührt gelassen zu nehmen.
- Wenn zu viel Lösung geht in die Pipette, wie Sie ernten, können Sie 3-Wege-Luer-Lock Armaturen und den Kolben der Spritze bis Überdruck in der Leitung zu halten. Die gewünschte Lautstärke wird mit der Art der Verarbeitung variieren, aber bis zu 5 ul sollte für die meisten Anwendungen gut.
Allgemeine Tipps molekularbiologischen Techniken
- Vortex alle Lager Rohre und Spin sie nieder, bevor es zu einer Reaktion. NEVER Wirbel Enzyme.
- Gründlich mischen Reaktionen vor Zugabe des Enzyms, um sicherzustellen, dass der Puffer in der richtigen Konzentration ist.
- Keep Enzym Aktien bei -20 ° C, wenn möglich mit einem stratacooler. Ansonsten, direkt vor dem Gebrauch zu entfernen, halten Sie auf dem Eis, und kehren sofort auf -20 ° C.
- Achten Sie immer Mastermixen bei der Vorbereitung mehr als eine Reaktion auf Pipettieren Fehler zu reduzieren. Berechnen Sie das erforderliche Volumen auf Basis der Anzahl der Proben und fügen 10-20%.
- Shop-RNA bei -80 ° C zu verzögern Abbau. RNA ist sehr stabil gelagert in einem Puffer zu verzögern apurination von RNA, die in sauren Bedingungen auftritt.
Grundzüge des aRNA Procedure
Abbildung 4A zeigt die erste Runde der aRNA Verfahren. In den ersten Strang Reaktion, wählt der Poly-T Teil des T7-Oligo (dT) Primer für mRNA-Spezies (lange weiße Rechteck) durch Bindung an die polyA Schwanz. Einige microRNAs sind auch polyadenyliert und wird durch dieses Verfahren erfasst werden. Vor allem aber wird die am häufigsten vorkommende RNAs in der Zelle, ribosomale RNAs, nicht. Diese Oligo dient als Primer für Reverse Transkriptase mit einem komplementären Strang der cDNA (langes graues Rechteck) zu synthetisieren mit der mRNA als Vorlage. Die T7 Teil des T7-Oligo (dT)-Primer enthält die T7-RNA-Polymerase-Promotor in Frame mit der Sequenz antisense an den Start mRNA. Dies wird später in der in vitro Transkriptions-Reaktion eingesetzt.
Anschließend wird die mRNA in die mRNA / DNA-Hybrid in den vorangegangenen Schritt erstellt teilhydrolysierte durch RNase H schaffen RNA "Primer" (kleine weiße Rechtecke) ähnlich wie die Okazaki-Fragmente in den rückständigen DNA-Synthese erstellt. DNA-Polymerase I benutzt die RNA-Fragmente prime DNA-Synthese mit dem DNA komplementär zur mRNA als Vorlage. Wenn es das nächste RNA-Fragment, dessen 5 erreicht 'nach 3' Nuklease-Aktivität entfernt die Ribonukleotiden und ersetzt sie durch Desoxyribonukleotiden. DNA-Ligase zugesetzt wird, um alle Stränge, wo der Austausch der führenden Stranges ist nicht vollständig unterbinden. T4-DNA-Polymerase hinzugefügt wird, um in den Bereichen zu füllen, wo RNA-Fragmente als erste Primer für die DNA-Polymerase I zu schaffen diente eine blunt-ended doppelsträngigen cDNA, die dann vor der Durchführung des IVT Reaktion gereinigt.
In der IVT Reaktion bindet T7-RNA-Polymerase, die T7-Promotors in der doppelsträngigen cDNA synthetisiert und Antisense-RNA-Moleküle (lange schwarze Rechtecke) mit der Sense-Strang als Vorlage aufgenommen. Dies dient als Verstärkung Schritt, in dem Tausende von Antisense-RNA-Moleküle aus jedem doppelsträngigen cDNA-Moleküls (Abbildung 4A) hergestellt werden.
Die zweite Runde, wie in Abbildung 4B dargestellt, beginnt mit einem Reverse-Transkriptase-Reaktion, die ein wenig anders als in der ersten Runde, da die Ausgangs-RNA ist antisense (durchgezogene schwarze Rechteck) und es fehlt die polyadenyliert Schwanz, der von der T7-oligo gezielte wurde (dT)-Primer in der ersten Runde. Daher ist diese Reaktion mit Random-Primern (kleine graue Rechtecke) und die RNA anschließend denaturiert grundiert. Der zweite Strang Reaktion wird dann durch die T7-Oligo (dT)-Primer, die den Poly-A-Sequenz bindet an das 3'-Ende des Sense-RNA in den vorangegangenen Reaktion der reversen Transkription erstellt grundiert. Ein weiterer IVT Reaktion ist in der gleichen Weise wie in der ersten Runde durchgeführt. Diese zweite Runde ist in der Regel mindestens einmal auf drei Runden der Amplifikation aus einer einzigen Zelle zu erreichen wiederholt.
Anwendungen
Die Techniken, die wir in diesem Artikel vorgestellt haben, können in eine Vielzahl von Anwendungen übersetzt werden. Die Einzelzellisolierung Protokoll kann für den Einsatz in akuten Schnitten geändert werden. 14 Obwohl technisch anspruchsvoll, die gleichen Prinzipien in dieser alternativen Zubereitung gelten. Außerdem, wenn die Größe der Pipette leicht angepasst ist, kann Aufnahmen der Physiologie der Zellen vor der Ernte was eine gut kontrollierte Untersuchung der molekularen Mechanismen hinter physiologischen Ausgänge erfolgen. Eine weitere kleine Änderung ist es, Prozesse aus der Zelle soma isolieren. 15 Für diese Anwendung zu sammeln Zellkörper mit einer Pipette und dann wieder mit einer frischen Pipette und sammeln 100-300 identifiziert dendrites oder Axonen pro Sammelrohr. 16
Sobald Zellen wurden geerntet, Vergleiche von mRNA Abundanzen und Kompositionen zwischen verschiedenen und sogar innerhalb der gleichen Zellpopulationen vorgenommen werden können. Die Einbeziehung biotinylierten-UTP in die dritte Runde aRNA ermöglicht Microarray-Analyse, um diese relative mRNA Häufigkeiten zu bestimmen. Die Zusammensetzung des ursprünglichen mRNA-Population kann auch nach dem aRNA Verfahren unter Verwendung der nächsten Generation Sequenzierung bestimmt werden. Das verstärkte aRNA kann auch verwendet werden, um Zellphänotyp Umwandlung Studien, in denen eine ganze Reihe von mRNAs aus einem Zelltyp in einen anderen Zelltyp transfiziert werden, um den Übergang von der Phänotyp des letzteren Zelltyp, in dem der ehemalige induzieren zu bestätigen, ein Verfahren, durch das Labor entwickelt und bekannt als Tiper. 17 Diese Studien sind besonders nützlich für die Untersuchung Krankheitsstadien und Zellphänotypen und solche Studien sind derzeit in den Labors. RT-PCR oder qPCR können auf das verstärkte Material durchgeführt werden, um die Expression von Zell-spezifische Gene zu bestätigen. Zusätzlich können Auswertungen der Effizienz der Transfektion oder Transduktion in der einzelnen Zelle Ebene getroffen werden.
Vorteile und Einschränkungen
Wie in der abstrakten gesagt, eliminiert Isolierung einzelner Zellen für die Analyse der Mittelung Effekte mit der Analyse von heterogenen Zellpopulationen zu sehen. Diese Mittelung Effekte falsch mRNA Häufigkeiten innerhalb einer einzigen Zelle, die durch über-repräsentiert reichlich Transkripte und Mittelung und die Verhinderung Detektion von vielen Low-Fülle-Transkripte. Die Durchflusszytometrie kann verwendet werden, um einzelne Zellen zu sortieren, aber diese Methode erfordert die Kenntnis der Zell-spezifische Marker und teure Ausrüstung. 18 Laser Mikrodissektion entweder mit UV-oder IR-Laser Mikrodissektion Systeme erlauben einzelne Zelle und sogar subzelluläre erfassen, erfordert aber Zellen von Interesse zu an der Oberfläche sehr dünne Schnitte entfernt werden. 19 Ähnliche um Durchflusszytometrie, Laser-Mikrodissektion auch teure Ausrüstung erforderlich.
Einer der wichtigsten Vorteile der Elektrode basiert Sammlung oben beschriebene Technik ist, dass wertvolle elektrophysiologische Daten können aus der Zelle von Interesse vor der Ernte erzielt werden, so dass für Funktions-und Transkriptom-Analyse auf der gleichen Zelle durchgeführt werden. 20 A Kehrseite unserer Technik ist dass es erfordert Erfahrung im Umgang mit Mikromanipulatoren. Die Ermittler kennen Mikromanipulatoren finden diese Technik sehr intuitiv, aber Personen, die keine solche Erfahrung benötigen, um sich mit den feinen Bewegungen erforderlich.
Inherent in jedem Verstärkung Technik ist die bevorzugte Verstärkung bestimmter Transkripte nach Größe und Nukleotid-Zusammensetzung. 4,6,7 Polymerase-Kettenreaktion (PCR) Techniken wie Reverse-Transkriptase-Polymerase-Kettenreaktion (RT-PCR) und Rapid Amplifikation von cDNA Enden (RACE) resultieren in exponentiellen Amplifikation der Transkripte, während die aRNA Verstärkung Vorgehen führt in lineare Verstärkung. So liegt einer der großen Vorteile der aRNA Verfahren in seiner Fähigkeit, besser zu bewahren die relativen Häufigkeiten der mRNA-Transkripte von nur linear verstärken etwaige Fehler oder Verzerrungen, die in der Verstärkung auftreten als exponentiell verstärkt gegen diesen Fehlern und Verzerrungen.
Die aRNA Verfahren mit Microarray-Analyse gekoppelt ermöglicht einen Vergleich der mRNA Abundanzen zwischen einzelnen Zellen mit gleicher oder unterschiedlicher Morphologie, behandelt oder unbehandelt. Darüber hinaus können verstärkt Material für die Sequenzierung der nächsten Generation eingereicht werden. 5,8 Aber Vorsicht ist bei solchen Analysen, da im Gegensatz zu der Verwendung von Random-Primer für das Verfahren, die Oligo-dT grundiert Verfahren über Vorurteile Verstärkung der beschriebenen genommen werden 3 'Enden der mRNA und führt in der Regel leichte Verkürzung der anschließenden verstärkt Material mit jeder Runde. Es sollte bei der Analyse von Microarray-Ergebnisse mit Standard-Methoden, da einige falsche abwesenden Anrufe aus leicht gekürzt amplifizierten Materials entstehen können übernommen werden. Darüber hinaus, während die Sequenzierung Ergebnisse werden in der Tat bieten die volle 5 'Sequenz die meisten der ursprünglichen mRNA, die 5' können Sequenzen von einigen mRNA entgehen lassen. Aus diesen Gründen sollte die Anzahl der Runden Verstärkungen begrenzt werden.
Offenlegungen
Danksagungen
Wir danken Ihnen, Kevin Miyashiro für die Beschichtung und Pflege von Zellkulturen, Dr. Terri Schochet für die Bereitstellung von Zellkulturen für die Bilder in diesem Dokument enthalten. Darüber hinaus Dankeschön an Kevin Miyashiro, Dr. Peter Buckley, und Tiina Pertiz für die Eingabe über die aRNA Verfahren. Die Finanzierung dieser Arbeit wurde vom National Institute on Aging, National Institute on Mental Health und der Human Resources Fact Finder Mitteln aus dem Commonwealth of Pennsylvania.
Materialien
| Name | Company | Catalog Number | Comments |
| Spiegelgas coverslips | Carolina Biological | 63-3029 | |
| Nunc 35x10 mm culture dishes | Fisher Scientific | 12-565-90 | |
| Water for cell culture | Lonza Inc. | 17-724Q | For making solutions used for cell culture and rinsing coverslips |
| Poly-D-Lysine MW70-150K | Sigma-Aldrich | 6407 | |
| Laminin, ultrapure | BD Biosciences | 354239 | |
| Boric acid | Sigma-Aldrich | B0252 | |
| MEM with Earle’s salts and glutamax | Invitrogen | 41090-101 | For plating cells |
| D-glucose | Sigma-Aldrich | G8769 | |
| Penicillin-streptomycin | Invitrogen | 15140-122 | |
| Horse serum | Invitrogen | 16050 | |
| Cytosine beta-D-arabinofuranoside | Sigma-Aldrich | C1768 | |
| MEM with Earle’s salts and L-glutamine | Invitrogen | 11095-098 | For growing cells |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| B27 serum-free supplement | Invitrogen | 17504-044 | |
| Borosilicate glass capillary tubes (1.5mm O.D, 100mm length) | Kimble Chase | 34500 99 | Any borosilicate glass pipette will work as long as the proper bore size is attained. |
| HBSS | Invitrogen | 14175 | Any solution will work as long as the components won’t interfere with any future processing (i.e. no Ca2+ or Mg2+) |
| 1ml syringe | BD Biosciences | 309628 | |
| Needle | BD Biosciences | Gauge depends on the diameter of the pipettes | |
| dNTP mix | Amersham | 28-4065-51 | |
| dt-T7 oligo | Custom | Midland Certified | |
| Second strand buffer (5x) | Invitrogen | Y01129 | |
| DTT | Supplied with second strand buffer | ||
| E.coli DNA Ligase | Invitrogen | 100002324 | |
| DNA polymerase I | Invitrogen | 100004926 | |
| Rnase H | Invitrogen | 18021-071 | |
| Megascript T7 kit | Ambion | AM1334 | |
| Random primers | BMB | 11034731001 | |
| Superscript III Reverse Transcriptase | Invitrogen | 56575 | in kit (18080-044) comes with first strand buffer (Y02321) and DTT |
| MEGAclear Kit | Ambion | 1908 | |
| MinElute Reaction Cleanup Kit | Qiagen | 28206 | |
| T4 DNA polymerase | Invitrogen | 100004994 | |
| Rnasin | Promega Corp. | N251B | |
| Illumina TotalPrep RNA Amplification Kit | Ambion | AMIL1791 | |
| Flaming/Brown micropipette puller | Sutter Instrument Co. | P-87 | Sutter has many other models, many are discussed in the cookbook |
| Micromanipulator | Olympus Corporation | Many other micromanipulators will work such as the newer Eppendorf models | |
| Pipette Holder | Warner Instruments | MP-S15A | Will vary with micromanipulator and pipette O.D. |
| Bioanalyzer RNA 6000 Nano Kit | Agilent Technologies | 5067-1511 |
Referenzen
- Davis, J. E., Eberwine, J. H., Hinkle, D. A., Marciano, P. G., Meaney, D. F., McIntonsh, T. K. Methodological considerations regarding single-cell gene expression profiling for brain injury. Neurochemical Research. 29, 1113-1121 (2004).
- Eberwine, J. Single-cell molecular biology. Nature Neuroscience. 4, 1155-1156 (2001).
- Kamme, F., Salunga, R., Yu, J., Tran, D., Zhu, J., Luo, J., Bittner, A., Guo, H., Miller, N., Wan, J., Erlander, M. Single-cell microarray analysis in hippocampus CA1: Demonstration and Validation of Cellular Heterogeneity. The Journal of Neuroscience. 23, 3607-3607 (2003).
- Hinkle, D., Glanzer, J., Sarabi, A., Pajunen, T., Zielinski, J., Belt, B., Miyashiro, K., McIntosh, T., Eberwine, J. Single neurons as experimental systems in molecular biology. Progress in Neurobiology. 72, 129-142 (2004).
- Ginsberg, S. D., Elarova, I., Ruben, M., Tan, F., Counts, S. E., Eberwine, J. H., Trojanowski, J. Q., Hemby, S. E., Mufson, E. J., Che, S. Single-cell gene expression analysis: Implications for Neurodegenerative and Neuropsychiatric Disorders. Neeurochemical Research. 29, 1053-1064 (2004).
- Eberwine, J., Spencer, K., Miyashirto, K., Mackler, S., Finnell, R. Complementary DNA synthesis in situ: methods and applications. Methods Enxymol. 216, 80-100 (1992).
- Eberwine, J., Yeh, H., Miyashiro, K., Cao, Y., Nair, S., Finnell, R., Zettel, M., Coleman, P. Analysis of gene expression in single live neurons. Proc. Natl. Acad. Sci. USA. 89, 3010-3014 (1992).
- Kelz, M. B., Dent, G. W., Therianos, S., Marciano, P. G., McIntosh, T. K., Coleman, P. D., Eberwine, J. H. Single-cell antisense RNA amplification and microarray analysis as a tool for studying neurological degeneration and restoration. Sci. Aging Knowledge Eviron. 1, re1-re1 (2002).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Research. 126, 397-425 (1977).
- . . P-1000 & P-97 Pipette Cookbook. , (2010).
- . . MinElute Handbook For MinElute Reaction Cleanup Kit. , 28-29 (2004).
- . . Megascript kit. , 7-8 .
- . . MEGAclear kit. , 4-5 .
- Eberwine, J., Kacharmina, J. E., Andrews, C., Miyashiro, K., McIntosh, T., Becker, K., Barrett, T., Hinkle, D., Dent, G., Marciano, P. mRNA expression analysis of tissue sections and single cells. The Journal of Neuroscience. 21, 8310-8314 (2001).
- Van Gelder, R. N., von Zastrow, M. E., Yool, A., Dement, W. C., Barchas, J. D., Eberwine, J. H. Amplified RNA synthesized from limited quantities of heterogeneous cDNA. Proc. Natl. Acad. Sci. USA. 87, 1663-1667 (1990).
- Miyashiro, K., Dichter, M., Eberwine, J. On the nature and differential distribution of mRNAs in hippocampal neuritis: Implications for neuronal functioning. Proc. Natl. Acad. Sci. USA. 91, 10800-10804 (1994).
- Sul, J., Wo, C. K., Zeng, F., Jochems, J., Lee, M. T., Kim, T. K., Peritz, T., Buckley, P., Cappelleri, D. J., Maronski, M., Kim, M., Kumar, V., Meaney, D., Kim, J., Eberwine, J. Transcriptional transfer produces a predictable cellular phenotype. Proc. Natl. Acad. Sci. USA. 106, 7624-7629 (2009).
- Sow, F. B., Gallup, J. M., Sacco, R. E., Ackerman, M. R. Laser capture microdissection revisited as a tool for transcriptomic analysis: Application of an excel-based qPCR preparation software (PREXCEL-Q). Int. J. Biomed. Sci. 5, (2010).
- Vandewoestyne, M., Deforce, D. Laser capture microdissection in forensic research: a review. Int J Legal Med. 124, (2010).
- Eberwine, J., Bartfai, T. Single cell transcriptomics of hypothalamic warm sensitive neurons that control core body temperature and fever response Signaling asymmetry and an extension of chemical neuroanatomy. Pharmacol. Ther. , (2010).
Erratum
Formal Correction: Erratum: Transcriptome Analysis of Single Cells
Posted by JoVE Editors on 11/18/2011. Citeable Link.
null
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten