Method Article
Fabricación de hidrogeles micropatterned para sistemas de cultivo neuronal usando fotolitografía dinámica de proyección Máscara
En este artículo
Resumen
Técnicas sencillas se describen para la producción rápida de microfabricated sistemas de cultivo neuronal mediante un dispositivo digital de microespejos para la litografía de proyección dinámica máscara regular de los sustratos de cultivo celular. Estos sistemas de cultivo pueden ser más representativos de la arquitectura biológica natural, y las técnicas descritas podrían ser adaptados para numerosas aplicaciones.
Resumen
Cada vez más, con dibujos ambientes de cultivo celular se están convirtiendo en una técnica relevante para estudiar las características celulares, y muchos investigadores creen en la necesidad de entornos 3D para representar los experimentos in vitro que imitan mejor en calidades 3.1 vivo. Los estudios en campos como la investigación sobre el cáncer 4, 5 neural ingeniería, la fisiología cardíaca 6, y la interacción célula-matriz 7,8 han demostrado el comportamiento celular difiere sustancialmente entre los cultivos en monocapa tradicional y construye en 3D.
Los hidrogeles son utilizados como escenarios en 3D, debido a su variedad, versatilidad y capacidad de adaptar la composición molecular a través de funcionalización 9.12. Existen numerosas técnicas para la creación de estructuras como las células de apoyo matrices, incluyendo electrospinning 13, sellos de elastómero 14, la impresión de inyección de tinta 15, 16 photopatterning aditivo, fotomáscara estática proyección litografía 17, y microstereolithography máscara dinámica 18. Por desgracia, estos métodos implican varios pasos de producción y / o equipos no son fácilmente adaptables a las células convencionales y los métodos de cultivo de tejidos. La técnica empleada en este protocolo se adapta los dos últimos métodos, utilizando un dispositivo digital de microespejos (DMD) para crear dinámicas de máscaras para la reticulación geométrica específica poli-(etilenglicol) (PEG) hidrogeles, inducida por UV inició polimerización por radicales libres. El resultado de "2,5 D" estructuras de proporcionar un entorno limitado en 3D para el crecimiento neuronal. Contamos con un enfoque de doble hidrogel, donde PEG sirve como una estructura celular región de restricción el suministro de un informe de lo contrario, pero la célula permisiva-auto-montaje de gel hecho a partir de cualquiera de Puramatrix o agarosa. El proceso es rápido simple fabricación de paso, que es altamente reproducible y adaptado fácilmente para su uso con los métodos convencionales de cultivo de células y sustratos.
Explantes de todo el tejido, como los ganglios de la raíz dorsal de embriones (GRD), se pueden incorporar en las construcciones de hidrogel doble para los ensayos experimentales, tales como crecimiento de las neuritas. Además, las células disociadas se puede encapsular en el hidrogel photocrosslinkable o auto polimerización, o de forma selectiva adheridos a la membrana permeable con el apoyo de células restrictivas photopatterning. Uso de la DMD, hemos creado hidrogel construcciones de hasta ~ 1 mm de grosor, pero de película delgada (<200 micras) las estructuras de PEG se vieron limitadas por bloqueo del oxígeno de la reacción de polimerización por radicales libres. Estamos posteriormente desarrolló una técnica que utiliza una capa de aceite por encima del líquido de polimerización que permite la polimerización fina estructura PEG.
En este protocolo, se describe la creación rápida de sistemas de hidrogel en 3D para la producción de células neuronales microfabricated y cultivos de tejidos. Las construcciones de hidrogel de doble demostrado en este comunicado representan versátil en modelos in vitro que pueden resultar útiles para los estudios de la neurociencia participación de la supervivencia celular, la migración, y / o el crecimiento de las neuritas y la orientación. Por otra parte, como el protocolo puede trabajar para muchos tipos de hidrogeles y las células, las posibles aplicaciones son variadas y extensas.
Protocolo
1. DMD de configuración
- La junta DMD, guía de luz UV (con colimador) y lente objetivo de 4x, están todos montados verticalmente sobre una mesa de aislamiento de vibración.
- La guía de luz UV debe ajustarse de modo que la luz incide en la serie del espejo en un ángulo de 45 º respecto al plano de los espejos, y 24 ° por debajo del plano de los espejos (Figura 1).
- La lente del objetivo está montado de modo que la distancia de la DMD en la lente del objetivo se corresponde con la longitud focal asociada a la lente.
- Un microscopio invertido se coloca por debajo de la lente del objetivo, de tal manera que la luz enfocada reflejada por la DMD pueden ser visualizados a través del microscopio. La distancia desde la lente del objetivo a la superficie de la polimerización de aproximadamente debe corresponder a la distancia de trabajo de la lente. La etapa en el microscopio se puede utilizar para ajustar la distancia de enfoque fino de la imagen. Esta distancia puede variar dependiendo de la superficie de polimerización elegido.
2. Construcciones de doble hidrogel para cultivos de explantes de tejidos
A. DRG adhesión explante
- Recubrir las paredes de los 6 y colágeno recubiertas insertos de cultivo celular (Corning) con Rain-X, teniendo cuidado de evitar la propia membrana. (Por otra parte, una pluma barrera hidrofóbica puede ser utilizado.)
- Inserta hidratar durante la noche con 1,5 ml de medio de adherencia en una incubadora a 37 ° C y 5% CO 2. Medio de la adhesión es de tamaño medio neurobasal con suero fetal bovino al 10%, 1% penicilina / estreptomicina, 0,5 mM L-glutamina, y 20 mg / ml de NGF.
- La cosecha de embriones ganglios de la raíz dorsal (GRD) de los cachorros E-15 de rata. DRG debe ser chapada en colágeno recubiertas de 6 y se inserta, hasta cuatro por cada inserción.
- Incubar inserta durante 2 horas para permitir la DRG adhesión a la membrana.
B. Dinámica fotopolimerización máscara
Un dispositivo digital de microespejos (DMD) es una resolución de 1024 x 768 matriz de espejos individuales, similar a la de los televisores de proyección, lo que refleja la luz de forma selectiva sobre la base de la posición del espejo. Para nuestros propósitos, la DMD se utiliza a los rayos ultravioleta del patrón (UV) en hidrogeles photocrosslinkable, la creación de geometrías especificable hidrogel de una manera sencilla y rápida. La Figura 1 muestra la configuración de la trayectoria de la luz UV y la DMD. A pesar de nuestra DMD es una unidad independiente, el dispositivo también puede ser integrado para su uso con muchos microscopios existentes.
- Eliminar todo el líquido sobrante de insertar y añadir 500 l de medio de polimerización en el interior del inserto. Medio de polimerización contiene 10% de PEG (1000 MW) y el 0,5% Irgacure 2959 disuelto en medio neurobasal suplementado con 20 mg / ml de NGF y el 1% penicilina / estreptomicina.
- Colocar la parte inferior del equipo DMD en un portaobjetos de vidrio de lluvia X tratados.
- Cargar la imagen en blanco y negro adecuado para ser utilizado como una "fotomáscara" en la DMD, a través del uso de la interfaz gráfica de usuario incluye el programa ALP-3 básicos. Para nuestros propósitos, una forma de bifurcación fue elegido para permitir la aplicación de sistemas de guía de las neuritas.
- Utilizando un microscopio invertido para la visualización, alinear los explantes de tejido con la ubicación adecuada en la fotomáscara una fuente de luz visible se refleja en el DMD.
- Cambiar la fuente de luz visible de la fuente de luz UV, e iluminar la solución de PEG hasta reticulación es suficiente. (Para las condiciones dadas y 5,0 vatios / cm 2 de incidentes en la DMD, la reticulación se puede completar en tan sólo 55 segundos.) Repita para todos los GRD cuatro en la inserción.
- Lave cada insertar tres veces con DPBS estéril y 1% Pen-Strep.
- Añadir medio de cultivo 1,5 ml por debajo de los insertos de cultivo celular, y hasta que se estabilice en una incubadora durante 30 minutos. Medio de crecimiento es de medio neurobasal contiene 2% de B-27, Pen 1% / estreptomicina, 0,5 mM L-glutamina, y 20 mg / ml de NGF.
C. Secundaria hidrogel
Puramatrix
- Para aplicaciones neuronal, el 1% Puramatrix se diluye de acuerdo con las instrucciones del fabricante a 0,15% en H 2 O estéril y se complementa con 1 mg / ml laminina soluble.
- Todos los medios se debe quitar el exceso de los huecos de PEG, que contienen los explantes de DRG, utilizando un aplicador con punta de algodón estéril, Kimwipe o micropipeta.
- Puramatrix se añade a los vacíos de PEG con una micropipeta con el fin de llenar el espacio vacío sin desbordarse. Dependiendo del volumen de vacío, por lo general ~ 1 l se utiliza por construir.
- Puramatrix comienza el proceso de auto-ensamblaje de inmediato al entrar en contacto con una solución salina fisiológica, es decir, el PEG hinchada, pero 1,5 ml de medio de cultivo se agrega debajo de la inserción y se colocan en la incubadora durante una hora para asegurar la gelificación total.
- Inicialmente, Puramatrix es ligeramente ácida, por lo que cambiar los medios de comunicación después de una hora para permitir que el pH se equilibre.
- Cambios en los medios de comunicación se requiere aproximadamente cada 48 horas. Tenga cuidado de que todos los medios de comunicaciónañadido por debajo de la inserción, para proteger la integridad de Puramatrix mecánicamente débil.
Agarosa
- Para aplicaciones neuronal, agarosa se diluye a una solución al 1% en medio de cultivo y se coloca en un baño de agua a 60 º C hasta que la agarosa se disuelva completamente (aproximadamente 1 hora). La solución se complementa con 1 mg / ml laminina soluble.
- Todos los medios se debe quitar el exceso de los huecos PEG.
- Agarosa se añade a los vacíos de PEG con el fin de llenar el espacio vacío sin desbordarse. Dependiendo del volumen de vacío, por lo general ~ 1 l se utiliza por construir.
- 1,5 ml de medio de cultivo es pre-enfriado (8 ° C) en una placa de 6 pocillos, y los insertos de agarosa que contienen se transfieren a los medios de comunicación refrigerados y mantenidos en un refrigerador a una temperatura de 8 ° C durante al menos tres minutos para permitir a la agarosa gel.
- Finalmente, los insertos son transferidos a 1,5 ml de medio de cultivo pre-calentado (37 ° C) y se mantienen en la incubadora a 37 ° C, con los cambios de los medios de comunicación necesarios cada 48 horas.
3. Hidrogel de doble encapsulación de células en 3D
Encapsulación de hidrogel doble es adecuada cuando se utiliza el gel de auto-montaje. El gel photocrosslinkable, en este caso, PEG, sirve de soporte estructural para la presentación geométrica del gel de auto-montaje, por ejemplo Puramatrix o agarosa. Algunos de los métodos, en particular el tipo de gel y la elección de fotomáscaras, dependerá de la aplicación particular que desee.
- Cargar una máscara adecuada en la DMD. Para la supervivencia de aplicación de células, que simplemente optaron por una presentación cilíndrica de Puramatrix para ayudar en la obtención de imágenes de las células. Los investigadores que estudian la señalización celular podría estar interesado en una geometría compartimentos para permitir la difusión de las moléculas quimiotácticas. Además, una aproximación de una arteria se muestra para representar a su posible aplicación a la investigación de los vasos sanguíneos.
- El tratamiento de las paredes de una inserción de poliéster de cultivo celular con Rain-X, y el lugar bajo la lluvia en la DMD-X diapositivas recubiertos.
- Añadir 500 l de medio de polimerización de la inserción. Inducir reticulación PEG por la exposición a la luz UV durante 55 segundos.
- Lavar tres veces con DPBS estéril y 1% de Pen-Strep.
- Retire todos los medios el exceso de los huecos PEG.
- Centrifugar las células a la densidad deseada en una pastilla. Se debe tener cuidado de eliminar todo el medio del pellet de células antes de la mezcla, como Puramatrix comienza auto-ensamblaje de inmediato al entrar en contacto con una solución salina. Suspender las células dentro de un 0,15% Puramatrix diluida en estéril H 2 O complementado con un 10% de sacarosa.
- Inyectar el Puramatrix / celular / sacarosa mezcla dentro de los huecos en PEG.
- Añadir 1,5 ml de medio de crecimiento por debajo de la inserción, y permitir que el gel dentro de la incubadora durante una hora.
- Cambiar los medios de comunicación después de una hora, y cada ~ 48 horas después.
4. Hidrogel solo encapsulación de células en 3D
A la encapsulación de hidrogel solo sería apropiado para cualquier situación en la que las células pueden ser examinados en el interior de un hidrogel photocrosslinkable.
- Cargar una máscara adecuada en la DMD. Para los estudios de supervivencia de las células, una vez más eligió una máscara circular básica para representar a un cilindro. Máscaras similares a los mostrados en el método 4 de nuevo se podría aplicar para el campo de la investigación correspondiente.
- El tratamiento de una célula de poliéster insertar la cultura con la lluvia-X, y de lugar en DMD en la lluvia-X diapositivas recubiertos.
- Las células en cualquier concentración deseada se pueden añadir directamente a la solución de PEG al 10%, mezclando bien para asegurar una distribución homogénea.
- Añadir 500 l de medio de polimerización de la inserción. Inducir reticulación PEG por la exposición a la luz UV durante 55 segundos.
- Lavar tres veces con DPBS estéril y 1% de Pen-Strep.
- Rellenar con medio de crecimiento por debajo y por encima de la inserción, el cambio de cada ~ 2 días.
5. De película delgada de polimerización de hidrogel
- Cargar una máscara adecuada en la DMD.
- Tratar de colágeno recubiertas de células de poliéster insertar la cultura con la lluvia-X, y el lugar en el Rain-X diapositivas recubiertos.
- Añadir medio de polimerización suficiente para cubrir sólo la parte inferior de la pieza (~ 250 a 300 l para las inserciones de placa de 6 pocillos). Permita que el medio para penetrar la membrana inserción durante 30-45 minutos a temperatura ambiente.
- Retire el exceso de medio de polimerización de la inserción con una micropipeta o Kimwipe. Agregue una cantidad suficiente de UV-transparente de aceite para cubrir totalmente la parte inferior de la inserción. Permitir la inserción de sentarse por 15-30 minutos a temperatura ambiente, tiempo suficiente para que el aceite para formar una capa distinta por encima de la saturación medio de polimerización de la membrana de inserción.
- Coloque el inserto y se deslizan bajo la DMD. Inducir reticulación PEG por la exposición a los rayos UV. Debido a la delgadez de la capa de PEG, la reticulación se puede completar en tan sólo 15 segundos a 5,0 W / cm 2 en el incidente de la DMD.
- Lave la inserción de tres veces con DPBS estéril y 1% de Pen-Strep. (Si la persistencia de un residuo aceitoso es una preocupación, un detergente suave, como Tween 20 (1%) puede ser añadido a la solución de lavado).
- Tienda de la inserción en una placa de tejido de 6 pocillos. Añadir medio de cultivo de células en suspensión, en la concentración deseada, y una pipeta un volumen suficiente de la suspensión de células dentro de la inserción de cultivo celular para obtener la densidad celular deseada. A continuación, agregue un medio de crecimiento bastante por debajo de la inserción a mantener totalmente la viabilidad celular (~ 1,5 ml).
- Después de 48 horas han transcurrido, lave la pieza tres veces con DPBS estéril y 1% de la pluma Strep-para desalojar a cualquier célula no adherida. Cambiar los medios de comunicación, aproximadamente una vez cada 48 horas.
6. Resultados representante
Ejemplos de hidrogel de doble construcciones que contengan explantes DRG se muestran en la Figura 2. Tenga en cuenta que la migración celular y la extensión de las neuritas se limita a la región de células permisivas del hidrogel de doble construcción. La Figura 3 muestra las células disociadas encapsulado de manera similar en el interior de las construcciones de hidrogel dual. Debido a la naturaleza dinámica de la fotomáscara DMD, la geometría para la encapsulación sólo está limitado por las dimensiones y la resolución de la óptica. Encapsulación de células también era posible dentro de un hidrogel solo fotopolimerizable, PEG, y una prueba de viabilidad en vivo / muerto se llevó a cabo como se evidencia en la Figura 4. Encapsulación de PEG se entiende sólo como un ejemplo, como PEG no representa un ambiente ideal para las células nerviosas. Por lo tanto, se dio cuenta de la viabilidad celular en las construcciones de nuestra PEG es comprensiblemente baja. Finalmente, los ejemplos de la utilización de películas delgadas de PEG como una capa de modelado restrictivas para la adhesión celular en las inserciones de cultivo celular se muestra en la Figura 5. Además, los ejemplos de posibles "malos" los resultados se ofrecen en la Figura 6.
Los resultados representan sólo una pequeña fracción de los posibles usos de los métodos desarrollados en nuestro laboratorio. Tienen el propósito de demostrar la facilidad, versatilidad y la viabilidad de nuestro enfoque, y podría ser tratado como "prueba de principio" para que los investigadores desarrollen sus posibles adaptaciones propias.
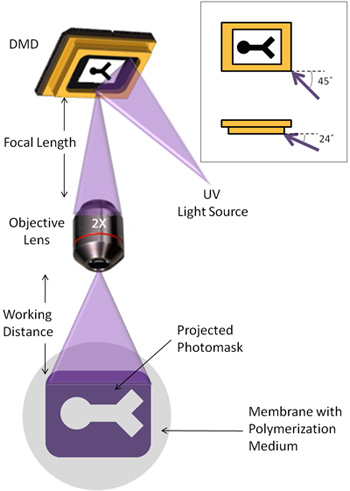
Figura 1. Esquema de la trayectoria de la luz utilizada para la fotolitografía. Recuadro: La luz UV se enciende la DMD en un ángulo de 45 ° y 24 ° por debajo del plano de la serie del espejo.

Figura 2. Etiquetada crecimiento y la proliferación en el GRD que contienen construcciones de doble hidrogel. AD) Las imágenes retratan polimerizado construye PEG (gris) con neuritas etiquetados con beta tubulina III (verde), los núcleos de células teñidas con DAPI (azul). Los explantes de DRG se encuentran en Puramatrix y ubicados en las regiones del patrón circular, con neuritas cada vez mayor hacia la bifurcación (s).
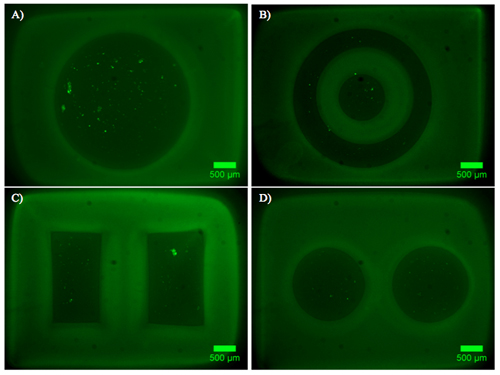
Figura 3. Construcciones de doble hidrogel que contiene las células marcadas con calceína AM, un marcador de células vivas, después de 48 horas en medio de crecimiento. AD) Diversas formas de PEG, lleno de Puramatrix contiene neuronas disociadas DRG (~ 5x10 3 células / ml).
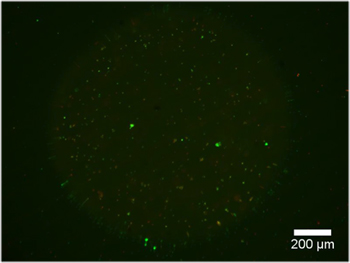
Figura 4. Hidrogel única construcción que contiene células vivas marcadas con calceína AM (verde) y las células muertas de la etiqueta con el homodímero de etidio-1 (roja) a las 24 horas en medio de cultivo (5x10 3 células / ml).
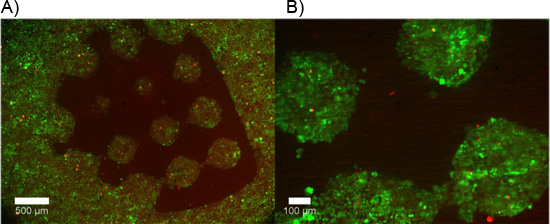
PEG Figura 5. Celular restrictivas polimerizada como una película delgada con un "patrón de prueba" a que se adhieran de forma selectiva las células disociadas de la membrana de colágeno recubiertas de soporte permeable. A, B) Las células vivas se etiquetan a las 48 horas con calceína AM (verde), mientras que las células muertas se etiquetan con homodímero de etidio-1 (roja). La adhesión celular mínima ocurre en el área que contiene la película delgada PEG.

Figura 6. Imágenes representativas de resultados no deseados. A) la polimerización parcial de PEG, dando lugar a una PEG inutilizable construir. Polimerización inadecuada puede ocurrir debido a la presencia de un menisco en el medio pre-polímero, una cantidad insuficiente de medio de polimerización, la exposición UV insuficiente o inadecuado enfoque de la óptica. B) Imagen de retratar polimerizado construye PEG (gris) con neuritas etiquetados con beta tubulina III (verde), los núcleos de células teñidas con DAPI (azul). Las neuritas fueron capaces de crecer fuera de los canales de dibujos PEG. Esto ocurre a menudo en la condición de que se desborda Puramatrix en la parte superior de la porción de PEG durante la inyección.
Discusión
El método descrito en este documento podría ser utilizado por cualquier investigador que buscan sistemas de celdas de simple y reproducible la cultura. En teoría, debido a la amplia variedad de hidrogeles fotopolimerizables disponibles, el medio ambiente podrían ser adaptados para permitir su uso con cualquier tipo de célula, incluyendo explantes de todo el tejido. Además, el sistema dual de hidrogel permite un mejor control espacial en la presentación de la auto-polimerización de los hidrogeles, que tiende a crear formas amorfas por su cuenta. El resultado de "2,5 D" construye hidrogel micropatterned proporcionar una matriz 3D para el crecimiento neuronal se presenta en una configuración 2D que permite la evaluación microscópica conveniente. El sustrato sobre el que los geles son polimerizados también se puede variar, lo que permite un mayor control en el diseño experimental. Nuestros métodos están optimizados para su uso con soportes de cultivo celular permeable, como se ha visto una mejor viabilidad (Figura 4), en comparación con la polimerización en portaobjetos de vidrio (datos no mostrados). Sin embargo, otras superficies de polimerización pueden ser más aplicables para diferentes aplicaciones: fabricación de placas de vidrio utilizados en los experimentos de microfluidos o formaciones de células agregado, por ejemplo.
Nuestra experiencia con estos sistemas de cultivo ha llevado a la identificación de posibles áreas de dificultad. En primer lugar, las técnicas de cuidado es necesario para mantener la esterilidad de las construcciones. Debido a la naturaleza voluminosa de la configuración de DMD, es difícil de realizar los pasos de polimerización bajo condiciones estériles. Para combatir este problema, el paso de enjuague se describe en los métodos es útil, y los antibióticos deben ser utilizados en todos los medios de comunicación. Además, el espesor final y la forma de la construcción polimerizado depende en gran medida el comportamiento de los fluidos de la pre-mezcla de polímeros, y la presencia de un menisco puede dar lugar a construcciones de gel que son demasiado delgados o polimerizado incompleta (Figura 6). A dos pasos se pueden tomar para minimizar la formación de un menisco en el interior se inserta el cultivo de células. Para los hidrogeles de espesor (> 200 m), una simple capa de lluvia-X alrededor de la pared interior de la pieza es suficiente. Sin embargo, como se describe brevemente más arriba, para las construcciones finas (<200 micras), una capa de aceite se requiere tanto para minimizar el menisco y negar bloqueo del oxígeno de la polimerización por radicales libres. Resolución se encontró que depende del espesor, con una disminución de tamaño de la característica realiza con geles cada vez más grueso. La resolución también variaba dependiendo de si la función representa un alivio positivo o negativo en el hidrogel. Sin embargo, hemos logrado una resolución suficiente para las construcciones con tamaños mínimos de la escala de aproximadamente 100 micras con los objetivos de centrarse sólo microscopio óptico.
Nuestros experimentos han demostrado que las construcciones de hidrogel de doble descritas aquí representan una excelente base para la formación básica de los modelos in vitro del crecimiento de las neuritas y la orientación. La técnica empleada micropatterning es una adaptación de los métodos existentes 18,19, pero nuestra puesta a punto hizo hincapié en un diseño fácil de implementar y se ha optimizado para la producción de construcciones de hidrogel de doble en las inserciones de cultivo celular, insertos de cultivo celular fueron vitales para la mejora de la viabilidad celular y como reticulación alrededor de explantes de tejido previamente adherentes. El alcance de los resultados mostrados se ve limitada por los intereses de nuestro laboratorio, sin embargo, creemos que los métodos descritos en esta publicación sea de utilidad para los investigadores en busca de un relativamente barato, método rápido y fácil de usar para la fabricación de cultivo de células en 3D modelos.
Divulgaciones
Agradecimientos
Los autores desean agradecer al laboratorio del profesor Anthony Windebank por compartir su experiencia en la disección de DRG y la cultura, así como el profesor Chen Shaochen útil para los debates sobre la instalación de DMD. Esta investigación fue financiada en parte por la Universidad de Tulane y subvenciones de la Junta de Regentes de Louisiana (LEQSF [2009-10]-RD-A-18) y el NIH (NS065374).
Materiales
| Name | Company | Catalog Number | Comments |
| Digital Micromirror Device | Texas Instruments | DLPD4X00KIT | |
| Collagen Coated Transwell Permeable Support | Corning | 3491 | Also referred to as Cell Culture Insert in manuscript |
| Polyester Transwell Permable Support | Corning | 3412 | Also referred to as Cell Culture Insert in manuscript |
| Neurobasal Medium | Invitrogen | 21103-049 | |
| Fetal Bovine Serum | Invitrogen | 16000-036 | |
| L-glutamine | Invitrogen | 25030-164 | |
| Nerve Growth Factor | Invitrogen | 13257-019 | |
| Pen/Strep | Invitrogen | 15140-122 | |
| B-27 Supplement | Invitrogen | 17504-044 | |
| DPBS | Invitrogen | 14190-250 | |
| Puramatrix | BD Biosciences | 354250 | |
| PEG 1000 | Polysciences, Inc. | 15178 | |
| Irgacure 2959 | Ciba Specialty Chemicals | 0298913AB | |
| Oil | Have used both canola oil and silicon oil | Needs to be UV transparent, and minimize +/- meniscus formation | |
| OmniCure Series 1000 | EXFO | ||
| Rain-X |
Referencias
- Abbott, A. Cell culture: biology's new dimension. Nature. 424, 870-872 (2003).
- Schindler, M. Living in three dimensions: 3D nanostructured environments for cell culture and regenerative medicine. Cell Biochem Biophys. 45, 215-227 (2006).
- Maltman, D. J., Przyborski, S. A. Developments in three-dimensional cell culture technology aimed at improving the accuracy of in vitro analyses. Biochemical Society Transactions. 38, 1072-1075 (2010).
- Smalley, K. S., Lioni, M., Herlyn, M. Life isn't flat: taking cancer biology to the next dimension. In Vitro Cell Dev Biol Anim. 42, 8-9 (2006).
- Irons, H. R. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. Journal of Neural Engineering. 5, 333-341 (2008).
- Bursac, N. Cultivation in rotating bioreactors promotes maintenance of cardiac myocyte electrophysiology and molecular properties. Tissue Eng. 9, 1243-1253 (2003).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294, 1708-1712 (2001).
- Cushing, M. C., Anseth, K. S. Materials science. Hydrogel cell cultures. Science. 316, 1133-1134 (2007).
- Kloxin, A. M., Kasko, A. M., Salinas, C. N., Anseth, K. S. Photodegradable hydrogels for dynamic tuning of physical and chemical properties. Science. 324, 59-63 (2009).
- Geckil, H., Xu, F., Zhang, X., Moon, S., Demirci, U. Engineering hydrogels as extracellular matrix mimics. Nanomedicine (Lond). 5, 469-484 (2010).
- Luo, Y., Shoichet, M. S. A photolabile hydrogel for guided three-dimensional cell growth and migration. Nature Materials. 3, 249-253 (2004).
- Wylie, R. G., Shoichet, M. S. Two-photon micropatterning of amines within an agarose hydrogel. Journal of Materials Chemistry. 18, 2716-2721 (2008).
- Ji, Y. Electrospun three-dimensional hyaluronic acid nanofibrous scaffolds. Biomaterials. 27, 3782-3792 (2006).
- Moeller, H. C., Mian, M. K., Shrivastava, S., Chung, B. G., Khademhosseini, A. A microwell array system for stem cell culture. Biomaterials. 29, 752-763 (2008).
- Xu, T. Viability and electrophysiology of neural cell structures generated by the inkjet printing method. Biomaterials. 27, 3580-3588 (2006).
- Liu Tsang, V. Fabrication of 3D hepatic tissues by additive photopatterning of cellular hydrogels. FASEB J. 21, 790-801 (2007).
- Beebe, D. J. Microfluidic tectonics: A comprehensive construction platform for microfluidic systems. Proceedings of the National Academy of Sciences of the United States of America. 97, 13488-13493 (2000).
- Lu, Y., Mapili, G., Suhali, G., Chen, S. C., Roy, K. A digital micro-mirror device-based system for the microfabrication of complex, spatially patterned tissue engineering scaffolds. Journal of Biomedical Materials Research Part A. 77, 396-405 (2006).
- Naiser, T., Mai, T., Michel, W., Ott, A. Versatile maskless microscope projection photolithography system and its application in light-directed fabrication of DNA microarrays. Review of Scientific Instruments. 77, 063711-063711 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados