Method Article
Fabricação de hidrogéis micropatterned para Sistemas de Cultura Neural usando fotolitografia Projeção Dinâmica Máscara
Neste Artigo
Resumo
Técnicas simples são descritos para a produção rápida de microfabricated sistemas de cultura neural usando um dispositivo de microespelhos digitais para litografia dinâmica máscara de projeção em substratos de cultura de células regulares. Estes sistemas cultura pode ser mais representativo da arquitectura biológica natural, e as técnicas descritas podem ser adaptadas para inúmeras aplicações.
Resumo
Cada vez mais, ambientes de cultura de células padronizadas estão se tornando uma técnica relevante para estudar características celulares, e muitos pesquisadores acreditam na necessidade de ambientes 3D para representar experimentos in vitro que imitar melhor em qualidades vivo 1-3. Estudos em áreas como a pesquisa do câncer 4, engenharia neural 5, fisiologia cardíaca 6, e célula-matriz de interação 7,8 têm mostrado o comportamento das células difere substancialmente entre as culturas tradicionais monocamada e construções em 3D.
Hidrogéis são utilizados como ambientes 3D devido à sua diversidade, versatilidade e capacidade de composição molecular sob medida através de funcionalização 9-12. Numerosas técnicas existem para a criação de construções como células de suporte matrizes, incluindo electrospinning 13, selos de elastômero 14, impressão jato de tinta 15, photopatterning aditivo 16, fotomáscara estática litografia de projeção-17, e microstereolithography máscara dinâmica 18. Infelizmente, esses métodos envolvem várias etapas de produção e / ou equipamentos não é facilmente adaptável a célula e métodos convencionais de cultura de tecidos. A técnica empregada neste protocolo adapta os dois últimos métodos, usando um dispositivo de microespelhos digitais (DMD) para criar máscaras dinâmicas para crosslinking geometricamente específicas poli (etileno glicol) (PEG) hidrogéis, induzida através da polimerização UV iniciada de radicais livres. O resultado do "2.5D" estruturas de fornecer um ambiente restrito em 3D para o crescimento neural. Nós empregamos uma abordagem dual-hidrogel, onde PEG serve como uma estrutura de células-região restritivas para fornecer uma outra maneira disforme, mas células permissivas gel auto-montagem feita a partir de qualquer Puramatrix ou agarose. O processo de fabricação é uma etapa rápida e simples um que é altamente reprodutível e facilmente adaptado para uso com métodos convencionais de células de cultura e substratos.
Explantes tecido inteiro, como gânglios da raiz dorsal embrionária (DRG), podem ser incorporadas ao hidrogel constrói dupla para ensaios experimentais, tais como crescimento de neuritos. Além disso, células dissociadas pode ser encapsulado no hidrogel photocrosslinkable ou auto-polimerização, ou seletivamente aderidas à membrana suporte permeável usando células-restritivas photopatterning. Usando o DMD, criamos hidrogel construções até ~ 1 mm de espessura, mas de película fina (<200 mm) estruturas PEG foram limitados pela têmpera de oxigênio da reação de polimerização por radicais livres. Nós posteriormente desenvolveu uma técnica utilizando uma camada de óleo acima do líquido de polimerização que permitiu a polimerização estrutura fina PEG.
Neste protocolo, descrevemos a criação rápida de sistemas de hidrogel 3D para a produção de células neurais e microfabricated culturas de tecidos. As construções de hidrogel dupla demonstrou aqui representam versáteis modelos in vitro que podem ser úteis para estudos em neurociência que envolvem a sobrevivência da célula, migração e / ou crescimento neurite e orientação. Além disso, como o protocolo pode funcionar para muitos tipos de hidrogéis e células, as possíveis aplicações são variadas e vastas.
Protocolo
1. Setup DMD
- A placa DMD, guia de luz UV (com colimador) e lente objetiva de 4x são todos montados verticalmente sobre uma mesa de isolamento de vibração.
- A guia de luz UV deve ser ajustada de modo que a luz atinge a matriz espelho em um ângulo de 45 ° em relação ao plano dos espelhos, e 24 ° abaixo do plano dos espelhos (Figura 1).
- A lente objetiva é montado de modo que a distância do DMD para a lente objetiva corresponde ao comprimento focal associada com a lente.
- Um microscópio invertido é colocado abaixo da lente objetiva, de tal forma que a luz refletida do foco DMD pode ser visualizado através do microscópio. A distância entre a lente objetiva para a superfície de polimerização deve corresponder aproximadamente à distância de trabalho da lente. O estágio no microscópio pode então ser usado para ajustar essa distância para finamente focalizar a imagem. Esta distância pode variar de acordo com a superfície de polimerização escolhido.
2. Constrói dupla Hydrogel de Culturas Remoção Tissue
A. adesão explante DRG
- Revestimento das paredes de 6 bem-colágeno insere célula revestido de cultura (Corning) com X-chuva, tendo o cuidado de evitar a própria membrana. (Como alternativa, uma caneta barreira hidrofóbica pode ser usado.)
- Insere hidratar durante a noite com 1,5 ml de meio de adesão em uma incubadora a 37 ° C e 5% CO 2. Média de adesão é de médio neurobasal com 10% de soro fetal bovino, 1% penicilina / estreptomicina, 0,5 mM L-glutamina, e 20 mcg / mL NGF.
- Colheita gânglios da raiz dorsal embrionária (DRG) de E-15 filhotes de rato. DRG deve ser banhado em colágeno revestido 6-bem inserções, até quatro por pastilha.
- Incubar inserções por 2 horas para permitir DRG adesão à membrana.
B. fotopolimerização máscara dinâmica
Um dispositivo de microespelhos digitais (DMD) é uma 1024 x 768 conjunto de espelhos individuais, semelhante ao de televisores de projeção, que reflete a luz seletivamente com base na posição do espelho. Para os nossos propósitos, a DMD é usada para acender padrão de radiação ultravioleta (UV) em hidrogéis photocrosslinkable, criando geometrias hidrogel especificáveis de uma maneira simples e rápida. A Figura 1 mostra a configuração do caminho DMD e luz UV. Embora a nossa DMD é uma unidade autônoma, o dispositivo também pode ser integrado para uso com muitos microscópios existentes.
- Retire o excesso de líquido de inserir e adicionar 500 mL de meio de polimerização dentro da pastilha. Meio da polimerização contém PEG 10% (1000 MW) e 0,5% IRGACURE 2959 dissolvidos em meio neurobasal suplementada com 20 mg / mL e NGF Pen 1% / Strep.
- Coloque a inserção por baixo do aparelho DMD numa lâmina de vidro chuva X-tratada.
- Carregar a imagem apropriada preto e branco para ser usado como um "fotomáscara" na DMD, através do uso do programa gráfico incluído ALP-3 básicos. Para nossos propósitos, uma forma bifurcando foi escolhido para permitir a implementação de sistemas de orientação neurite.
- Usando um microscópio invertido para visualização, alinhar os explantes de tecido com o local apropriado no fotomáscara usando uma fonte de luz visível, refletindo a DMD.
- Mudar a fonte de luz visível para a fonte de luz UV, e iluminar a solução PEG até crosslinking é suficiente. (Para as condições dadas e 5,0 Watts / cm 2 incidente sobre a DMD, de reticulação pode ser concluída em menos de 55 segundos.) Repita o procedimento para todos os DRG quatro no insert.
- Lave cada inserir três vezes com DPBS estéril e 1% Pen Strep.
- Adicionar 1,5 ml meio de crescimento abaixo do inserções cultura de células, e deixar equilibrar em uma incubadora por 30 minutos. Meio de crescimento é médio neurobasal contendo B-27 2% Pen, 1% / Strep, 0,5 mM L-glutamina, e 20 mcg / mL NGF.
C. hidrogel Secundária
Puramatrix
- Para aplicações neuronal, Puramatrix 1% é diluída de acordo com as instruções do fabricante para 0,15% em estéril H 2 O e suplementado com 1 laminina mcg / mL solúvel.
- Todos os meios em excesso devem ser removidos dos vazios PEG, que contêm os explantes DRG, usando um aplicador de ponta de algodão esterilizado, Kimwipe, ou micropipeta.
- Puramatrix é adicionado ao vazios PEG com uma micropipeta, a fim de preencher o espaço vazio, sem transbordar. Dependendo do volume vazio, tipicamente ~ 1 mL é usado por construir.
- Puramatrix começa o processo de auto-montagem imediatamente após o contato com uma solução salina fisiológica, ou seja, o PEG inchado, mas 1,5 mL de meio de crescimento é adicionado abaixo da inserção e colocado na incubadora por uma hora para garantir a gelificação total.
- Inicialmente, Puramatrix é ligeiramente ácido, por isso alterar a mídia depois de uma hora para permitir que o pH para equilibrar.
- Mudanças de mídia são necessários aproximadamente a cada 48 horas. Tenha cuidado para que toda a mídia éadicionada por baixo da inserção, para proteger a integridade de Puramatrix mecanicamente fraco.
Agarose
- Para aplicações neuronal, agarose é diluída para uma solução a 1% em meio de crescimento e colocado em banho-maria a 60 ° C até a agarose dissolve completamente (~ 1 hr). A solução é, então, suplementado com 1 mg / mL laminina solúveis.
- Todos os meios em excesso devem ser removidos dos vazios PEG.
- Agarose é adicionado ao vazios PEG, a fim de preencher o espaço vazio, sem transbordar. Dependendo do volume de vazio, tipicamente ~ 1 mL é usado por construir.
- 1,5 mL de meio de crescimento é pré-refrigeradas (8 ° C) em uma placa de 6 poços, e as pastilhas contendo agarose são transferidos para a mídia refrigerado e mantido em geladeira a 8 ° C por pelo menos três minutos para permitir que a agarose gel.
- Finalmente, as inserções são transferidos para 1,5 mL de pré-aquecido meio de crescimento (37 ° C) e mantido na incubadora a 37 ° C, com mudanças mídia necessária a cada 48 horas.
3. Dupla Hydrogel encapsulamento de células em 3D
Encapsulamento hidrogel dupla é apropriado quando se usa qualquer gel de auto-montagem. O gel photocrosslinkable, neste PEG caso, serve como um suporte estrutural para a apresentação geométrica do gel de auto-montagem, por exemplo Puramatrix ou agarose. Alguns dos métodos, especificamente o tipo de gel e escolha de fotomáscara, vai depender da aplicação específica desejada.
- Carregar uma máscara adequada na DMD. Para a nossa sobrevivência celular, aplicação, nós simplesmente escolhemos uma apresentação cilíndrica de Puramatrix para ajudar na criação de imagens de células. Pesquisadores que estudam a sinalização celular poderia estar interessado em uma geometria compartimental para permitir a difusão de moléculas quimiotáticas. Além disso, uma aproximação grosseira de uma artéria foi mostrado para representar possível aplicação para a investigação dos vasos sanguíneos.
- Tratar as paredes de uma inserção da cultura de células de poliéster com Rain-X, e de local em DMD no slide Rain-X revestido.
- Adicionar 500 mL de meio de polimerização para a inserção. Induzir a reticulação PEG pela exposição à luz UV por 55 segundos.
- Lavar três vezes com DPBS estéril e 1% Pen Strep.
- Remova toda a mídia em excesso dos vazios PEG.
- Spin down células na densidade desejada em um pellet. Cuidados devem ser tomados para remover todas as médias do pellet de células antes da mistura, como Puramatrix começa a auto-montagem imediatamente após o contato com uma solução salina. Suspender as células dentro Puramatrix 0,15% diluído em H 2 O estéril suplementada com sacarose 10%.
- Injetar o Puramatrix / célula / sacarose mistura dentro vazios em PEG.
- Adicionar 1,5 mL de meio de crescimento abaixo da inserção, e deixe gel dentro da incubadora por uma hora.
- Alterar mídia após uma hora, e ~ a cada 48 horas depois.
4. Hidrogel único encapsulamento de células em 3D
Um único encapsulamento hidrogel seria apropriado para qualquer situação onde as células podem ser examinados dentro de um hidrogel photocrosslinkable.
- Carregar uma máscara adequada na DMD. Para estudos de sobrevivência da célula, mais uma vez escolheu uma máscara circular básicos para representar um cilindro. Máscaras semelhantes às mostradas no método 4 poderia voltar a ser aplicada para o campo de pesquisa apropriado.
- Tratar um poliéster inserir cultura de células com Rain-X, e de local em DMD no slide Rain-X revestido.
- Células em qualquer concentração desejada pode ser adicionado diretamente à solução de PEG 10%, misturando bem para garantir a distribuição homogênea.
- Adicionar 500 mL de meio de polimerização para a inserção. Induzir a reticulação PEG pela exposição à luz UV por 55 segundos.
- Lavar três vezes com DPBS estéril e 1% Pen Strep.
- Preencha com o meio de crescimento ambos abaixo e em cima do insert, mudando a cada ~ 2 dias.
5. Polimerização Hydrogel Thin Film
- Carregar uma máscara adequada na DMD.
- Tratar uma colágeno revestido de poliéster inserir cultura de células com chuva X-, e colocar no slide Rain-X revestido.
- Adicionar meio da polimerização suficiente para apenas cobrir o fundo da inserção (~ 250-300 mL para inserções 6 bem-plate). Permitir que os meios de comunicação a permear a membrana de inserção para 30-45 minutos em temperatura ambiente.
- Remova o meio de polimerização em excesso da pastilha com uma micropipeta ou Kimwipe. Adicionar uma quantidade suficiente de UV-transparente do petróleo para cobrir completamente a parte inferior da pastilha. Permitir a inserção de sentar para 15-30 minutos em temperatura ambiente, tempo suficiente para que o óleo forma uma camada distinta acima do meio da polimerização saturando a membrana de inserção.
- Coloque a inserção e deslize sob a DMD. Induzir a reticulação PEG pela exposição à luz UV. Devido à pequena espessura da camada PEG, de reticulação pode ser concluída em menos de 15 segundos a 5,0 Watts / cm 2 incidente sobre a DMD.
- Lave a inserir três vezes com DPBS estéril e 1% Pen Strep. (Se a persistência de um resíduo oleoso é uma preocupação, um detergente suave, como Tween 20 (1%) pode ser adicionado ao tampão de lavagem).
- Armazenar os inserir em uma placa de cultura de 6 bem tecido. Adicionar meio de crescimento para as células em suspensão, na concentração desejada, e pipetar um volume suficiente de suspensão de células dentro do insert de cultura de células para obter a densidade de célula desejada. Em seguida, adicione meio de crescimento bastante abaixo da inserção para manter a viabilidade celular completamente (~ 1,5 mL).
- Após 48 horas se passaram, lave a inserir três vezes com DPBS estéril e 1% Pen-Strep para desalojar quaisquer células unadhered. Alterar media aproximadamente uma vez a cada 48 horas.
6. Resultados representante
Exemplos de hidrogel contendo dupla constrói explantes DRG são mostrados na Figura 2. Observe que a migração celular e extensão neurite está limitada à região de células permissivas do hidrogel dupla construir. A Figura 3 mostra células dissociadas encapsulado dentro da mesma forma as construções de hidrogel dual. Devido à natureza dinâmica do fotomáscara DMD, a geometria disponíveis para encapsulamento é limitada apenas pelas dimensões e resolução da óptica. Encapsulamento de células foi também possível dentro de um hidrogel único fotopolimerizável, PEG, e um teste de viabilidade ao vivo / morto foi realizada conforme evidenciado na Figura 4. Encapsulamento em PEG destina-se apenas como um exemplo, como PEG não representa um ambiente ideal para células neurais. Portanto, a viabilidade celular realizado em construções de nossa PEG é compreensivelmente baixo. Finalmente, utilizando exemplos de filmes PEG fina como uma camada padrão restritivo para adesão celular em inserções de cultura de células são mostrados na Figura 5. Além disso, exemplos de possíveis "maus" resultados são oferecidas na Figura 6.
Os resultados representam apenas uma pequena fração dos possíveis usos dos métodos desenvolvidos em nosso laboratório. Elas são destinadas a demonstrar a facilidade, versatilidade e viabilidade de nossa abordagem, e poderia ser tratado como "prova de princípio" para os pesquisadores a desenvolver seus próprios possíveis adaptações.
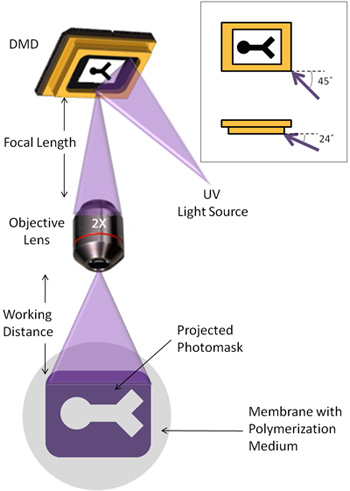
Figura 1. Ilustração esquemática do caminho de luz usado para fotolitografia. Detalhe: A luz UV ilumina a DMD em um ângulo de 45 ° e 24 ° abaixo do plano da matriz espelho.

Figura 2. Rotuladas de crescimento e proliferação de construções de hidrogel contendo DRG dual. AD) Imagens que retratam construções polimerizado PEG (cinza) com neurites rotulados com Beta-tubulina III (verde), núcleos de células manchadas DAPI (azul). Os explantes DRG estão contidos em Puramatrix e localizados nas regiões circular do padrão, com neurites crescente para a bifurcação (s).
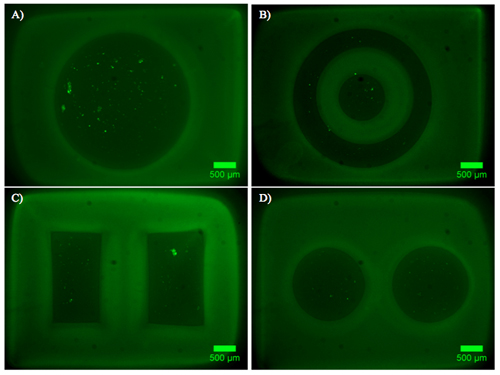
Figura 3. Constrói hidrogel duplo contendo células marcadas com calceína AM, um marcador de células vivas, após 48 horas em meio de crescimento. AD) formas PEG Various, cheio de Puramatrix contendo neurônios dissociados DRG (~ 5x10 3 células / mL).
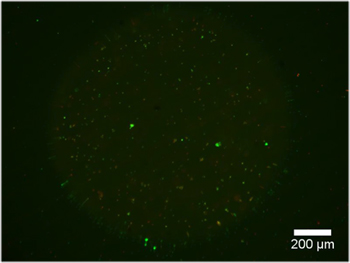
Figura 4. Hidrogel única construção que contém células vivas rotulados com calceína AM (verde) e células mortas rotulados com homodímero de etídio-1 (vermelho) após 24 horas em meio de crescimento (5x10 3 células / mL).
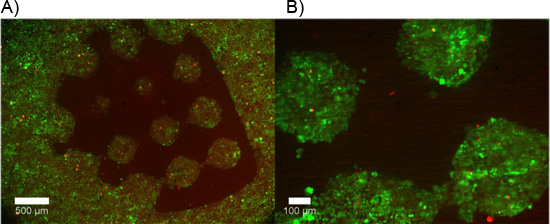
Figura 5. PEG celular restritivas polimerizado como um filme fino utilizando um "padrão de teste" para seletivamente células dissociadas aderir à membrana de colágeno revestido de suporte permeável. A, B) células vivas são rotulados depois de 48 horas com calceína AM (verde), enquanto as células mortas são rotulados com homodímero de etídio-1 (vermelho). Adesão celular mínima ocorre na área do PEG contendo o filme fino.

Figura 6. Imagens representativas de resultados indesejáveis. A) polimerização parcial de PEG, levando a um PEG inutilizável construir. Polimerização inadequada pode ocorrer devido à presença de um menisco no meio de pré-polímero, quantidades insuficientes de meio da polimerização, a exposição UV insuficiente ou inadequada foco da óptica. B) Imagem retratando construções polimerizado PEG (cinza) com neurites rotulados com Beta-tubulina III (verde), núcleos de células manchadas DAPI (azul). O neurites foram capazes de crescer fora dos canais padronizados PEG. Isso geralmente ocorre na condição de que transborda Puramatrix em cima da porção PEG durante a injeção.
Discussão
O método descrito aqui pode ser usado por qualquer pesquisador que procuram sistemas de cultura de células simples e reprodutível. Teoricamente, devido à grande variedade de hidrogéis fotopolimerizável disponíveis, o ambiente pode ser adaptado para permitir o uso com qualquer tipo de célula, incluindo explantes tecido inteiro. Além disso, o sistema de hidrogel dupla permite o controle espacial melhorada na apresentação de auto-polimerização hidrogéis, que tendem a formar formas amorfas por conta própria. O resultado do "2.5D" constrói hidrogel micropatterned fornecer uma matriz 3D para o crescimento neural apresentado em uma configuração 2D que permite a avaliação microscópica conveniente. O substrato sobre o qual os géis são polimerizados também podem ser variadas, permitindo maior controle no delineamento experimental. Nossos métodos são otimizados para uso com suportes de cultura de células permeáveis, como vimos melhoria da viabilidade (Figura 4), em comparação com a polimerização em lâminas de vidro (dados não mostrados). No entanto, outras superfícies de polimerização pode ser mais aplicável para diferentes aplicações: fabricação em lâminas de vidro utilizado em experimentos microfluídica ou formações agregado de células, por exemplo.
Nossa experiência com esses sistemas de cultura levou à identificação de áreas potenciais de dificuldade. Primeiro, as técnicas de cuidado são necessários para manter a esterilidade das construções. Devido à natureza volumosos da configuração do DMD, é difícil de operar as etapas de polimerização sob condições estéreis. Para combater este problema, a etapa de lavagem descrito nos métodos é útil, e os antibióticos devem ser usados em todas as mídias. Além disso, a espessura final e forma da construção polimerizado é altamente dependente do comportamento do fluido da pré-mistura de polímeros, ea presença de um menisco pode resultar em construções de gel que são muito finas ou incompleta polimerizadas (Figura 6). Dois passos podem ser tomadas para minimizar a formação de um menisco no interior insere cultura de células. Para hidrogéis de espessura (> 200 mm), um revestimento simples de X-Chuva volta a parede interna da pastilha é suficiente. No entanto, como brevemente descrito acima, para construções finas (<200 mm), uma camada de óleo é necessária para minimizar tanto o menisco e nega extinção de oxigênio da polimerização de radicais livres. Resolução foi encontrado para ser dependente de espessura, com uma diminuição no tamanho do recurso cada vez mais realizado com gel mais espesso. A resolução também variou dependendo se o recurso representou um alívio positivo ou negativo no hidrogel. No entanto, conseguimos uma resolução suficiente para construções com tamanhos traço mínimo na escala de ~ 100 mm usando objetivos microscópio apenas como foco óptica.
Nossos experimentos mostraram que o hidrogel dupla constrói aqui descritos representam uma excelente base para a formação de base in-vitro modelos de crescimento neurite e orientação. A técnica empregada micropatterning é uma adaptação dos métodos existentes 18,19, mas o nosso set-up enfatizou uma concepção simples de implementar e foi otimizado para a produção de construções de hidrogel dupla insere em cultura de células; insere cultura de células foram vitais para melhorar a viabilidade das células, assim como crosslinking torno explantes tecidos anteriormente aderente. O alcance dos resultados apresentados é limitada pelos interesses de nosso laboratório, no entanto, acreditamos que os métodos descritos nesta publicação serão úteis para os pesquisadores à procura de um método relativamente barato, rápido e fácil de usar para a fabricação de cultura celular 3D modelos.
Divulgações
Agradecimentos
Os autores gostariam de agradecer o laboratório do Prof Anthony Windebank para compartilhar os seus conhecimentos sobre DRG dissecção e cultura, bem como o Prof Shaochen Chen para discussões úteis a respeito da configuração do DMD. Esta pesquisa foi financiada em parte pela Tulane University e subvenções do Conselho de Regentes Louisiana (LEQSF [2009-10]-RD-A-18) e os NIH (NS065374).
Materiais
| Name | Company | Catalog Number | Comments |
| Digital Micromirror Device | Texas Instruments | DLPD4X00KIT | |
| Collagen Coated Transwell Permeable Support | Corning | 3491 | Also referred to as Cell Culture Insert in manuscript |
| Polyester Transwell Permable Support | Corning | 3412 | Also referred to as Cell Culture Insert in manuscript |
| Neurobasal Medium | Invitrogen | 21103-049 | |
| Fetal Bovine Serum | Invitrogen | 16000-036 | |
| L-glutamine | Invitrogen | 25030-164 | |
| Nerve Growth Factor | Invitrogen | 13257-019 | |
| Pen/Strep | Invitrogen | 15140-122 | |
| B-27 Supplement | Invitrogen | 17504-044 | |
| DPBS | Invitrogen | 14190-250 | |
| Puramatrix | BD Biosciences | 354250 | |
| PEG 1000 | Polysciences, Inc. | 15178 | |
| Irgacure 2959 | Ciba Specialty Chemicals | 0298913AB | |
| Oil | Have used both canola oil and silicon oil | Needs to be UV transparent, and minimize +/- meniscus formation | |
| OmniCure Series 1000 | EXFO | ||
| Rain-X |
Referências
- Abbott, A. Cell culture: biology's new dimension. Nature. 424, 870-872 (2003).
- Schindler, M. Living in three dimensions: 3D nanostructured environments for cell culture and regenerative medicine. Cell Biochem Biophys. 45, 215-227 (2006).
- Maltman, D. J., Przyborski, S. A. Developments in three-dimensional cell culture technology aimed at improving the accuracy of in vitro analyses. Biochemical Society Transactions. 38, 1072-1075 (2010).
- Smalley, K. S., Lioni, M., Herlyn, M. Life isn't flat: taking cancer biology to the next dimension. In Vitro Cell Dev Biol Anim. 42, 8-9 (2006).
- Irons, H. R. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. Journal of Neural Engineering. 5, 333-341 (2008).
- Bursac, N. Cultivation in rotating bioreactors promotes maintenance of cardiac myocyte electrophysiology and molecular properties. Tissue Eng. 9, 1243-1253 (2003).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294, 1708-1712 (2001).
- Cushing, M. C., Anseth, K. S. Materials science. Hydrogel cell cultures. Science. 316, 1133-1134 (2007).
- Kloxin, A. M., Kasko, A. M., Salinas, C. N., Anseth, K. S. Photodegradable hydrogels for dynamic tuning of physical and chemical properties. Science. 324, 59-63 (2009).
- Geckil, H., Xu, F., Zhang, X., Moon, S., Demirci, U. Engineering hydrogels as extracellular matrix mimics. Nanomedicine (Lond). 5, 469-484 (2010).
- Luo, Y., Shoichet, M. S. A photolabile hydrogel for guided three-dimensional cell growth and migration. Nature Materials. 3, 249-253 (2004).
- Wylie, R. G., Shoichet, M. S. Two-photon micropatterning of amines within an agarose hydrogel. Journal of Materials Chemistry. 18, 2716-2721 (2008).
- Ji, Y. Electrospun three-dimensional hyaluronic acid nanofibrous scaffolds. Biomaterials. 27, 3782-3792 (2006).
- Moeller, H. C., Mian, M. K., Shrivastava, S., Chung, B. G., Khademhosseini, A. A microwell array system for stem cell culture. Biomaterials. 29, 752-763 (2008).
- Xu, T. Viability and electrophysiology of neural cell structures generated by the inkjet printing method. Biomaterials. 27, 3580-3588 (2006).
- Liu Tsang, V. Fabrication of 3D hepatic tissues by additive photopatterning of cellular hydrogels. FASEB J. 21, 790-801 (2007).
- Beebe, D. J. Microfluidic tectonics: A comprehensive construction platform for microfluidic systems. Proceedings of the National Academy of Sciences of the United States of America. 97, 13488-13493 (2000).
- Lu, Y., Mapili, G., Suhali, G., Chen, S. C., Roy, K. A digital micro-mirror device-based system for the microfabrication of complex, spatially patterned tissue engineering scaffolds. Journal of Biomedical Materials Research Part A. 77, 396-405 (2006).
- Naiser, T., Mai, T., Michel, W., Ott, A. Versatile maskless microscope projection photolithography system and its application in light-directed fabrication of DNA microarrays. Review of Scientific Instruments. 77, 063711-063711 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados