Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un protocolo para la recolección y la tinción de los hemocitos del mosquito de la fiebre amarilla Aedes aegypti
En este artículo
Resumen
Un método simplificado pero preciso para recoger y mancha hemocitos mosquito se describe. Nuestro método combina la simplicidad de la perfusión con la precisión de las técnicas de inyección de alta para aislar a los preparativos limpia de hemocitos en los mosquitos Aedes. Este método facilita el conocimiento de los estudios que requieren los tipos de hemocitos y su abundancia.
Resumen
Los mosquitos son vectores de una serie de patógenos que causan enfermedades como el virus de la fiebre amarilla, parásitos de la malaria y filarias. Los laboratorios están investigando anti-patógeno componentes del sistema inmune innato en la especie vector de la enfermedad con la esperanza de la generación de mosquitos transgénicos que son refractarios a los agentes patógenos como 1, 2. El sistema inmune innato de los mosquitos se compone de varias líneas de defensa 3. Patógenos que logran escapar de la barrera impuesta por el mosquito del epitelio del intestino medio-alineado 4 entrar en la hemolinfa y el encuentro hemocitos circulantes, componentes celulares importantes que encapsulan y patógenos engullir 5, 6. Los investigadores no han encontrado pruebas de los tejidos hematopoyéticos en los mosquitos y la evidencia actual sugiere que el número de hemocitos se fija en la emergencia de adultos y los números en realidad puede disminuir a medida que el mosquito 7. La capacidad de recoger e identificar correctamente los hemocitos de los insectos de importancia médica es un paso esencial para los estudios en la inmunidad celular. Sin embargo, el pequeño tamaño de los mosquitos y el limitado volumen de hemolinfa plantean un desafío a la recogida de las células inmunitarias.
Dos métodos establecidos para la recolección de hemocitos mosquitos incluyen la expulsión de la hemolinfa de un corte trompa 8, y el desplazamiento de volumen (perfusión), en el que la solución salina es inyectada en la región necklike membranosa entre la cabeza y el tórax (es decir, el cuello uterino) y la hemolinfa perfundidos recogidos se a partir de una apertura de partido en una región distal del abdomen 9, 10. Estas técnicas, sin embargo, están limitadas por la baja recuperación de los hemocitos y la posible contaminación por las células de grasa corporal, respectivamente 11. Más recientemente, un método conocido como de inyección de alta / recuperación de la recuperación mejorada de inmunocitos por el uso de tampones anticoagulante, mientras que la reducción de los niveles de contaminación de las escalas y los tejidos internos 11. Mientras que el método permite un mejor método de recopilación y mantenimiento de hemocitos para cultivo primario, que conlleva una serie de medidas de inyección y recolección que no son necesarios si el objetivo posterior es recoger, fijar y teñir hemocitos para el diagnóstico. Aquí, demostramos nuestro método de recolección de la hemolinfa de mosquitos que combina la simplicidad de la perfusión, usando tampones anticoagulante en lugar de solución salina, con la precisión de las técnicas de inyección de alta para aislar a los preparativos limpia de hemocitos en los mosquitos Aedes.
Protocolo
1. Preparación antes de la recolección de hemocitos
- Prepare una solución diluyente hemolinfa que consta de Schneider media del 60%, 10% de suero fetal bovino (SFB), y el 30% de tampón citrato (anticoagulante; 98 mM NaOH, 186 mM NaCl, 1,7 mM EDTA, 41 mM de ácido cítrico, pH 4,5) 11. Hacer 1,0 ml alícuotas que se pueden almacenar a -20 ° C. Use cada alícuota de una sola vez (ver Materiales).
- Preparar portaobjetos de vidrio (75 x 25 x 1 mm) al anotar un círculo de 1 cm de diámetro en un extremo con una herramienta de vidrio grabado. Por otra parte, portaobjetos con dos pre-grabado círculos se pueden comprar (por ejemplo, Fisher Scientific o fuentes EMS). Una placa de vidrio por los mosquitos serán necesarios.
- Preparar un conjunto de agujas de vidrio (ver Materiales) tiró de acuerdo con los siguientes valores sugeridos (Sutter Instruments, modelo P-87):
El calor de rampa 5 Tire: 45 Vel: 75 Tiempo: 175 Presión de 580
Utilizando los valores recomendados en este tirador, construimos las agujas que son alrededor de 500 mm de longitud total, con longitudes de caña de unos 3 mm. Pre-retiró las agujas también se pueden comprar (por ejemplo, Tritech de Investigación).
2. Preparación de microinyector antes de la recolección de hemocitos
- Insertar una aguja se detuvo en el porta-agujas microinyector de acuerdo a las instrucciones del fabricante. Rellene el microinyector (ver Materiales) tubo, jeringa y aguja de vidrio tirado con aceite mineral de acuerdo a las instrucciones del fabricante.
3. Preparación de los mosquitos hembra antes de la recolección de hemocitos
- Aspirar 15 hembras adultas en pequeños contenedores jaula sólida que puede estar en contacto con el hielo. Jaula de sumergirse con los mosquitos en el hielo lo suficientemente profundo para que toda la altura de la jaula y todos los lados están en contacto con el hielo. Esto asegurará que todos los mosquitos se exponen al frío.
Fría los mosquitos anestesiar durante unos 8 minutos o hasta que ya no son móviles. - Coloque un mosquito en un portaobjetos de la depresión. Esta diapositiva será el sitio para las inyecciones.
4. Colección de hemocitos
- Establecer el microinyector tomar hasta 12 l de diluyente hemolinfa utilizando una aguja de vidrio tirado e inyectar la solución en el mosquito entre los segmentos abdominales VII y VIII. Alrededor de 3 mosquitos pueden ser inyectados con 3-3,5 l de un total de 12 l de volumen ocupado. El mosquito debe ser agitado en su lugar con una pinza mientras que la inyección se lleva a cabo. Un pequeño volumen de diluyente debe permanecer en la punta de la aguja con el fin de evitar que el aceite mineral de ser inyectada. Después de la inyección en el abdomen debería ser "lleno" o hinchado.
- Lugar inyectado mosquitos en un recipiente limpio por separado en el hielo para recuperar durante 5 min. La incubación de la solución diluyente anticoagulante en el interior del mosquito ayudar a desalojar hemocitos adherirse al tejido interno. El promedio de 3 a 5 mosquitos se inyectan nuevos durante cada período de 5 minutos de recuperación.
- Después de 5 minutos de recuperación, corte con tijeras de las piernas, las alas y la punta del abdomen (en el octavo segmento) de cada uno de los mosquitos de uno en uno con unas tijeras micro. Esto se debe hacer en la copa de recuperación se coloca en hielo. El corte de las patas y las alas reduce la probabilidad de que las escalas que se transfieren a las diapositivas de la colección. Nota: no corte las piernas y las alas muy cerca de los sitios de fijación torácica o corre el riesgo de la creación de otras aberturas de la hemolinfa de escapar. Hemolinfa sólo debe ser recogida a través de la abertura creada en el extremo del abdomen.
- Lavar un portaobjetos de vidrio microscopio grabado con el 70% de etanol y se seca con un Kimwipe. Una posición de inyección y se recuperó de mosquitos en la diapositiva en el borde exterior del círculo grabado. Establecer microinyector para recoger 12 l de diluyente hemolinfa fresca e inyectar este volumen en el mosquito en la parte lateral de su mesotórax. Entregar más, pero no todo el volumen de diluyente (alrededor de 8 a 10 l) con el fin de evitar que el aceite mineral de ser inyectada. Un pequeño volumen de diluyente debe permanecer en la punta de la aguja.
- La posición del mosquito por lo que la apertura abdominal corte en el borde del círculo de 1 cm. Después de la inyección de la hemolinfa diluida debe ser recogida dentro del área marcada. Una vez que se retira la aguja de la inyección mesothoracic, reanudar la celebración de los mosquitos entre las dos ramas de la pinza y apretar suavemente el abdomen con las pinzas para dirigir la hemolinfa en el área del círculo grabado.
- Permitir hemolinfa diluida para secar en la diapositiva durante unos 10 minutos o hasta que esté seco de forma visible.
5. La fijación y la tinción de hemocitos
- Tinción de cada diapositiva por separado con HEMA3 7 (ver Materiales): Dip slide en fijador de 5 veces durante 1 segundo cada vez, Dipslide en la solución de I 3 veces durante 1 segundo cada uno y, por último, inmersión en solución de diapositivas II 3 veces durante 1 segundo cada uno. Enjuague la parte de atrás de la corredera con agua destilada. La parte delantera de la diapositiva no deben enjuagarse. Blot-seca la parte delantera de la diapositiva fuera del círculo que contiene grabados de tejidos teñidos.
- Aplicar medio de montaje (por ejemplo, Shur / Monte o Polymount) alrededor del centro de grabado y colocar un cubreobjetos sobre ella. Presione suavemente hacia abajo en la hoja de la cubierta (25 x 25 mm) para que el montaje se extiende a medio y toda el área cubierta por la hoja de la cubierta (incluyendo círculo grabado que contiene tejido teñido). Permitir que se sequen por un mínimo de 3 horas o toda la noche. Hemocitos debe ser visto dentro de 2 semanas después de la recogida para una visualización óptima y de imagen.
6. Resultados representante
Ejemplos de hemocitos teñidos fijos y HEMA3 recogidos de una hembra de Aedes aegypti adultos se muestran en la Figura 1-C. La figura 1A muestra una hemocitos que hemos identificado como una prohemocyte sobre la base de su pequeño tamaño, esférica y la forma esferoidal de alta nuclear de citoplasma (550x de aumento) 11. La figura 1B muestra una hemocitos clasificado como un oenocytoid en función de su forma esferoidal y el citoplasma alta proporción nuclear (550x aumentos). Por último, la Figura 1C muestra una hemocitos de granulocitos y tipo (550x aumentos). Los granulocitos son más granular en la naturaleza y tienden a ser más ameboides en la forma y el comportamiento, ya que se adhieren a las superficies de vidrio. Utilizando los criterios publicados previamente para la tipificación de hemocitos y la recuperación de 11, nuestro método de recolección de producido el mismo número de hemocitos totales y también encontró que los granulocitos constituyen el mayor porcentaje de hemocitos un total de 11 (Fig. 2).
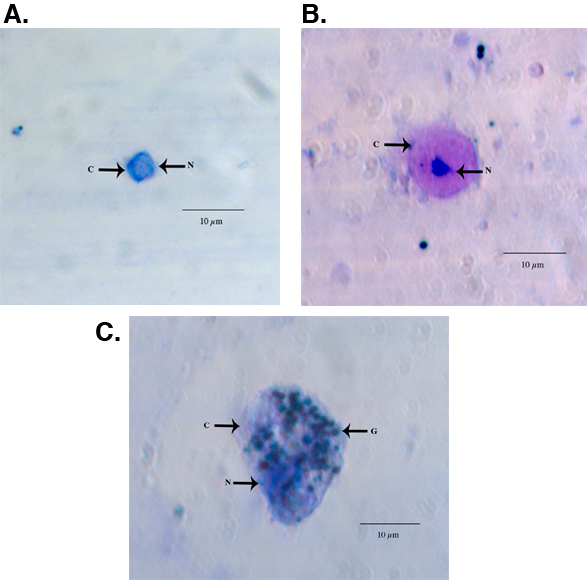
Figura 1. Imágenes de microscopio de luz de un representante HEMA3 prohemocyte fija, manchado (A), oenocytoid (B), y de granulocitos (C) de una Ae. aegypti hembra adulta. C = citoplasma, núcleo N = G = gránulos.
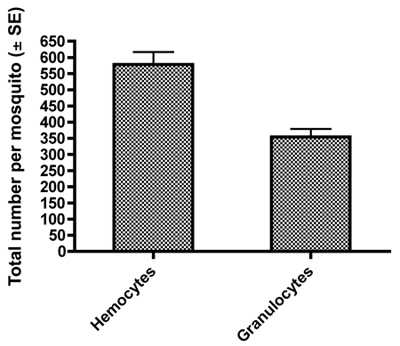
Figura 2. Recuento total ± SE de todos los hemocitos y granulocitos obtenidos por los mosquitos hembra de nuestra dilución de la hemolinfa y el método de recolección.
Discusión
El método de recogida de hemocitos se describe aquí es una modificación de los métodos publicados anteriormente y permite aislar los preparativos limpia de hemocitos de los mosquitos Aedes, con menos pasos. Aunque nuestro interés particular se encuentra en la caracterización de las poblaciones de hemocitos en los mosquitos Aedes, creemos que esta técnica se puede aplicar a los grupos de mosquitos otros después de los ensayos iniciales se llevan a cabo para determinar los volú...
Divulgaciones
Agradecimientos
Los autores desean agradecer a John Frey y Ben Peterson para la cría de mosquitos. También queremos agradecer a Christine Davis y Gary Radice para ayudar con las micrografías hemocitos. Esta investigación fue financiada por la Universidad de Richmond Arte y Ciencia de becas de verano para AA Qayum y la facultad de conceder A. Telang.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
|---|---|---|---|
| Medio de Schneider | Sigma-Aldrich | S0146 | |
| De suero fetal bovino | Sigma-Aldrich | F0643 | |
| Hema3 kit de tinción | Pescador | 123-869 | |
| Agujas de vidrio (Borosilicato con filamento) | Sutter Instrumento | BF100-78-10 | 1.0mm OD y ID 0.78mm |
| Aguja extractor | Sutter Instrumentos | Modelo P-87 | |
| Microinyector | Tritech Investigación | Minj-PD | |
| Porta-agujas | Tritech Investigación | Minj-4 |
Referencias
- Enayati, A., Hemingway, J. Malaria management: past, present, and future. Annu. Rev. Entomol. 55, 569-569 (2010).
- Medlock, J., Luz, P. M., Struchiner, C. J., Galvani, A. P. The impact of transgenic mosquitoes on dengue virulence to humans and mosquitoes. The American Naturalist. 174, 565-565 (2009).
- Baton, L. A., Garver, L., Xi, Z., Dimopoulos, G. Functional genomics studies on the innate immunity of disease vectors. Insect Sci. 15, 15-15 (2008).
- Thomas, R. E., Wu, W. K., Verleye, D., Rai, K. S. Midgut basal lamina thickness and dengue-1 virus dissemination rates in laboratory strains of Aedes albopictus (Diptera: Culicidae). J. Med. Entomol. 30, 326-326 (1993).
- Bartholomay, L. C. Profiling infection responses in the haemocytes of the mosquito, Aedes aegypti. Insect Mol. Biol. 16, 761-761 (2007).
- Strand, M. R. The insect cellular immune response. Insect Sci. 15, 1-1 (2008).
- Hillyer, J. F. Age-associated mortality in immune challenged mosquitoes (Aedes aegypti) correlates with a decrease in haemocyte numbers. Cell. Microbiol. 7, 39-39 (2005).
- Chen, C. C., Laurence, B. R. In vitro study on humoral encapsulation of microfilariae: establishment of technique and description of reaction. International Journal for Parasitology. 17, 781-781 (1987).
- Beerntsen, B. T., Christensen, B. M. Dirofilaria immitis: effects on hemolymph polypeptide synthesis in Aedes aegypti during melanotic encapsulation reactions against Microfilariae. Exp. Parasitol. 71, 406-406 (1990).
- Hillyer, J. F., Schmidt, S. L., Christensen, B. M. The antibacterial innate immune response by the mosquito Aedes aegypti is mediated by hemocytes and independent of Gram type and pathogenicity. Microb. Infect. 6, 448-448 (2004).
- Castillo, J. C., Robertson, A. E., Strand, M. R. Characterization of hemocytes from the mosquitoes Anopheles gambiae and Aedes aegypti. Insect Biochem. Mol. Biol. 36, 891-891 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados