Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Протокол для сбора и окрашивания гемоциты от желтой лихорадки комаров Aedes aegypti
В этой статье
Резюме
Упрощенный еще точный метод для сбора и пятна комаров гемоциты описывается. Наш метод сочетает в себе простоту перфузии с точностью высокотехнологичной техники инъекции, чтобы изолировать чистые препараты гемоциты в Aedes комаров. Этот метод облегчает исследованиях, требующих знания типов гемоцитов и их изобилие.
Аннотация
Комары являются переносчиками для целого ряда болезнетворных патогенов, таких как вирус желтой лихорадки, малярии паразиты и филяриатозных червей. Лаборатории проводят расследование против патогенных компонентов иммунной системы в переносчиками болезней видов в надежде получения трансгенных комаров, которые поддаются таких патогенов 1, 2. Врожденной иммунной системы комаров состоит из нескольких линий защиты 3. Патогенные микроорганизмы, которые удается бежать барьер введенные эпителия картонных комаров кишки 4 введите гемолимфы и сталкиваются с циркулирующим гемоциты, важные клеточные компоненты, которые инкапсулируют и поглотит патогенов 5, 6. Ученые не нашли доказательств кроветворной ткани в комаров и текущие данные свидетельствуют о том, что количество гемоцитов зафиксирована на уровне взрослых возникновение и цифры могут на самом деле падение, как комар возрасте от 7. Умение правильно собрать и идентифицировать гемоциты из медицинской важных насекомых является важным шагом для исследований в клеточный иммунитет. Тем не менее, небольшой размер комаров и ограниченного объема гемолимфы создать проблему для сбора клеток иммунной системы.
Две организованные методы сбора комаров гемоциты включают изгнание из гемолимфы сократить хоботок 8, и объема перемещения (перфузии), в котором солевой вводится в мембранных necklike области между головой и грудной клетки (например, шейки матки) и перфузии гемолимфы собирается из разорванной открытия в дистальной части брюшной полости 9, 10. Эти методы, однако, ограничиваются низкой восстановления гемоцитов и возможного загрязнения жировыми клетками тела, соответственно 11. Совсем недавно метода называют высокий инъекции / восстановления обеспечивают быстрое восстановление иммуноцитов с использованием антикоагулянта буферов при одновременном снижении уровня загрязнения масштабов и внутренних тканей 11. Хотя этот метод позволяет усовершенствованный метод сбора и хранения гемоциты для первичной культуры, оно влечет за собой ряд впрыска и сбора шаги, которые не нужны, если вниз по течению целью является сбор, фиксация и пятно гемоциты для диагностики. Здесь мы демонстрируем наш метод сбора комаров гемолимфы, что сочетает в себе простоту перфузии, используя антикоагулянта буферы вместо физиологического раствора, с точностью высокотехнологичной техники инъекции, чтобы изолировать чистые препараты гемоциты в Aedes комаров.
протокол
1. Подготовка заранее гемоцитов коллекцию
- Приготовьте раствор гемолимфы разбавителя, который состоит из 60% среднего Шнайдер, 10% эмбриональной телячьей сыворотки (FBS), и 30% цитрат буфер (антикоагулянта, 98 мМ NaOH, 186 мМ NaCl, 1,7 мМ EDTA, 41 мМ лимонной кислоты, рН 4,5) 11. Сделать 1,0 мл аликвот, которые могут храниться при температуре -20 ° C. Используйте каждую аликвоту только один раз (см. материалы).
- Подготовка стекла предметные стекла (75 х 25 х 1 мм), забив 1 см в диаметре круг на одном конце использованием стекла травлением инструмент. Кроме того, предметные стекла с двумя предустановленными травления круги могут быть приобретены (например, Fisher Scientific или EMS источников). Один стекло на комаров будет необходимо.
- Подготовка набор стеклянных игл (см. материалы) потянул в соответствии со следующими рекомендуемые настройки (Саттер инструменты, модель P-87):
Тепло Рампа +5 Вытяните: 45 Vel: 75 Время: 175 Давление 580
Использование рекомендуемые настройки на этой съемник, строим иглы, что около 500 мм в длину с хвостовиком длиной около 3 мм. Предварительно вытащил иглы также можно приобрести (например, Tritech исследований).
2. Подготовка microinjector заранее гемоцитов коллекцию
- Вставьте вытащил иглу в держатель иглы microinjector в соответствии с инструкциями производителя. Засыпка microinjector (см. материалы) трубки, шприц и иглу вытащил стекло с минеральным маслом в соответствии с инструкциями производителя.
3. Подготовка самок комаров заранее гемоцитов коллекцию
- Аспирируйте 15 взрослых самок на мелкие твердые контейнеры клетки, которые могут быть в контакте со льдом. Опустите клетку с комарами во льду достаточно глубоко, так что всю высоту клетке, и все стороны находятся в контакте со льдом. Это будет гарантировать, что все комары будут подвергаться воздействию холода.
Холодная комаров анестезию в течение приблизительно 8 минут или пока они больше не являются мобильными. - Разместите один комар на депрессию слайда. На этом слайде будет служить в качестве места для инъекций.
4. Гемоцитов коллекцию
- Установить microinjector занять 12 мкл гемолимфы разбавителя в вытащил стекло иглой и вводят раствор в комара между седьмым и восьмым брюшных сегментов. Около 3 комары могут быть введены с 3-3,5 мкл всего 12 мкл принято. Комаров следует осторожно удерживается на месте с щипцами в то время как инъекции не выполняется. Небольшой объем разбавителя должна оставаться на кончике иглы, чтобы предотвратить нефтепродуктов от инъекции. После инъекции живот должен выглядеть "заполнен" или раздутой.
- Место инъекции комаров в отдельном чистом контейнере со льдом, чтобы восстановить в течение 5 мин. Инкубации антикоагулянта решение разбавителя внутри комаров поможет выбить гемоциты придерживаясь внутренних тканей. В среднем от 3 до 5 свежих комары могут быть введены в течение каждого периода восстановления 5 мин.
- Через 5 минут на восстановление, отрезать ноги, крылья и кончик живота (на восьмом сегменте) каждого комара по одному времени с помощью микро-ножниц. Это должно быть сделано в восстановлении чашку помещают на лед. Отрезание ног и крыльев снижает вероятность весы передаются коллекции слайдов. Примечание: не режут ноги и крылья слишком близко к грудной сайтов вложения или вы рискуете другие отверстия для гемолимфы бежать. Гемолимфы должны быть собраны через отверстие создан на кончике живота.
- Вымойте один стакан травления слайд микроскоп с 70% этанола и высушить его с kimwipe. Первая позиция вводится и выздоровел от комаров скользить по внешнему краю травления круг. Установить microinjector, чтобы забрать 12 мкл разбавителя свежей гемолимфы и ввести этот объем в комара в боковой стороне его среднегруди. Доставить большинство, но не весь объем разбавителя (около 8 - 10 мкл), с тем чтобы предотвратить нефтепродуктов от инъекции. Небольшой объем разбавителя должна оставаться на кончике иглы.
- Позиция комаров таким образом, чтобы сократить брюшной открытие на краю 1 см круг. После инъекции разбавленной гемолимфы должны быть собраны в пределах отмеченной области. Как только игла удаляется из mesothoracic месте инъекции, возобновить проведение комаров между двумя рукавами пинцетом и слегка сжать живот с теми, щипцы, чтобы направить гемолимфы на протравленных площадь круга.
- Разрешить разбавленный гемолимфы сушить на слайде в течение приблизительно 10 минут или пока не будет заметно сухая.
5. Гемоцитов фиксации и окрашивания
- Пятно каждый слайд по отдельности с HEMA3 7 (см. материалы): Dip сLiDE в фиксатор 5 раз в течение 1 секунды каждый раз; Dipslide в решение, которое я 3 раза в течение 1 секунды каждая, и, наконец, окуните в раствор слайд II 3 раза в течение 1 секунды каждое. Промыть задней слайд с водой DI. Перед слайд не должны быть промыты. Пятно сухой перед слайд вне травления круг, содержащий окрашенных тканей.
- Применение установки среды (например, Шур / Mount или Polymount) вокруг центра травления и место покровное стекло на ней. Надавите слегка на покровное стекло (25 х 25 мм), так что монтаж средой распространяется на всей территории, охваченной покровным стеклом (в том числе травление круг, содержащий окрашенные ткани). Разрешить слайды высохнуть в течение не менее 3 часов или на ночь. Гемоциты должны рассматриваться в течение 2 недель после коллекцию для оптимальной визуализации и обработки изображений.
6. Представитель Результаты
Примерами фиксированных и окрашенных HEMA3 гемоциты собраны из женщин Aedes aegypti взрослых, показаны на рис 1A-C. Рисунок 1А показывает гемоцитов, которые мы определили как prohemocyte основан на свои небольшие размеры, сферическая-сфероидальной формы и высоких ядерных в цитоплазму отношение (550x увеличение) 11. На рисунке 1б показывает гемоцитов классифицируется как oenocytoid на основе ее сфероидальной формы и высокой цитоплазмы ядерной отношение (550x увеличение). Наконец, на рисунке показана 1С гранулоцитарного типа гемоцитов (550x увеличение). Гранулоцитов более гранулированный характер и имеют тенденцию быть более амебоидных по форме и поведению они придерживаются стеклянных поверхностей. Использование ранее опубликованных критериев гемоцитов ввода и восстановление 11, наш метод сбора дали такое же количество от общего числа гемоцитов и мы также обнаружили, что гранулоциты составляют большой процент от общего числа гемоциты 11 (рис. 2).
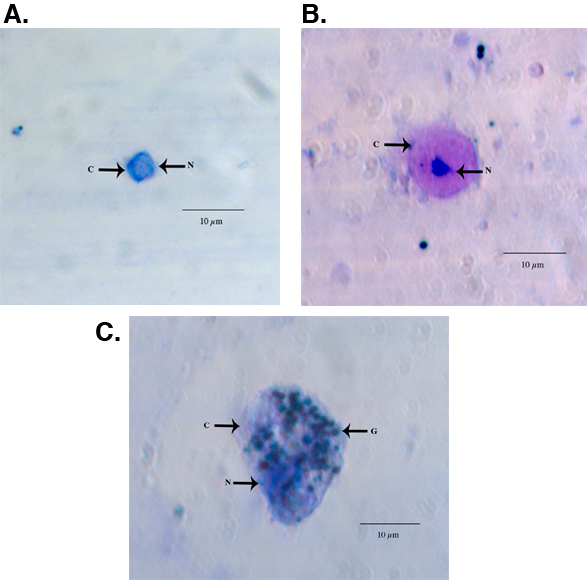
Рисунок 1. Свет изображений микроскопа представитель HEMA3 фиксированных, окрашенных prohemocyte (А), oenocytoid (B), и гранулоцитов (C) от Ae. aegypti взрослой женщины. С = цитоплазму, ядро N = G = гранул.
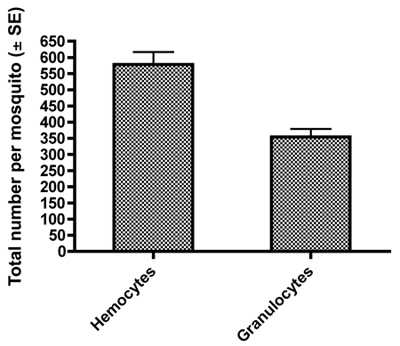
Рисунок 2. Всего насчитывает ± SE всех гемоциты и гранулоцитов получить у одной самки комара от нашего разведения гемолимфы и метод сбора.
Обсуждение
Гемоцитов метод сбора описанные здесь изменяется от ранее опубликованных методов и позволяет изолировать чистую препараты гемоциты от комаров Aedes с меньшим количеством шагов. Хотя наш особый интерес заключается в характеризующие гемоцитов населения в Aedes комаров, мы считае?...
Раскрытие информации
Благодарности
Авторы хотели бы поблагодарить Джона Фрея и Бен Петерсон для москитных воспитания. Мы также благодарим Кристин Дэвис и Гари Radice за помощь в гемоцитов микрофотографии. Это исследование было профинансировано из Университета Ричмонда искусств и наук летом стипендии А. А. Каюм и преподавателей предоставить А. Telang.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии (необязательно) |
|---|---|---|---|
| Шнайдера среднего | Sigma-Aldrich | S0146 | |
| Фетальной телячьей сыворотки | Sigma-Aldrich | F0643 | |
| Hema3 пятно комплект | Рыболов | 123-869 | |
| Стекло иглы (Боросиликатного с нитью) | Саттер Инструмент | BF100-78-10 | 1,0 мм и диаметром 0.78mm ID |
| Иглы съемник | Саттер инструменты | Модель P-87 | |
| MicroInjector | Tritech исследований | MINJ-ПД | |
| Иглодержатель | Tritech исследований | MINJ-4 |
Ссылки
- Enayati, A., Hemingway, J. Malaria management: past, present, and future. Annu. Rev. Entomol. 55, 569-569 (2010).
- Medlock, J., Luz, P. M., Struchiner, C. J., Galvani, A. P. The impact of transgenic mosquitoes on dengue virulence to humans and mosquitoes. The American Naturalist. 174, 565-565 (2009).
- Baton, L. A., Garver, L., Xi, Z., Dimopoulos, G. Functional genomics studies on the innate immunity of disease vectors. Insect Sci. 15, 15-15 (2008).
- Thomas, R. E., Wu, W. K., Verleye, D., Rai, K. S. Midgut basal lamina thickness and dengue-1 virus dissemination rates in laboratory strains of Aedes albopictus (Diptera: Culicidae). J. Med. Entomol. 30, 326-326 (1993).
- Bartholomay, L. C. Profiling infection responses in the haemocytes of the mosquito, Aedes aegypti. Insect Mol. Biol. 16, 761-761 (2007).
- Strand, M. R. The insect cellular immune response. Insect Sci. 15, 1-1 (2008).
- Hillyer, J. F. Age-associated mortality in immune challenged mosquitoes (Aedes aegypti) correlates with a decrease in haemocyte numbers. Cell. Microbiol. 7, 39-39 (2005).
- Chen, C. C., Laurence, B. R. In vitro study on humoral encapsulation of microfilariae: establishment of technique and description of reaction. International Journal for Parasitology. 17, 781-781 (1987).
- Beerntsen, B. T., Christensen, B. M. Dirofilaria immitis: effects on hemolymph polypeptide synthesis in Aedes aegypti during melanotic encapsulation reactions against Microfilariae. Exp. Parasitol. 71, 406-406 (1990).
- Hillyer, J. F., Schmidt, S. L., Christensen, B. M. The antibacterial innate immune response by the mosquito Aedes aegypti is mediated by hemocytes and independent of Gram type and pathogenicity. Microb. Infect. 6, 448-448 (2004).
- Castillo, J. C., Robertson, A. E., Strand, M. R. Characterization of hemocytes from the mosquitoes Anopheles gambiae and Aedes aegypti. Insect Biochem. Mol. Biol. 36, 891-891 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены