JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
옐로 피버 모스키토에서 Hemocytes를 수집 및 스테 이닝을위한 프로토콜 Aedes aegypti
요약
A는 설명 모기 hemocytes를 수집하고 얼룩 아직 정확한 방법을 단순화. 우리의 방법은 Aedes 모기에 hemocytes의 깨끗한 준비를 분리 높은 사출 기술의 정확성과 재관류의 단순 결합. 이 방법은 연구가 필요한 hemocytes의 유형에 대한 지식과 풍부한을 용이하게합니다.
초록
모기는 황열병 바이러스, 말라리아 기생충 및 filarial 웜과 같은 질병을 유발 병원균의 번호를 벡터입니다. 실험실은 병원균 1, 2 내화물 아르 유전자 변형 모기를 생성하는 희망에서 질병 벡터 수종에 본래 면역 시스템의 백신 병원체 구성 요소를 조사하고 있습니다. 모기의 타고난 면역 시스템은 방어 3 몇 가지 라인으로 구성되어 있습니다. 상피 - 줄지어 모기 midgut 사에 의해 부과된 장벽을 탈출하기 위해 관리 병원균은 hemolymph를 입력 순환 hemocytes, 캡슐 중요한 세포 구성 요소와 삼켜의 병원균 5, 6을 발생합니다. 연구팀은 모기의 조혈 조직에 대한 증거를 발견하지 않은 현재의 증거는 hemocytes의 숫자가 성인 출현에 고정하고 숫자가 실제로 모기 세 7로 거부할 수있는 제안합니다. 제대로 수집하고 의료 중요한 곤충의 hemocytes를 식별하는 능력은 세포 면역의 연구에 필수적인 단계입니다. 그러나, 모기의 작은 크기와 hemolymph의 제한된 볼륨 면역 세포를 수집하는 도전을 제기.
모기 hemocytes를 수집하기 위해 두 설립 방법은 상처 코 8 hemolymph의 추방, 그리고 호수가 머리와 흉부 (즉, 자궁 경부)와 perfused hemolymph가 수집되는 사이 막의 necklike 영역으로 주입되는 볼륨 변위 (재관류)를 포함 복부 9, 10의 말초 지역의 찢어진 오프닝에서. 이러한 기술은, 그러나, hemocytes의 낮은 복구 및 각각 11 지방 신체 세포에 의해 오염 가능성에 의해 제한됩니다. 오염 저울 및 내부 조직 11 레벨을 감소하면서 최근에는 방법이 항응고제 버퍼의 사용에 의해 immunocytes 높은 주입 / 복구 개선 복구이라고도합니다. 그 방법이 기본 문화 hemocytes를 수집 및 유지 관리의 개선 방법에 대한 수 있지만, 그것은 주사와 하류 목표가 진단에 대한 hemocytes를 수집, 수정하고 얼룩이있다면 필요하지 않습니다 수집 단계의 숫자를 알아볼 수 있습니다. 여기, 우리는 Aedes 모기에 hemocytes의 깨끗한 준비를 분리 높은 사출 기술의 정확성과 생리 식염수 대신에 항응고제 버퍼를 사용하여 재관류의 단순 결합 모기 hemolymph를 수집하는 우리의 방법을 보여줍니다.
프로토콜
1. hemocyte 컬렉션 사전에 준비
- (; 98 MM NaOH, 186 MM NaCl, 1.7 MM EDTA (에틸렌 다이아 민 테트라 초산), 41 MM 구연산 산성, pH를 4.5 항응고제) 60% 슈나이더의 중간 10 % 태아 소 혈청 (FBS) 및 30 % 구연 산염 버퍼의 구성된 hemolymph의 희석제 솔루션을 준비 11. -20 ° C.에 저장할 수 있습니다 1.0 ML aliquots 만들기 (자료 참조) 한 번만 각 나누어지는을 사용합니다.
- 유리 에칭 도구를 사용하여 한쪽 끝에 1cm 직경의 원을 채점하여 유리 현미경 슬라이드 (75 X 25 X 1mm)를 준비합니다. 또는 두 사전 에칭 원을과 현미경 슬라이드 (예 : 피셔 과학 또는 EMS 소스) 구입할 수 있습니다. 모기 당 하나의 유리 슬라이드가 필요합니다.
- 유리 바늘 세트를 (자료 참조) 준비는 다음과 같은 제안 설정 (셔터 인 스트 루먼트, 모델 P - 87)에 따라 가져온 :
열 램프 5 당기 : 45 벨 : 75 시간 : 175 압력 580
이 풀러의 제안 설정을 사용하여, 우리는 약 3mm의 생크 길이와 전체 길이 500mm 주위 바늘을 구축. 미리 뽑아 바늘도 (예 : Tritech 연구) 구입할 수 있습니다.
2. hemocyte 컬렉션 사전에 microinjector의 준비
- 제조 업체의 지침에 따라 microinjector 니들 홀더에 뽑아 바늘을 삽입합니다. Backfill는 microinjector (자료 참조) 튜브, 주사기 및 제조 업체의 지침에 따라 광유와 유리 바늘을 뽑아.
3. hemocyte 컬렉션 사전에 여성 모기의 준비
- 얼음과 접촉 수있는 작은 고체 케이지 용기에 15 성인 여성을 대기음. 깊은만큼 얼음에 모기와 함께 젖어 케이지는 케이지 모든 측면의 전체 높이 때문에 얼음과 접촉하고 있습니다. 이것은 모든 모기가 추위에 노출 될 수 있도록합니다.
약 8 분 또는 때까지 차가운 마취의 모기들은 더 이상 이동되지 않습니다. - 우울증 슬라이드에 한 모기를 놓습니다. 이 슬라이드는 주사에 대한 사이트로 될 것입니다.
4. Hemocyte 모음
- 가져온 유리 바늘로 hemolymph의 희석제 12 μl를 타고 일곱 번째와 여덟째 복부 세그먼트 사이 모기에 솔루션을 주입하는 microinjector을 설정합니다. 약 3 모기가 차지하는 총 12 μl 볼륨 3-3.5 μl로 주입 수 있습니다. 주입이 수행되는 동안 모기는 부드럽게 포셉와 장소에서 개최한다. 희석액의 작은 볼륨 주입되는 미네랄 오일을 방지하기 위해있는만큼 바늘의 끝에 유지됩니다. 주사 후 복부는 "가득"또는 부풀어 보일 것입니다.
- 장소는 5 분 복구 얼음에 별도의 깨끗한 용기에 모기를 주입했다. 모기 내부 항응고제 희석제 솔루션의 부화는 내부 조직을 준수 hemocytes을 이동시키다 도움이 될 것입니다. 평균 3-5 신선한 모기는 각 5 분 복구 기간 동안 주입 수 있습니다.
- 복구, 다리에서, 싹둑, 날개, 그리고 마이크로 가위를 사용하여 한 번에 하나씩 각 모기 하나의 복부 (여덟째 세그먼트에서)의 팁 5 분 후에. 이것은 얼음에 게재 복구 컵에서 수행되어야합니다. 다리와 날개를 잘랐다 수집 슬라이드로 전송되는 저울의 가능성을 줄여줍니다. 참고 : 다리를 자르고 날개도 흉부 첨부 파일 사이트에 가까이 또는 hemolymph 탈출하기 위해 다른 구멍을 만드는 위험하지 않습니다. Hemolymph은 복부의 끝에 만들어진 구멍을 통해 수집해야합니다.
- 70 % 에탄올 한 유리 에칭 현미경 슬라이드를 세척하고 kimwipe로 건조. 위치 하나는 에칭 원의 바깥쪽 가장자리에 슬라이드에 모기를 주입하고 복구. 신선한 hemolymph의 희석제 12 μl를 데리러와 mesothorax의 측면 측면에서 모기에이 볼륨을 삽입하는 microinjector을 설정합니다. 주입되는 미네랄 오일을 방지하기 위해만큼 - 희석제의가 아닌 전체 볼륨 (10 μl 약 8) 가장 전달하지만. 희석액의 작은 볼륨 바늘의 끝에 유지됩니다.
- 절단 복부 자리가 1cm의 원형의 가장자리에 있습니다 있도록 모기를 놓습니다. 주사 후 희석 hemolymph가 표시된 지역 수집해야합니다. 바늘이 mesothoracic 주사 사이트에서 제거되면, 포셉의 두 팔 사이에 모기를 들고 다시 부드럽게 에칭 서클 지역에 hemolymph 직접 이러한 포셉와 복부를 당겨요.
- 희석 hemolymph은 10 분 정도하거나 가시 건조까지 슬라이드에 건조하도록 허용합니다.
5. Hemocyte 고정 및 염색법
- 딥 S : HEMA3 7 (자료 참조)와 별도로 각 슬라이드를 얼룩때마다 일초에 대한 정착액 5 회에 라이드, 각 일초과, 마지막으로, 솔루션 II에서 수영을 슬라이드 3 번, 나는 각각의 일초 3 시간이 솔루션 Dipslide. DI 워터 슬라이드의 뒷면을 씻어. 슬라이드의 앞에는 씻어서해서는 안됩니다. 스테인드 조직을 포함하는 에칭 동그라미 밖 슬라이드의 전면을 가릴 건조.
- 에칭 중심 주위를 장착 매체 (예 : Shur / 마운트 또는 Polymount)를 적용하고 그 위에 덮개 용지를 넣으십시오. 그래서 커버 슬립 (25 X 25mm)로 가볍게 눌러되는 커버 슬립 (스테인드 조직을 포함하는 에칭 동그라미 포함)이 적용되는 전체 영역에 장착 매체 확산. 슬라이드 3 시간 또는 밤새 최소 건조하실 수 있습니다. Hemocytes는 최적의 시각화 및 이미징에 대한 수집 다음과 같은 이주 내에 볼 수 있습니다.
6. 대표 결과
Aedes aegypti 성인 여성에서 수집한 고정 및 HEMA3 스테인드 hemocytes의 예 그림 1A - C에 표시됩니다. 그림 1A 우리가 세포질 비율 (550x 배율) 11 핵 작은 크기, 구형 - 회전 타원체의 형태와 높이에 따라 prohemocyte로 식별되는 hemocyte를 보여줍니다. 그림 1B는 핵 비율 (550x 배율)하기 위해 회전 타원체의 형상과 높은 세포질에 따라 oenocytoid로 분류 hemocyte를 보여줍니다. 마지막으로, 그림 1C는 과립 타입 hemocyte (550x 배율)를 보여줍니다. Granulocytes 자연에 더 세분화하고 그들이 유리 표면을 준수 같은 모양과 행동에 더 amoeboid 경향이 있습니다. hemocyte 입력 및 복구 11 이전에 게시된 기준을 사용하여, 우리의 수집 방법은 총 hemocytes의 비슷한 번호를 굴복 우리는 마찬가지로 granulocytes 총 hemocytes의 가장 큰 비율 11 (그림 2) 메이크업 것으로 나타났습니다.
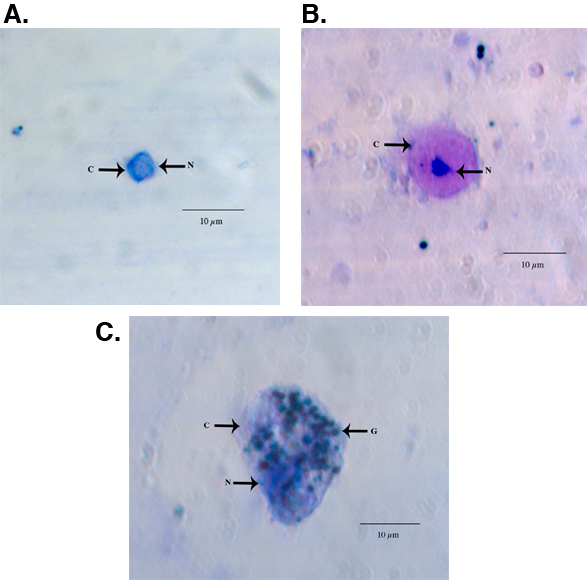
그림 1. 대표 HEMA3 고정, 스테인드 prohemocyte의 빛 현미경 이미지 (A), oenocytoid (B), 그리고 애의 과립 (C). aegypti 성인 여성. C = 세포질, 핵 N = G = 과립.
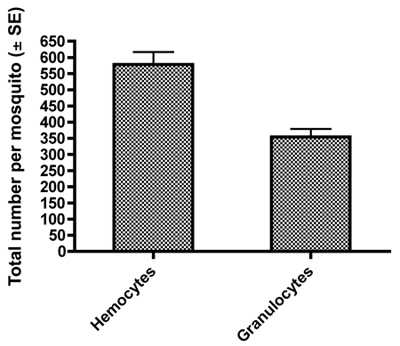
그림 2. 총 카운트 ± 저희 hemolymph 희석 및 수집 방법으로 여성 모기 당 얻은 모든 hemocytes와 granulocytes의 SE.
토론
hemocyte 수집 방법은 이전에 게시 방법에서 수정 한 적은 수의 단계를 Aedes 모기에서 hemocytes의 깨끗한 준비를 분리 수있다 여기에서 설명한. 우리의 특별한 관심 Aedes 모기에 hemocyte 인구 특성화에 자리잡고 있지만, 우리는 초기 실험이 적절한 사출 볼륨을 결정하기 위해 실시 후이 기법은 다른 모기 그룹에 적용할 수 믿습니다. 우리 프로토콜은 생리 식염수 대신 항응고제 버퍼를 사용?...
공개
감사의 말
저자는 모기가 양육을 위해 존 프라이와 벤 피터슨 감사하고 싶습니다. 우리는 또한 hemocyte micrographs와 관련하여 도움이 크리스틴 데이비스와 게리 Radice 감사드립니다. 이 연구는 리치몬드 예술 & AA Qayum와 A. Telang에 교수 부여하는 과학 여름 교제 대학에 의해 투자되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 (옵션) |
|---|---|---|---|
| 슈나이더의 중간 | 시그마 - 알드리치 | S0146 | |
| 태아 소 혈청 | 시그마 - 알드리치 | F0643 | |
| Hema3 얼룩 키트 | 어부 | 123-869 | |
| 유리 바늘 (필라멘트와 borosilicate) | 서터 악기 | BF100 - 78-10 | 1.0mm OD 및 0.78mm ID |
| 니들 풀러 | 서터 인 스트 루먼트 | 모델 P - 87 | |
| MicroInjector | Tritech 연구 | MINJ - PD | |
| 니들 홀더 | Tritech 연구 | MINJ - 4 |
참고문헌
- Enayati, A., Hemingway, J. Malaria management: past, present, and future. Annu. Rev. Entomol. 55, 569-569 (2010).
- Medlock, J., Luz, P. M., Struchiner, C. J., Galvani, A. P. The impact of transgenic mosquitoes on dengue virulence to humans and mosquitoes. The American Naturalist. 174, 565-565 (2009).
- Baton, L. A., Garver, L., Xi, Z., Dimopoulos, G. Functional genomics studies on the innate immunity of disease vectors. Insect Sci. 15, 15-15 (2008).
- Thomas, R. E., Wu, W. K., Verleye, D., Rai, K. S. Midgut basal lamina thickness and dengue-1 virus dissemination rates in laboratory strains of Aedes albopictus (Diptera: Culicidae). J. Med. Entomol. 30, 326-326 (1993).
- Bartholomay, L. C. Profiling infection responses in the haemocytes of the mosquito, Aedes aegypti. Insect Mol. Biol. 16, 761-761 (2007).
- Strand, M. R. The insect cellular immune response. Insect Sci. 15, 1-1 (2008).
- Hillyer, J. F. Age-associated mortality in immune challenged mosquitoes (Aedes aegypti) correlates with a decrease in haemocyte numbers. Cell. Microbiol. 7, 39-39 (2005).
- Chen, C. C., Laurence, B. R. In vitro study on humoral encapsulation of microfilariae: establishment of technique and description of reaction. International Journal for Parasitology. 17, 781-781 (1987).
- Beerntsen, B. T., Christensen, B. M. Dirofilaria immitis: effects on hemolymph polypeptide synthesis in Aedes aegypti during melanotic encapsulation reactions against Microfilariae. Exp. Parasitol. 71, 406-406 (1990).
- Hillyer, J. F., Schmidt, S. L., Christensen, B. M. The antibacterial innate immune response by the mosquito Aedes aegypti is mediated by hemocytes and independent of Gram type and pathogenicity. Microb. Infect. 6, 448-448 (2004).
- Castillo, J. C., Robertson, A. E., Strand, M. R. Characterization of hemocytes from the mosquitoes Anopheles gambiae and Aedes aegypti. Insect Biochem. Mol. Biol. 36, 891-891 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유