Method Article
La introducción de la tensión de cizallamiento en el Estudio de la adhesión bacteriana
En este artículo
Resumen
Durante el proceso de infección, un paso clave es la adhesión de los patógenos con las células huésped. En la mayoría de los casos este paso la adhesión se produce en presencia de la tensión mecánica generada por el flujo de líquidos. Se describe una técnica que presenta el esfuerzo cortante como un parámetro importante en el estudio de la adhesión bacteriana.
Resumen
Durante las infecciones bacterianas de una secuencia de interacciones se producen entre el patógeno y su huésped. La adhesión bacteriana a la superficie de la célula huésped es a menudo el paso inicial y determinante de la patogénesis. Aunque experimentalmente adherencia es en su mayoría estudiaron en condiciones estáticas de adhesión en realidad se lleva a cabo en presencia de flujo de líquido. Los primeros encuentros entre la bacteria y su huésped a menudo se producen a nivel de mucosas, boca, pulmones, intestinos, ojos, etc, donde el moco fluye a lo largo de la superficie de las células epiteliales. Después de la infección, los patógenos en ocasiones acceder a la circulación de la sangre que causan enfermedades graves como sepsis septicemia y meningitis. Un rasgo característico de estas infecciones es la capacidad de estos patógenos para interactuar con las células endoteliales en presencia de la sangre circulante. La presencia de flujo de líquido, moco o sangre, por ejemplo, determina la adhesión, ya que genera una fuerza mecánica sobre el patógeno. Para caracterizar el efecto del flujo de un líquido por lo general se refiere a la noción de esfuerzo cortante, que es la fuerza tangencial ejercida por unidad de superficie por un fluido en movimiento cerca de una pared fija, expresada en dinas / cm 2. Intensidades de esfuerzo cortante varían mucho según el tipo de embarcaciones diferentes, el tamaño, el órgano, ubicación, etc (000 a 100 dinas / cm 2). La circulación en los capilares puede alcanzar valores de corte muy bajo estrés e incluso detener temporalmente durante los períodos que oscilan entre unos pocos segundos hasta varios minutos 1. En el otro extremo del espectro de la tensión de corte en las arteriolas pueden alcanzar los 100 dinas / cm 2 2. El impacto de la tensión de corte en diferentes procesos biológicos se ha demostrado claramente, como por ejemplo durante la interacción de los leucocitos con el endotelio 3. Para tener en cuenta este parámetro mecánico en el proceso de adhesión bacteriana que se aprovechó de un procedimiento experimental basado en el uso de un flujo de 4 cámaras desechables. Las células hospedadoras se cultivan en la cámara de flujo y bacterias fluorescentes se introducen en el flujo controlado por una bomba de jeringa. Inicialmente se centró nuestras investigaciones sobre la bacteria patógena Neisseria meningitidis, una bacteria Gram-negativo responsable de la septicemia y la meningitis. El procedimiento descrito aquí nos ha permitido estudiar el impacto del esfuerzo cortante en la capacidad de las bacterias a: adherirse a las células 1, que proliferan en la superficie celular y 5 para separar a colonizar nuevos sitios 6 (Figura 1). Información técnica complementaria se puede consultar la referencia 7. Los valores de esfuerzo de corte presentados aquí fueron elegidos en base a nuestra experiencia previa y una para representar los valores encontrados en la literatura. El protocolo debe ser aplicable a una amplia gama de agentes patógenos con ajustes específicos en función de los objetivos del estudio.
Protocolo
1. Célula huésped humana y un cultivo bacteriano
- HUVECs la cultura entre el paso 1 y 9 a 37 ° en una incubadora humidificada con un 5% (v / v) de CO 2. El paso de las células cuando se acercan a 80% de confluencia con tripsina / EDTA para proporcionar el mantenimiento de las culturas 75 frascos de cultivo de 2 cm y cultivos experimentales en cámaras de flujo desechables (μ-Slides VI).
- Retirar medio de los frascos que pases, se lavan las células con 10 ml de PBS, retirar y reemplazar con 1,5 ml de tripsina / EDTA. Permitir que las células de separar en un cultivo celular incubadora durante 5 minutos a 37 ° C.
- Recoger las células con 10 ml de medio de cultivo celular en un tubo de 15 ml de colección. Que sedimenten las células con una centrifugación de 5 minutos (a 200 g), a temperatura ambiente. Suspender las células en 4 ml de Endo-SFM complementado con un 10% (v / v) de SFB y contar con ellos en una cámara de Malassez, de acuerdo con las instrucciones del fabricante.
- Introducir 30 l de una 1x10 6 células HUVEC por ml de suspensión en el canal (3x10 4 en total) y permitir que las células se adhieran durante 3 horas a 37 º en un incubador humidificado con una atmósfera de 5% (v / v) de CO 2. Añadir un volumen adicional de 120 l de Endo-SFM para llenar los pozos. Las células deben formar una monocapa subconfluentes (Figura 2).
- Crecer N. meningitidis que expresan GFP (en este caso la cepa 8013 GFP expresa bajo el control de un promotor de IPTG-inducible), en placas de agar GCB suplementos que contienen Kellogg y 5 mg / ml de cloranfenicol a 37 ° C en una atmósfera húmeda con 5% (v / v) de CO 2 durante 16 horas.
2. Adhesión inicial de las bacterias individuales a las células huésped
- Ajustar la concentración de bacterias cultivadas en placas de agar GCB a un OD 600 de 0,05 con pre-calentado Endo-SFM contiene un 10% (v / v) de SFB y se incuba durante 120 minutos a 37 ° C en una atmósfera húmeda con 5% (v / v) de CO 2, bajo agitación suave (130 rpm). Inducir la expresión de GFP mediante la adición de 1 mM IPTG al medio de cultivo para el período de incubación.
- Coloque el desechables μ-Slide en el escenario de un microscopio invertido equipado con una plataforma de calefacción para mantener la temperatura de la muestra a 37 ° C.
- Vierta precalentado Endo-SFM suplementado con 2% (v / v) FBS en un vaso de vidrio estéril y llene una jeringa estéril de 50 ml con este medio. Coloque la "entrada" tubo a la jeringa y llenar con la introducción de mediano plazo.
- Conecte la "entrada" tubo a la μ-Slide, con cuidado, con el fin de evitar la introducción de aire en la cámara. Luego, colocar la "salida" del tubo al otro extremo y con mucho cuidado rellenar el canal con un medio de distancia de aproximadamente 1 cm de la cámara de "salida".
- Medir el OD600 bacteriana y ajustarse a las 0.15 en Endo-SFM contiene un 2% (v / v) de SFB. Con el fin de observar las bacterias individuales, los agregados deben ser interrumpidos por agitación vigorosa de la muestra bacteriana.
- Colocar 100 l de Endo-SFM suplementado con 2% (v / v) FBS medio en el depósito y añadir 100 ml de la solución bacteriana tomado de la parte superior de la solución de vortex para evitar cualquier toma de muestras de agregados de bacterias restantes.
- Con cuidado introducir el volumen de 200 l en la μ-Slide girando la llave de paso para inyectar las bacterias en la cámara.
- Introducir Endo-SFM contiene un 2% (v / v) de SFB, mantiene a 37 ° C con la plataforma de calefacción, en la cámara utilizando una bomba de jeringa con una tensión de corte compatible con la adhesión de 0.044 dinas / cm 2 durante 15 minutos.
Véase, por vídeo o un gráfico 3 ejemplo. Después de este paso, ya sea ir a las secciones 3, 4 o 6.
3. La cuantificación de la adhesión inicial de las bacterias individuales a las células huésped
- Después de la adhesión inicial de 15 minutos, obtener imágenes de los diez campos al azar, mientras que el líquido esté todavía en circulación.
- Analizar las imágenes obtenidas mediante el software ImageJ 8, con el fin de acceder a la media del número de bacterias adherant por campo. Esto se hace de la siguiente manera: en primer lugar, cada imagen es un umbral a través del "umbral" de la ventana se encuentra en el menú "Imagen" para poner de relieve la adhesión individuales bacterias fluorescentes, y reducir al mínimo el fondo de las celdas. Entonces, cada bacteria individual sea contado, utilizando el plug-in "contador de células" ( http://rsb.info.nih.gov/ij/plugins/cell-counter.html ). Los datos de cada imagen se presentan en una hoja de cálculo Excel y se promedian para cuantificar el número medio de bacterias adheridas por campo.
4. La medición de la resistencia al flujo de las bacterias individuales adheridas a las células huésped
- Programa de la jeringa de la bomba puesta en marcha para generar la tensión de corte que van desde 3 hasta 100 dinas / cm 2 durante 5 minutos.
- Al final de los 5 minutos, adquirir diez campos elegidos al azar como se describe en el paso 3.1, pero con el flujo se detuvo prior a la adquisición.
- Analizar las imágenes obtenidas como se describe en el paso 3.2 y cuantificar el número medio de bacterias que permanecen en cada campo.
5. Medir el crecimiento de una bacteria aislada a un adherente microcolonia
- Introducir Endo-SFM contiene un 10% (v / v) de SFB, mantiene a 37 ° C con la plataforma de calefacción, en la cámara utilizando una bomba de jeringa con la tensión de corte elegido por varias horas. Graba imágenes de microscopía de vídeo en tiempo real en un marco cada 5 minutos.
- Después de la microscopía de vídeo, detener el esfuerzo cortante al desactivar la bomba de jeringa, adquirir imágenes adicionales y 2-3 y luego se detiene la secuencia de adquisición de imágenes en el software. Un ejemplo de la proliferación bacteriana se puede ver en el vídeo 2.
6. La medición de la resistencia al flujo de adherentes microcolonias bacterianas
- Después de la formación de microcolonias grandes en la superficie celular (step5.2) 2-3 adquirir imágenes de las dos células (por contraste de fase) y bacterias (por las buenas prácticas agrarias de fluorescencia) antes de la aplicación de flujo. Para el resto del experimento, el protocolo de adquisición del monitor sólo la fluorescencia.
- La aplicación de esfuerzo cortante alto por 5 minutos (300 a 100 dinas / cm 2) y grabar imágenes en un marco cada 5 segundos.
- Detener el esfuerzo cortante al desactivar la bomba de jeringa, adquirir imágenes adicionales y 2-3 y luego se detiene la secuencia de adquisición de imágenes en el software.
- A continuación, retire la "salida" tubo de primera y con cuidado, para evitar el vaciado del canal y luego añadir pre-calentado medio fresco para llenar los pozos antes de retirar la "entrada" la tubería.
- Para valorar el efecto del esfuerzo cortante en la resistencia bacteriana, un ensayo de recubrimiento puede llevarse a cabo de la siguiente manera: recoger el medio restante y se lava la μ-Slide dos veces con 120 l de PBS, que elimina el medio restante de la canal (ambas coladas se ) también recogió.
- Separar las células infectadas con la adición de 50 l de tripsina / EDTA durante 5 minutos a 37 ° y mezclar esta muestra individual con la suspensión recogidos en el paso anterior.
- Realizar diluciones seriadas en PBS y la placa de una fracción de 10 l en placas de agar GCB, por triplicado, con el fin de determinar el número de unidades formadoras de colonias (UFC) al día siguiente, después de la incubación de las placas a 37 ° C en una incubadora con 5% (v / v) de CO 2.
Videos 3 y 4 comparan la cepa de tipo salvaje con el mutante pilV.
7. Desprendimiento de microcolonias bacterianas
- Infectar a las células en la cámara de flujo repitiendo los pasos 2.1 a 2.8 y permitir que la infección siga por 30 minutos.
- Eliminar las bacterias desatado por el aumento del flujo a 10 dinas / cm 2 para un período de 2 minutos y dejar que continúe la infección durante 2 horas.
- Reducir el flujo a 0,15 dinas / cm 2.
- Cada hora, se recoge una gota de medio de salir de la cámara de flujo.
- Realizar diluciones seriadas de las muestras y la placa que en placas de agar GCB.
- Determinar el número de unidades formadoras de colonias (UFC) al día siguiente, después de la incubación de las placas a 37 ° C en una incubadora con 5% (v / v) de CO 2.
8. Los resultados representativos
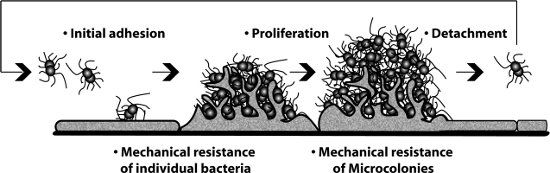
Figura 1: Las diferentes etapas de una monocapa celular que puede ser observado y medido en la presencia de flujo en el procedimiento.
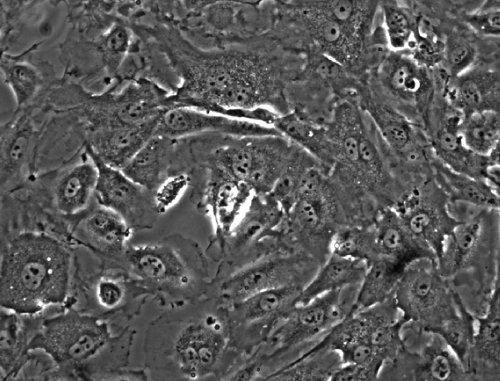
Figura 2: monocapa de células endoteliales en la cámara de flujo en el inicio de un experimento (ausencia de tensión de corte). Alrededor del 50 por las células endoteliales se organizan en una sola capa sub-confluentes.
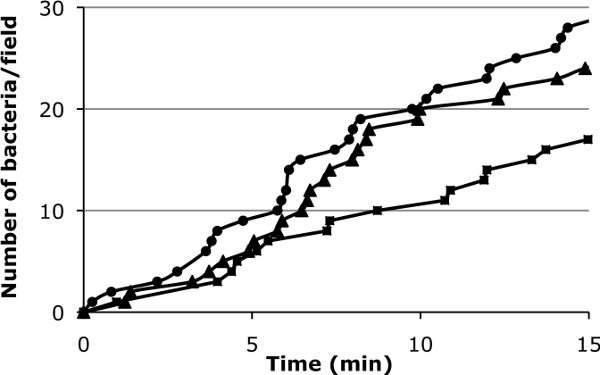
Figura 3: Representación gráfica de la adhesión inicial de bacterias en la superficie celular. Los valores de tres campos están indicados para dar una idea de la variación del campo a campo que se espera (0044 dinas / cm 2).
Video 1. Visualización de la adhesión inicial de bacterias en la monocapa celular en función del tiempo (0044 dinas / cm 2). GFP-expresando bacterias están siguiendo la dirección del medio que fluye. La película se acelera 60 veces, la duración real del video es de 10 minutos.
Haga clic aquí para ver el vídeo.
Video 2. Después de las bacterias adhesión inicial se les permitió a proliferar en la superficie celular por un período de 7 horas (acelerada 1000 veces).
Haga clic aquí para ver el vídeo.
Video 3. Después de la proliferación en la superficie celular de la mecánicaresistencia al de microcolonias fue probado por el aumento del nivel de estrés de corte a 10 dinas / cm 2 durante 5 minutos, pero microcolonias de tipo salvaje son resistentes acelerado de 60 veces.
Haga clic aquí para ver el vídeo.
Microcolonias de vídeo 4. Formados por el mutante pilV se ven afectados por aumentar el flujo (10 dinas / cm 2). Este mutante no puede inducir a la remodelación de la membrana plasmática en microcolonias y por lo tanto más altamente sensibles al aumento del estrés de corte (video se acelera 60 veces) 5.
Haga clic aquí para ver el vídeo.
Discusión
La importancia del esfuerzo de corte y en general de los aspectos mecánicos en la biología es cada vez más reconocida. Por ejemplo, las propiedades altamente adaptados adhesiva de la familia de las selectinas de las proteínas en el proceso de adhesión de linfocitos y rodar sobre la pared vascular ha sido reconocida por la introducción de esfuerzo cortante en el proceso. El procedimiento descrito anteriormente se aplicó a las bacterias Gram-negativas Neisseria meningitidis, pero debe ser aplicable a una amplia gama de agentes patógenos. La importancia del esfuerzo de corte se ha demostrado también por otros agentes patógenos y otros sitios de infección. La adhesión bacteriana condicionada por el esfuerzo cortante ha sido descrito por el estudio de la adhesina FimH encuentra en uropatógena Escherichia coli (UPEC) 9. Similar a las selectinas, la interacción entre FimH y su receptor de la célula huésped se demostró que era reforzada por corte inducido por fuerzas mecánicas 9 y la adhesina de E. coli enterotoxigénica de CFAE ha informado también a la mediación de la adhesión a células epiteliales intestinales a través de un corte que dependen de mecanismo 10. Nos informó, a través del protocolo de cámara de flujo laminar ensayo descrito en este capítulo que Streptococcus agalactiae pili eran esenciales para el cumplimiento de este patógeno a las células epiteliales en condiciones de flujo 11. Estos estudios confirman que nuestro ensayo cámara de flujo es una herramienta útil para la investigación de la célula huésped-patógeno interacciones en condiciones de esfuerzo cortante.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer a Emilie Mairey y Donnadieu Emmanuel para la instalación inicial del procedimiento.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
| μ-Slide VI 0.4 kit de flujo | Ibidi | 80606 | |
| Plastipak jeringa de 50 ml Luer-Lock | Becton Dickinson | 300865 | |
| Tubos Tygon R3603 3,2 x 4,8 mm | Fisher-Científico | R3603 | |
| Llave de 3 vías, 2 luer hembra a macho luer | Bio-Rad | 7328103 | |
| Jeringa de la bomba | Harvard Apparatus | PHD 2000 | |
| Microscopio invertido, Nikon | Nikon | Eclipse T i | |
| CCD de la cámara | Hamamatsu | ORCA 285 CCD o ORCA 3-CCD | |
| ImageJ software | NIH | Freeware ( http://rsbweb.nih.gov/ij/ ) |
Referencias
- Mairey, E. Cerebral microcirculation shear stress levels determine Neisseria meningitidis attachment sites along the blood-brain barrier. J Exp Med. 203, 1939-1950 (2006).
- Pries, A. R., Secomb, T. W., Gaehtgens, P. Design Principles of Vascular Beds. Circ Res. 77, 1017-1023 (1995).
- Zarbock, A., Ley, K. Neutrophil adhesion and activation under flow. Microcirculation. 16, 31-42 (2009).
- Tissot, O., Pierres, A., Foa, C., Delaage, M., Bongrand, P. Motion of cells sedimenting on a solid surface in a laminar shear flow. Biophys J. 61, 204-215 (1992).
- Mikaty, G. Extracellular bacterial pathogen induces host cell surface reorganization to resist shear stress. PLoS Pathog. 5, e1000314-e1000314 (2009).
- Chamot-Rooke, J. Posttranslational modification of pili upon cell contact triggers N. meningitidis dissemination. Science. 331, 778-782 (2011).
- Soyer, M., Dumínil, G. Bacterial adhesion under shear stress. Neisseria meningitidis: Methods and Protocols (Methods in Molecular Biology). Christodoulides, M. , Humana Press Inc. New York. (2011).
- Abramoff, M. D., Magelhaes, P. J., Ram, S. J. Image Processing with ImageJ. Biophotonics International. 11, 36-42 (2004).
- Thomas, W. E., Trintchina, E., Forero, M., Vogel, V., Sokurenko, E. V. Bacterial adhesion to target cells enhanced by shear force. Cell. 109, 913-923 (2002).
- Tchesnokova, V. Shear-enhanced binding of intestinal colonization factor antigen I of enterotoxigenic Escherichia coli. Mol Microbiol. 76, 489-502 (2010).
- Konto-Ghiorghi, Y. Dual role for pilus in adherence to epithelial cells and biofilm formation in Streptococcus agalactiae. PLoS Pathog. 5, e1000422-e1000422 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados