Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Luz correlativa y Microscopía Electrónica (CLEM) como una herramienta para visualizar moléculas microinyección y sus objetivos eucariotas subcelulares
En este artículo
Resumen
La técnica CLEM se ha adaptado para analizar la morfología ultraestructural de las membranas, orgánulos, y estructuras subcelulares afectados por moléculas microinyectados. Este método combina las poderosas técnicas de micromanipulación / microinyección, microscopía fluorescente confocal y microscopía electrónica para permitir a milímetro resolución nanométrica múltiples. Esta técnica es viable para una amplia variedad de aplicaciones.
Resumen
La célula eucariota se basa en la compleja, altamente regulado, y los compartimentos de membrana ligados funcionalmente distintas que conservan una polaridad necesaria bioquímico para la correcta función celular. La comprensión de cómo las enzimas, proteínas, y componentes del citoesqueleto gobernar y mantener esta segregación bioquímica tanto, es de suma importancia. El uso de moléculas marcadas con fluorescencia para localizar y / o perturbar los compartimentos subcelulares se ha producido una gran cantidad de conocimientos y avanzar en nuestra comprensión de la regulación celular. Las técnicas de imagen tales como microscopía de fluorescencia confocal y hacer la determinación de la posición de una molécula de marcado fluorescentemente pequeña relativamente sencillo, sin embargo, la resolución de estructuras muy pequeñas se limita 1.
Por otra parte, la microscopía electrónica ha revelado los detalles de la morfología subcelular a una resolución muy alta, pero su naturaleza estática hace que sea difícil de medir pro altamente dinámicoprocesos con precisión 2,3. Así, la combinación de la microscopía de luz con el microscopio electrónico de la misma muestra, Light denomina correlativa y Microscopía Electrónica (CLEM) 4,5, proporciona la doble ventaja de formación de imágenes ultrarrápida fluorescente con la alta resolución de la microscopía electrónica 6. Esta poderosa técnica se ha aplicado para estudiar muchos aspectos de la biología celular 5,7. Desde su creación, este procedimiento ha aumentado nuestra capacidad de distinguir las arquitecturas subcelulares y morfologías de alta resolución.
A continuación, presentamos un método simplificado para realizar la microinyección rápida seguida de CLEM (Fig. 1). El procedimiento de CLEM microinyección puede ser utilizado para introducir cantidades específicas de moléculas pequeñas y / o proteínas directamente en el citoplasma de células eucariotas y estudiar los efectos de un milímetro a la resolución de varios nanómetros (Fig. 2). La técnica se basa en la microinyecciónlas células cultivadas en cubreobjetos de vidrio grabado láser reticulados fijados a la parte inferior de platos y de formación de imágenes de células vivas con tanto microscopía confocal fluorescente y electrones. La localización de la célula (s) de interés se ve facilitada por el patrón de rejilla, que se transfiere fácilmente, junto con las células de interés, a la resina Epon utilizado para la inmovilización de muestras y corte antes del análisis de microscopía electrónica (Fig. 3). Superposición de fluorescencia y las imágenes EM permite al usuario determinar la localización subcelular, así como los cambios morfológicos y / o ultraestructurales inducidas por la molécula microinyectado de interés (Fig. 4). Esta técnica es susceptible de puntos de tiempo que van desde ≤ 5 s hasta varias horas, dependiendo de la naturaleza de la muestra microinyectado.
Protocolo
1. Cultivo de células mamíferas
- Riñón de rata normal (NRK), inmortalizada cáncer de cuello uterino (HeLa), u otras líneas celulares de mamífero adecuadas se cultivan a 37 ° C, 5% de CO 2, en cubreobjetos de vidrio fotograbados reticulados fijados a vivir platos de células (véase la Tabla 1 para cualquier reactivo o aparato usado en este protocolo) en DMEM + 10% de FBS y 1% Pen / Strep. Se deben tomar precauciones para mantener un ambiente estéril cuando se trabaja con células de mamífero cultivadas.
- Dependiendo de su experimental línea de tiempo (0-5 horas vs 1-2 días después de la inyección) la confluencia de las células debe ser ajustado a ~ 50% o ~ 25%, respectivamente.
2. Microinyección
- Preparar proteína deseada, ADN o moléculas pequeñas en su elección de tampón, en función de su susceptibilidad a la cultura celular, a un volumen final de ~ 50 l. Inertes tintes fluorescentes como Texas Red o Blue Cascadese incluyen con el fin de marcar las células microinyectados; elección del colorante de inyección y la sonda fluorescente debe tener excitación que no se solapan y longitudes de onda de emisión. La concentración de la molécula de interés necesaria para la microinyección deben ser determinadas empíricamente, y los colorantes fluorescentes de rastreo se utilizan comúnmente en 0.5-1.0 mg / ml. Típicamente, la rodamina o fluoróforo otro se une covalentemente a la molécula de interés utilizando un kit comercial, sin embargo, otros métodos de detección pueden ser utilizados dependiendo de la sensibilidad. Para obtener más información, vea Consideraciones de Críticos de abajo.
- Filtrar la inyectante (~ 50 l) a través de un filtro de 0,22 micras centrífuga. Filtros centrífugos son preferibles a vacío y / o filtración de jeringa que se han asociado volúmenes muertos.
- Para generar la aguja de microinyección, pipetas de vidrio de borosilicato se extraen usando una micropipeta Brown Flaming-Puller directrices siguientes fabricantes. Alternativamente, la microinyecciónagujas se pueden comprar de proveedores como Eppendorf que hace Femtotip agujas de microinyección.
- Con cuidado, pipetear 4 l de inyectado en el extremo de la aguja sin ser molestados con microinyección Eppendorf 20 Femtotips. Asegúrese de que no hay burbujas en la aguja de microinyección tiró. Cargar aguja de microinyección en el brazo de la micromanipulador Eppendorf InjectMan FemptoJet unido a un microscopio invertido. Para una buena revisión del procedimiento de microinyección, el lector es dirigido a una revista anterior del artículo experimentos visualizados 8.
- Colocar plato de células vivas con cubreobjetos reticulados y de células cultivadas en el soporte de plato del microscopio invertido Zeiss. Encontrar las células que crecen dentro de una cuadrícula fotoincisa y anotar el identificador alfanumérico de rejillas, este se utilizará en todas las etapas posteriores. Idealmente, localizar las células en el centro del cubreobjetos como las medidas subsiguientes, limitar la transferencia de la muestra en los bordes del cubreobjetos.
- Inyección manualmente el brazo inferior en su lugar sobre el cubreobjetos, y el uso de la palanca de mando micromanipulador y controles, inferior aguja de inyección hacia abajo hasta que la punta toca suavemente la superficie de las células cultivadas y Límite de prensa 'para evitar el movimiento de la aguja más allá de este punto y rompiendo así el frágil sacó de vidrio de borosilicato. Todos los demás aspectos de la microinyección de células se realizan como por Eppendorf manual de usuario FemtoJet InjectMan. La técnica de microinyección fue utilizado recientemente para entender individuales secretadas proteínas de virulencia de las bacterias 9.
- Microinyectar cualquier otra célula dentro de la red elegida. Con las células cultivadas a ~ 50% de confluencia, se puede esperar ~ 80 células por 600 micras 2 rejilla (ejemplo mostrado en la fig. 3A). Por lo tanto, después de una inspección microscopía de fluorescencia y electrónica, habrá un n de ~ 30-40 experimental y control de las células.
- Coloque en vivo de células de mamífero plato de nuevo en cultivo celular incubadora para deseadotiempo según lo dictado por la configuración experimental. Alternativamente, se puede proceder directamente de microinyección para el análisis por microscopía de lapso de tiempo para esperar la aparición de determinadas estructuras subcelulares de interés antes de la fijación.
3. Microscopía de fluorescencia
- Si se desea, realizar vivo de células con lapso de tiempo mediciones de fluorescencia de células microinyectados, después de lo cual, reemplazar el medio con 2,5% de glutaraldehído en 0,1 M tampón de cacodilato (pH 7,4) y se incuba durante 10 min a temperatura ambiente. Sin embargo, si las mediciones de células vivas no son necesarios, descartar los medios de crecimiento celular y fijar las células con 5 ml de formaldehído 3,7% en 1xPBS a temperatura ambiente durante 10 minutos. Deseche fijador y reemplace con 5 ml 1xPBS, vaya al paso 3.2. Nota: es muy importante no añadir glutaraldehído hasta después de microscopía de fluorescencia se ha completado.
- Colocar el plato de célula viva con cubreobjetos fotoincisa cuadriculada en un microscopio de fluorescencia (confocal no se requiere para thipaso s) y recoger campo 5-10 brillante y las imágenes fluorescentes de la rejilla apropiada para documentar la disposición de las células (Fig. 4A). Identificar las células que han sido microinyectados utilizando las longitudes de onda de excitación y emisión del colorante inerte inyección (Fig. 4B). Es importante para obtener imágenes a diferentes aumentos (por ejemplo, 10x y 65x) con el fin de facilitar la identificación de células microinyectados en los pasos posteriores que implican microscopía electrónica.
- Utilizando un microscopio de fluorescencia confocal, se recoge una pila Z de células microinyectados dentro de la cuadrícula identificado en el paso por encima de 2,5. Gran aumento (100x) que se necesita con el fin de correlacionar las imágenes fluorescentes con estructuras subcelulares que serán identificados en microscopía electrónica.
- Los cubreobjetos se retiran del fondo de las placas de células vivas con cubreobjetos líquido eliminación comercialmente disponible y se coloca la celda hacia arriba en un plato de cultivo celular que contiene 5 ml virgen1xPBS. El cubreobjetos se procesa entonces para microscopía electrónica como se detalla a continuación.
4. Microscopía electrónica de transmisión
- Reemplazar tampón 1xPBS con 2 ml de glutaraldehído 2,5% en tampón cacodilato 0,1 M (pH 7,4) y se incuba a temperatura ambiente durante 10 minutos. Más tiempo de incubación, aunque no es necesario, ayudará en el mantenimiento de las estructuras subcelulares. Nota: formaldehído por sí sola no es suficiente para un fijador EM análisis.
- Eliminar las células fijador y se mancha con la adición de 2 ml de tetróxido de osmio al 1% en tampón cacodilato 0,1 M durante 30 min seguido por tres lavados con tampón de cacodilato y finalmente sustituir el tampón con ddH 2 O.
- Siguiendo los protocolos estándar de EM, deshidratar la muestra en un gradiente (70% a 100%) series de etanol. Preparar resina Epon y cubreobjetos lugar de células hacia abajo sobre la parte superior de una resina Epon tubo lleno. Permitir la polimerización durante 24 horas a 60 ° C. Al colocar el cubreobjetos fotograbados cuadriculada celda del lado hacerwn sobre la resina Epon, tanto las células de interés, así como el patrón de rejilla se transfiere a la resina Epon durante la polimerización (ejemplo mostrado en la fig. 3B).
- Retire cubreobjetos de resina Epon rápidamente por inmersión en nitrógeno líquido y / o agua hirviendo. Inspeccione la superficie de la resina en un ámbito de disección binocular para localizar la red de interés (nota: el golpeteo de la red se transferirá como una imagen de espejo). Utilizando una cuchilla de afeitar estéril o bisturí, corte del bloque de Epon hacia abajo de tal manera que sólo la red de interés está en el vértice del bloque de resina Epon.
- Uso de un ultramicrotomo, adquirir las secciones de serie del bloque recortan en el espesor deseado (~ 70 nm de espesor para TEM convencional y ~ 250 nm de espesor para tomográfica TEM). Contraste las secciones con acetato de uranilo y citrato de plomo siguiendo los protocolos estándar.
5. Luz correlativa y Microscopía Electrónica
- Reubicar las células de interés enel microscopio electrónico utilizando imágenes obtenidas en los pasos anteriores. Una vez que las células microinyectados de interés se han situado, utilice las imágenes de alta resolución confocal de fluorescencia para identificar las regiones dentro de la célula que son de interés. Imagen de éstos en alta resolución utilizando TEM. Usar puntos de referencia tales como la periferia de la célula y la envoltura nuclear para determinar qué fluorescente z-pila imagen corresponde a la EM rebanada.
- Utilizando el programa de imágenes de su elección (por ejemplo, la imagen J, Adobe Photoshop, etc), reducir la opacidad de la imagen fluorescente al 50% y se superpone sobre la imagen TEM con las que se relaciona. Alinear las imágenes mediante el ajuste de la escala (recordar para restringir las proporciones) y la rotación de la imagen confocal para que coincida con la imagen de MET. Ajustes precisos de contraste, nitidez, etc en la imagen fluorescente puede ayudar en la alineación. Nota: se ha encontrado que la heterocromatina, la envoltura nuclear, y la periferia de la célula representa un excelentes puntos de referencia para ayudaren la orientación de las dos imágenes.
6. Consideraciones críticas
- Para ayudar mucho en la localización de la molécula pequeña inyectado, una etiqueta fluorescente, tal como rodamina o fluoresceína se pueden unir covalentemente usando kits disponibles comercialmente. Información adicional se gana ectópica expresar una proteína fluorescente marcador localización subcelular antes de la microinyección. Por lo tanto, la elección de fluoróforos y colorante inerte microinyección de seguimiento es importante.
- Elegir las células para la microinyección que se adhieren cerca del centro del cubreobjetos y evitar la elección de una cuadrícula cerca del borde. Esta para presentar una mayor probabilidad de que las células de interés se transfieren a la resina Epon utilizado para microscopía electrónica.
- Confluencia de células is importante, como una placa completamente confluente hará que la identificación de células microinyectados en el microscopio electrónico muy difícil. Más bien, las células de semillas tales que lleguen a ~ 50% de confluencia en el día de un experimento de corta, o ~ 25% de confluencia en el día de un tiempo (1-2 días) experimento. Utilice la posición y forma de las células, así como el espacio 'vacío como puntos de referencia para orientar la imagen de microscopía electrónica.
- Espesor óptico confocal rebanada debe ser sintonizado a las necesidades del experimento y por lo tanto debe ser determinada empíricamente 10.
- El formaldehído y el glutaraldehído fijadores deben ser de la más alta calidad disponible. El formaldehído se fijar las células, sin embargo, conservar las propiedades de fluorescencia de ambas proteínas y pequeñas moléculas fluorescentes (tales como rodamina o FITC). Sin embargo, no va a preservar las estructuras para permitir alta resolución EM. Glutaraldehído preserva las membranas y estructuras subcelulares a un alto grado de EM análisissis, pero significativamente obstaculizar fluorescencia. Por lo tanto, la fijación de dos pasos es fundamental tanto para fluorescencia y microscopía de EM. La etapa de fijación de formaldehído se puede omitir si la realización de las mediciones de células vivas, como la fijación definitiva se puede realizar por tratamiento con glutaraldehído.
7. Los resultados representativos
Este procedimiento proporciona la capacidad de suministrar una molécula de interés directamente en el citoplasma celular eucariota y vigilar su localización y / o efectos en la arquitectura celular y organeller de milímetro a la resolución de varios nanómetros. Una ilustración esquemática de la configuración experimental y procedimiento se muestra en la Figura 2. Esta técnica se basa en la microinyección de células cultivadas sobre un cubreobjetos de vidrio grabada con láser sobre malla (Fig. 3A), que después de la microscopía confocal, es capaz de transferir tanto de las células de interés, así como el patrón de rejilla a la resina Epon (Fig.3B).
Un procedimiento de microinyección CLEM típico produce imágenes de fluorescencia y micrografías de electrones, que combinados entre sí, permiten tanto la localización subcelular y el análisis ultraestructural. Las células cultivadas en un cubreobjetos de vidrio cuadriculada fotoincisa se microinyectan con una molécula de interés después de que las imágenes de campo claro se obtienen (Fig. 4A). Un colorante inerte seguimiento se incorpora para distinguir las células de microinyectados no microinyectados células (Fig. 4B). Confocal z-pilas se obtienen utilizando un fluoróforo u otro identificador unido a la molécula microinyectado pequeña de interés (Fig. 4C). La muestra se fijaron con glutaraldehído y se procesaron para microscopía electrónica. Micrografías electrónicas se obtienen y se superpone a las células a las que corresponden (Fig. 4D). Áreas albergan señales fluorescentes son inspeccionados con mayor detalle a mayor aumento (4E Fig. ).

Figura 1. Cronograma del procedimiento de microinyección CLEM. Dependiendo de la configuración experimental, microinyección y las mediciones de fluorescencia pueden realizarse en el mismo día. Preparación de la muestra para microscopía electrónica es el más tiempo debido a que consume pasos incubaciones largas y tendrá una duración de 2-3 días. TEM análisis y la correlación de las señales de fluorescencia con imágenes de microscopía electrónica se puede realizar en un solo día.

Figura 2 Ilustración general del procedimiento de CLEM microinyección Paso 1:.. Localizar las células que crecen en cubreobjetos de vidrio grabado láser reticulados y de microinyectar molécula de interés Paso 2:.. Captura dos imágenes de campo claro y fluorescencia confocal z-pilas de células microinyectados Paso 3: prepararcubreobjetos para EM análisis e incrustar en resina Epon. Usando patrón transferido red, recorte bloquear de manera que las células de interés se encuentran en el vértice Paso 4:. Cortar secciones seriadas con ultramicrótomo Paso 5:. Correlacionar imágenes fluorescentes con EM imágenes.
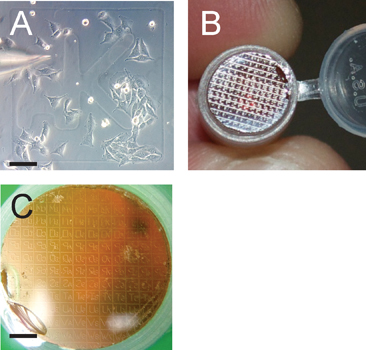
. Figura 3 patrón de cuadrícula facilita la identificación de las células de interés Panel A representa la microinyección de células cultivadas a ~ 50% de confluencia;. Observar la rejilla de identificador de AK. La barra de escala es de 100 micras. Panel B muestra el patrón de rejilla transfiere desde el cubreobjetos sobre el bloque de resina polimerizada Epon que se seccionará en serie después de la cuadrícula de interés se identifica en un microscopio de disección. Panel C muestra el patrón de rejilla transferido en preparación para seccionar . Tenga en cuenta que el golpeteo de la red transferida es a la inversa en el bloque de resina; scalbar e es de 1200 m.
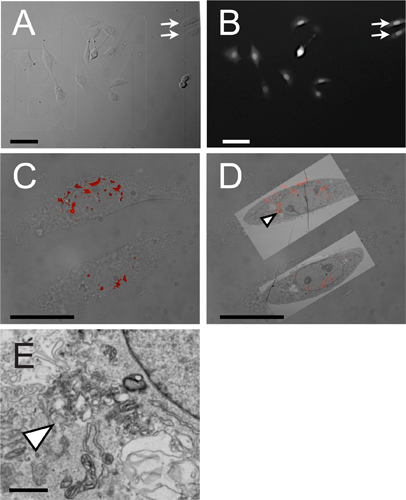
.. Figura 4 Los resultados representativos de luz correlativo microinyección y microscopía electrónica El panel A muestra la micrografía de campo brillante de células NRK que crecen en un cubreobjetos de vidrio grabada con láser cuadriculada; flechas indican dos células que se visualizan por CLEM en CD paneles panel B muestra la fluorescencia. del colorante de seguimiento inerte, en este caso Cascade Blue, utilizado para identificar las células que fueron microinyectadas. panel C muestra la superposición de campo brillante y la firma de fluorescencia de rodamina marcado con una molécula pequeña. Las dos celdas mostradas aquí se indican mediante flechas en los paneles A y B. Panel D representa CLEM de campo brillante, microscopía de fluorescencia y electrónica;. Punta de la flecha indica fluorescente puncta fotografiado a mayor aumento en Panel E Las barras de escala son de la siguientemanera: Los paneles A y B, 100 m; C y D, a 50 micras; E, a 100 nm.
Discusión
El método que aquí se presenta permite la entrega directa de las proteínas, ácidos nucleicos purificados, o pequeñas moléculas al citoplasma eucariótico y proporciona ultra alta resolución a través de análisis de la correlación de microscopía de fluorescencia y electrónica. El uso de este método es simple, pero robusto y se puede realizar en casa con muchas instalaciones de base existentes y / o debidamente equipados laboratorios de microscopía electrónica. La técnica es también sensible a la célula v...
Divulgaciones
No hay conflictos de intereses se declaran.
Agradecimientos
Damos las gracias a los miembros del Alto laboratorio útil para los debates. También agradecemos a El Fondo para Imagen Molecular y Celular de la Universidad de Texas Southwestern Medical Center, específicamente el Dr. Chris Gilpin, Januszewski Tom, y Mueller Laurie por su experiencia técnica y asesoramiento. También agradecemos al Dr. Dong Xionan para la lectura crítica del manuscrito. Este trabajo es apoyado por el NIH subvención AI083359 a NMA
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Cubreobjetos Fotograbado y placa en vivo de células | MatTek | P35G-2-14-CGRD | |
| Texas Red | Invitrogen | D3329 | |
| Cascada Azul | Invitrogen | D7132 | |
| Rodamina Etiquetado Kit | Thermo Scientific | 53002 | |
| 0,22 m unidad de filtración centrífuga | Millipore | UFC30GV00 | |
| Pipetas de vidrio de borosilicato | Sutter Instruments | BF100-50-10 | |
| Micropipetas Puller | Sutter Instruments | Modelo P-97 | Utilice el programa n º 4 después de realizar la prueba de rampa |
| FemtoJet sistema de microinyección | Eppendorf | InjectMan NI2 | |
| Cubreobjetos líquido eliminación | MatTek | PDCF OS 30 | |
| Technai Microscopio Electrónico de Transmisión | FEI | Technai G2 BioTWIN | |
| Ultramicrotombe | Leica | EM UC6 |
Referencias
- Schmolze, D. B., Standley, C., Fogarty, K. E., Fischer, A. H. Advances in microscopy techniques. Arch. Pathol. Lab Med. 135, 255-263 (2011).
- Giepmans, B. N. Bridging fluorescence microscopy and electron microscopy. Histochem. Cell Biol. 130, 211-217 (2008).
- Mayhew, T. M., Muhlfeld, C., Vanhecke, D., Ochs, M. A review of recent methods for efficiently quantifying immunogold and other nanoparticles using TEM sections through cells, tissues and organs. Ann. Anat. 191, 153-170 (2009).
- Razi, M., Tooze, S. A. Correlative light and electron microscopy. Methods Enzymol. 452, 261-275 (2009).
- Svitkina, T. M., Borisy, G. G. Correlative light and electron microscopy of the cytoskeleton of cultured cells. Methods Enzymol. 298, 570-592 (1998).
- van Weering, J. R. Intracellular membrane traffic at high resolution. Methods Cell Biol. 96, 619-648 (2010).
- Polishchuk, R. S. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. J. Cell Biol. 148, 45-58 (2000).
- Lim, J., Danuser, G. Live Cell Imaging of F-actin Dynamics via Fluorescent Speckle Microscopy (FSM). J. Vis. Exp. (30), e1325 (2009).
- Selyunin, A. S. The assembly of a GTPase-kinase signalling complex by a bacterial catalytic scaffold. Nature. 469, 107-111 (2011).
- Semwogerere, D., Weeks, E. R. . Confocal Microscopy in Encyclopedia of Biomaterials and Biomedical Engineering. , (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados