È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Luce Correlativo e Microscopia Elettronica (CLEM) come strumento per visualizzare molecole microiniezione e dei loro sub-cellulari eucariotiche Obiettivi
In questo articolo
Riepilogo
La tecnica CLEM è stato adattato per analizzare morfologia ultrastrutturale delle membrane, organelli e strutture subcellulari affetti da molecole microiniezione. Questo metodo combina le potenti tecniche di micromanipolazione / microiniezione, microscopia confocale a fluorescenza, e la microscopia elettronica per consentire millimetro a multi-risoluzione nanometrica. Questa tecnica è suscettibile di una vasta gamma di applicazioni.
Abstract
La cellula eucariotica si basa su complessi, altamente regolamentato, e compartimenti di membrana funzionalmente distinti associati, che conservano una polarità biochimica necessaria per una corretta funzione cellulare. Capire come gli enzimi, proteine, e componenti del citoscheletro governare e mantenere questa separazione biochimica è quindi di fondamentale importanza. L'utilizzo di molecole fluorescenti tag di localizzare e / o turbano compartimenti subcellulari ha prodotto un patrimonio di conoscenze e avanzato la nostra comprensione della regolazione cellulare. Tecniche di imaging come la microscopia confocale a fluorescenza e rendere esaminano la posizione di una molecola fluorescente etichettato piccola relativamente semplice, tuttavia la risoluzione di strutture molto piccole è limitato 1.
D'altra parte, microscopia elettronica ha rivelato i dettagli di morfologia subcellulare ad altissima risoluzione, ma la sua natura statica rende difficile misurare pro altamente dinamicoprocessi con precisione 2,3. Pertanto, la combinazione di microscopio ottico con il microscopio elettronico dello stesso campione, chiamato Luce correlativa e Microscopia Elettronica (CLEM) 4,5, offre il duplice vantaggio di imaging fluorescente con ultraveloce ad alta risoluzione della microscopia elettronica 6. Questa potente tecnica è stata implementata per studiare molti aspetti della biologia cellulare 5,7. Fin dalla sua nascita, questa procedura ha aumentato la nostra capacità di distinguere architetture subcellulari e morfologie ad alta risoluzione.
Qui, presentiamo un metodo semplificato per eseguire microiniezione rapida seguita da CLEM (Fig. 1). La procedura CLEM microiniezione può essere utilizzato per introdurre quantità specifiche di piccole molecole e / o proteine direttamente nel citoplasma delle cellule eucariotiche e studiare gli effetti di millimetro a multi-nanometri risoluzione (Fig. 2). La tecnica si basa sul microinjectingcellule coltivate su vetrini con laser a griglia applicata sul fondo dei piatti cellule vive e immagini sia con la microscopia confocale a fluorescenza ed elettronica. Localizzazione della cella (s) di interesse è facilitata dalla griglia, che viene facilmente trasferita, insieme con le cellule di interesse, alla resina Epon utilizzato per l'immobilizzazione di campioni e sezionamento prima analisi microscopia elettronica (Fig. 3). Sovrapposizione di immagini fluorescenti e EM permette all'utente di determinare la localizzazione subcellulare nonché eventuali cambiamenti morfologici e / o ultrastrutturali indotte dalla molecola microiniezione di interesse (Fig. 4). Questa tecnica è suscettibile di punti di tempo variabili da ≤ 5 s fino a diverse ore, a seconda della natura del campione microiniezione.
Protocollo
1. Colture Cellulari mammiferi
- Rene di ratto normale (NRK), immortalata tumore della cervice uterina (HeLa), o di altre linee cellulari di mammiferi appropriate sono coltivate a 37 ° C, 5% di CO 2, su vetrini fotoincisioni gridded apposti a vivere piatti cellulari (vedi Tabella 1 per ogni reagente o apparecchiatura utilizzata in questo protocollo) in DMEM + 10% FBS e 1% Pen / Strep. Devono essere prese precauzioni per mantenere un ambiente sterile quando si lavora con una coltura di cellule di mammifero.
- A seconda del tempo sperimentale-line (0-5 ore vs 1-2 giorni dopo iniezione) la confluenza di cellule dovrebbero essere adattati per ~ 50% ~ 25%, rispettivamente.
2. Microiniezione
- Preparare proteina desiderata, DNA, o piccole molecole nella scelta del buffer, a seconda della sua riconducibilità alla cultura cellulare, ad un volume finale di 50 pl ~. Inerti coloranti fluorescenti come il Texas Rosso o Blu Cascadesono inclusi per marcare le cellule microiniettati; scelta del colorante iniezione e sonda fluorescente dovrebbe avere eccitazione non sovrapposti e lunghezze d'onda di emissione. La concentrazione della molecola di interesse necessaria per microiniezione dovrebbe essere determinato empiricamente, ed i coloranti fluorescenti inseguimento vengono comunemente usati a 0.5-1.0 mg / ml. Tipicamente, rodamina o altro fluoroforo è covalentemente attaccata alla molecola di interesse utilizzando un kit commerciale, tuttavia altri metodi di rilevamento possono essere utilizzati a seconda della sensibilità. Per ulteriori informazioni, vedere Considerazioni critiche di seguito.
- Filtrare la injectant (~ 50 ml) attraverso un filtro di 0,22 micron centrifugo. Filtri centrifughi sono preferite a vuoto e / o filtrazione siringa che sono associati volumi morti.
- Per generare l'ago microiniezione, pipette in vetro borosilicato sono tirati utilizzando un Flaming-Brown micropipetta Estrattore seguenti linee guida produttori. In alternativa, microiniezionegli aghi possono essere acquistati presso i fornitori tra cui Eppendorf che rende aghi microiniezione femtotip.
- Pipettare attentamente 4 l di injectant nell'estremità indisturbati dell'ago microiniezione con Eppendorf 20 Femtotips. Assicurarsi che non siano presenti bolle all'interno dell'ago microiniezione tirato. Caricare ago microiniezione nel braccio micromanipolatore del FemptoJet Eppendorf InjectMan collegato ad un microscopio invertito. Per una buona revisione della procedura microiniezione, il lettore è indirizzato ad un Journal precedente articolo visualizzato Esperimenti 8.
- Posizionare piatto dal vivo delle cellule con coprioggetto con griglia e cellule in coltura nel supporto piatto del microscopio invertito Zeiss. Trova cellule in crescita all'interno di una griglia fotoincisione e notare la alfanumerico identificativo griglie, questo sarà utilizzato in tutte le fasi successive. Idealmente, individuare le celle al centro del vetrino come step successivi limitare il trasferimento di esempio ai bordi del coprioggetto.
- Iniezione braccio Abbassare manualmente in posizione sopra il vetrino, e utilizzando il joystick micromanipolatore e controlli, ago per l'iniezione più in basso fino a quando la punta non tocca leggermente la superficie delle cellule in coltura e limite premere 'per impedire il movimento dell'ago di là di questo punto, e quindi rompere il fragile tirato in vetro borosilicato. Tutti gli altri aspetti microiniezione cellule vengono effettuate per utente Eppendorf FemtoJet manuale InjectMan. La tecnica di microiniezione è stato recentemente utilizzato per comprendere le singole proteine di virulenza secrete dai batteri 9.
- Microinject ogni altra cellula all'interno della griglia scelta. Con cellule cresciute a ~ 50% di confluenza, ci si può aspettare ~ 80 cellule per 600 um 2 griglia (esempio mostrato in Fig. 3A). Pertanto, previo controllo microscopia a fluorescenza ed elettronica, ci sarà un n sperimentale di ~ 30-40 e cellule di controllo.
- Posizionare live-cell piatto nuovo in incubatrice mammiferi di coltura cellulare per la desideratatempo come dettato dal setup sperimentale. In alternativa, si può procedere direttamente dalla microiniezione di time-lapse analisi al microscopio di attendere la comparsa di particolari strutture subcellulari di interesse prima della fissazione.
3. Microscopia a fluorescenza
- Se desiderato, effettuare live-cellule time lapse misure di fluorescenza di cellule microiniezione, dopo di che, sostituire il supporto con il 2,5% di glutaraldeide in 0,1 M tampone cacodilato (pH 7,4) e incubare per 10 min a temperatura ambiente. Tuttavia, se vivo di cellule misurazioni non sono necessarie, scartare supporti crescita cellulare e fissare le cellule con 5 ml di formaldeide 3,7% in 1xPBS a temperatura ambiente per 10 minuti. Gettare fissativo e sostituire con 5 ml 1xPBS, passare al punto 3.2. Nota: è importante non aggiungere glutaraldeide fino a dopo la microscopia a fluorescenza è completa.
- Posizionare il live-cella piatto con fotoincisione coprioggetto con griglia in un microscopio a fluorescenza (confocale non è necessario per this step) e raccogliere 5-10 campo chiaro e immagini fluorescenti della griglia appropriata per documentare la disposizione delle cellule (Fig. 4A). Identificare quelle cellule che sono state microiniettati con le lunghezze d'onda di eccitazione ed emissione del colorante inerte iniezione (Fig. 4B). È importante per ottenere immagini a diversi ingrandimenti (ad esempio 10x e 65x) al fine di facilitare l'identificazione delle cellule microiniezione in fasi successive che comportano microscopia elettronica.
- Utilizzando un microscopio confocale a fluorescenza, raccogliere un Z-stack di celle microiniettati all'interno della griglia identificato nel passo 2.5. Alto ingrandimento (100x) è necessaria al fine di correlare immagini fluorescenti con strutture subcellulari che saranno identificati in microscopia elettronica.
- I vetrini vengono rimossi dal fondo dei piatti cellule vive con liquido coprioggetto commercio rimozione e collocato cellula-lato in un piatto di coltura cellulare vergine contenente 5 ml1xPBS. Il vetrino viene elaborato per la microscopia elettronica come di seguito dettagliato.
4. Microscopia elettronica a trasmissione
- Sostituire tampone 1xPBS con 2 ml di glutaraldeide 2,5% in 0,1 M tampone cacodilato (pH 7,4) e incubare a temperatura ambiente per 10 minuti. Più incubazione, mentre non necessario, sarà di aiuto nella manutenzione delle strutture subcellulari. Nota: formaldeide da solo non è sufficiente per un fissativo EM analisi.
- Rimuovere le cellule fissativo e macchia con l'aggiunta di 2 ml tetrossido di osmio 1% in tampone cacodilato 0,1 M per 30 min seguito da tre lavaggi con tampone cacodilato e infine sostituire tutti tampone con DDH 2 O.
- Seguendo protocolli standard EM, disidratare il campione in un graduata (70% al 100%) serie di etanolo. Preparare resina Epon e applicare il coprioggetto luogo cellulare rivolto verso il basso sulla parte superiore di un tubo pieno di resina Epon. Consentono polimerizzazione per 24 ore a 60 ° C. Inserendo il coprioggetto fotoincisione griglia cella sul lato down sulla resina Epon, sia le cellule di interesse e la griglia viene trasferito alla resina Epon durante la polimerizzazione (ad esempio mostrato in Fig. 3B).
- Rimuovere coprioggetti di resina Epon in fretta immersione in azoto liquido e / o acqua bollente. Controllare la superficie della resina in un ambito di dissezione binocolo per individuare la rete di interesse (nota: lo scalpiccio griglia trasferirà come immagine speculare). Usando una lama di rasoio o bisturi sterile, rifilare il blocco Epon basso tale che solo la griglia di interesse è all'apice del blocco di resina Epon.
- Utilizzando un ultramicrotomo, acquisire sezioni seriali di blocco rifilato al desiderato spessore (~ 70 nm di spessore TEM convenzionale e ~ 250 nm di spessore tomografica TEM). Contrasto le sezioni con acetato di uranile e citrato di piombo seguendo protocolli standard.
5. Luce Correlativo e microscopia elettronica
- Spostare le celle di interesse ail microscopio elettronico utilizzando immagini ottenute nei passaggi precedenti. Una volta che le cellule microiniezione di interesse sono stati localizzati, utilizzare le immagini confocali alta risoluzione fluorescenti per identificare regioni all'interno della cella che erano di interesse. Immagine questi ad alta risoluzione utilizzando TEM. Utilizzare punti di riferimento come la periferia cellulare e la membrana nucleare per determinare quale fluorescente z-serie di immagini corrisponde al EM tagliare.
- Utilizzando il programma di imaging di vostra scelta (ad esempio Image J, Adobe Photoshop, etc), ridurre l'opacità dell'immagine fluorescente al 50% e sovrapporlo l'immagine TEM con la quale si correla. Allineare le immagini regolando la scala (ricordate le proporzioni) e la rotazione della immagine confocale a corrispondere l'immagine TEM. Regolazioni di precisione per contrasto, nitidezza, ecc dell'immagine fluorescente può essere di aiuto l'allineamento. Nota: abbiamo trovato che l'eterocromatina, l'involucro nucleare, e la periferia delle cellule rappresentano un punti di riferimento eccellente per aiutarenell'orientamento delle due immagini.
6. Considerazioni critiche
- Per facilitare notevolmente nel localizzare la piccola molecola iniettata, un tag fluorescente come fluoresceina o rodamina possono essere covalentemente utilizzando kit disponibili in commercio. Ulteriori informazioni si guadagna ectopicamente esprimendo una proteina marker fluorescente subcellulare localizzazione prima di microiniezione. Da qui, la scelta di fluorofori e inerte colorante monitoraggio microiniezione è importante.
- Scegliere celle per microiniezione che sono aderenti vicino al centro del vetrino ed evitare di scegliere una griglia vicino al bordo. Questo presenta la maggiore probabilità che le cellule di interesse vengono trasferiti alla resina Epon utilizzato per la microscopia elettronica.
- Confluenza di cellule is importante, come piastra completamente confluenti farà identificazione di cellule microiniettati al microscopio elettronico molto difficile. Piuttosto, alveoli tale che essi raggiungono ~ 50% di confluenza del giorno di un breve esperimento, o ~ 25% di confluenza del giorno di una più lunga (1-2 giorni) esperimento. Utilizzare la posizione e la forma delle cellule e la 'spazio vuoto come punti di riferimento per orientare l'immagine microscopia elettronica.
- Confocale spessore di strato ottico deve essere sintonizzato alle esigenze dell'esperimento e deve pertanto essere determinata empiricamente 10.
- La formaldeide e glutaraldeide fissativi dovrebbe essere di alta qualità disponibile. Formaldeide sarà fissare le cellule, pur mantenendo le proprietà di fluorescenza di entrambe le proteine e piccole molecole fluorescenti (come rodamina o FITC). Tuttavia, non si conservano le strutture per consentire alta risoluzione EM. Glutaraldeide conserva membrane e strutture subcellulari ad un grado elevato di analisi EMsis, ma ostacolare in modo significativo la fluorescenza. Pertanto, in due fasi fissazione è critica sia per fluorescenza e microscopia EM. Il passo fissazione con formaldeide può essere omesso se performing live-misurazioni cellulari, come la fissazione finale può essere eseguita mediante trattamento con glutaraldeide.
7. Risultati rappresentativi
Questa procedura offre la capacità di fornire una molecola di interesse direttamente nel citoplasma cellulare eucariotica e monitorare la sua localizzazione e / o gli effetti di architettura cellulare e organeller da millimetro a multi-risoluzione nanometrica. Una illustrazione schematica della configurazione sperimentale e procedura è mostrato in Figura 2. Questa tecnica si basa sulla microiniezione di cellule cresciute su un vetrino laser vetro acidato reticolata (Fig. 3A), che dopo la microscopia confocale, è in grado di trasferire sia le cellule di interesse e la griglia alla resina Epon (Fig.3B).
Una tipica procedura di microiniezione CLEM produce immagini di fluorescenza e microscopio elettronico, che, quando correlati, consentono sia la localizzazione subcellulare e l'analisi ultrastrutturale. Cellule coltivate su vetrino coprioggetti fotoincisione gridded sono microiniettati con una molecola di interesse, dopo che le immagini in campo chiaro sono ottenute (Fig. 4A). Un colorante inerte monitoraggio è incorporato per distinguere cellule microiniettati da non microiniettati cellule (Fig. 4B). Confocali z-stacks sono ottenuti utilizzando un fluoroforo o altro identificatore attaccata alla molecola piccola microiniezione di interesse (Fig. 4C). Il campione viene fissato con glutaraldeide e processati per la microscopia elettronica. Microscopio elettronico si ottengono e sovrapposti sulle celle a cui corrispondono (Fig. 4D). Le aree che ospitano i segnali fluorescenti vengono esaminate più dettagliatamente a maggiore ingrandimento (Fig. 4E ).

Figura 1. Cronologia del procedimento microiniezione CLEM. A seconda della configurazione sperimentale, microiniezione e misure di fluorescenza possono essere eseguite nello stesso giorno. Preparazione del campione per la microscopia elettronica è più tempo debito dispendioso lunghi passi incubazioni e durerà 2-3 giorni. Analisi TEM e correlando i segnali di fluorescenza con immagini di microscopia elettronica può essere effettuato in un giorno.

Figura 2 illustrazione generale della procedura di microiniezione CLEM Fase 1:.. Individuare le celle che crescono sul vetrino laser vetro acidato con griglia e microinject molecola di interesse. Fase 2:. Catturare sia immagini in campo chiaro e fluorescenza confocale z-pile di cellule microiniettati Fase 3: prepararecoprioggetto per EM analisi e incorporare in resina Epon. Utilizzo di griglia trasferito, tagliare bloccare tali che le cellule di interesse sono al vertice Fase 4:. Tagliare sezioni seriali con ultramicrotomo Passo 5:. Correlate immagini fluorescenti con EM immagini.
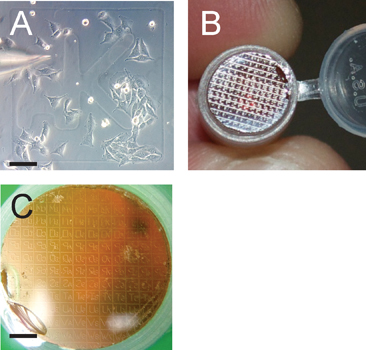
. Figura 3 griglia facilita l'identificazione di cellule di interesse Pannello A mostra la microiniezione di cellule cresciute di circa il 50% di confluenza,. Notare la griglia identificatore aK. Barra di scala è 100 micron. Pannello B mostra la griglia trasferito dal vetrino sul blocco polimerizzato resina Epon che sarà sezionato serialmente dopo la griglia di interesse viene individuato in un microscopio di dissezione. Pannello C mostra la griglia trasferito in preparazione per il sezionamento . Notare che il patter griglia trasferito è in retromarcia sul blocco di resina; scalbar e è di 1200 micron.
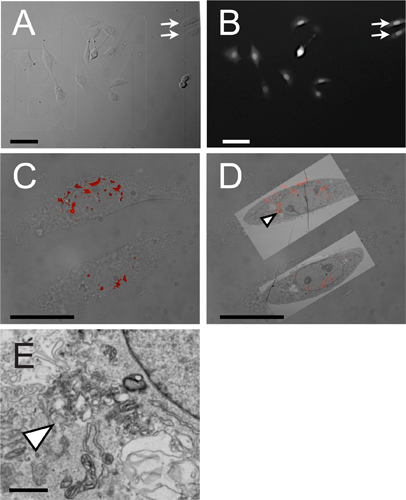
.. Figura 4 I risultati rappresentativi dalla luce microiniezione correlativo e microscopia elettronica Pannello A mostra la micrografia brillante campo delle cellule NRK che crescono su un vetrino laser vetro acidato griglia; frecce indicano due celle che sono visualizzate da CLEM in CD pannelli Pannello B mostra la fluorescenza. monitoraggio del colorante inerte, in questo caso Cascade blu, usato per identificare cellule che sono stati microiniettati. Pannello C mostra la sovrapposizione del campo luminoso e la firma fluorescenza di un Rhodamine marcato piccola molecola. Le due celle qui illustrati sono indicati da frecce in pannelli A e B. Pannello D rappresenta CLEM di campo luminoso, microscopia a fluorescenza ed elettronica,. Punta della freccia indica fluorescente puncta ripreso a maggiore ingrandimento E Pannello di barre di scala sono nel seguentebassi: Pannelli A e B, 100 micron; C & D, 50 pm, E, 100 nm.
Discussione
Il metodo qui presentato permette la fornitura diretta di proteine purificate, acidi nucleici, o piccole molecole nel citoplasma eucariotico e offre ultra analisi ad alta risoluzione attraverso la correlazione di microscopia a fluorescenza ed elettronica. L'uso di questo metodo è semplice ma robusto e possono essere eseguite in-house con molti servizi di base esistenti e / o opportunamente attrezzati laboratori di microscopia elettronica. La tecnica è anche soggetto a live-cella, permettendo all'utente d...
Divulgazioni
Nessun conflitto di interesse sono dichiarati.
Riconoscimenti
Ringraziamo i membri del laboratorio Alto per le discussioni utili. Ringraziamo anche lo strumento per imaging molecolare e cellulare del Southwestern Medical Center, in particolare il dottor Chris Gilpin, Tom Januszewski, e Laurie Mueller per la competenza tecnica e consulenza. Ringraziamo anche il Dott. Xionan Dong per la lettura critica del manoscritto. Questo lavoro è sostenuto da NIH sovvenzione AI083359 a NMA
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti |
| Coverslip Fotoincisioni e Live-cell piastra | MatTek | P35G-2-14-CGRD | |
| Texas Red | Invitrogen | D3329 | |
| Cascade Blu | Invitrogen | D7132 | |
| Rhodamine Labeling Kit | Thermo Scientific | 53002 | |
| 0,22 unità di micron di filtrazione centrifuga | Millipore | UFC30GV00 | |
| Pipette in vetro borosilicato | Sutter Instruments | BF100-50-10 | |
| Micropipetta Puller | Sutter Instruments | Modello P-97 | Utilizzare il programma # 4 dopo aver eseguito test di rampa |
| FemtoJet Microiniezione sistema | Eppendorf | InjectMan NI2 | |
| Coverslip rimozione dei liquidi | MatTek | PDCF OS 30 | |
| Technai Transmission Electron Microscope | FEI | Technai G2 BioTWIN | |
| Ultramicrotombe | Leica | EM UC6 |
Riferimenti
- Schmolze, D. B., Standley, C., Fogarty, K. E., Fischer, A. H. Advances in microscopy techniques. Arch. Pathol. Lab Med. 135, 255-263 (2011).
- Giepmans, B. N. Bridging fluorescence microscopy and electron microscopy. Histochem. Cell Biol. 130, 211-217 (2008).
- Mayhew, T. M., Muhlfeld, C., Vanhecke, D., Ochs, M. A review of recent methods for efficiently quantifying immunogold and other nanoparticles using TEM sections through cells, tissues and organs. Ann. Anat. 191, 153-170 (2009).
- Razi, M., Tooze, S. A. Correlative light and electron microscopy. Methods Enzymol. 452, 261-275 (2009).
- Svitkina, T. M., Borisy, G. G. Correlative light and electron microscopy of the cytoskeleton of cultured cells. Methods Enzymol. 298, 570-592 (1998).
- van Weering, J. R. Intracellular membrane traffic at high resolution. Methods Cell Biol. 96, 619-648 (2010).
- Polishchuk, R. S. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. J. Cell Biol. 148, 45-58 (2000).
- Lim, J., Danuser, G. Live Cell Imaging of F-actin Dynamics via Fluorescent Speckle Microscopy (FSM). J. Vis. Exp. (30), e1325 (2009).
- Selyunin, A. S. The assembly of a GTPase-kinase signalling complex by a bacterial catalytic scaffold. Nature. 469, 107-111 (2011).
- Semwogerere, D., Weeks, E. R. . Confocal Microscopy in Encyclopedia of Biomaterials and Biomedical Engineering. , (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon