Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
En tiempo real de imágenes digitales de los leucocitos del endotelio interacción en el daño por isquemia-reperfusión (IRI) del músculo cremáster Rata
En este artículo
Resumen
Digital microscopía intravital epifluorescencia de vénulas post-capilares de la microcirculación cremastérico es un método conveniente para obtener información sobre la interacción leucocito-endotelio En vivo En la lesión por isquemia-reperfusión (IRI) de músculo estriado. Estamos aquí proporcionar un protocolo detallado para realizar con seguridad la técnica y discutir sus aplicaciones y limitaciones.
Resumen
La isquemia-reperfusión (IRI) ha sido implicado en una gran variedad de condiciones patológicas tales como accidente cerebrovascular, infarto de miocardio, isquemia intestinal, así como seguir. Trasplante y cirugía cardiovascular una reperfusión del tejido previamente isquémico, aunque es esencial para la prevención de la irreversible las lesiones de tejidos, provoca inflamación excesiva del tejido afectado. Adyacente a la producción de especies reactivas del oxígeno, la activación del sistema del complemento y el aumento de la permeabilidad microvascular, la activación de los leucocitos es uno de los principales actores en la cascada patológica de la lesión tisular inflamatoria durante la reperfusión. 2, 3 activación de leucocitos es un proceso de varias fases que consiste de material, la adhesión firme y la transmigración y está mediada por una compleja interacción entre las moléculas de adhesión en respuesta a factores quimiotácticos como factores del complemento, quimiocinas, o el factor activador de plaquetas. 4 <p class = "jove_content"> Mientras rodadura de leucocitos en las vénulas postcapilares está predominantemente mediado por la interacción de selectinas 5 con sus ligandos de venta libre, la adhesión firme de los leucocitos al endotelio es selectina-controlado a través de la unión a las moléculas de adhesión intercelular (ICAM) y celulares vasculares las moléculas de adhesión (VCAM). 6, 7
Estándar de oro para el estudio in vivo de leucocitos del endotelio interacción es la técnica de microscopía intravital, describió por primera vez en 1968. 8
Aunque varios modelos de IRI (isquemia-reperfusión) se han descrito para diversos órganos, 9-12 sólo unos pocos son adecuadas para la visualización directa de reclutamiento de leucocitos en el lecho microvascular en un alto nivel de calidad de imagen. 8
Estamos aquí, promover el digital de microscopía intravital epifluorescencia de la vénula postcapilares en la microcirculación cremastéricode la rata 13 como un método práctico para analizar cualitativa y cuantitativamente el reclutamiento de leucocitos por el IRI de investigación en el tejido muscular estriado y proporcionar un manual detallado para llevar a cabo la técnica. Nos ilustran aún más las trampas más comunes y proporcionar consejos útiles que deberían permitir al lector a apreciar de verdad, y con seguridad realizar el método.
En un paso a paso el protocolo que describen cómo empezar con anestesia respiración controlada bajo vigilancia suficiente para evitar que el animal anestesiado con firmeza durante períodos más largos de tiempo. A continuación, describen la preparación cremastérico como una delgada lámina plana para la resolución óptica excepcional y proporcionar un protocolo para obtener imágenes de leucocitos en el IRI que ha sido bien establecido en nuestros laboratorios.
Protocolo
1. Anestesia y Vigilancia
- Apropiadas éticos nacionales e institucionales deben estar en su lugar antes de realizar experimentos con animales. Tras la aprobación de los comités de ética de anestesiar ratas macho Sprague Dawley con un peso desde 120 hasta 180 g. Entrega 2 a 3% en volumen isoflurano a una caja de plexiglás a través de vaporizador de isoflurano y coloque el interior de la rata.
- Tan pronto como el nivel adecuado de anestesia se consigue (falta de reacción a los pies o pellizco cola) a la rata se pondera y afeitado en la zona cervical ventral.
- Colocar la rata en decúbito dorsal sobre una almohadilla de calentamiento para mantener la temperatura corporal a 37 ° C y aplicar isoflurano a 2% en volumen utilizando una máscara de silicona.
Las siguientes etapas de preparación se logra mejor utilizando un microscopio quirúrgico.
- Para la preparación de la tráquea, la arteria carótida y la vena yugular, realizar una incisión de 2 cm de piel horizontal en la zona de Of de la horquilla esternal y movilizar a las glándulas salivales lateralmente.
- Usted ahora se enfrentan a los músculos del cuello ventral. Con cuidado, separar en la línea media y encontrar la tráquea. Exponer 1 - 2 cm de la tráquea y colocar una pinza de micro en virtud del mismo modo que lo levantaré.
- Ahora cortó a mitad de camino a través de la parte ventral de la tráquea. Tenga cuidado de no cortar hasta el final, si lo hace, el extremo del corte de la tráquea se vuelve a caer en el pecho y será muy difícil trabajar con ellos.
- Insertar un tubo Abbocath (14G) utilizado como tubo traqueal en la parte inferior de la tráquea, que ha sido previamente conectada a un ventilador de los animales. Sugerencia: una fijación firme en las mordazas del imán, así como la sutura de la tráquea alrededor del tubo es esencial para mantener el tubo traqueal en su lugar. Generalmente se utiliza Terylene 5/0 sutura, material de sutura sin embargo similar se puede utilizar.
- La respiración puede ser controlada por volumen (frecuencia, 35 - 45 respiraciones por minuto, volumen corriente, 4,5 a 5 ml, FiO 2 , 0,35 a 0,50;. isoflurano 1,5 a 2% en volumen) 14 atelectasia se puede prevenir, manteniendo un positivo final de la espiración la presión de 5 a 10 mm de H 2 O. 15
- Para la canulación carótida, el músculo esternohioideo derecho está separado mediante disección roma para localizar la arteria carótida.
- Separar cuidadosamente el nervio vago de la arteria carótida y la arteria en montar una pinza en ángulo micro para detener la sangre que fluye desde el corazón.
- Pase dos piezas de igual longitud de sutura debajo de la arteria carótida. En referencia al corazón, la sutura más distal está ligado fuertemente a ocluir la sangre que fluye desde la región de la cabeza mientras que la sutura proximal está atado flojamente alrededor de la arteria carótida.
- Con unas tijeras micro una pequeña incisión en la arteria carótida entre las dos ligaduras.
- Insertar un catéter de polietileno (0,28 mm de diámetro interior) llena con solución salina normal que está conectado a un transductor de presión.
- Remove las pinzas de micro y deslizar el catéter en la arteria más. A continuación, apretar la ligadura proximal alrededor de la arteria y el catéter. Consejo: La aplicación de una segunda sutura proximal evita el sangrado después de retirar las pinzas de micro.
- Atar la ligadura distal alrededor de la carótida y la sonda de anclaje adicional.
- Monitorear continuamente la anestesia por la tasa de monitoreo cardíaco y la presión arterial. Realizar análisis intermitentes gases en sangre arterial con un analizador de gases en sangre. 16 Una frecuencia cardíaca inferior a 300 latidos por minuto o superior a 360 latidos por minuto, así como una presión arterial media cayendo por debajo de 80 mmHg durante más de 5 minutos son los criterios para la exclusión. 17, 18 Mantener la sangre pH dentro de los límites fisiológicos (7,35-7,45). En caso de que el experimento tiene que ser terminada debido a los tipos de vigilancia anormales, cortes en el animal por dislocación cervical o exanguation.
Para la aplicación intravenosa de tintes fluorescentes u otros fármacos of interés, haga lo siguiente:
- Enfoque el área de la vena yugular izquierda con el microscopio quirúrgico.
- Con pinzas en cada mano, romper la fascia delgada para revelar la vena yugular. Montar la vena de una pinza en ángulo micro. El flujo sanguíneo se detendrá.
- Con unas pinzas, dos piezas de igual longitud de la sutura se pasa por debajo de la vena yugular en concordancia con la canulación carótida. Ate la sutura distal con fuerza y la sutura proximal libremente alrededor de la vena yugular.
- Haz un pequeño corte en la vena yugular e insertar un catéter de polietileno (0,28 mm de diámetro interior), que ha sido limpiada con una solución salina. Marcar que la incisión y canulación puede ser más exigente y consume mucho tiempo que el de la carótida.
- Pase el catéter hacia el corazón y apretar la ligadura más cercana al corazón alrededor de la vena y el catéter.
- Después de la permeabilidad de conformación, ate ligadura distal alrededor del catéter. Sugerencia: la fijación adicional de la boº catéteres con cinta puede evitar desalojo.
- Enjuagar catéteres con frecuencia para evitar la coagulación intraluminal.
2. Preparación del músculo Cremaster
- Usamos una etapa de aluminio de 1,5 a 2 cm de espesor para obtener imágenes de cremastérico. La etapa rápidamente adopta la temperatura deseada de la almohadilla de calentamiento aliviando así el control térmico del tejido cremastérico. Esto es crucial para los estudios de la inflamación. Alternativamente una plataforma de plexiglás se puede utilizar aunque la regulación de la temperatura cremastérico es más difícil. Coloque el escroto en el centro de la etapa.
- La incisión inicial se produce en la piel y la fascia espermática externa por encima del escroto en el final distal seguida de dilatación cuidado con el espacio subdérmico con unas tijeras finas. Evite tocar el tejido subyacente con los instrumentos.
- Tan pronto como el tejido se expone que se humedece con pre-calentada (37 ° C) solución salina tamponada con fosfato wiª calcio y magnesio. Aplicar la solución con regularidad a cualquier tejido expuesto.
- El tejido conectivo entre la fascia espermática externa y el músculo cremáster se retira cuidadosamente para liberar el músculo cremáster del tejido circundante.
- La superficie exterior del músculo cremáster es entonces cuidadosamente limpiado de tejido conectivo. Superfusión continua durante los hidratos de disección del tejido conectivo, lo que facilita la visibilidad y la eliminación.
- Suture el extremo distal del saco cremáster para sujetar y ampliar ligeramente el extremo del saco.
- Incida el extremo distal del saco en la cara ventral y alargado de la incisión proximal utilizando tijeras micro. Con cuidado, cauterizar los vasos sangrantes a lo largo de las líneas de incisión utilizando un cauterio térmico. Evite la cauterización innecesarios adicionales para limitar los estímulos inflamatorios. Consejo:. Dinámica de flujo de sangre cerca de la periferia de la preparación son alteradas por este daño tisular 19 Por lo tanto, para minimizar elsí afecta a la recopilación de datos, los vasos sanguíneos cerca del centro de la preparación debe ser utilizada para obtener imágenes.
- El cremáster abierta quede plana sobre el pedestal de aluminio, aunque aún está conectado por un ligamento delgada en el epidídimo por debajo del testículo. Como reflejo de los testículos a un lado expone este ligamento incluyendo una pequeña arteria y la vena que se conecta al epidídimo. El uso del cauterio para sellar los vasos y emplear las tijeras micro para cortar el ligamento de conexión entre los testículos y el tejido cremastérico.
- Empuje suavemente la espalda del testículo, aislado en el canal inguinal. Otros autores extirpar el testículo luego de la ligadura proximal (orquiectomía), junto con la plataforma de moda inguinal asociada. 20 En un modelo sensible como la inducida por la activación de leucocitos IRI que tratamos de evitar todos los estímulos quirúrgicos adicionales, por lo tanto, nos abstenemos de la resección del testículo, que normalmente no es necesario para obtener la exposición suficiente del músculo cremáster.
- Además de la primerala fijación de sutura cuatro bordes de tejido (dos en cada lado) y se unen los hilos a las cintas de precaución para difundir el tejido cremastérico radialmente en el escenario de aluminio. Dejando un espacio entre el escenario de aluminio y la entrada externa del canal inguinal simplifica cremastérico recorte posterior de la isquemia.
- Coloque dos extremos del catéter de polietileno (0,28 mm de diámetro interior) cerca del tejido cremastérico para la configuración de superfusión. Asegúrese de que la luz es libre de aire para evitar burbujas de aire en la cámara de fluido posible.
- Dibuja una línea de vaselina (vaselina) alrededor del músculo cremáster usando una jeringa. La línea se debe extender el tamaño de la hoja de cubierta que se utiliza para la cobertura.
- Para crear una cámara de fluido, colocar una hoja de cubierta cuadrada (32 x 32 mm) sobre el tejido cremastérico y firmemente fijar los bordes de la línea de vaselina.
- En caso de que el tejido no se cremastérico superfused con un medicamento específico, la sustitución continua de la gripe que rodeaIdentificación no es esencial. Una sola aplicación de solución salina tamponada con fosfato de calcio y magnesio en la cámara crea entonces puede ser suficiente. Estimulación local con fármacos sin embargo debe ser realizado de forma continua mediante una bomba de micro-perfusión a una velocidad de 3 ml por hora.
- El tejido cremastérico está ahora listo para la imagen microscópica.
3. Configuración intravital
La configuración básica intravital puede variar. Para imágenes de epifluorescencia los experimentos deben ser ejecutados en un cuarto oscuro.
- El animal se transfiere a la etapa de un microscopio epifluorescente intravital equipado con un LED 470 nm fuente luminosa para epi-iluminación. Utilizar un objetivo de inmersión en agua (20 x / 1,0) para conseguir aumentos de aproximadamente 800 x. Anote las observaciones por medio de una cámara digital de alta resolución y guardar registros en un ordenador personal para la evaluación en línea.
- Para el etiquetado de los leucocitos, inyectar rodamina6G por vía intravenosa a través del catéter yugular a concentraciones de 0,4 peso corporal mg / kg.
- Elija una vénula postcapilares para la observación. Tamaño de la embarcación debe oscilar entre 20 a 60 micras y el flujo sanguíneo debe ser suficiente. Para reducir al mínimo la influencia de la pre-activación del tejido, sólo los buques en el que leucocitos de rodadura es <20 cells/30 segundo y el número de células adherentes <10 cells/200μm de endotelio venular puede ser utilizada para su posterior análisis.
- Si es posible, hasta tres vénulas post-capilares se pueden utilizar para la observación, sin embargo, debe estar ubicado en una sección correspondiente del tejido cremastérico que no induzca a los vasos en diferentes momentos.
4. Por isquemia-reperfusión (IIR)
- Vamos tejido estabilizar durante 30 minutos.
- Lleve a cabo una grabación de 30 segundos para establecer los valores basales de leucocitos de rodadura y la adherencia. Idealmente, generar un total de tres grabaciones basales para verificar celularlos números y para obtener las desviaciones estándar.
- Suavemente colocar un clip de buque Biemer alrededor del extremo proximal de la muy tejido cremastérico expuesta mediante el uso de las pinzas de aplicación. Estasis debe ocurrir inmediatamente y pueden ser visualizadas por microscopía de epifluorescencia en la sección de buque observado.
- Una variedad de cursos de tiempo puede ser utilizado en función del nivel de daño necesario. Nosotros aplicamos los 30 minutos de tiempo de isquemia según lo descrito por otros autores 21-23. Retire la abrazadera de buques después. Permitir corriente de la sangre se estabilice durante otros 15 minutos.
- Grabaciones posteriores de 30 segundos de duración puede hacerse durante todo el período de reperfusión (por ejemplo, 30 segundos cada 15 minutos). Guardar grabaciones en formato digital para análisis fuera de línea.
- Para la terminación del experimento, la rata se sacrificaron por dislocación cervical bajo anestesia suficiente pulsando un instrumento romo como el borde romo de una hoja de tijera en la base del cráneo. Con la otramano, la base de la cola se sacó rápidamente, provocando la separación de las vértebras cervicales del cráneo.
5. Vídeo Análisis de reproducción en línea
- Para el análisis de la reproducción de vídeo en línea, es útil utilizar el software que permite la selección de imágenes distintas y la observación de la secuencia de vídeo a cámara lenta. Ajustar el contraste y el brillo adecuadamente. Utilizamos el software proporcionado por el fabricante del microscopio que permite mediciones de la longitud y la ampliación digital.
- Para la cuantificación de leucocitos de rodadura, definir una línea virtual que cruza verticalmente el barco que es consistente en todos los registros. Cuente el número de leucocitos de rodadura que pasan a la línea dentro de los 30 segundos de forma manual.
- Para la cuantificación de los leucocitos adherentes, definir una sección de 200 m buque que es consistente en todos los registros de 23 Contar el número de leucocitos claramente visibles que permanecen estáticos durante 30 segundos -. Lo que deficado como adherente. 24
6. Los resultados representativos
IRI del músculo cremáster no tiene ningún efecto sobre la presión arterial media (PAM), el ritmo cardíaco y pH de la sangre
Usando la preparación anterior (Figura 1), se determinó la microcirculación en el IRI en un protocolo de dos horas, sin embargo, un tiempo de observación mucho más tiempo de hasta 6 horas es posible. Como se muestra en la Figura 2, el IRI del músculo cremáster no tiene efectos significativos sobre la circulación macrohemodynamic rata como presión arterial media y la frecuencia cardíaca permanecer estable durante todo el período de investigación. Además, monitoreamos la homeostasis mediante mediciones frecuentes de la sangre arterial, pH que osciló dentro de los límites fisiológicos y no mostraron significativas entre los grupos entre las diferencias.
IRI induce leucocitos de rodadura en la circulación cremastérico
La interacción endotelial de leucocitos es una claveevento en la inflamación aguda. Por medio de microscopía intravital hemos observado un incremento en función del tiempo en el número de leucocitos de rodadura en el IRI del músculo cremáster (Figura 3) concordantes con los datos anteriores 21, 25. Balanceo montado sobre el tiempo de observación de dos horas para un máximo de 137,63 ± 22,55% del valor inicial después de 120 minutos de tiempo de reperfusión y luego alcanzó la significación estadística en comparación con los animales operación simulada (137,63 ± 22,55 frente a 99,43 ± 14,04% del valor basal).
IRI induce la adhesión de leucocitos en la circulación cremastérico
Para la evaluación adicional de la interacción leucocito-endotelio se analizó la adhesión de leucocitos en una sección de 200 m del vaso. IRI indujo un incremento en el número de leucocitos adherentes que superaron significativamente los valores de operación simulada animales después de 60 minutos (118,33 ± 6,83 vs 96,27 ± 5,78% del valor basal) y ASCE másnded por 120 minutos de reperfusión (Figura 3B).
En resumen, el descrito en el modelo in vivo proporciona datos consistentes de activación leucocitaria aguda en la supervivencia de los animales, mientras que el IRI y la estabilidad de la circulación está garantizada.
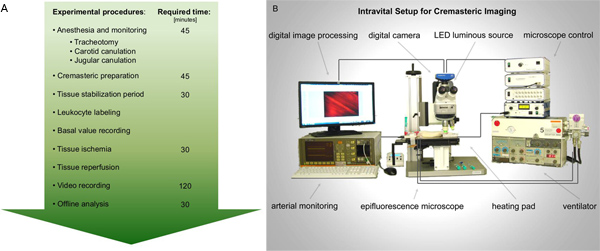
Figura 1. Diagrama de flujo para un rendimiento A. intravital microscopía de epifluorescencia en la lesión por isquemia-reperfusión del músculo cremáster de la rata. A raíz de los preparativos necesarios para la anestesia y el control, el músculo cremáster ratas se expone para la imagen. Los registros de activación de los leucocitos se toman antes y después de la isquemia tisular. Tras el análisis de vídeo se realiza mejor en línea. B. La figura esquemática de la configuración intravital propuesta. Haga clic aquí para ver más grande la figura .
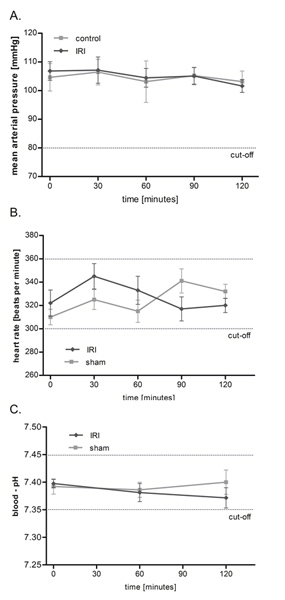
Figura 2. IRI del músculo cremáster no tiene ningún efecto sobre la presión arterial media (PAM), frecuencia cardíaca y pH de la sangre. La presión arterial media (A) y la frecuencia cardíaca (B) fueron monitoreados cada 30 minutos durante todo el experimento a través del transductor de presión después de la canulación del derecho la arteria carótida. Medición de la sangre arterial de pH (C) se realizó después de 0, 60 y 120 minutos. Los valores son medias ± SEM de 6 ratas diferentes, oscilando en los niveles fisiológicos, sin diferencias significativas entre los grupos. Haga clic aquí para ver más grande la figura .
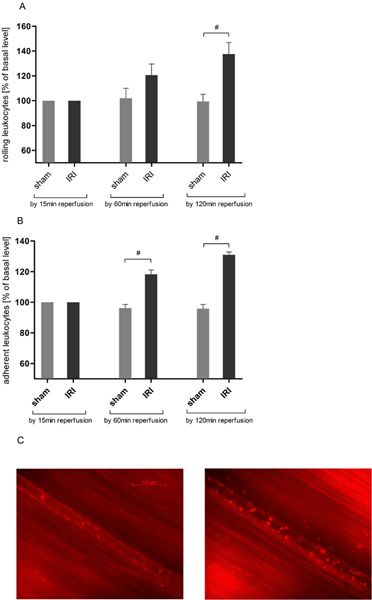
Figura 3. IRI aumenta los leucocitos-Endotelial interacción en la circulación cremastérico. Después de etiquetado de los leucocitos con rodamina 6G (0,4 mg / kg de peso corporal) microscopía de epifluorescencia intravital se utilizó para determinar leucocitos del endotelio interacción en la lesión por reperfusión en un protocolo de 120 minutos después de 30 minutos de isquemia tisular. Los registros fueron llevados a un aumento de aproximadamente × 800. A. IRI aumenta significativamente el número de leucocitos de rodadura en vénulas post-capilares del músculo cremáster por 120 minutos de reperfusión, mientras que de leucocitos de rodadura se mantiene estable durante todo el experimento en el tejido cremastérico que no se sometieron a la isquemia. Los valores son medias ± SEM de 6 ratas observadas. # P <0,05 con la prueba de t no apareada. B. El número de leucocitos adherentes es significativamente mayor en un escogido de forma aleatoria la sección 200μm vasos postcapilares después de 30 minutos de isquemia cremastérico y posteriores 60 minutos de la reperfusión del tejido. Resultados vengarse mesesre pronunciada después de un período de reperfusión dos horas. Los valores son medias ± SEM de 6 ratas observadas. # P <0,05 con la prueba de t no apareada. C. imágenes representativas de una vénula poscapilar antes de la isquemia (izquierda) y 120 minutos después de que el IRI (derecha). Haga clic aquí para ver más grande la figura .
Access restricted. Please log in or start a trial to view this content.
Discusión
Leucocitos del endotelio interacción, la producción de especies reactivas del oxígeno y la activación del sistema del complemento son las principales características de la disfunción del tejido inducido por el IRI. 26 La microcirculación del tejido afectado es considerado como el sitio integral para el inicio inflamatoria. Aparte de los experimentos ex vivo, como los ensayos de la cámara de flujo 27, 28, es obligatorio proporcionar modelos bien establecidos de imagen intravital par...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por una beca de la "Deutsche Forschungsgemeinschaft" a SU Eisenhardt (IE 866/1-1).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del equipo: | Empresa: | Artículo número: | Comentarios: |
| Forene 100% (V / V) | Abad | B506 | API de isoflurano |
| Terylene sutura | Serag Weissner | OC108000 | |
| Portex Bellas Diámetro tubo de polietileno | Smiths Medical | 800/100/100 | 0,28 mm de diámetro interior |
| 0,9% de solución salina | Fresinus Kabi | 808771 | |
| -A cambio de punta de lujo kit de cauterio | Bovie Medical | Del1 | |
| Abbocath-T 14G | Venisystems | G713- A01 | utilizado como tubo de lente |
| Servo 900C Ventilador | Maquet | utilizada como ventialtor animales | |
| Transductor de presión lógico | Smiths Medical | MX1960 | |
| Sirecust 404 Monitor de | Siemens | ||
| ABL 700 Analizador de mesa | Radiómetro | para la medición de gases en sangre | |
| Almohadilla eléctrica | Effenberger | 8319 | |
| Aluminio fase | ALFUN | AW7022 | |
| Microscopio quirúrgico OPMI 6-SDFC | Carl Zeiss | ||
| Microcirugía de los instrumentos de laboratorio de set | S & T | 767 | |
| Biemer clip de buques | Diener | 64.562 | |
| La aplicación de fórceps | Diener | 64.568 | para el clip de buques Biemer |
| Rodamina 6G | Sigma-Aldrich | R4127 | |
| Vaselina blanca DAB | Winthrop | 2726853 | |
| Cubreobjetos | 32x32 mm | ||
| Configuración intravital | |||
| Zeis Axio Scope A-1 MAT | Carl Zeis | 490036 | microscopio de epifluorescencia |
| 470 nm LED | Carl Zeis | 423052 | fuente de luz fluorescente |
| 2 Sistema de Colibri | Carl Zeis | 423052 | |
| W Plan-Apochromat 20x / 1,0 DIC | Carl Zeis | 421452 | objetivo de inmersión en el agua |
| AxioCam MRM Rev. 3 FireWire | Carl Zeis | 426509 | cámara digital de alta resolución |
| Axio LE software de la visión | Carl Zeis | 410130 | utilizar para análisis fuera de línea |
Referencias
- Cetin, C. Protective effect of fucoidin (a neutrophil rolling inhibitor) on ischemia reperfusion injury: experimental study in rat epigastric island flaps. Ann. Plast. Surg. 47, 540-546 (2001).
- Granger, D. N. Role of xanthine oxidase and granulocytes in ischemia-reperfusion injury. Am. J. Physiol. 255, H1269-H1275 (1988).
- Lazarus, B. The role of mast cells in ischaemia-reperfusion injury in murine skeletal muscle. J Pathol. 191, 443-448 (2000).
- van den Heuvel, M. G. Review: Ischaemia-reperfusion injury in flap surgery. J. Plast. Reconstr. Aesthet. Surg. 62, 721-726 (2009).
- Rosen, S. D. Cell surface lectins in the immune system. Semin. Immunol. 5, 237-247 (1993).
- van der Flier, A., Sonnenberg, A. Function and interactions of integrins. Cell Tissue Res. 305, 285-298 (2001).
- Panes, J., Perry, M., Granger, D. N. Leukocyte-endothelial cell adhesion: avenues for therapeutic intervention. Br. J. Pharmacol. 126, 537-550 (1999).
- Gavins, F. N., Chatterjee, B. E. Intravital microscopy for the study of mouse microcirculation in anti-inflammatory drug research: focus on the mesentery and cremaster preparations. J. Pharmacol. Toxicol. Methods. 49, 1-14 (2004).
- Sutton, T. A. Injury of the renal microvascular endothelium alters barrier function after ischemia. Am. J. Physiol. Renal. Physiol. 285, 191-198 (2003).
- Serracino-Inglott, F. Differential nitric oxide synthase expression during hepatic ischemia-reperfusion. Am. J. Surg. 185, 589-595 (2003).
- Eppinger, M. J. Mediators of ischemia-reperfusion injury of rat lung. Am J Pathol. 150, 1773-1784 (1997).
- Dumont, E. A. Real-time imaging of apoptotic cell-membrane changes at the single-cell level in the beating murine heart. Nat Med. 7, 1352-1355 (2001).
- Baez, S. An open cremaster muscle preparation for the study of blood vessels by in vivo microscopy. Microvasc Res. 5, 384-394 (1973).
- Woeste, G. Octreotide attenuates impaired microcirculation in postischemic pancreatitis when administered before induction of ischemia. Transplantation. 86, 961-967 (2008).
- Schultz, J. E., Hsu, A. K., Gross, G. J. Morphine mimics the cardioprotective effect of ischemic preconditioning via a glibenclamide-sensitive mechanism in the rat heart. Circ. Res. 78, 1100-1104 (1996).
- Dobschuetz, E. von Dynamic intravital fluorescence microscopy--a novel method for the assessment of microvascular permeability in acute pancreatitis. Microvasc Res. 67, 55-63 (2004).
- Vutskits, L. Adverse effects of methylene blue on the central nervous system. Anesthesiology. 108, 684-692 (2008).
- Takasu, A. Improved survival time with combined early blood transfusion and fluid administration in uncontrolled hemorrhagic shock in rats. J. Trauma. 8, 312-316 (2010).
- Proctor, K. G., Busija, D. W. Relationships among arteriolar, regional, and whole organ blood flow in cremaster muscle. Am. J. Physiol. 249, 34-41 (1985).
- Bagher, P., Segal, S. S. The Mouse Cremaster Muscle Preparation for Intravital Imaging of the Microcirculation. J. Vis. Exp. (52), e2874(2011).
- Kanwar, S., Hickey, M. J., Kubes, P. Postischemic inflammation: a role for mast cells in intestine but not in skeletal muscle. Am. J. Physiol. 275, 212-218 (1998).
- Leoni, G. Inflamed phenotype of the mesenteric microcirculation of melanocortin type 3 receptor-null mice after ischemia-reperfusion. FASEB J. 22, 4228-4238 (2008).
- Simoncini, T. Interaction of oestrogen receptor with the regulatory subunit of phosphatidylinositol-3-OH kinase. Nature. 407, 538-541 (2000).
- Woollard, K. J. Pathophysiological levels of soluble P-selectin mediate adhesion of leukocytes to the endothelium through Mac-1 activation. Circ. Res. 103, 1128-1138 (2008).
- Mori, N. Ischemia-reperfusion induced microvascular responses in LDL-receptor -/- mice. Am. J. Physiol. 276, H1647-H1654 (1999).
- Eisenhardt, S. U. Monitoring Molecular Changes Induced by Ischemia/Reperfusion in Human Free Muscle Flap Tissue Samples. Ann. Plast. Surg. , (2011).
- Eisenhardt, S. U. Generation of activation-specific human anti-{alpha}M{beta}2 single-chain antibodies as potential diagnostic tools and therapeutic agents. Blood. 109, 3521-3528 (2007).
- Eisenhardt, S. U. Dissociation of pentameric to monomeric C-reactive protein on activated platelets localizes inflammation to atherosclerotic plaques. Circ Res. 105, 128-137 (2009).
- Eisenhardt, S. U. C-reactive protein: how conformational changes influence inflammatory properties. Cell Cycle. 8, 3885-3892 (2009).
- Granger, D. N. Physiology and pathophysiology of leukocyte adhesion. , Oxford University Press. New York. 520(1995).
- Baatz, H. Kinetics of white blood cell staining by intravascular administration of rhodamine 6G. Int. J. Microcirc. Clin. Exp. 15, 85-91 (1995).
- Mempel, T. R. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr. Opin. Immunol. 16, 406-417 (2004).
- Abbitt, K. B., Rainger, G. E., Nash, G. B. Effects of fluorescent dyes on selectin and integrin-mediated stages of adhesion and migration of flowing leukocytes. J. Immunol. Methods. 239, 109-119 (2000).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados