Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
En temps réel d'imagerie numérique de leucocytes-endothélial interaction dans l'ischémie-reperfusion (IRI) du muscle Cremaster Rat
Dans cet article
Résumé
Numérique intravitale microscopie à épifluorescence des veinules post-capillaires de la microcirculation crémastérien est une méthode pratique pour obtenir un aperçu de leucocytes-endothélial interaction In vivo En cas d'ischémie-reperfusion (IRI) du tissu musculaire strié. Nous avons ici de fournir un protocole détaillé pour effectuer en toute sécurité de la technique et de discuter de ses applications et ses limites.
Résumé
D'ischémie-reperfusion (IRI) a été impliqué dans un large éventail de conditions pathologiques telles que l'accident vasculaire cérébral, infarctus du myocarde, l'ischémie intestinale ainsi que suite à la greffe et de la chirurgie cardio-vasculaire. Une reperfusion des tissus ischémiques précédemment, si elle est indispensable pour la prévention de l'irréversible lésion des tissus, provoque une inflammation excessive du tissu affecté. Adjacent à la production d'espèces réactives de l'oxygène, l'activation du système du complément et augmentation de la perméabilité microvasculaire, l'activation des leucocytes est l'un des principaux acteurs dans la cascade pathologique de la lésion tissulaire inflammatoire lors de la reperfusion. 2, 3 l'activation des leucocytes est un processus en plusieurs étapes consistant du matériel, l'adhésion ferme et la transmigration et est médiée par une interaction complexe entre les molécules d'adhérence en réponse à chimiotactiques tels que les facteurs du complément, des chimiokines, ou facteur d'activation plaquettaire 4. <p class = "jove_content"> Bien roulement des leucocytes dans veinules post-capillaires est principalement médiée par l'interaction des sélectines 5 avec leurs ligands contre, l'adhérence ferme des leucocytes à l'endothélium est la sélectine-contrôlé via une liaison à des molécules d'adhésion intercellulaire (ICAM) et vasculaire cellulaires molécules d'adhésion (VCAM). 6, 7
Étalon-or pour la observation in vivo de leucocytes-endothélium interaction est la technique de microscopie intravitale, décrite pour la première en 1968 8.
Bien que différents modèles de l'IRI (ischémie-reperfusion) ont été décrits pour différents organes, 9-12 seulement quelques-uns sont adaptés à la visualisation directe de recrutement des leucocytes dans le lit microvasculaire sur un niveau élevé de qualité de l'image 8.
Nous avons ici de promouvoir le numérique microscopie intravitale épifluorescence de la veinule postcapillaire dans la microcirculation crémastériendu rat 13, comme une méthode pratique pour analyser qualitativement et quantitativement le recrutement des leucocytes pour l'IRI-recherche dans le tissu musculaire strié et de fournir un manuel détaillé pour la réalisation de la technique. Nous illustrons les pièges courants et fournir des conseils utiles qui devraient permettre au lecteur de vraiment apprécier, et effectuer en toute sécurité la méthode.
Dans une étape par étape le protocole que nous dépeignent la façon de commencer avec une anesthésie respiration contrôlée sous surveillance suffisante pour maintenir fermement l'animal anesthésié pendant de longues périodes de temps. Nous décrivons ensuite la préparation crémastérien comme une feuille plate et mince pour la résolution optique exceptionnelle et de fournir un protocole pour l'imagerie des leucocytes dans l'IRI qui a été bien établi dans nos laboratoires.
Protocole
1. Anesthésie et de surveillance
- Appropriées d'éthique nationaux et institutionnels devraient être en place avant de procéder à des expérimentations animales. Suite à l'approbation du comité d'éthique des rats Sprague-Dawley mâles anesthésier avec un poids de 120 à 180 g. Livrer de 2 à 3% vol isoflurane à une boîte de plexiglas par vaporisateur l'isoflurane et le placer à l'intérieur de rat.
- Dès que le niveau approprié de l'anesthésie est réalisée (absence de réaction à l'orteil ou pincement de la queue) chez le rat est pondéré et rasé sur la zone ventrale col de l'utérus.
- Placez le rat en décubitus dorsal sur un coussin chauffant pour maintenir la température du corps à 37 ° C et d'appliquer l'isoflurane à 2% vol en utilisant un masque de silicone.
Les étapes de préparation suivantes sont plus accomplie en utilisant un microscope chirurgical.
- Pour la préparation de la trachée, l'artère carotide et la veine jugulaire, effectuer une incision de 2 cm la peau horizontal dans la zone of la fourchette sternale et de mobiliser les glandes salivaires latéralement.
- Vous avez maintenant faire face aux muscles du cou ventrales. Soigneusement les séparer dans la ligne médiane et de trouver la trachée. Exposer 1 - 2 cm de la trachée et placer une pince micro, de sorte à le porter vers le haut.
- Maintenant fendre vers le milieu de la face ventrale de la trachée. Veillez à ne pas couper tout le chemin à travers, si vous le faites, l'extrémité coupée de la trachée se glisser de nouveau dans la poitrine et être très difficile de travailler avec.
- Insérer un tube Abbocath (14G) utilisé comme tube de trachée dans la partie inférieure de la trachée, qui a été préalablement connecté à un ventilateur animale. Astuce: la fixation ferme sur pinces magnétiques ainsi que la suture de la trachée à travers le tube est essentiel de garder le tube trachéal en place. En règle générale, nous utilisons Terylene 5/0 de suture, matériel de suture cependant similaire peut être utilisée.
- Respiration peut alors être volume contrôlé (fréquence, 35 - 45 respirations par minute; volume courant, de 4,5 à 5 ml; FiO 2 , de 0,35 à 0,50;. isoflurane de 1,5 à 2% vol) 14 Atélectasie peut être prévenue par le maintien d'un expiratoire positive pression de 5 à 10 mm de H 2 O. 15
- Pour la canulation carotidienne, le muscle sterno droit est séparée par dissection pour localiser l'artère carotide.
- Séparer le nerf vague soigneusement de l'artère carotide et l'artère monter sur une pince à angle micro pour arrêter le sang qui coule du cœur.
- Passez deux pièces d'égale longueur de suture sous l'artère carotide. En ce qui concerne le cœur, la suture plus distale est liée étroitement à occlure sang qui coule de la région de la tête tandis que la suture proximale est liée de façon lâche autour de l'artère carotide.
- Avec des ciseaux micro une petite incision est faite dans l'artère carotide entre les deux ligatures.
- Insérer un cathéter polyéthylène (0,28 mm de diamètre intérieur) rempli de solution saline normale qui est connecté à un transducteur de pression.
- Remove les micropincettes et du fil de la sonde plus loin dans l'artère. Puis serrer la ligature proximale autour de l'artère et le cathéter. Astuce: Application d'un second fil de suture proximale empêche le saignement après avoir enlevé les pinces micro.
- Attachez la ligature distale autour de la carotide et le cathéter pour l'ancrage supplémentaire.
- Surveiller en permanence l'anesthésie par le rythme cardiaque de surveillance et de la pression artérielle. Effectuer intermittents artérielles analyses des gaz du sang en utilisant un analyseur des gaz du sang. 16 A de la fréquence cardiaque inférieure à 300 bpm ou supérieur à 360 bpm, ainsi que d'une pression artérielle moyenne tombant en dessous de 80 mmHg pendant plus de 5 minutes sont des critères d'exclusion. 17, 18 Maintenir le sang pH dans les limites physiologiques (de 7.35 à 7.45). Dans le cas où l'expérience doit être interrompue en raison des taux anormaux de surveillance, scarifier l'animal par la dislocation du cou ou exanguation.
Pour l'application intraveineuse de colorants fluorescents ou d'autres médicaments of intérêt, effectuez les opérations suivantes:
- Focaliser la zone de la veine jugulaire gauche avec le microscope chirurgical.
- Avec une pince dans chaque main, déchirer le fascia mince pour révéler la veine jugulaire. Montez la veine sur une pince à angle micro. La circulation du sang s'arrête alors.
- En utilisant des pinces, deux morceaux de longueur égale de suture sont passés sous la veine jugulaire concordantes à l'canulation carotidienne. Attacher le fil de suture distale hermétiquement et la suture proximale de façon lâche autour de la veine jugulaire.
- Faire une petite incision dans la veine jugulaire et insérer un cathéter en polyéthylène (0,28 mm de diamètre intérieur) qui a été rincé avec une solution saline. Marquez ce que l'incision et canulation peut être plus exigeante et plus de temps que celui de la carotide.
- Enfiler le cathéter vers le cœur et serrer la ligature la plus proche du coeur autour de la veine et le cathéter.
- Après la perméabilité conforme, ligature distale autour du cathéter. Astuce: la fixation supplémentaire de bocathéters e avec du ruban adhésif peut empêcher tout déplacement.
- Rincer les cathéters fréquemment pour éviter la coagulation intraluminale.
2. Préparation de la crémaster
- Nous utilisons un stade d'aluminium de 1,5 à 2 cm d'épaisseur pour l'imagerie crémastérien. L'étape adopte rapidement la température souhaitée du coussin chauffant allégeant ainsi le contrôle thermique du tissu crémastérien. Ceci est crucial pour les études de l'inflammation. Sinon, une plate-forme de plexiglas peut être utilisé si la réglementation de la température crémastérien est plus difficile. Placez le scrotum dans le centre de la scène.
- L'incision initiale est faite dans la peau et fascia spermatique externe au-dessus du scrotum à la fin très distale suivie par une dilatation prudente de l'espace sous-cutané à l'aide de ciseaux fins. Évitez de toucher le tissu sous-jacent avec les instruments.
- Dès que le tissu est exposé, il est humidifié avec de pré-chauffée (37 ° C) une solution saline tamponnée de phosphate wie de calcium et de magnésium. Appliquer la solution régulièrement pour tous les tissus exposés.
- Le tissu conjonctif entre le fascia spermatique et externe du muscle crémaster est soigneusement enlevé pour libérer le muscle crémaster du tissu environnant.
- La surface extérieure du muscle crémaster est alors prudemment effacée du tissu conjonctif. Superfusion continue pendant hydrates de dissection du tissu conjonctif, ce qui facilite la visibilité et l'enlèvement.
- Suturer l'extrémité distale du sac crémaster à maintenir vers le bas et légèrement prolonger l'extrémité du sac.
- Incisez l'extrémité distale du sac sur la face ventrale et allongé l'incision proximale avec des ciseaux micro. Soigneusement cautériser saignements navires le long des lignes d'incision utilisant une cautérisation thermique. Évitez la cautérisation inutile de limiter supplémentaires stimuli inflammatoires. Astuce:. La dynamique des flux de sang près de la périphérie de la préparation sont modifiées par le présent des dommages aux tissus 19 C'est pourquoi, afin de minimiser l'soi affecte la collecte des données, des vaisseaux sanguins près du centre de la préparation doit être utilisée pour l'imagerie.
- Le crémaster ouvert repose à plat sur le socle en aluminium tout en restant connecté par un ligament mince à l'épididyme sous le testicule. Reflétant le testicule d'un côté expose ce ligament, y compris une petite artère et la veine qui se connectent à l'épididyme. Utilisez le cautère pour sceller les vaisseaux et d'employer les ciseaux micro pour couper le ligament conjonctif entre testicule et de tissus crémastérien.
- Poussez doucement le dos du testicule isolé dans le canal inguinal. D'autres auteurs réséquer le testicule après ligature proximale (orchidectomie) avec le tampon de la mode inguinale associée 20. Dans un modèle sensible que l 'IRI induite par l'activation des leucocytes nous essayons d'éviter tous les stimuli supplémentaires chirurgicales, par conséquent, nous nous abstenons de résection du testicule, qui n'est généralement pas nécessaire pour obtenir une exposition suffisante du muscle crémaster.
- En plus de la premièresuture de fixation quatre bords du tissu (deux de chaque côté) et fixer les fils à bandes à répandre prudemment le tissu crémastérien radialement sur la scène en aluminium. Laissant un espace entre la scène d'aluminium et l'entrée extérieure du canal inguinal simplifie écrêtage crémastérien ultérieure de l'ischémie.
- Lieu deux extrémités de cathéter polyéthylène (0,28 mm de diamètre intérieur) à proximité de l'tissu crémastérien pour la configuration de surfusion. Assurez-vous que la lumière est libre de l'air pour éviter les bulles d'air dans la chambre de fluide éventuelle.
- Tracez une ligne de gelée de pétrole (Vaseline) autour du muscle crémaster aide d'une seringue. La ligne doit s'étendre la taille de la lamelle qui est utilisé pour la couverture.
- Pour créer une chambre de fluide, placer une lamelle carrée (32 × 32 mm) sur le tissu et fixer solidement crémastérien les bords de la ligne de vaseline.
- Dans le cas où le tissu crémastérien n'est pas superfusées avec un médicament spécifique, le remplacement continu de la grippe qui entoureid est non essentiel. Une seule application de phosphate de solution saline tamponnée avec du calcium et de magnésium dans la chambre créée peut ensuite être suffisant. Stimulation locale avec des médicaments contre doit être réalisée en continu via des micro-pompe de perfusion à une vitesse de 3 ml par heure.
- Le tissu crémastérien est maintenant prêt pour l'imagerie microscopique.
3. Configuration intravitale
La configuration de base peut varier intravitale. Pour l'imagerie à épifluorescence les expériences doivent être exécutées dans une pièce sombre.
- L'animal est transféré à la platine d'un microscope à épifluorescence intravitale équipé d'un LED 470 nm source lumineuse pour l'Epi-illumination. Utilisez un objectif à immersion de l'eau (20 × / 1,0) pour atteindre un grossissement d'environ 800 ×. Consigner les observations au moyen d'un appareil photo numérique haute résolution et stocker des dossiers sur un ordinateur personnel pour l'évaluation déconnecté.
- Pour l'étiquetage des leucocytes, injecter la rhodamine6G intraveineuse via le cathéter jugulaire à des concentrations de 0,4 poids corporel mg / kg.
- Choisissez une veinule postcapillaire pour l'observation. La taille des navires devrait se situer entre 20 à 60 um et le flux sanguin devrait être suffisant. Afin de minimiser l'influence de la pré-activation du tissu, seuls les navires qui roulement des leucocytes est <20 cells/30 secondes et le nombre de cellules adhérentes <10 cells/200μm de l'endothélium des veinules peuvent être utilisées pour une analyse plus approfondie.
- Si possible, jusqu'à trois veinules post-capillaires peut être utilisée pour l'observation, mais ils devraient être situés dans une section correspondante du tissu crémastérien d'éviter de confondre les vaisseaux à différents moments.
4. D'ischémie-reperfusion (IIF)
- Laissez le tissu se stabiliser pendant 30 minutes.
- Effectuer un enregistrement de 30 secondes pour établir les valeurs basales de roulement des leucocytes et le respect. Idéalement, de générer au total trois enregistrements basales de vérifier la cellulenombres et pour obtenir les écarts-types.
- Placez délicatement un clip navire Biemer autour de la fin proximale du tissu crémastérien exposée à l'aide de la pince d'application. Stasis devrait avoir lieu immédiatement et peuvent être visualisées par microscopie à épifluorescence dans la section navire observé.
- Une variété de cours à temps peuvent être utilisés en fonction du niveau de dommages subis requis. Nous appliquons 30 minutes de temps d'ischémie comme décrit par d'autres auteurs. 21-23 Retirez la pince navire par la suite. Autoriser la circulation sanguine se stabiliser pendant encore 15 minutes.
- Enregistrements ultérieurs de 30 secondes chacun peuvent être faites tout au long de la période de reperfusion (par exemple 30 secondes toutes les 15 minutes). Enregistrer des enregistrements numériques pour l'analyse hors-ligne.
- Pour la fin de l'expérience, le rat est euthanasié par dislocation cervicale sous anesthésie suffisante en appuyant sur un instrument contondant, comme le côté émoussé d'une lame de ciseaux à la base du crâne. Avec l'autremain, la base de la queue est rapidement retiré, provoquant la séparation des vertèbres cervicales du crâne.
5. Hors ligne Analyse de lecture vidéo
- Pour une analyse de lecture vidéo hors ligne, il est utile d'utiliser un logiciel qui permet la sélection d'images distinctes et d'observation de la séquence vidéo au ralenti. Réglez le contraste et la luminosité de façon appropriée. Nous utilisons un logiciel fourni par le fabricant du microscope qui permet de mesurer la longueur et le grossissement numérique.
- Pour la quantification des leucocytes roulant, de définir une ligne virtuelle qui croise le navire à la verticale qui est conforme dans tous les enregistrements. Comptez le nombre de leucocytes roulant qui passent la ligne dans les 30 secondes manuellement.
- Pour la quantification des leucocytes adhérentes, de définir une section de 200 um navire qui est conforme dans tous les dossiers 23 Compter le nombre de leucocytes clairement visibles qui restent statiques pendant 30 secondes -. Ainsi Defined comme adhérente 24.
6. Les résultats représentatifs
IRI du muscle crémaster n'a aucun effet sur la pression artérielle moyenne (PAM), la fréquence cardiaque et le pH sanguin
Utilisation de la configuration ci-dessus (Figure 1), nous avons étudié la microcirculation dans IRI sur un protocole en deux heures, mais un temps d'observation beaucoup plus longue jusqu'à 6 heures est possible. Comme le montre la figure 2, IRI du muscle crémaster n'a pas d'effets significatifs sur la circulation macrohemodynamic rat comme la pression artérielle moyenne et la fréquence cardiaque reste stable pendant toute la période d'enquête. En outre, nous avons surveillé l'homéostasie par des mesures fréquentes de la artériel-pH qui varie dans des limites physiologiques et ne présentaient aucun importantes différences entre les groupes.
IRI induit roulement des leucocytes dans la circulation crémastérien
Leucocytes interaction endothéliale est un élément cléévénement dans l'inflammation aiguë. Par le biais de la microscopie intravitale, nous avons trouvé une augmentation en fonction du temps du nombre de leucocytes roulant dans IRI du muscle crémaster (figure 3A) concordants aux données précédentes 21, 25. Roulant monté sur le temps de deux heures d'observation à un maximum de 137,63 ± 22,55% de la valeur de référence après 120 minutes de temps de reperfusion, puis atteint une signification statistique par rapport aux animaux une opération fictive (137,63 ± 22,55 vs 99,43 ± 14,04% de la valeur de référence).
IRI induit l'adhérence des leucocytes dans la circulation crémastérien
Pour une évaluation plus poussée de leucocytes-endothélium interaction, nous avons analysé l'adhérence des leucocytes dans une section de 200 um navire. IRI a induit une augmentation du nombre de leucocytes adhérents que largement dépassé les valeurs de une opération fictive animaux après 60 minutes (118,33 ± 6,83 vs 96,27 ± 5,78% de la valeur de référence) et l'ASCE en outrended de 120 minutes de reperfusion (figure 3B).
En résumé, le modèle in vivo décrit fournit des données cohérentes de l'activation des leucocytes aiguë dans la survie des animaux IRI et la stabilité tout en circulation est justifiée.
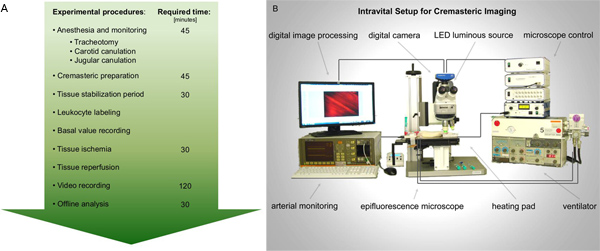
Figure 1. Diagramme A. pour une performance microscopie intravitale épifluorescence dans l'ischémie-reperfusion du muscle crémaster chez le rat. Après les préparations requises pour l'anesthésie et la surveillance, le muscle crémaster chez le rat est exposé pour l'imagerie. Dossiers de l'activation des leucocytes sont prises avant et après ischémie tissulaire. Après analyse vidéo est préférable d'effectuer déconnecté. B. La figure schématique de la configuration proposée intravitale. Cliquez ici pour agrandir la figure .
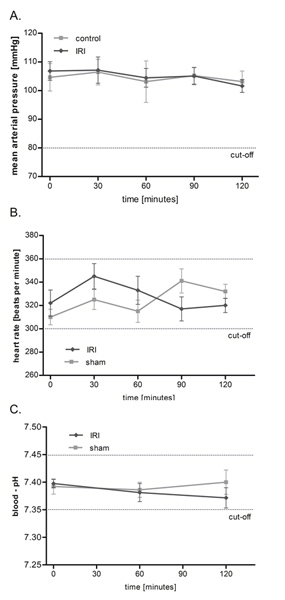
Figure 2. IRI du muscle crémaster n'a aucun effet sur la pression artérielle moyenne (PAM), la fréquence cardiaque et le pH sanguin. La pression artérielle moyenne (A) et la fréquence cardiaque (B) ont été surveillés toutes les 30 minutes tout au long de l'expérience par l'intermédiaire du transducteur de pression après canulation du droit l'artère carotide. Mesure de la barrière hémato-pH artériel (C) a été réalisée après 0, 60 et 120 minutes. Les valeurs sont la moyenne ± SEM de 6 rats, varie sur les niveaux physiologiques sans différences significatives entre les groupes. Cliquez ici pour agrandir la figure .
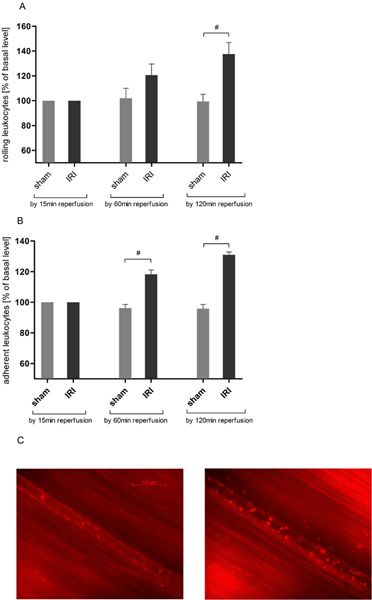
Figure 3. IRI augmente leucocytes-Endothélial interaction dans la circulation crémastérien. Après marquage des leucocytes avec de la rhodamine 6G (0,4 poids corporel mg / kg) intravitale microscopie à épifluorescence a été utilisée pour déterminer des leucocytes-endothélial interaction dans les lésions de reperfusion sur un protocole de 120 minutes après 30 minutes d'ischémie tissulaire. Les dossiers ont été prises à un grossissement d'environ × 800. A. IRI augmente de façon significative le nombre de leucocytes roulant en veinules post-capillaires du muscle crémaster de 120 minutes de reperfusion tandis roulement des leucocytes reste stable tout au long de l'expérience dans le tissu crémastérien qui n'ont pas subi une ischémie. Les valeurs sont la moyenne ± SEM de 6 rats observées. # P <0,05 par le test t apparié. B. Le nombre de leucocytes adhérents est significativement augmentée dans une section choisie au hasard navire 200 pm postcapillaire après 30 minutes d'ischémie crémastérien et ultérieures 60 minutes de la reperfusion tissulaire. Résultats obtenir encore moêtes prononcé après une période de deux heures de reperfusion. Les valeurs sont la moyenne ± SEM de 6 rats observées. # P <0,05 par le test t apparié. Images représentatives de C. une veinule postcapillaire avant l'ischémie (à gauche) et 120 minutes après l'IRI (à droite). Cliquez ici pour agrandir la figure .
Discussion
Leukocyte-endothélial interaction, de production d'espèces réactives de l'oxygène et l'activation du système du complément sont les principales caractéristiques de la dysfonction des tissus IRI-induite. 26 La microcirculation du tissu affecté est considéré comme le site intégrante de l'apparition inflammatoire. Mis à part des expériences ex vivo tels que des tests de chambre d'écoulement 27, 28, il est obligatoire de fournir des modèles bien établis de l...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été soutenu par une subvention de la «Deutsche Forschungsgemeinschaft» pour SU Eisenhardt (AE 866/1-1).
matériels
| Name | Company | Catalog Number | Comments |
| Nom de l'équipement: | Société: | No de catalogue: | Commentaires: |
| Forene 100% (V / V) | Abbé | B506 | API isoflurane |
| Terylene Suture | Serag Weissner | OC108000 | |
| Portex fine pour injection tubes en polyéthylène | Smiths Medical | 800/100/100 | 0,28 mm de diamètre intérieur |
| 0,9% de solution saline | Fresinus Kabi | 808771 | |
| Change-A-tip luxe kit cautérisation | Bovie médicale | DEL1 | |
| Abbocath-T 14G | Venisystems | G713- A01 | utilisée comme tube à lentille |
| 900C Ventilateur Servo | Maquet | utilisée comme ventialtor animale | |
| Transducteur de pression logique | Smiths Medical | MX1960 | |
| Sirecust 404 Moniteur | Siemens | ||
| ABL 700 de paillasse Analyzer | Radiomètre | pour la mesure des gaz du sang | |
| Coussin chauffant | Effenberger | 8319 | |
| Stade de l'aluminium | Alfun | AW7022 | |
| Microscope chirurgical OPMI 6-SDFC | Carl Zeiss | ||
| Microchirurgicale instruments de laboratoire set | S & T | 767 | |
| Clip navire Biemer | Diener | 64.562 | |
| L'application de forceps | Diener | 64.568 | pour le clip de navire Biemer |
| Rhodamine 6G | Sigma-Aldrich | R4127 | |
| Vaseline blanche DAB | Winthrop | 2726853 | |
| Couvrir verres | 32x32 mm | ||
| Configuration intravitale | |||
| Zeis Axio Scope A-1 MAT | Carl Zeiss ® | 490036 | microscope à épifluorescence |
| 470 nm LED | Carl Zeiss ® | 423052 | source de lumière de fluorescence |
| Colibri 2 Système | Carl Zeiss ® | 423052 | |
| W Plan-Apochromat 20x / 1,0 DIC | Carl Zeiss ® | 421452 | objectif à immersion de l'eau |
| AxioCam MRM Rev 3 FireWire | Carl Zeiss ® | 426509 | caméra numérique haute résolution |
| Axio LE logiciel de vision | Carl Zeiss ® | 410130 | utiliser pour l'analyse hors-ligne |
Références
- Cetin, C. Protective effect of fucoidin (a neutrophil rolling inhibitor) on ischemia reperfusion injury: experimental study in rat epigastric island flaps. Ann. Plast. Surg. 47, 540-546 (2001).
- Granger, D. N. Role of xanthine oxidase and granulocytes in ischemia-reperfusion injury. Am. J. Physiol. 255, H1269-H1275 (1988).
- Lazarus, B. The role of mast cells in ischaemia-reperfusion injury in murine skeletal muscle. J Pathol. 191, 443-448 (2000).
- van den Heuvel, M. G. Review: Ischaemia-reperfusion injury in flap surgery. J. Plast. Reconstr. Aesthet. Surg. 62, 721-726 (2009).
- Rosen, S. D. Cell surface lectins in the immune system. Semin. Immunol. 5, 237-247 (1993).
- van der Flier, A., Sonnenberg, A. Function and interactions of integrins. Cell Tissue Res. 305, 285-298 (2001).
- Panes, J., Perry, M., Granger, D. N. Leukocyte-endothelial cell adhesion: avenues for therapeutic intervention. Br. J. Pharmacol. 126, 537-550 (1999).
- Gavins, F. N., Chatterjee, B. E. Intravital microscopy for the study of mouse microcirculation in anti-inflammatory drug research: focus on the mesentery and cremaster preparations. J. Pharmacol. Toxicol. Methods. 49, 1-14 (2004).
- Sutton, T. A. Injury of the renal microvascular endothelium alters barrier function after ischemia. Am. J. Physiol. Renal. Physiol. 285, 191-198 (2003).
- Serracino-Inglott, F. Differential nitric oxide synthase expression during hepatic ischemia-reperfusion. Am. J. Surg. 185, 589-595 (2003).
- Eppinger, M. J. Mediators of ischemia-reperfusion injury of rat lung. Am J Pathol. 150, 1773-1784 (1997).
- Dumont, E. A. Real-time imaging of apoptotic cell-membrane changes at the single-cell level in the beating murine heart. Nat Med. 7, 1352-1355 (2001).
- Baez, S. An open cremaster muscle preparation for the study of blood vessels by in vivo microscopy. Microvasc Res. 5, 384-394 (1973).
- Woeste, G. Octreotide attenuates impaired microcirculation in postischemic pancreatitis when administered before induction of ischemia. Transplantation. 86, 961-967 (2008).
- Schultz, J. E., Hsu, A. K., Gross, G. J. Morphine mimics the cardioprotective effect of ischemic preconditioning via a glibenclamide-sensitive mechanism in the rat heart. Circ. Res. 78, 1100-1104 (1996).
- Dobschuetz, E. v. o. n. Dynamic intravital fluorescence microscopy--a novel method for the assessment of microvascular permeability in acute pancreatitis. Microvasc Res. 67, 55-63 (2004).
- Vutskits, L. Adverse effects of methylene blue on the central nervous system. Anesthesiology. 108, 684-692 (2008).
- Takasu, A. Improved survival time with combined early blood transfusion and fluid administration in uncontrolled hemorrhagic shock in rats. J. Trauma. 8, 312-316 (2010).
- Proctor, K. G., Busija, D. W. Relationships among arteriolar, regional, and whole organ blood flow in cremaster muscle. Am. J. Physiol. 249, 34-41 (1985).
- Bagher, P., Segal, S. S. The Mouse Cremaster Muscle Preparation for Intravital Imaging of the Microcirculation. J. Vis. Exp. (52), e2874 (2011).
- Kanwar, S., Hickey, M. J., Kubes, P. Postischemic inflammation: a role for mast cells in intestine but not in skeletal muscle. Am. J. Physiol. 275, 212-218 (1998).
- Leoni, G. Inflamed phenotype of the mesenteric microcirculation of melanocortin type 3 receptor-null mice after ischemia-reperfusion. FASEB J. 22, 4228-4238 (2008).
- Simoncini, T. Interaction of oestrogen receptor with the regulatory subunit of phosphatidylinositol-3-OH kinase. Nature. 407, 538-541 (2000).
- Woollard, K. J. Pathophysiological levels of soluble P-selectin mediate adhesion of leukocytes to the endothelium through Mac-1 activation. Circ. Res. 103, 1128-1138 (2008).
- Mori, N. Ischemia-reperfusion induced microvascular responses in LDL-receptor -/- mice. Am. J. Physiol. 276, H1647-H1654 (1999).
- Eisenhardt, S. U. Monitoring Molecular Changes Induced by Ischemia/Reperfusion in Human Free Muscle Flap Tissue Samples. Ann. Plast. Surg. , (2011).
- Eisenhardt, S. U. Generation of activation-specific human anti-{alpha}M{beta}2 single-chain antibodies as potential diagnostic tools and therapeutic agents. Blood. 109, 3521-3528 (2007).
- Eisenhardt, S. U. Dissociation of pentameric to monomeric C-reactive protein on activated platelets localizes inflammation to atherosclerotic plaques. Circ Res. 105, 128-137 (2009).
- Eisenhardt, S. U. C-reactive protein: how conformational changes influence inflammatory properties. Cell Cycle. 8, 3885-3892 (2009).
- Granger, D. N. . Physiology and pathophysiology of leukocyte adhesion. , 520 (1995).
- Baatz, H. Kinetics of white blood cell staining by intravascular administration of rhodamine 6G. Int. J. Microcirc. Clin. Exp. 15, 85-91 (1995).
- Mempel, T. R. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr. Opin. Immunol. 16, 406-417 (2004).
- Abbitt, K. B., Rainger, G. E., Nash, G. B. Effects of fluorescent dyes on selectin and integrin-mediated stages of adhesion and migration of flowing leukocytes. J. Immunol. Methods. 239, 109-119 (2000).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon