È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
In tempo reale Imaging digitale di leucociti-endotelio in ischemia-riperfusione (IRI) del muscolo Cremaster Rat
In questo articolo
Riepilogo
Digital microscopia intravitale epifluorescenza delle venule postcapillari nella microcircolazione cremasterico è un metodo comodo per acquisire conoscenze in leucociti-endotelio In vivo In ischemia-riperfusione (IRI) del tessuto muscolare striato. Noi qui forniamo un protocollo dettagliato per eseguire in sicurezza la tecnica e discutere le sue applicazioni e limitazioni.
Abstract
L'ischemia-riperfusione (IRI) è stata implicata in una vasta gamma di condizioni patologiche come ictus cerebrale, infarto del miocardio, ischemia intestinale così come a seguito di trapianto e chirurgia cardiovascolare. 1 riperfusione di tessuto precedentemente ischemico, mentre essenziale per la prevenzione di irreversibile lesione dei tessuti, provoca infiammazione eccessiva del tessuto colpito. Adiacente alla produzione di specie reattive dell'ossigeno, l'attivazione del sistema del complemento e aumento della permeabilità microvascolare, l'attivazione di leucociti è uno degli attori principali nella cascata patologica del danno tissutale infiammatorio durante la riperfusione. 2, 3 attivazione dei leucociti è un processo multifasico che consiste di laminazione, adesione e la ferma ed è mediata da una complessa interazione tra molecole di adesione in risposta a fattori chemiotattici quali fattori del complemento, chemochine, o fattore attivante le piastrine 4. <p class = "jove_content"> Mentre rolling leucociti in venule postcapillari è mediato principalmente dall'interazione di selectine 5 con loro ligandi contatore, ferma adesione dei leucociti all'endotelio selectina è controllato tramite legame a molecole di adesione intercellulare (ICAM) e vascolare cellulari molecole di adesione (VCAM) 6, 7.
Gold standard per l'osservazione in vivo di leucociti-endotelio è la tecnica della microscopia intravitale, descritta per la prima nel 1968 8.
Benché vari modelli di IRI (ischemia-riperfusione) sono stati descritti per vari organi, 9-12 solo pochi sono adatti per la visualizzazione diretta del reclutamento di leucociti nel microcircolo a un alto livello di qualità dell'immagine. 8
Abbiamo qui promuovere la microscopia digitale intravitale epifluorescenza del venule postcapillari del microcircolo cremastericodel ratto 13 come un metodo conveniente per analizzare qualitativamente e quantitativamente il reclutamento dei leucociti per la ricerca IRI-nel tessuto muscolare striato e fornire un manuale dettagliato per realizzare la tecnica. Abbiamo inoltre illustrare le insidie più comuni e fornire consigli utili che dovrebbe consentire al lettore di apprezzare veramente, e sicuro di eseguire il metodo.
In un passo dal protocollo passo che raffigurano come iniziare con l'anestesia respirazione controllata sotto il controllo sufficiente a mantenere l'animale saldamente anestetizzato per lunghi periodi di tempo. Abbiamo poi descrivere la preparazione cremasterico come un sottile foglio appartamento in eccellente risoluzione ottica e fornisce un protocollo per l'imaging dei leucociti in IRI che è stato ben stabilito nei nostri laboratori.
Protocollo
1. Anestesia e monitoraggio
- Etico competente nazionale e istituzionale dovrebbe essere a posto prima di effettuare esperimenti su animali. Dopo l'approvazione al comitato etico anestetizzare ratti Sprague Dawley maschi con un peso corporeo 120-180 g. Consegna 2 - 3% vol isoflurano a una finestra di plexiglas con vaporizzatore isoflurano e posizionare all'interno ratto.
- Non appena il livello adeguato di anestesia si ottiene (mancanza di reazione a punta o la coda pizzico), il ratto è ponderato e rasato l'area ventrale del collo dell'utero.
- Posizionare il ratto in decubito dorsale su un tappetino di riscaldamento per mantenere la temperatura corporea a 37 ° C e applicare isoflurano al 2% vol utilizzando una maschera di silicone.
Le fasi di preparazione seguenti sono meglio realizzato utilizzando un microscopio chirurgico.
- Per la preparazione della trachea, l'arteria carotide e la vena giugulare, eseguire una incisione cutanea orizzontale 2 cm nella zona of soprasternale e mobilitare le ghiandole salivari lateralmente.
- Si trovano ora ad affrontare i muscoli del collo ventrali. Separarli accuratamente sulla linea mediana e trovare la trachea. Esporre 1 - 2 cm della trachea e posizionare una pinza micro sotto di esso in modo da sollevarla.
- Ora, tagliato a metà attraverso il lato ventrale della trachea. Fare attenzione a non tagliare tutto il modo attraverso, se lo fai, alla fine taglio della trachea scivolerà nuovamente dentro il petto e essere molto difficile da lavorare.
- Inserire un tubo Abbocath (14G) utilizzato come tubo tracheale nella parte inferiore della trachea, che è stato precedentemente collegato ad un ventilatore animale. Suggerimento: Studio su staffe di fissaggio magnetico, nonché la sutura della trachea intorno al tubo è essenziale per mantenere il tubo tracheale in posizione. Generalmente si usa Terylene 5/0 sutura, il materiale di sutura tuttavia simile può essere utilizzato.
- La respirazione può quindi essere controllata in volume (frequenza, 35 - 45 respiri al minuto, volume corrente, 4.5 - 5 ml; FiO 2 , 0,35-0,50;. isoflurano 1,5-2% vol) 14 Atelettasia può essere evitata mantenendo una positiva pressione di fine espirazione di 5 a 10 mm di H 2 O. 15
- Per la canulation carotide, il muscolo destra sterno viene separato per via smussa per individuare l'arteria carotide.
- Separare il nervo vago con attenzione dalla carotide e montare l'arteria su un angolo micro pinza per fermare il sangue che scorre dal cuore.
- Passare due pezzi di lunghezza uguale di sutura sotto la carotide. In riferimento al cuore, la sutura più distale è strettamente legato a occludere il sangue che fluisce dalla regione della testa, mentre la sutura viene legata prossimale liberamente attorno carotide.
- Utilizzando forbici micro un piccolo taglio viene effettuato nella carotide tra i due legature.
- Inserire un catetere di polietilene (0,28 mm di diametro interno) riempito con soluzione fisiologica che è collegato ad un trasduttore di pressione.
- Remuovere le pinze micro e filo ulteriormente il catetere nell'arteria. Quindi stringere la legatura prossimale intorno all'arteria e il catetere. Suggerimento: Applicazione di una seconda sutura prossimale impedisce sanguinamento dopo la rimozione delle micro pinze.
- Legare la legatura distale intorno alla carotide e il catetere per l'ancoraggio aggiuntivo.
- Monitorare costantemente l'anestesia dal monitoraggio della frequenza cardiaca e pressione arteriosa. Eseguire intermittenti arterioso emogas analisi utilizzando un analizzatore di gas di sangue 16. Una frequenza cardiaca inferiore a 300 bpm o superiore a 360 bpm e una pressione arteriosa media cadere di sotto di 80 mmHg per più di 5 minuti sono i criteri di esclusione. 17, 18 Mantenere il sangue pH nei limiti fisiologici (7,35-7,45). Nel caso in cui l'esperimento deve essere chiuso a causa di tassi anomali di monitoraggio, scarificare l'animale dal collo o dislocazione exanguation.
Per la somministrazione endovenosa di coloranti fluorescenti o altri farmaci of interesse, effettuare le seguenti operazioni:
- Fuoco l'area della vena giugulare sinistra con il microscopio chirurgico.
- Con una pinza in ogni mano, strappare il sottile fascia di rivelare la vena giugulare. Montare la vena su una pinza ad angolo micro. Il flusso di sangue si fermerà.
- Con pinze, due pezzi di lunghezza uguale di sutura vengono passati sotto la vena giugulare concorde al canulation carotide. Legare saldamente la sutura distale e prossimale della sutura liberamente attorno alla vena giugulare.
- Fate un piccolo taglio nella vena giugulare e inserire un catetere di polietilene (0,28 mm di diametro interno) che è stata lavata con soluzione salina. Contrassegnare che incisione e canulation può essere più impegnativo e richiede tempo di quello della carotide.
- Passare il catetere verso il cuore e stringere la legatura più vicina al cuore intorno alla vena e il catetere.
- Dopo la pervietà conforme, legare legatura distale intorno al catetere. Suggerimento: fissaggio supplementare di bocateteri ° con nastro può impedire dislocamento.
- Risciacquare cateteri frequentemente per evitare la coagulazione intraluminale.
2. Preparazione del Muscle Cremaster
- Usiamo una fase in alluminio di 1,5 - 2 cm di spessore per l'imaging cremasterico. La fase adotta rapidamente la temperatura desiderata del termocuscino attenuando controllo termico del tessuto cremasterico. Questo è fondamentale per gli studi infiammazione. In alternativa, una piattaforma plexiglas può essere utilizzata se la regolazione della temperatura cremasterico è più difficile. Posizionare lo scroto al centro del palco.
- L'incisione iniziale è realizzata in pelle e fascia esterna spermatico sopra scroto alla fine distale seguita dalla dilatazione prudente dello spazio sottocutaneo usando forbici sottili. Evitare di toccare il tessuto sottostante con gli strumenti.
- Non appena il tessuto è esposto è inumidito con pre-riscaldato (37 ° C) soluzione salina tamponata con fosfato with calcio e magnesio. Applicare questa soluzione a qualsiasi tessuto esposto.
- Il tessuto connettivo tra la fascia spermatica esterna e il muscolo cremastere è accuratamente rimosso per liberare il muscolo cremastere dal tessuto circostante.
- La superficie esterna del muscolo cremastere è poi cautamente alla rimozione del tessuto connettivo. Superfusione continuo durante idrati dissezione del tessuto connettivo, facilitando la visibilità e la rimozione.
- Suturare l'estremità distale del sacco cremastere di tenere premuto leggermente e prolungare l'estremità del sacco.
- Incidere l'estremità distale del sacco sulla parte ventrale e allungato l'incisione prossimale usando forbici micro. Con attenzione cauterizzare sanguinamento navi lungo le linee di incisione che utilizzano una cauterizzazione termica. Evitare inutili cauterizzazione per limitare ulteriori stimoli infiammatori. Tip:. Dinamica del flusso sanguigno vicino alla periferia della preparazione sono modificate dal presente danno tissutale 19 Pertanto, per ridurre l'se influisce sulla raccolta di dati, i vasi sanguigni vicino al centro della preparazione deve essere usata per l'imaging.
- Il Cremaster aperto sia piatto sul piedistallo di alluminio anche se ancora collegati da un legamento sottile dell'epididimo sotto il testicolo. Riflettendo il testicolo da un lato espone questo legamento tra cui una piccola arteria e la vena che collegano l'epididimo. Utilizzare il cauterio per sigillare i vasi ed impiegare le forbici per tagliare il micro legamento connettivo tra testicolo e tessuto cremasterico.
- Spingere delicatamente indietro il testicolo isolato nel canale inguinale. Altri autori resecare il testicolo dopo la legatura prossimale (orchiectomia) insieme con il pad associato moda inguinale 20. In un modello sensibile come l'attivazione dei leucociti IRI indotta si cerca di evitare tutti gli stimoli aggiuntivi chirurgici, quindi ci asteniamo dalla resezione del testicolo, che non è di solito necessaria per ottenere una sufficiente esposizione del muscolo cremastere.
- Oltre al primosutura quattro bordi di tessuto (due su ogni lato) e collegare i fili ai nastri di diffondere con cautela il tessuto cremasterico radialmente sul palco in alluminio. Lasciando uno spazio tra la fase di alluminio e l'ingresso esterno del canale inguinale semplifica clipping successiva cremasterico per ischemia.
- Inserire due estremità del catetere di polietilene (0,28 mm di diametro interno) vicino al tessuto cremasterico per l'installazione superfusione. Assicurarsi che il lume è privo di aria, per evitare bolle d'aria nella camera di fluido finale.
- Tracciare una linea di vaselina (vaselina) intorno al muscolo cremastere con una siringa. La linea deve estendere la dimensione del vetrino che viene utilizzato per la copertura.
- Per creare una camera di fluido, posizionare un foglio quadrato coperchio (32 x 32 mm) sul tessuto cremasterico e fissare i bordi alla linea di vaselina.
- Nel caso in cui il tessuto non è cremasterico superfuso con un farmaco specifico, sostituzione continua delle influenza circostanteid è non essenziale. Una singola applicazione di soluzione salina tamponata con fosfato di calcio e magnesio nella camera creata può quindi essere sufficiente. Stimolazione locale con farmaci tuttavia deve essere eseguita in modo continuo tramite micro-perfusione pompa ad una velocità di 3 ml per ora.
- Il tessuto cremasterico è ora pronto per l'imaging microscopico.
3. Setup intravitale
La configurazione di base intravitale possono variare. Per l'imaging epifluorescenza gli esperimenti devono essere eseguiti in una stanza buia.
- L'animale viene trasferito alla fase di un microscopio intravitale epifluorescenza dotato di un LED 470 nm sorgente luminosa per epi-illuminazione. Utilizzare un obiettivo ad immersione in acqua (20 × / 1,0) per ottenere un ingrandimento di circa 800 ×. Osservazioni record mediante una fotocamera digitale ad alta risoluzione e conservare dati su un personal computer per la valutazione in linea.
- Per l'etichettatura dei leucociti, iniettare rodamina6G via endovenosa attraverso il catetere giugulare a concentrazioni di 0,4 mg / kg di peso corporeo.
- Scegli un venule postcapillari per l'osservazione. Dimensioni delle navi deve essere compresa tra 20-60 micron e il flusso sanguigno dovrebbe essere sufficiente. Per ridurre al minimo l'influenza di pre-attivazione del tessuto, in cui solamente navi rotolamento dei leucociti è <20 cells/30 secondo e il numero di cellule aderenti <10 cells/200μm dell'endotelio venulare può essere utilizzato per ulteriori analisi.
- Se possibile, fino a tre venule postcapillari può essere utilizzato per l'osservazione, tuttavia devono essere situati in una corrispondente sezione del tessuto cremasterico non confondere i vasi in punti temporali diversi.
4. Ischemia-riperfusione (IIR)
- Lasciare tessuto stabilizzare per 30 minuti.
- Eseguire una registrazione di 30 secondi per stabilire i valori basali di rotolamento e l'aderenza dei leucociti. Idealmente, generano in totale tre registrazioni per verificare cellule basalinumeri e per ottenere deviazioni standard.
- Posizionare delicatamente una clip nave Biemer intorno alla fine prossimale del tessuto cremasterico esposto utilizzando la pinza di applicazione. Stasi deve avvenire immediatamente e possono essere visualizzati mediante microscopia in epifluorescenza nella sezione nave osservata.
- Una varietà di andamento nel tempo può essere utilizzato a seconda del livello di danni. Noi applichiamo 30 minuti di tempo di ischemia, come descritto da altri autori. 21-23 Rimuovere la fascetta nave dopo. Lasciare flusso sanguigno di stabilizzarsi per altri 15 minuti.
- Le successive registrazioni di 30 secondi la durata può essere effettuata per tutto il periodo di riperfusione (ad esempio 30 secondi ogni 15 minuti). Salva le registrazioni in digitale per l'analisi offline.
- Per la chiusura del dell'esperimento, il ratto è sacrificati mediante dislocazione cervicale in anestesia sufficiente premendo un corpo contundente come il bordo opaco di una lama forbice alla base del cranio. Con l'altramano, la base della coda viene tirato in fretta, provocando la separazione delle vertebre cervicali dal cranio.
5. Analisi di riproduzione video offline
- Per l'analisi offline la riproduzione video è utile utilizzare un software che consente la selezione di immagini distinte e l'osservazione della sequenza video al rallentatore. Regolare il contrasto e la luminosità in modo appropriato. Si usa il software fornito dal produttore del microscopio che permette misure di lunghezza e ingrandimento digitale.
- Per la quantificazione di laminazione leucociti, definiscono una linea virtuale che interseca la nave verticale che è coerente in tutti i record. Contare il numero di leucociti colline che passano la linea entro 30 secondi manualmente.
- Per la quantificazione dei leucociti aderenti, definire una sezione a 200 micron nave che sia coerente in tutti i record 23 Contare il numero di leucociti ben visibili che rimangono statici per 30 secondi -. Così defied in quanto aderente 24.
6. Risultati rappresentativi
IRI del muscolo cremastere non ha alcun effetto sulla pressione arteriosa media (MAP), la frequenza cardiaca e del pH del sangue
Utilizzando la configurazione summenzionata (figura 1), abbiamo studiato la microcircolazione in IRI su un protocollo due ore, ma un tempo di osservazione molto più lungo fino a 6 ore è possibile. Come mostrato in figura 2, IRI del muscolo cremastere non ha effetti significativi sulla circolazione macrohemodynamic ratto come pressione arteriosa media e della frequenza cardiaca rimanere stabile per tutto il periodo dell'inchiesta. Inoltre abbiamo monitorato l'omeostasi da misurazioni frequenti del pH del sangue arterioso che spaziava entro i limiti fisiologici e non ha mostrato significative differenze tra gruppi.
IRI induce rotolamento dei leucociti in circolo cremasterico
L'interazione leucociti endoteliale è una chiaveevento nel infiammazione acuta. Per mezzo di microscopia intravitale abbiamo trovato un tempo-dipendente aumento del numero di leucociti di laminazione in IRI del muscolo cremastere (Figura 3A) concorde ai dati precedenti 21, 25. Rotolamento montato sopra il tempo di osservazione due ore ad un massimo di 137,63 ± 22,55% del valore basale dopo 120 minuti di riperfusione e quindi raggiunto la significatività statistica rispetto agli animali fittizi azionati (137,63 ± 22,55 vs 99,43 ± 14,04% del valore basale).
IRI induce l'adesione dei leucociti in circolo cremasterico
Per ulteriore valutazione dei leucociti-endotelio abbiamo analizzato l'adesione dei leucociti in una sezione di 200 micron nave. IRI indotto un aumento del numero di leucociti aderenti notevolmente superati i valori di sham azionato animali dopo 60 minuti (118,33 ± 6,83 vs 96,27 ± 5,78% del valore basale) e ASCE ulteriorended da 120 minuti di riperfusione (Figura 3B).
In sintesi, la descritta nel modello in vivo fornisce dati consistenti di acuta attivazione leucocitaria IRI in termini di sopravvivenza degli animali, mentre la circolazione e la stabilità è garantita.
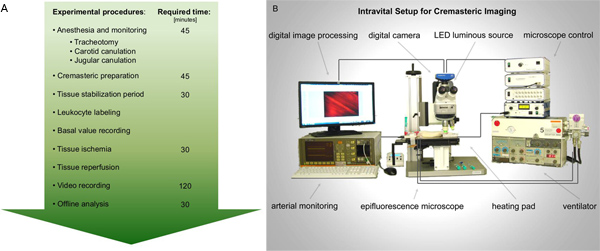
Figura 1. Diagramma di flusso A. intravitale prestazioni epifluorescenza in ischemia-riperfusione del muscolo cremastere di ratto. Dopo i preparativi necessari per l'anestesia e il monitoraggio, il muscolo cremastere di ratto è esposto per l'imaging. Record di attivazione dei leucociti sono prese prima e dopo l'ischemia del tessuto. Successiva analisi video è meglio eseguito offline. B. Figura schematica della configurazione proposta intravitale. Clicca qui per ingrandire la figura .
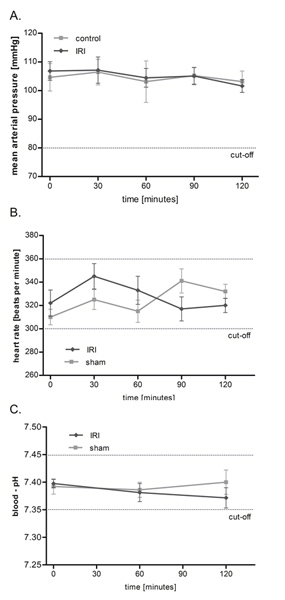
Figura 2. IRI del muscolo cremastere ha alcun effetto sulla pressione arteriosa media (MAP), la frequenza cardiaca e il pH del sangue. Pressione arteriosa media (A) e frequenza cardiaca (B) sono stati monitorati ogni 30 minuti durante l'esperimento con trasduttore di pressione dopo canulation del diritto carotide. Misurazione del sangue arterioso pH-(C) è stata eseguita dopo 0, 60, e 120 minuti. I valori sono media ± SEM di 6 ratti diverse e andavano sui livelli fisiologici senza significative differenze tra gruppi. Clicca qui per ingrandire la figura .
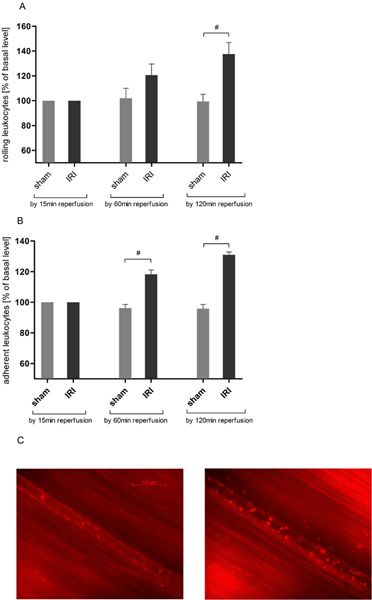
Figura 3. IRI aumenta leucociti-Endotelio nella circolazione cremasterico. Dopo etichettatura dei leucociti con rodamina 6G (0,4 mg / kg di peso corporeo) intravitale epifluorescenza è stato utilizzato per determinare leucociti-endotelio in riperfusione tramite un protocollo di 120 minuti dopo 30 minuti di ischemia tessuto. Records sono state prese con un ingrandimento di circa × 800. A. IRI aumenta significativamente il numero di leucociti di laminazione in venule postcapillari del muscolo cremastere da 120 minuti di riperfusione, mentre al rotolamento dei leucociti rimane stabile durante l'esperimento nel tessuto cremasterico che non hanno subito ischemia. I valori sono media ± SEM di 6 topi osservati. # P <0,05 utilizzando il test t spaiato. B. Il numero di leucociti aderenti è significativamente aumentata in uno scelto casualmente sezione 200μm nave postcapillari dopo 30 minuti di ischemia cremasterico e dei successivi 60 minuti di riperfusione tessuto. Risultati da ottenere anche moè pronunciata dopo un periodo di riperfusione due ore. I valori sono media ± SEM di 6 topi osservati. # P <0.05 utilizzando il test t spaiato. Foto C. rappresentativi di una venula postcapillari prima di ischemia (a sinistra) e 120 minuti dopo l'IRI (a destra). Clicca qui per ingrandire la figura .
Discussione
Leucociti-endotelio, la produzione di specie reattive dell'ossigeno e l'attivazione del sistema del complemento sono le caratteristiche principali di IRI indotta disfunzione tessuto. 26 La microcircolazione del tessuto colpito è considerato come il sito integrale per l'insorgenza infiammatoria. A parte gli esperimenti ex vivo come test camera di flusso 27, 28, è obbligatorio fornire consolidati modelli di imaging intravitale di valutare ulteriormente la rilevanza in vivo....
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Questo lavoro è stato sostenuto da una concessione del "Deutsche Forschungsgemeinschaft" a SU Eisenhardt (EI 866/1-1).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del prodotto: | Società: | N. di catalogo: | Commenti: |
| Forene 100% (V / V) | Abate | B506 | API isoflurane |
| Terylene sutura | Serag Weissner | OC108000 | |
| Portex Belle Bore tubi in polietilene | Smiths Medical | 800/100/100 | 0,28 mm diametro interno |
| 0,9% soluzione salina | Fresinus Kabi | 808771 | |
| Change-A-tip deluxe kit cautery | Bovie Medical | Del1 | |
| Abbocath-T 14G | Venisystems | G713- A01 | utilizzato come tubo lente |
| Servo Ventilatore 900C | Maquet | utilizzati come ventialtor animale | |
| Trasduttore di pressione Logical | Smiths Medical | MX1960 | |
| Sirecust 404 Monitor | Siemens | ||
| ABL 700 da banco Analyzer | Radiometro | per la misurazione del gas sangue | |
| Riscaldamento pad | Effenberger | 8319 | |
| Alluminio stage | ALFUN | AW7022 | |
| Chirurgica microscopio OPMI 6-SDFC | Carl Zeiss | ||
| Microchirurgica strumenti di laboratorio set | S & T | 767 | |
| Biemer nave Clip | Diener | 64,562 | |
| L'applicazione di forcipe | Diener | 64,568 | per clip nave Biemer |
| Rodamina 6G | Sigma-Aldrich | R4127 | |
| Vaselina bianca DAB | Winthrop | 2726853 | |
| Coprire gli occhiali | 32x32 millimetri | ||
| Installazione intravitale | |||
| Zeis Axio Scope A-1 MAT | Carl Zeis | 490036 | microscopio a epifluorescenza |
| 470 nm LED | Carl Zeis | 423052 | fluorescenza sorgente luminosa |
| Colibri 2 Sistema | Carl Zeis | 423052 | |
| W Plan-Apochromat 20x / 1,0 DIC | Carl Zeis | 421452 | immersione in acqua obiettivo |
| AxioCam MRm Rev. 3 FireWire | Carl Zeis | 426509 | fotocamera digitale ad alta risoluzione |
| Axio LE vision software | Carl Zeis | 410130 | utilizzare per l'analisi offline |
Riferimenti
- Cetin, C. Protective effect of fucoidin (a neutrophil rolling inhibitor) on ischemia reperfusion injury: experimental study in rat epigastric island flaps. Ann. Plast. Surg. 47, 540-546 (2001).
- Granger, D. N. Role of xanthine oxidase and granulocytes in ischemia-reperfusion injury. Am. J. Physiol. 255, H1269-H1275 (1988).
- Lazarus, B. The role of mast cells in ischaemia-reperfusion injury in murine skeletal muscle. J Pathol. 191, 443-448 (2000).
- van den Heuvel, M. G. Review: Ischaemia-reperfusion injury in flap surgery. J. Plast. Reconstr. Aesthet. Surg. 62, 721-726 (2009).
- Rosen, S. D. Cell surface lectins in the immune system. Semin. Immunol. 5, 237-247 (1993).
- van der Flier, A., Sonnenberg, A. Function and interactions of integrins. Cell Tissue Res. 305, 285-298 (2001).
- Panes, J., Perry, M., Granger, D. N. Leukocyte-endothelial cell adhesion: avenues for therapeutic intervention. Br. J. Pharmacol. 126, 537-550 (1999).
- Gavins, F. N., Chatterjee, B. E. Intravital microscopy for the study of mouse microcirculation in anti-inflammatory drug research: focus on the mesentery and cremaster preparations. J. Pharmacol. Toxicol. Methods. 49, 1-14 (2004).
- Sutton, T. A. Injury of the renal microvascular endothelium alters barrier function after ischemia. Am. J. Physiol. Renal. Physiol. 285, 191-198 (2003).
- Serracino-Inglott, F. Differential nitric oxide synthase expression during hepatic ischemia-reperfusion. Am. J. Surg. 185, 589-595 (2003).
- Eppinger, M. J. Mediators of ischemia-reperfusion injury of rat lung. Am J Pathol. 150, 1773-1784 (1997).
- Dumont, E. A. Real-time imaging of apoptotic cell-membrane changes at the single-cell level in the beating murine heart. Nat Med. 7, 1352-1355 (2001).
- Baez, S. An open cremaster muscle preparation for the study of blood vessels by in vivo microscopy. Microvasc Res. 5, 384-394 (1973).
- Woeste, G. Octreotide attenuates impaired microcirculation in postischemic pancreatitis when administered before induction of ischemia. Transplantation. 86, 961-967 (2008).
- Schultz, J. E., Hsu, A. K., Gross, G. J. Morphine mimics the cardioprotective effect of ischemic preconditioning via a glibenclamide-sensitive mechanism in the rat heart. Circ. Res. 78, 1100-1104 (1996).
- Dobschuetz, E. v. o. n. Dynamic intravital fluorescence microscopy--a novel method for the assessment of microvascular permeability in acute pancreatitis. Microvasc Res. 67, 55-63 (2004).
- Vutskits, L. Adverse effects of methylene blue on the central nervous system. Anesthesiology. 108, 684-692 (2008).
- Takasu, A. Improved survival time with combined early blood transfusion and fluid administration in uncontrolled hemorrhagic shock in rats. J. Trauma. 8, 312-316 (2010).
- Proctor, K. G., Busija, D. W. Relationships among arteriolar, regional, and whole organ blood flow in cremaster muscle. Am. J. Physiol. 249, 34-41 (1985).
- Bagher, P., Segal, S. S. The Mouse Cremaster Muscle Preparation for Intravital Imaging of the Microcirculation. J. Vis. Exp. (52), e2874 (2011).
- Kanwar, S., Hickey, M. J., Kubes, P. Postischemic inflammation: a role for mast cells in intestine but not in skeletal muscle. Am. J. Physiol. 275, 212-218 (1998).
- Leoni, G. Inflamed phenotype of the mesenteric microcirculation of melanocortin type 3 receptor-null mice after ischemia-reperfusion. FASEB J. 22, 4228-4238 (2008).
- Simoncini, T. Interaction of oestrogen receptor with the regulatory subunit of phosphatidylinositol-3-OH kinase. Nature. 407, 538-541 (2000).
- Woollard, K. J. Pathophysiological levels of soluble P-selectin mediate adhesion of leukocytes to the endothelium through Mac-1 activation. Circ. Res. 103, 1128-1138 (2008).
- Mori, N. Ischemia-reperfusion induced microvascular responses in LDL-receptor -/- mice. Am. J. Physiol. 276, H1647-H1654 (1999).
- Eisenhardt, S. U. Monitoring Molecular Changes Induced by Ischemia/Reperfusion in Human Free Muscle Flap Tissue Samples. Ann. Plast. Surg. , (2011).
- Eisenhardt, S. U. Generation of activation-specific human anti-{alpha}M{beta}2 single-chain antibodies as potential diagnostic tools and therapeutic agents. Blood. 109, 3521-3528 (2007).
- Eisenhardt, S. U. Dissociation of pentameric to monomeric C-reactive protein on activated platelets localizes inflammation to atherosclerotic plaques. Circ Res. 105, 128-137 (2009).
- Eisenhardt, S. U. C-reactive protein: how conformational changes influence inflammatory properties. Cell Cycle. 8, 3885-3892 (2009).
- Granger, D. N. . Physiology and pathophysiology of leukocyte adhesion. , 520 (1995).
- Baatz, H. Kinetics of white blood cell staining by intravascular administration of rhodamine 6G. Int. J. Microcirc. Clin. Exp. 15, 85-91 (1995).
- Mempel, T. R. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr. Opin. Immunol. 16, 406-417 (2004).
- Abbitt, K. B., Rainger, G. E., Nash, G. B. Effects of fluorescent dyes on selectin and integrin-mediated stages of adhesion and migration of flowing leukocytes. J. Immunol. Methods. 239, 109-119 (2000).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon