Method Article
A Parasite Rescate y Transformación de ensayo para la detección antileishmanial contra intracelular
En este artículo
Resumen
Un ensayo parásito-rescate y la transformación con células THP1 infectadas In vitro Con Leishmania donovani Se ha optimizado para la detección de drogas anti-Leishmania. El análisis implica la diferenciación de células THP1, la infección con promastigotos, el tratamiento con fármacos de ensayo, la lisis controlada de los macrófagos infectados, rescate de amastigotes, la transformación y el crecimiento de promastigotes promastigote seguimiento y la proliferación con un ensayo fluorométrico.
Resumen
La leishmaniasis es una de las enfermedades más olvidadas del mundo, en gran medida afecta a los más pobres de los pobres, sobre todo en los países en desarrollo. Más de 350 millones de personas que se consideran en riesgo de contraer leishmaniasis, y aproximadamente 2 millones de casos nuevos cada año 1. Leishmania donovani es el agente causante de la leishmaniasis visceral (LV), la forma más mortal de la enfermedad. La elección de los fármacos disponibles para el tratamiento de la leishmaniasis está limitada 2, los tratamientos actuales proporcionan una eficacia limitada y muchos son tóxicos en dosis terapéuticas. Además, la mayoría de los fármacos de tratamiento de primera línea ya han perdido su utilidad debido a la creciente resistencia a múltiples drogas 3. La actual cartera de fármacos anti-Leishmania también seriamente mermado. Son necesarios esfuerzos constantes para enriquecer un nuevo anti-Leishmania tubería descubrimiento de fármacos, y este esfuerzo depende de la disponibilidad de adecuado en modelos de cribado in vitro.
En promastigotes 4 in vitro y ensayos de amastigotes axénicos 5 se utilizan principalmente para la detección de drogas anti-Leishmania sin embargo, puede no ser apropiado debido a grandes diferencias celulares, fisiológicos, bioquímicos y moleculares en comparación con amastigotes intracelulares. Los ensayos de tipo macrófago, con amastigotes modelos se consideran más cercano a las condiciones fisiopatológicas de la leishmaniasis, y por lo tanto son los más apropiados para la selección in vitro. Diferenciadas, que no se dividen las células humanas de leucemia monocítica aguda (THP1) (crea un atractivo) como alternativa a aislados macrófagos primarios y se puede utilizar para el ensayo de anti-Leishmania actividad de diferentes compuestos en contra de amastigotes intracelulares.
A continuación, presentamos un análisis de los parásitos de rescate y transformación de células diferenciadas THP1 infectadas in vitro con Leishmania donovani para el cribado de compuestos puros y productos naturalesductos extractos y la determinación de la eficacia contra los amastigotes de Leishmania intracelulares. El ensayo implica los siguientes pasos: (1) la diferenciación de células THP1 a que no se dividen los macrófagos, (2) la infección de macrófagos con L. donovani promastigotes metacíclicos, (3) tratamiento de las células infectadas con los fármacos de ensayo, (4) la lisis controlada de macrófagos infectados, (5) la liberación / rescate de amastigotes y (6) transformación de amastigotes a promastigotos vivos. El ensayo se optimizó utilizando tratamiento con detergente para la lisis controlada de infectados por Leishmania células THP1 para lograr rescate casi completa de amastigotes intracelulares viables con un efecto mínimo en su capacidad de transformar a promastigotes. Macrófagos diferente: relaciones promastigotes fueron probados para lograr la infección máxima. La cuantificación de la infección se realizó a través de la transformación de vida, rescató a Leishmania amastigotes a promastigotos y la evaluación de su crecimiento por un alamarBlue fluorométricos ensayo en microplacas de 96 pocillos. Este ensayo es comparable a la utilizada actualmente-gen microscópico, reportero transgénico y de imagen digital ensayos de análisis. Este ensayo es robusta y mide sólo los amastigotes intracelulares vivas en comparación con el gen reportero y ensayos de análisis de imágenes, que no puede diferenciar entre amastigotes vivos y muertos. Además, el ensayo ha sido validado con un panel actual de fármacos anti-Leishmania y se ha aplicado con éxito a gran escala de detección de compuestos puros y una biblioteca de fracciones de productos naturales (Tekwani et al. No publicado).
Protocolo
1. Mantener y Subcultura THP1 cultivo celular
- Mantener células THP1 en medio RPMI-1640 con FBS (10% y pH 7,4) a 37 ° C en un 5% de CO 2 incubadora.
- Subculture células dos veces a la semana para evitar el recuento de células de exceder 1x10 6 células / ml. Esto es importante para mantener su capacidad de transformación.
2. Mantener y Subcultura Leishmania donovani promastigotes Cultura
- Mantener la L. donovani promastigotes (S1, cepa Sudán) en medio RPMI-1640 (sin bicarbonato sódico y piruvato sódico) con FBS al 10% a 26 ° C.
- Subcultura L. donovani promastigotes dos veces a la semana, con la más alta concentración de células en el intervalo de 20-25x10 6 promastigotes / ml.Caution: Todos los medios y soluciones deben ser llevados a la temperatura ambiente antes de su uso.
3. Siembra y diferenciación de las células THP1 en un 96-así microplacas y 16-cámara de diapositivas de vidrio Cultura.
- Preparar un cultivo diluido THP1 con recuento de células de 2.5x10 5 células / ml de un cultivo de células de cuatro días de edad (recuento de células no debería exceder 10 6 células / ml) en medio RPMI-1640 con inactivado por calor 10% de FBS. Preparado 20 ml de cultivo por cada placa de 96 pocillos y 4 ml de cultivo para cada diapositiva cámara de 16-así.
- Añadir forbol 12-miristato 13-acetato (PMA) (para la diferenciación de THP1) a la suspensión diluida de cultivo celular (10 μl/20 ml de cultivo de la población de 50 mg / ml en DMSO) (concentración final de PMA en cultivo de células diluido debe ser 25 ng / ml).
- Para comparar el Digital-Image-Análisis-Direct-Counting-ensayo y Parasite-Rescue-Transformación de ensayo-, configure los ensayos de forma simultánea en claro, de fondo plano de 96 pocillos y 16 de cámara, vidrio, diapositivas cultura microscópico.
- Dispensar 200 l de células THP1-tratadas con PMA a cada pocillo o cámara.
- Incubar la p de 96 pocilloslates y 16-así la cámara de diapositivas en un 37 ° C, 5% de CO 2 incubadora durante la noche para permitir la diferenciación casi completa de las células.
Nota: Las células THP1, que normalmente crecen en suspensión, se diferencian en macrófagos adherentes.
4. La infección de las células transformadas THP1 con promastigotes de Leishmania donovani
- Para la infección de cultivo de células THP1 diferenciadas con promastigotes de Leishmania donovani, la mayoría de los parásitos deben estar en la fase metacyclic infecciosa (largas formas cilíndricas, ~ 5-6 días cultivo de edad).
- Una célula THP1 1:10 a relación de parásito es óptima para la infección tanto en la imagen digital-Análisis-directo de Conteo de-muestra y la promastigotes-Rescue-Transformación de ensayo-.
- Preparar un cultivo diluido de L. donovani promastigotes con un recuento de parásitos de 2.5x10 6 parásito / ml (para células THP1: relación de parásitos = 1:10) deun cultivo de 5 a 6-días de edad en medio RPMI-1640 con FBS al 2%.
- Desde el paso de 3,5 (después de la diferenciación durante la noche del cultivo de células THP1) sacar las placas y las diapositivas de la cámara, retire el medio y lavar los cultivos de células una vez con suero libre de RPMI-1640.
- Después de lavado cuidadoso de PMA tratados con células THP1 libre de suero, cálido RPMI-1640 (~ 37 ° C) medio, sustituir el medio libre de suero con 200 l de cultivo diluido de L. donovani promastigotes (2.5x10 6 parásitos / ml) desde el paso 4,3. Configuración de los pocillos de control de células THP1 sin el parásito y los parásitos sin células THP1 en cada placa y 16-así la cámara de diapositivas.
- Después de añadir parásito al cultivo celular THP1, incubar la placa y se desliza a 37 ° C, 5% de CO 2 durante 24 horas para permitir que los parásitos infectan las células diferenciadas THP1.
5. El tratamiento de los macrófagos infectados con fármacos de ensayo / Compuestos
- PruebaLa anfotericina B, pentamidina y miltefosina como estándar anti-Leishmania medicamentos para el cribado. Preparar las soluciones madre de los fármacos / compuestos de ensayo en agua o DMSO como se menciona en la tabla reactivo. Prueba de cada fármaco en 6 concentraciones.
- Diluciones seriadas (1:5) de los fármacos estándar y compuestos de ensayo en una placa fresca de 96 pocillos o tubos de 2 ml (para la cámara de diapositivas) con medio RPMI-1640 con FBS al 2%. Las drogas / concentraciones de compuesto de ensayo en esta placa son 2X de concentraciones finales.
- Lave las placas de cultivo y las diapositivas de la cámara infectados con L. donovani promastigotes (del paso 4,5) por lo menos 5 veces con suero libre, medio RPMI-1640. Añadir 100 l medio de cultivo (RPMI-1640 con FBS al 2%) en cada pocillo / cámara. Los múltiples lavados son necesarios para asegurar la eliminación completa de no internalizadas promastigotes.
- Añadir 100 l de medio en serie diluido corriente anti-Leishmania drogas o los compuestos de ensayo a cada pocillo o cámara. Configure la infecciónted células THP1 controles sin fármacos simultáneamente en cada diapositiva placa / cámara.
- Incubar las placas y los portaobjetos de cámara a 37 ° C, 5% de CO 2 durante 48 horas.
6. Cámara de tinción de diapositivas, imágenes de microscopio fluorescente y Análisis de Imágenes para la cuantificación de la infección y el efecto del tratamiento de drogas
- Después de una incubación de 48 horas, se lava la cámara de corredera 3 veces con suero libre de RPMI-1640. Despegue las cámaras de plástico de los portaobjetos y fijar las células mediante la inmersión de los portaobjetos en metanol durante 30 sec. Deja las diapositivas de bio-bajo campana de flujo de aire para el secado.
- Preparar un SYBR Green I solución de tinción (5X) diluyendo (1:2000) de las existencias (10.000 X) con agua.
- Mancha de las diapositivas en condiciones de oscuridad con el SYBR Green I mancha diluida solución durante 15 min a temperatura ambiente, se lava una vez con agua y dejar los portaobjetos bajo el flujo de aire para el secado.
- Coloque un cubreobjetos de vidrio total sobre el staiNED deslizante con la ayuda de medio de montaje.
- Capturar las imágenes digitales de células THP1: sin infección (en blanco), con la infección (control), las células infectadas tratadas con diferentes fármacos estándar o los compuestos de ensayo en diferentes diluciones (Figura 3, 5 y 6)) utilizando un microscopio Nikon Eclipse 90i fluorescente acompañada por elemento NIS software AR 3,2.
- Contar los núcleos de macrófagos (grande), y los núcleos parásito (pequeño con cinetoplasto) usando ImageJ (Figura 7), que es un públicamente-disponible, basada en Java programa de procesamiento de imágenes desarrollado en los Institutos Nacionales de la Salud ( http://rsb. info.nih.gov / ij / download.html ). Expresar los datos como el número de amastigotes por 100 transformado células THP1.
7. El Parásito-Rescue-Transformación-ensayo: lisis controlada de L. donovani macrófagos infectados con amastigotes
- Lavar la microplaca de 96 pocillos de 5,5 paso tres veces con suero libre de medio de cultivo RPMI-1640.
- Entre diferentes detergentes ensayados en diferentes concentraciones, 0,05% de tratamiento de SDS durante 30 segundos es óptimo para la lisis controlada (lisis celular máxima con la mínima pérdida de viabilidad parásitos rescatado ').
- Eliminar el medio libre de suero de cada pocillo después del último lavado y se añaden 20 l de RPMI-1640 (con 0,05% de SDS) a cada pocillo. Agitar la placa durante 30 segundos y añadir 180 l completo RPMI-1640 (con FBS al 10%) a cada pocillo.
- Las placas se incuban a 26 ° C durante 48 horas para la transformación de amastigotes a promastigotos rescatados.
8. Análisis cuantitativo de promastigotes Transformado (alamarBlue ensayo)
- Después de una incubación de 48 hr a 26 ° C, todos los amastigotes rescatados vivos se transforman en promastigotes (Figura 1D). Añadir 10 l de alamarBlue a cada pocillo de la p 96 pocilloslates.
- Incubar las placas a 26 ° C durante la noche.
- Después de la incubación durante la noche, leer las placas de fluorescencia estándar en un fluorímetro Fluostar Galaxy (BMG Tecnologías Lab) en nm de excitación 544, emisión 590 nm.
- Preparar las curvas de respuesta de dosis (por ciento de crecimiento frente a la concentración del fármaco o de prueba) con ExcelFit (Figuras 7-9) y calcular IC 50 / IC 90 valores de estas curvas (Tabla 1).
9. La estandarización de las células THP1 Relación Parásitos
- Estandarizar las células THP1 relación a los parásitos para determinar la sensibilidad del ensayo. Nota: la infección bajo / alto número de parásitos / puede comprometer con sensibilidad y selectividad de la detección.
- Estandarizar las células THP1 relación a los parásitos siguiendo el protocolo descrito anteriormente para THP1 siembra de células y la infección por Leishmania promastigotes (sección 3 y 4), salvo el uso diffratios de erent de células THP1 a parásitos como 1:1,25, 1:2,5, 1:5 y 1:10.
- El montaje del experimento tanto en la corredera 16-cámara (por análisis de imagen) y 96-así placa (para el ensayo de rescate de parásito) formatos para comparar el rescate de parásitos y los ensayos de análisis de imagen.
10. Normalización de los diferentes detergentes para la lisis celular controlada
- El principal objetivo de este experimento es para optimizar el protocolo de lisis controlada de las células THP1 para lograr el máximo / lisis completa THP1 células sin afectar significativamente a la viabilidad de los parásitos amastigotes rescatados.
- Probar diferentes detergentes tales como Tween 20, Tween 80, Triton X-100, NP 40-y SDS a diferentes concentraciones y diferentes duraciones de tratamiento (Figura 2).
- Células THP1 relación a los parásitos es 1:10 y otras condiciones son similares como secciones anteriores 1-8.
- Pruebe el 0,05% SDS tratamiento adicional para el tiempo de tratamiento diferentes para optimizar aún más la lisis celular controlada.
Resultados
El análisis cuantitativo se realizó tanto para Digital-Image-Análisis-Direct-Counting-ensayo y Parasite-Rescue-Transformación-Ensayo para 24, 48, 72 y 96 h de tratamiento post-droga
En el método de conteo directo, infección de L. donovani macrófagos infectados (células THP1) se calculó mediante la siguiente ecuación:
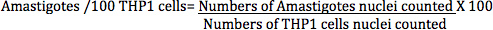
Los amastigotes (determinó contando núcleos amastigotes) / 100 transformado células THP1 (determinado por el recuento contado en núcleos de células THP1) (Figura 7) es una medida más exacta para analizar el efecto de estándar diferente o compuestos de ensayo que el porcentaje de infectados células THP1 , como se informó en algunos documentos anteriores, ya que este número está directamente relacionada con el efecto global de compuestos, ya sea mediante una disminuciónen los parásitos en células de macrófagos o la eliminación total de los parásitos de la cells.Infection macrófagos se calculó a partir de imágenes digitales de infectados THP1 células tratadas con diferentes fármacos estándar en diferentes diluciones para diversos intervalos de tiempo (Figura 10 y Tabla 1). La lectura de la Digital-Imagen-Análisis-Direct-Counting-ensayo se amastigotes infection/100 THP1 transformado células, mientras que la lectura para el parásito-Rescue-Transformación-ensayo fue de unidades de fluorescencia relativa (RFU), que es directamente proporcional al número de amastigotes de Leishmania en vivo rescatados de los macrófagos infectados y se transforman en promastigotes. El ensayo alamarBlue se utiliza rutinariamente para la detección de drogas Leishmania promastigotes anti-Leishmania.
El ensayo fue inicialmente estandarizada y optimizada para la lisis controlada de infectados por Leishmania células THP1. El objetivo era optimizar las condiciones para el detergente en tretamiento, que producen la lisis casi completa de células THP1 con un efecto mínimo sobre la viabilidad de los amastigotes rescatados. Figura 1 representa una vista microscópica del protocolo de ensayo completo. THP1 intactas las células infectadas con amastigotes de Leishmania se puede ver en la Figura 1A. Figura 1B muestra la lisis de las células THP1 después de tratamiento con detergente. Figura 1C muestra rescatado Leishmania amastigotes, que han sido parcialmente transformado en promastigotos y Figura 1D muestra la transformación casi completa de amastigotes en promastigotes y su proliferación posterior. El crecimiento de estas promastigotes transformadas pueden ser cuantitativamente controlados con adición de alamarBlue y la medición de la fluorescencia en un lector de microplacas. El tratamiento con NP-40 (Figura 2A) y Triton X-100 (Figura 2B) se lisaron las células infectadas THP1, sin embargo, también influyó en la viabilidad ytransformación de los amastigotes rescatados. El tratamiento con Tween 20 (Figura 2C) y Tween 80 (Figura 2D) no causan la lisis óptima de células THP1 resultantes en un rescate incompleta de amastigotes como se indica por un bajo número de promastigotes transformadas. El tratamiento con 0,05% de SDS durante 30 seg (2E Figura) produjo lisis casi completa de infectados por Leishmania células THP1 y no afectó a la viabilidad y la transformación de amastigotes rescatado. Optimización adicional demostró que el tratamiento de las células con 0,05% de SDS durante 20-30 segundos dio más alto de rescate de amastigotes de Leishmania viables (Figura 2F). En experimentos posteriores, el tratamiento con 0,05% de SDS durante 30 seg fue usado. Procedimiento para el tratamiento de SDS es la misma para las placas individuales o múltiples. En placas múltiples, el tratamiento se llevó a cabo SDS columna por columna con una pipeta multicanal. Medio libre de suero fue eliminado de todos los 8 pocillos de una columna de la placa y 20 y mu; L de SDS al 0,05% se añadió en 8 pozos de la misma columna y se diluyó después de 30 segundos con RPMI-1640 con FBS al 10%. Durante la calibración inicial del ensayo, las placas se examinan bajo el microscopio para no internalizadas promastigotes. Un mínimo de cinco lavados fueron necesarias para la eliminación de parásitos antes de la etapa 5 de tratamiento de las células de macrófagos infectados con compuestos estándar y tres lavados fueron necesarias antes del paso 7 de tratamiento de SDS. Así, las células se lavaron 8 veces y no visibles no internalizadas promastigotes se mantuvo antes de la lisis de control de infectados células THP1.
Análisis de imagen digital y conteo directo
Las imágenes digitales de los infectados por Leishmania células THP1 fueron capturados en microscopio Nikon Eclipse 90i fluorescente después de la tinción con SYBR Green I. Ambos núcleos macrófagos y núcleos intracelular Leishmania con ADN cinetoplasto característica se observaron bajo los filtros fluorescentes (Figura 3). Además, las imágenes de las células infectadas THP1 también fueron capturados bajo DIC. Cuando las dos imágenes se fusionaron, los contornos de las células THP1 con amastigotes intracelulares se ve más claramente (Figura 4). El software ImageJ se utilizó para analizar estas imágenes. ImageJ es un dominio público, basado en Java, de procesamiento de imágenes programa desarrollado en los Institutos Nacionales de Salud ( http://rsb.info.nih.gov/ij/download.html ). ImageJ ha sido diseñado con una arquitectura abierta que provee extensibilidad a través de plugins de Java y macros grabables. Plugins adquisición personalizada, análisis y procesamiento se pueden desarrollar utilizando built-in editor de ImageJ y un compilador Java. Para recuento diferencial de células y núcleos THP1 núcleos parásito por ImageJ, la imagen fue inaugurado en ImageJ. Contador celular se encuentra en la opción Analizar en el plugin del Software. La imagen se ha inicializado y el tipo celular contador 1 fue seleccionado para THP1 cnúcleos ell y tipo de célula contador 2 ha sido seleccionado para los núcleos del parásito (Figura 3). Conteo diferencial se hizo para núcleos de las células por lo menos 200 THP1 y los amastigotes intracelulares presentes en estos núcleos de células THP1. Una comparación de ensayo parásito-rescate y el método de análisis de imágenes se realizó para evaluar la infectividad de las células THP1 con diferente macrófagos:. Ratios de promastigotes (Figura 4) Figura 5 representa la infectividad diferencial en células THP1 en macrófagos diferente: relaciones de promastigotes. Ambos métodos mostraron resultados comparables y macrófagos: relación entre promastigotes de 1:10 cedido infectividad óptima y reproducible.
Una vez que las condiciones de ensayo parasite-rescue/transformation y el análisis de imagen digital se optimizaron, la utilidad de estos ensayos se evaluó para la detección de drogas anti-Leishmania. Los infectados por Leishmania THP1 células fueron tratadas con diferentes concentraciones de un estándarnti-Leishmania medicamentos a saber anfotericina B, pentamidina y miltefosina para diferentes intervalos de tiempo de 24 a 96 h. El experimento de parásito rescatado / transformación ensayo se realizó por triplicado y el experimento para recuento directo de células método se realizó por duplicado. Figura 6 muestra imágenes microscópicas del control de control no infectadas, no tratadas infectadas y Leishmania infectados, tratados células THP1. Las curvas de respuesta de dosis se preparó a partir del ensayo de parásito-rescate y la transformación (concentración del fármaco frente a parásitos transformadas) y el ensayo de análisis de imagen (número de amastigotes/100 células THP1) (Figuras 7-9). El IC 50 de los fármacos se calcularon por ExcelFit y se presentan en la Tabla 1. Digital-Image-Análisis-Direct-Counting-ensayo y Parasite-Rescue-Transformación ensayo mostraron resultados comparables. Digital-Image-Análisis-Direct-Counting-ensayo fue menos óptima durante los momentos iniciales de 24 y 48 h de drogas camisetasreatments, mientras que el parásito-Rescue-Transformación-ensayo mostró resultados más consistentes con los valores reportados en todos los puntos de tiempo durante la hora 24-96 después de los tratamientos farmacológicos. Esta diferencia de resultados con Digital-Image-Análisis-Direct-Counting-ensayo y Parasite-Rescue-Transformación de ensayo-puede ser debido a la presencia de amastigotes no viables durante períodos tempranos del tratamiento farmacológico en Digital-Image-Análisis-Direct-Counting -Ensayo.

Figura 1. Una vista microscópica de la Leishmania donovani amastigotes de rescate y la transformación de promastigotes. A - adherentes THP1 células infectadas con Leishmania amastigotes, b - adherentes, infectados THP1 células después de la lisis controlada C - Transformada de Leishmania donovani promastigotes de los amastigotes rescatados de macrófagos infectados THP1 células D - Crecimiento y proliferación de Transformed Leishmania donovani promastigotes.
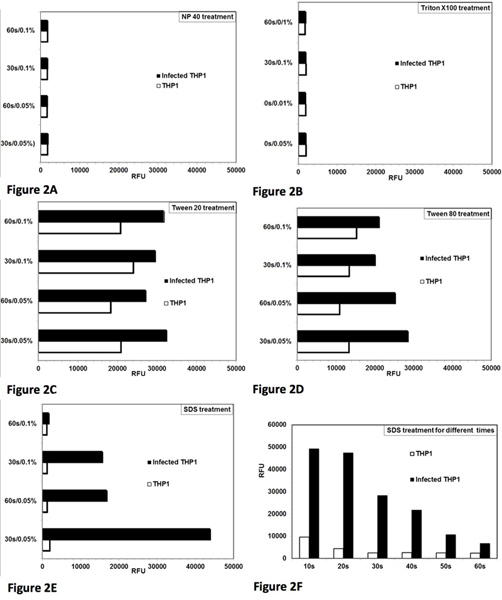
Figura 2. Optimización de lisis controlada de células THP1 infectados para lograr rescate máximo de amastigotes de Leishmania donovani vivos y su transformación a promastigotes. Análisis de la lisis de las células THP1 y rescate de amastigotes de los infectados por Leishmania células THP1 con diferentes detergentes. Dos concentraciones (0,05% y 0,1%) de detergente y dos periodos de tiempo (30 segundos y sec 60) para el tratamiento se ensayaron. RFU = unidades de fluorescencia relativa. Cada barra representa la media de las observaciones duplicadas. [A] NP-40 tratamiento provocó la lisis de las células THP1 y también se ve afectada la viabilidad de los parásitos amastigotes rescatados. [B] Triton X-100 tratnt causó la lisis de las células THP1 y también se ve afectada la viabilidad de los parásitos amastigotes rescatados [C] de Tween 80 causado lisis parcial de células THP1 para rescatar a los amastigotes. [D] de Tween 80 causado lisis parcial de células THP1 para rescatar a los amastigotes. [E ] tratamiento SDS lisis producida casi completa de células THP1 y no afectó a la viabilidad de los amastigotes rescatadas en 0,05% / 30 seg. [F] El tratamiento con 0,05% de SDS durante 20-30 seg causado lisis casi completa de células THP1 y rescatados parásito viable amastigotes se transforman en promastigotes a. Haga clic aquí para ampliar la cifra .

Figura 3. Fluorescente imagen digital de una THP1 diferenciadas de células infectadas in vitro con Leishmaniun donovani amastigotes. El kADN característica también se puede ver con cada núcleo parásito. El núcleo de macrófagos (mN) (1) y los núcleos parásito (pN) (2) pueden ser diferencialmente marcadas diferencialmente y se contaron por software ImageJ análisis para la evaluación cuantitativa de la infección. La cuantificación se realizó como número de amastigotes/100 células THP1.
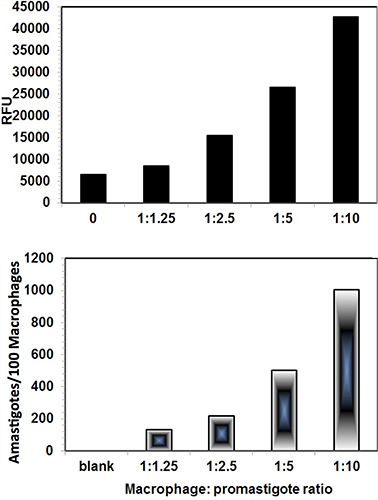
Figura 4. Comparación entre-Digital-Image-análisis directo de Conteo-ensayo (panel inferior) y Parasite-Rescue-Transformación-ensayo (panel superior). El macrófago: relación de promastigote de 1:10 dio infección óptima. Ambos mostraron resultados comparables. El ensayo de rescate parásito mostró algunos valores de fondo. Cada barra muestra la media de los valores duplicados.

Figura 5 THP1 células infectadas con promastigotes de Leishmania por diferentes THP1:. Relación de promastigote. Los resultados cuantitativos como el número de amastigotes/100 células THP1 se presentan en la Figura 4.

Figura 6. Imágenes digitales (Fluorescente + DIC) de células THP1 infectados con Leishmania donovani amastigotes después del tratamiento con anti-Leishmania estándar medicamentos para diferentes períodos de tiempo. Los resultados fueron cuantificados como número de amastigotes/100 células THP1 y se utiliza para calcular el porcentaje de crecimiento en comparación con controles no tratados y determinar los valores de CI 50.

Figura 7. Comparación de Digital-Image-Análisis-Direct-Counting-ensayo y Parasite-Rescue-Transformación-Ensayo para la detección de drogas anti-Leishmania (Amophotericin B). Los macrófagos infectados fueron tratados con diferentes concentraciones de anti-Leishmania estándar fármaco para diferentes períodos. IC 50 (g / ml) los valores se calculan a partir de la curva dosis-respuesta por Excelfit. Haga clic aquí para ampliar la cifra .
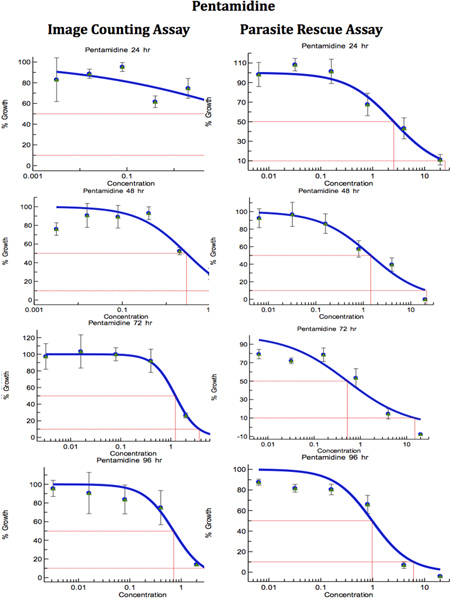
Figura 8. Comparación de Digital-Image-Análisis-Direct-Counting-ensayo y Parasite-Rescue-Transformación-Ensayo para unanti-Leishmania detección de drogas (pentamidina). Los macrófagos infectados fueron tratados con diferentes concentraciones de anti-Leishmania estándar fármaco para diferentes períodos. IC 50 (g / ml) los valores se calculan a partir de las curvas de dosis-respuesta por Excelfit. Haga clic aquí para ampliar la cifra .
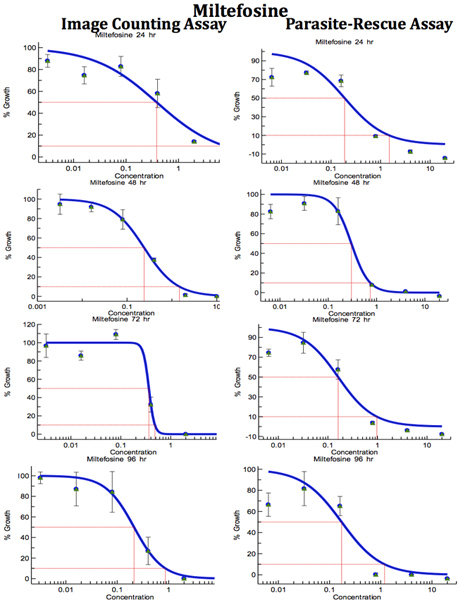
Figura 9. Comparativa de Digital-Image-Análisis-Direct-Counting-ensayo y Parasite-Rescue-Transformación-Ensayo para la detección de drogas anti-Leishmania (Mitefosine). Los macrófagos infectados fueron tratados con diferentes concentraciones de anti-Leishmania estándar fármaco durante períodos de tiempo diferentes. IC 50 (g / ml) los valores se calculan a partir de las curvas de respuesta a dosis por Excelfit.Haga clic aquí para ampliar la cifra .
| Examen de drogas | 24 horas un | 48 hr un | 72 horas un | 96 horas un | ||||
| B IACA | C PRTA | B IACA | C PRTA | B IACA | C PRTA | B IACA | C PRTA | |
| La anfotericina B | 0,24 ± 0,03 | 0,17 ± 0,01 * | 0,12 ± 0,04 | 0,20 ± 0,07 | 0,06 ± 0,01 | 0,06 ± 0,01 | 0,11 ± 0,03 | 0,10 ± 0,03 |
| La pentamidina | > 10 | 2,55 ± 1,16 * | 2,88 y plusmn; 0,58 | 1,43 ± 0,91 | 1,24 ± 0,35 | 1,52 ± 0,16 | 0,71 ± 0,63 | 0,98 ± 0,33 |
| Miltefosina | 0,38 ± 0,02 | 0,19 ± 0,08 * | 0,24 ± 0,06 | 0,30 ± 0,08 | 0,36 ± 0,02 | 0,16 ± 0,06 | 0,21 ± 0,15 | 0,17 ± 0,10 |
Tabla 1. Comparación de Digital-Image-Análisis-Direct-Counting-ensayo y Parasite-Rescue-Transformación-Ensayo para la detección de drogas anti-Leishmania. Los macrófagos infectados fueron tratados con diferentes concentraciones de anti-Leishmania estándar fármaco para diferentes períodos. IC 50 (g / ml) los valores se calculan a partir de las curvas de respuesta a dosis por Excelfit (figuras 7-9) un puesto de horas de tratamiento de drogas;. Contaje IACA b = Análisis de Imagen y directoEnsayo, c = PRTA Parasite-Rescue y Ensayo de Transformación. Los valores dados son IC 50 (concentración del fármaco que causa el 50% de inhibición en el crecimiento del parásito) como g / ml y son la media ± SD de al menos tres experimentos. * Estadísticamente diferente (<0,05) en comparación con IC 50 valores con IACA.
Discusión
Hay varios métodos disponibles para la detección de drogas anti-Leishmania basándose en los macrófagos-amastigotes modelos. Los ensayos se pueden hacer con los macrófagos recogidos de animales huéspedes células de exudado peritoneal a saber (PEC), células de monocitos de sangre periférica (PBMC) 6 o derivados de médula ósea macrófagos (BMM) o en líneas celulares monocíticas, tales como ratón (J774 y RAW264.7 ) 7 y humano (THP1, U937, HL-60) 8 células monocíticas. Los ensayos, que utilizan células que se dividen de acogida, debe asegurarse de que los efectos de confusión de la actividad de la droga, tanto en número de parásitos y células huésped son considerados. Los macrófagos diferenciados primarios recopilados de diversas fuentes, tales como los ratones y las ratas son la no división en la naturaleza, pero estas preparaciones celulares no pueden tener poblaciones homogéneas de células. Monocítica células derivados de las líneas celulares son homogéneos en la naturaleza y son un modelo mejor para la detección de macrófagos amastigote basada. Fuera de diferentes líneas celulares monocíticas, diferentiated células THP1 (aguda humana línea celular de leucemia monocítica) pueden formar una monocapa que no se dividen y ofrecer una alternativa atractiva a los macrófagos aislados primarios.
La detección de macrófagos amastigote basado se puede hacer de varias maneras. Evaluación microscópica clásica basada en células directo y contar parásito 9 es mano de obra intensiva. La ausencia de automatización limita la utilidad de este ensayo. Recuento de células consume mucho tiempo y puede dar determinación inexacta de valores de CI 50 puesto que la determinación de la viabilidad del parásito a través de un procedimiento de tinción es difícil. Muchos colorantes fluorescentes y anticuerpos monoclonales pueden emplearse para ensayos de citometría de flujo 10, 11, pero estos ensayos también son limitadas debido a la menor sensibilidad y la limitación del intervalo de tiempo de tratamiento de drogas para un solo día. Hay varios ensayos de gen reportero disponibles para cuantificar el crecimiento de amastigotes intracelulares 12,13,14. Un autómataed cribado puede ser posible utilizando genes indicadores, pero estos ensayos también tienen ciertos inconvenientes. En primer lugar, la mayoría de estos ensayos requieren la selección de medicamentos para el mantenimiento de la expresión episomal de los genes indicadores, que puede no ser ideal para un experimento de detección de drogas. La manera por la que se introduce el gen indicador también podría influir en las propiedades fisiológicas del parásito y tener un impacto en el cribado. Si el gen reportero es la parte de un plásmido episomal, la salida relativa del reportero puede depender del número de copias del plásmido transfectado (que varía de célula a célula) en lugar de en la actividad del fármaco 14. Algunos parásitos reportero que se transforman parásitos no necesita presión selectiva para mantener el gen indicador, sin embargo, podría haber consecuencias biológicas ya sea mediante la interrupción de la arquitectura genómica o simplemente por la presencia de las proteínas indicadoras extranjeros 15. En algunos ensayos de gen reportero basados, hayasuntos de actividad sensibilidad y el fondo 16. Lo más importante, muchos de los ensayos de expresión de genes informadores, especialmente el uno con GFP reportero gene15, no puede diferenciar entre los amastigotes intracelulares vivas y muertas. Los ensayos basados en el gen reportero de la luciferasa puede discernir entre vivos y muertos amastigotes intracelulares, pero sustrato y tampón de lisis celular para estos ensayos son costosos para el cribado a gran escala 17. Para superar estas desventajas y limitaciones de los ensayos de selección anteriores macrófago-amastigote basada, hemos desarrollado y optimizado este ensayo parásito-rescate y la transformación. Este ensayo se basa en células THP1, que tienen una buena homogeneidad y son que no se dividen en la naturaleza, como células huésped.
El ensayo Parásito-Rescue-Transformación-ensayo descrito aquí es comparable con el ensayo basado en Digital-Image-Análisis-Direct-Recuento de los amastigotes intracelulares. Microscopía de fluorescencia y DIC, digital imaganálisis e por ImageJ para recuento diferencial de los núcleos de los macrófagos y los núcleos parásito han perfeccionado el ensayo de recuento microscópico. La captura de las imágenes en virtud de filtros de luz fluorescente y de contraste diferencial de interferencia (DIC) filtros han mejorado la calidad de la imagen digital para la cuenta más exacta de los parásitos intracelulares. Ambas imágenes fluorescentes y DIC se pueden combinar para obtener las imágenes digitales con contornos claros y núcleos celulares de macrófagos intracelular fluorescente. Los núcleos de los macrófagos y los núcleos parásito puede ser diversamente reconocido con ImageJ. Por lo tanto, ambas Digital-Image-Análisis-Direct-Counting-ensayo y Parasite-Rescue-Transformación de ensayo-tienen el potencial para la automatización y la aplicación a gran escala de cribado. Los pasos críticos en el Parásito-Rescue-Transformación-ensayo son los siguientes: (a) los lavados repetidos de THP1 cultivos de células después de la exposición a promastigotes de Leishmania, para asegurar la eliminación casi total de la no-internospromastigotes zado y (b) la lisis controlada de las células THP1 infectadas con SDS. Tanto los pasos también se pueden controlar con la automatización y no deben comprometer con el rendimiento del ensayo. El segundo paso de lavado, después de la exposición de las células THP1 Leishmania infectadas a los fármacos de ensayo / compuestos elimina los restantes no internalizadas parásitos, si los hay. El Parásito-Rescue-Transformación-ensayo ofrece ventajas significativas sobre los existentes gen reportero microscópico, y ensayos de análisis de imágenes. El ensayo es simple, robusto y reproducible, puede ser automatizado para gran escala de detección y por lo tanto debe tener una aplicación importante en el cribado de bibliotecas de compuestos grandes para el descubrimiento de nuevos fármacos anti-Leishmania. Además, el ensayo también se puede aplicar para la evaluación de la infectividad de clínica, así como, aislamientos de laboratorio de Leishmania in vitro.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
El NCNPR-USDA-ARS Científico acuerdo No. 58-6408-2-0009; CDMRP Premio subvención # W81XWH-09-2-0093 por Ejército de los EE.UU. La investigación médica y el Comando de Material.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de Catálogo | Comentarios |
| Forbol 12-miristato 13-acetato (PMA) | Sigma-Aldrich EE.UU. | P1585 | Necesaria para la diferenciación de células THP1. |
| Medio RPMI-1640 | Invitrogen | 23400021 | |
| Lab-Tek Cámara System Slide (16 Sala) | Thermo Scientific Nunc | 178599 | |
| Claro, de fondo plano, de 96 pocillos | BD Falcon | 353075 | Platos para llevar a cabo de 96 pocillos placa de ensayo |
| La anfotericina B | Sigma-Aldrich EE.UU. | A4888 | Estándar anti-Leishmania fármaco se disuelve en DMSO (2 mg / ml) |
| La pentamidina isotionato Salt | Sigma-Aldrich EE.UU. | P 0547 | Estándar anti-Leishmania fármaco se disuelve en DMSO (2 mg / ml) |
| Miltefosina | EMD Biosciences EE.UU. | 475841 | Estándar anti-Leishmania fármaco se disuelve en suero libre de RPMI-1640 (preparar fresco) (2 mg / ml) |
| Sodio Stibogluconate | EMD Biosciences EE.UU. | 567565 | Estándar anti-Leishmania fármaco preparar en medio RPMI-1640 con FBS al 4%. (1 mg / ml) |
| Dodecil sulfato de sodio | Sigma-Aldrich EE.UU. | L 5750 | |
| Microscopio de Fluorescencia | NIKON | ECLIPSE 90i | |
| Fluorescencia Lector de Microplacas | BMG | Polar Galaxy Star | |
| Medio de Montaje | Sigma-Aldrich EE.UU. | M 1289 | |
| unlamarBlue | AbD Serotec | BUF012 B | |
| SYBR Green I | Sigma-Aldrich EE.UU. | S 9430 | |
| Bicarbonato de Sodio | Fisher Ciencia. | 523500 | |
| Piruvato de sodio | Sigma-Aldrich EE.UU. | P2256 | |
| 2-mercaptoetanol | Sigma-Aldrich EE.UU. | M6250 | |
| Suero Bovino Fetal | Atlanta Biológicos | S11050H | |
| Tween 20 | Sigma-Aldrich EE.UU. | P9416 | |
| Tween 80 | Sigma-Aldrich EE.UU. | P6474 | |
| Triton X-100 | Sigma-Aldrich EE.UU. | T8787 | |
| NP-40 | Calbiochem | 492016 |
Referencias
- WHO. . Control of the leishmaniasis: report of a meeting of the WHO Expert Committee on the Control of Leishmaniasis. Xii, 22-26 (2010).
- Croft, S. L., Seifert, K., Yardley, V. Current scenario of drug development for leishmaniasis. Indian J. Med. Res. 123 (3), 399-410 (2006).
- Croft, S. L., Sundar, S., Fairlamb, A. H. Drug Resistance in Leishmaniasis. Clinical Microbiology reviews. 19 (1), 111-126 (2006).
- Mikus, J., Steverding, D. A simple colorimetric method to screen drug cytotoxicity against Leishmania using the dye AlamarBlue. Parasitology International. 48 (3), 265-269 (2000).
- Callahan, H. L., Portal, A. C., Devereaux, R., Grogl, M. An Axenic Amastigote System for Drug Screening. Antimicrob. Agents Chemother. 41 (4), 818-822 (1997).
- Seifert, K., Escobar, P., Croft, S. L. In vitro activity of anti-leishmanial drugs against Leishmania donovani is host cell dependent. J. Antimicrob. Chemother. 65 (3), 508-511 (2010).
- Kolodziej, H., Kiderlen, A. F. Antileishmanial activity and immune modulatory effects of tannins and related compounds on Leishmania parasitized RAW 264.7 cells. Phytochemistry. 66 (17), 2056-2071 (2005).
- Maia, C., et al. Infectivity of five different types of macrophages by Leishmania infantum. Acta Tropica. 103 (2), 150-155 (2007).
- Neal, R. A., Croft, S. L. An in vitro system for determining the activity of compounds against the intracellular amastigote form of Leishmania donovani. J. Antimicrob. Chemother. 14, 463-475 (1984).
- Abdullah, S. M., Flath, B., Presber, H. W. Comparison of different staining procedures for the flow cytometric analysis of U-937 cells infected with different Leishmania-species. J. Microbiol Methods. 37 (2), 123-138 (1999).
- Giorgio, C. D., et al. Flow Cytometric Detection of Leishmania Parasites in Human Monocyte-Derived Macrophages: Application to Antileishmanial-Drug Testing. Antimicrob Agents Chemother. 44 (11), 3074-3078 (2000).
- Mandal, S., et al. High throughput screening of Leishmania donovani clinical isolates against drug using a colorimetric β Lactamase assay. Indian J. Exp. Biol. 47 (6), 475-479 (2009).
- Chan, M. M. Y., Bulinski, J. C., Chang, K. P., Fong, D. A. Microplate assay for Leishmania amazonensis promastigotes expressing multimeric green fluorescent protein. Parasitol. Res. 89 (4), 266-271 (2003).
- Buckner, F. S., Wilson, A. J. Colorimetric assay for screening compounds against Leishmania Amastigote Grown in macrophages. Am. J. Trop. Med. 72 (5), 600-605 (2005).
- Sereno, D., et al. Advances and perspectives in Leishmania cell based drug-screening procedures. Parasitol. Int. 56 (1), 3-7 (2007).
- Gupta, S., Nishi, Visceral leishmaniasis: experimental models for drug discovery. Indian J. Med. Res. 133, 27-39 (2011).
- Roy, G., et al. Episomal and stable expression of the luciferase reporter gene for quantifying Leishmania spp. Infections in macrophages and in animal models. Mol. Biochem. Parasitol. 110 (2), 195-206 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados