Method Article
Анализ паразитов спасению и преобразованию Antileishmanial для скрининга против внутриклеточных
В этой статье
Резюме
Паразита-спасательных и преобразование анализа с THP1 клеток, инфицированных В пробирке С Leishmania donovani Была оптимизирована для борьбы с leishmanial наркотиков отбора. Анализ включает в себя дифференциацию THP1 клеток, инфекция promastigotes, обработка тестов препаратов, контролируемых лизис инфицированных макрофагов, спасение amastigotes, переход к promastigotes и наблюдение за ростом и распространением промастиготы с флуорометрической анализа.
Аннотация
Leishmaniasis is one of the world's most neglected diseases, largely affecting the poorest of the poor, mainly in developing countries. Over 350 million people are considered at risk of contracting leishmaniasis, and approximately 2 million new cases occur yearly1. Leishmania donovani is the causative agent for visceral leishmaniasis (VL), the most fatal form of the disease. The choice of drugs available to treat leishmaniasis is limited 2;current treatments provide limited efficacy and many are toxic at therapeutic doses. In addition, most of the first line treatment drugs have already lost their utility due to increasing multiple drug resistance 3. The current pipeline of anti-leishmanial drugs is also severely depleted. Sustained efforts are needed to enrich a new anti-leishmanial drug discovery pipeline, and this endeavor relies on the availability of suitable in vitro screening models.
In vitro promastigotes 4 and axenic amastigotes assays5 are primarily used for anti-leishmanial drug screening however, may not be appropriate due to significant cellular, physiological, biochemical and molecular differences in comparison to intracellular amastigotes. Assays with macrophage-amastigotes models are considered closest to the pathophysiological conditions of leishmaniasis, and are therefore the most appropriate for in vitro screening. Differentiated, non-dividing human acute monocytic leukemia cells (THP1) (make an attractive) alternative to isolated primary macrophages and can be used for assaying anti-leishmanial activity of different compounds against intracellular amastigotes.
Here, we present a parasite-rescue and transformation assay with differentiated THP1 cells infected in vitro with Leishmania donovani for screening pure compounds and natural products extracts and determining the efficacy against the intracellular Leishmania amastigotes. The assay involves the following steps: (1) differentiation of THP1 cells to non-dividing macrophages, (2) infection of macrophages with L. donovani metacyclic promastigotes, (3) treatment of infected cells with test drugs, (4) controlled lysis of infected macrophages, (5) release/rescue of amastigotes and (6) transformation of live amastigotes to promastigotes. The assay was optimized using detergent treatment for controlled lysis of Leishmania-infected THP1 cells to achieve almost complete rescue of viable intracellular amastigotes with minimal effect on their ability to transform to promastigotes. Different macrophage:promastigotes ratios were tested to achieve maximum infection. Quantification of the infection was performed through transformation of live, rescued Leishmania amastigotes to promastigotes and evaluation of their growth by an alamarBlue fluorometric assay in 96-well microplates. This assay is comparable to the currently-used microscopic, transgenic reporter gene and digital-image analysis assays. This assay is robust and measures only the live intracellular amastigotes compared to reporter gene and image analysis assays, which may not differentiate between live and dead amastigotes. Also, the assay has been validated with a current panel of anti-leishmanial drugs and has been successfully applied to large-scale screening of pure compounds and a library of natural products fractions (Tekwani et al. unpublished).
протокол
1. Поддержание и субкультуры THP1 культуре клеток
- Поддерживать THP1 клеток в RPMI-1640 среды (с 10% FBS и рН 7,4) при 37 ° С в 5% СО 2 инкубатора.
- Субкультура клетки два раза в неделю, чтобы предотвратить клеток от превышения 1x10 6 клеток / мл. Это важно для поддержания их трансформации способности.
2. Поддержание и субкультуры Leishmania donovani Promastigotes культуры
- Поддерживать L. donovani promastigotes (S1, Судан деформации) в RPMI-1640 среде (без бикарбоната натрия и пируват натрия) с 10% FBS при 26 ° C.
- Субкультура L. donovani promastigotes два раза в неделю, с высокой концентрацией клеток в диапазоне от 20-25x10 6 promastigotes / ml.Caution: все средства массовой информации и решения должны быть доведены до комнатной температуры перед использованием.
3. Посев и дифференциации клеток THP1 в 96-луночных микропланшетов и 16-камеры стекло культуры слайдов.
- Подготовка разбавленный THP1 культуре клеток из 2.5x10 5 клеток / мл с четырех-дневных культуре клеток (клеток не должна превышать 10 6 клеток / мл) в RPMI-1640 с добавлением 10% инактивированной нагреванием FBS. Подготовлено 20 мл культуры для каждого 96-луночный планшет и 4 мл культуры для каждого 16-а камера слайд.
- Добавить форболового 12-миристат 13-ацетат (PMA) (для дифференциации THP1) в разбавленной суспензии культуры клеток (10 μl/20 мл культуры из запаса 50 мкг / мл в ДМСО) (конечная концентрация PMA в разбавленной культуры клеток должны быть 25 нг / мл).
- Для сравнения цифрового анализа изображений-Директ-Счетчик анализа и паразитов-Rescue-Преобразование-анализа, созданная анализов одновременно в ясный, с плоским дном, 96-луночный планшет и 16-камерой, стекла, микроскопические слайды культуры.
- Внесите 200 мкл THP1-PMA-обработанных клеток в каждую лунку или камеры.
- Выдержите 96-а рпокойным и 16-а слайды камере при 37 ° C, 5% CO 2 инкубаторе ночь, чтобы почти полной дифференцировки клеток.
Примечание: THP1 клеток, которые обычно растут в подвеске, которые дифференцированы в приверженца макрофагов.
4. Инфекция трансформированных клеток с THP1 Leishmania donovani Promastigotes
- Для заражения дифференцированных THP1 культуре клеток с Leishmania donovani promastigotes, большинство паразитов должны быть в стадии инфекционного метациклическая (длинными цилиндрическими формами, ~ 5-6 день старая культура).
- 1:10 THP1 ячейки отношение паразита является оптимальным для инфекции в обоих цифрового анализа изображений-Директ-Счетчик анализа и промастиготы-Rescue-Преобразование-анализа.
- Подготовка разбавленной культуры L. donovani promastigotes со счетом паразит 2.5x10 6 паразитов / мл (для THP1 клеток: паразиты отношение = 1:10) с5-6-дневных культуры в RPMI-1640 среде с 2% FBS.
- С шагом 3,5 (после ночного дифференциации THP1 культуре клеток) вынуть пластины и камеры слайдов, удалить средних и мыть клеточных культурах один раз бессывороточной RPMI-1640.
- После тщательного мытья PMA-лечение THP1 клетки без сыворотки, теплый RPMI-1640 (~ 37 ° C) среды, заменить среде без сыворотки с 200 мкл разбавленного культуры L. donovani promastigotes (2.5x10 6 паразитов / мл) с шагом 4.3. Установить контроль скважин THP1 клетки без паразитов и паразитов без THP1 клеток в каждой пластины и 16-а слайды камеры.
- После добавления паразита к THP1 культуре клеток, Инкубировать и слайдов при 37 ° C, 5% CO 2 в течение 24 часов, чтобы позволить паразитам, чтобы заразить дифференцированной THP1 клеток.
5. Лечение инфицированных макрофагов с тестировать лекарства / Соединения
- ТестАмфотерицин B, Пентамидин и милтефозина как стандартный анти-leishmanial препараты для скрининга. Подготовка растворов препаратов / исследуемых соединений в воде или ДМСО в качестве реагента, упомянутых в таблице. Тестирование каждого лекарственного соединения в 6 концентрациях.
- Серийно разбавления (1:5) стандартные препараты и тест соединения в свежем 96-луночный планшет или 2 мл пробирок (для камеры слайдов) с RPMI-1640 среде с 2% FBS. Наркотики / концентрациями тестируемого соединения в этой пластины 2X конечной концентрации.
- Вымойте культуре тарелки и камеры слайды инфицированных L. donovani promastigotes (с шагом 4,5) минимум в 5 раз без сыворотки, RPMI-1640. Добавить 100 мкл культуральной среды (RPMI-1640 с 2% FBS) в каждую лунку / камеру. Нескольких стирок, необходимые для обеспечения полного удаления не-внутреннее promastigotes.
- Добавить 100 мкл среды из серийно разбавленных стандартных анти-leishmanial наркотики или исследуемых соединений в каждую лунку или камеры. Установить инфекцииТед THP1 клеток управляет без наркотиков одновременно в каждой пластине / камеры слайдов.
- Инкубируйте пластины и камеры слайды при 37 ° C, 5% CO 2 в течение 48 часов.
6. Окрашивание палаты слайдов, флуоресцентный микроскоп изображений и анализа изображения для количественного определения инфекции и эффект лечения наркотической
- После 48 ч инкубации, мыть камеру слайд 3 раза бессывороточной RPMI-1640. Снимите пластиковые камеры с горками и зафиксировать клетки путем погружения слайды в метаноле в течение 30 сек. Оставьте слайды в био-капот под поток воздуха для сушки.
- Подготовка SYBR Green I окрашивание раствора (5X) путем разбавления (1:2000) акции (10.000 X) с водой.
- Пятно слайды в условиях низкой освещенности с разбавленным Зеленый SYBR я пятно раствор в течение 15 мин при комнатной температуре, промывают один раз водой и оставить слайдов под поток воздуха для сушки.
- Поместите полный покровного стекла над СТАИНед слайдов с помощью монтажной среды.
- Захват цифровых изображений THP1 клетки: без инфекции (пробел), с инфекцией (контроль), инфицированные клетки, обработанные различными стандартными препаратами или тестируемых соединений в различных разведениях (рис. 3, 5 и 6)) использовании Nikon Eclipse 90i флуоресцентным микроскопом сопровождается по NIS элемент программного обеспечения AR 3.2.
- Граф ядер макрофагов (большой) и паразит ядер (с небольшим kinetoplast) с использованием ImageJ (рис. 7), которая является публично доступной, Java на основе обработки изображений программой, разработанной в Национальном институте здоровья ( http://rsb. info.nih.gov / ц / download.html ). Выразите данные, как количество amastigotes на 100 преобразован THP1 клеток.
7. Паразит-Rescue-Преобразование-анализа: контролируемая лизис L. donovani Amastigotes-инфицированных макрофагов
- Промойте 96-ю лунками с шагом 5,5 три раза бессывороточной RPMI-1640 культуральной среде.
- Среди различных моющих средств протестированы в различных концентрациях, 0,05% SDS лечения в течение 30 сек оптимально для контролируемых лизиса (максимальный лизис клеток с минимальной потерей жизнеспособности спас паразитов »).
- Снимите бессывороточной среды из каждой лунки после последней промывки и добавить 20 мкл RPMI-1640 (с 0,05% SDS) в каждую лунку. Встряхните пластину в течение 30 сек и добавить 180 мкл полной RPMI-1640 (с 10% FBS) в каждую лунку.
- Инкубируйте пластины при 26 ° С в течение 48 ч для преобразования спас amastigotes в promastigotes.
8. Количественный анализ трансформированных промастиготы (alamarBlue анализ)
- После 48 ч инкубации при 26 ° C, все спасены живыми amastigotes превращается в promastigotes (рис. 1D). Добавить 10 мкл alamarBlue в каждую лунку 96-а ррует.
- Инкубируйте пластины при температуре 26 ° С в течение ночи.
- После инкубации в течение ночи, читать пластины для стандартных флуоресценции на Fluostar Galaxy флуориметра (BMG Лаборатория технологий) в 544 нм возбуждения 590 нм излучения.
- Подготовка дозы кривые отклика (рост процентов по сравнению с концентрацией соединения наркотиков или тест) с ExcelFit (рис. 7-9) и вычислить IC 50 / IC 90 значений из этих кривых (табл. 1).
9. Стандартизация THP1 Клетки Отношение Паразиты
- Стандартизация THP1 клетки отношение паразитов, чтобы определить чувствительность анализа. Примечание: низкий / высокий паразитов числа / инфекция может на компромисс с чувствительностью и селективностью скрининга.
- Стандартизация THP1 клетки отношение паразитов, следуя протоколу, описанному выше для THP1 клеток посева и Leishmania промастиготы инфекции (раздел 3 и 4), за исключением использования разн.различны соотношения THP1 клеток паразитов, как 1:1,25, 1:2,5, 1:5 и 1:10.
- Настройка эксперимента, как в 16-камерой слайд (для анализа изображений) и 96-луночный планшет (для паразита-спасательных анализ) форматов для сравнения паразита спасательных и анализы анализа изображений.
10. Стандартизация различных моющих средств для контролируемого лизис клеток
- Основная цель этого эксперимента заключается в оптимизации протоколов для контролируемого лизис клеток THP1 для достижения максимальной / полный лизис клеток THP1 без существенного влияния на жизнеспособность спасенных паразитов амастигота.
- Тестируйте различные моющие средства, такие как Твин 20, Твин-80, Triton X-100, NP-40 и ДСН при различных концентрациях и различной длительности лечения (рис. 2).
- THP1 клетки соотношение составляет 1:10 паразитов и других аналогичных условиях, как указано выше разделах 1-8.
- Проверьте 0,05% SDS дальнейшего лечения для разного времени леченияс дальнейшей оптимизации контролируемых лизис клеток.
Результаты
Количественный анализ был сделан для цифрового анализа изображений-Директ-Счетчик анализа и паразитов-Rescue-Преобразование-анализа для 24, 48, 72 и 96 ч после лечения наркозависимости
В прямой метод подсчета, инфекции L. donovani-инфицированных макрофагов (клеток THP1) рассчитывается по следующей формуле:
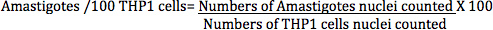
Amastigotes (определяется путем подсчета amastigotes ядер) / 100 преобразован THP1 клеток (определяется путем подсчета учитывается на THP1 ядрах клеток) (рис. 7) является более точной мерой для анализа влияния различных стандартных или тестируемых соединений, чем процент инфицированных клеток THP1 , как сообщалось в некоторых предыдущих работ, так как это число напрямую связано с общим эффектом соединения, либо через снижениеВ паразитов в клетках макрофагов или полное удаление паразита из макрофагов cells.Infection была рассчитана с цифровыми изображениями зараженных THP1 клетки, обработанные различными стандартными препаратами в различных разведениях для различных временных интервалах (рис. 10 и таблица 1). Считывания для цифрового анализа изображений-Директ-Счетчик анализа была преобразована amastigotes infection/100 THP1 клеток, в то время считывания для паразита-Rescue-Преобразование-анализа была относительных единицах флуоресценции (РФС), который является прямо пропорциональна количеству живых amastigotes Leishmania спас от инфицированных макрофагов и превращаются в promastigotes. Анализ alamarBlue обычно используется для Leishmania promastigotes анти-leishmanial наркотиков отбора.
Анализ изначально был стандартизирован и оптимизирован для контролируемого лизис Leishmania-инфицированных THP1 клеток. Цель состояла в том, чтобы оптимизировать условия для моющих средств Treтерпимостью и лечением, которые дают почти полный лизис THP1 клетки с минимальным влиянием на жизнеспособность спас amastigotes. рисунке 1 представлена микроскопическая Ввиду полного протокола анализа. Неповрежденном THP1 клеток, инфицированных amastigotes Leishmania можно увидеть на рисунке 1а. Рис. 1б показывает лизис THP1 клеток после моющего средства лечения. Рис. 1С показывает спас Leishmania amastigotes, которые были частично превращается в promastigotes и рис 1D показывает почти полное преобразование в amastigotes promastigotes и их последующее распространение. Рост этих превращается promastigotes может быть количественно контролировать с добавлением alamarBlue и измерения флуоресценции от планшетного. Лечение NP-40 (рис. 2A) и Тритон Х-100 (рис. 2В) лизировали инфицированные клетки THP1, однако, оно также повлияло на жизнеспособность иПреобразование спас amastigotes. Лечение с помощью Tween 20 (рис. 2C) и Tween 80 (рис. 2D) не вызывает оптимального лизиса THP1 клеток, полученных в неполной спасения amastigotes как указано небольшое число преобразовано promastigotes. Лечение с 0,05% SDS в течение 30 сек (рис. 2E) дало почти полное лизис Leishmania-инфицированных THP1 клеток и не влиял на жизнеспособность и преобразования amastigotes спасены. Дальнейшая оптимизация показали, что обработка клеток с 0,05% SDS в течение 20-30 сек дали высокие спасение жизнеспособных amastigotes Leishmania (рис. 2F). В последующих экспериментах, лечение с 0,05% SDS в течение 30 секунд была использована. Процедура лечения SDS является одинаковым для одной или несколькими плитами. В нескольких пластин, SDS лечения была реализована по столбцам с многоканальной пипетки. Бессывороточной среды был смещен со всех 8 скважин, из одного столбца пластины и 20-му, Л 0,05% SDS был добавлен в 8 скважинах той же колонке и разбавляют через 30 сек с RPMI-1640 с добавлением 10% FBS. Во время начальной стандартизация анализа, пластины были проверены под микроскопом для не-внутреннее promastigotes. Не менее пяти стирок были необходимы для удаления паразитов до шага 5 лечению инфицированных клеток макрофагов со стандартными соединениями и трех стирок было необходимо перед пунктом 7 лечения SDS. Таким образом, клетки промывали 8 раз и не видно, не внутреннее promastigotes осталось до контроля лизис инфицированных клеток THP1.
Цифрового анализа изображений и прямым подсчетом
Цифровые изображения Leishmania-инфицированных THP1 клетки были захвачены на Nikon Eclipse 90i флуоресцентного микроскопа после окрашивания SYBR Green I. Оба ядер макрофагов и внутриклеточный ядер Leishmania с характерным ДНК kinetoplast наблюдались при освещении лампами дневного фильтра (рис. 3). Кроме того, изображения THP1 инфицированных клеток также захватили в ОПК. Когда оба изображения были объединены, контуры THP1 клеток с внутриклеточными amastigotes было видно более четко (рис. 4). Программное обеспечение ImageJ была использована для анализа этих изображений. ImageJ является общественным достоянием, Java-основе, программа для обработки изображений разработанный в Национальном институте здоровья ( http://rsb.info.nih.gov/ij/download.html ). ImageJ была разработана с открытой архитектурой, которая обеспечивает расширяемость с помощью плагинов Java и запись макросов. Пользовательские сбора, анализа и обработки плагины могут быть разработаны с использованием встроенного редактора ImageJ и компилятора Java. Для дифференциального подсчета THP1 клеток ядер и паразитов ядер ImageJ, образ был открыт в ImageJ. Сотовые счетчик был найден в Анализировать вариант в плагине программного обеспечения. Образ был инициализирован и клеточных счетчиков типа 1 был выбран для THP1 сядрами локоть и клеточных типа счетчика 2 был выбран для паразита ядер (рис. 3). Дифференциальный подсчет был сделан, по крайней мере, 200 THP1 ядрах клеток и внутриклеточных amastigotes присутствует в этих THP1 клеточных ядер. Сравнение паразита-спасательных анализа и метод анализа изображений было сделано для оценки инфекционность THP1 клеток с разными макрофагов. Promastigotes отношения (Рисунок 4) Рисунок 5 представляет собой дифференциальный инфекционность в THP1 клеток при различных макрофагов: промастиготы отношения. Оба метода показали сопоставимые результаты и макрофагов: промастиготы соотношении 1:10 дали оптимальную и воспроизводимые инфекционности.
После того, условия для анализа parasite-rescue/transformation и цифрового анализа изображений были оптимизированы, полезность этих анализов была оценена по борьбе с наркотиками leishmanial скрининга. Leishmania-инфицированных THP1 клетки обрабатывали различными концентрациями стандартныхNTI-leishmanial наркотики именно амфотерицин B, Пентамидин и милтефозина для разных интервалов времени в диапазоне от 24 до 96 часов. Эксперимент для паразита спас / трансформации анализ был сделан в трех экземплярах и эксперимент по прямой метод подсчета клеток была сделана в двух экземплярах. 6 показана микроскопических изображений контроля неинфицированных, контроль инфицированных необработанных и Leishmania-инфицированных, лечение THP1 клеток. Кривые доза-ответ были получены из паразитов-спасательных и преобразование анализа (концентрация препарата против паразитов преобразован) и анализа анализа изображения (количество amastigotes/100 THP1 клетки) (рис. 7-9). IC 50 препаратов были вычислены ExcelFit и представлены в таблице 1. Digital-анализа изображений-Директ-Счетчик анализа и паразитов-Rescue-Преобразование-анализа показали сопоставимые результаты. Digital-анализа изображений-Директ-Счетчик анализа была менее оптимальным в первые моменты времени 24 и 48 ч т наркотиковreatments, в то время как паразитов-Rescue-Преобразование-анализа показали результаты более соответствует сообщил значения во всех точках времени, в течение 24-96 ч после медикаментозного лечения. Эта разница в результатах с Digital-анализа изображений-Директ-Счетчик анализа и паразитов-Rescue-Преобразование-анализа может быть связано с наличием нежизнеспособных amastigotes во время раннего периода лечения наркомании в Digital-анализа изображений-Директ-счетной -анализа.

Рисунок 1. Микроскопического зрения Leishmania donovani amastigotes спасению и преобразованию в promastigotes. - Приверженец THP1 клеток, инфицированных Leishmania amastigotes, B - Приверженец, инфицированные клетки THP1 после контролируемой лизиса C - Трансформированные Leishmania donovani promastigotes от amastigotes спас от инфицированной THP1 макрофагов D - Рост и распространение переходовsformed Leishmania donovani promastigotes.
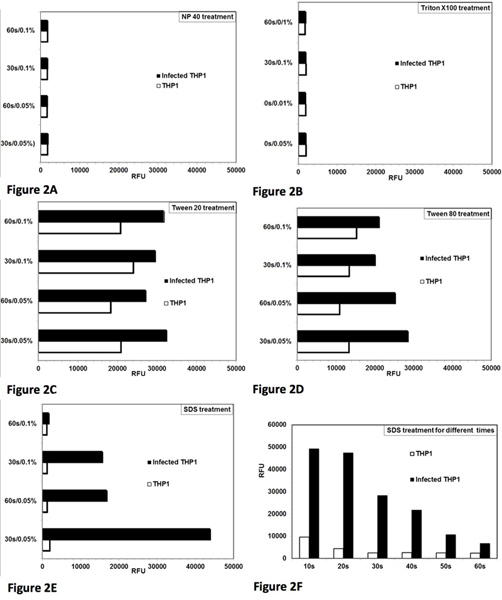
Рисунок 2. Оптимизация контролируемых лизис инфицированных клеток THP1 для достижения максимальной спасения живых Leishmania amastigotes donovani и превращение их в promastigotes. Анализ лизис клеток THP1 и спасения amastigotes от Leishmania-инфицированных THP1 клеток с различными моющими средствами. Два концентраций (0,05% и 0,1%), моющих средств и двумя периодами времени (30 сек и 60 сек) для лечения были протестированы. РФС = относительных единицах флуоресценции. Каждая панель представляет собой среднее дубликатов наблюдений. [A] NP-40 лечения вызвали лизис THP1 клеток, а также повлияло на жизнеспособность спасенных паразитов амастигота. [B] Triton X-100 treatmeNT вызвали лизис THP1 клеток, а также повлияло на жизнеспособность спасенных паразитов амастигота [C] Tween 80 вызвали частичный лизис клеток THP1, чтобы спасти amastigotes. [D] Tween 80 вызвали частичный лизис клеток THP1, чтобы спасти amastigotes. [E ] SDS лечения вызвана почти полным лизисом THP1 клеток и не влиял на жизнеспособность спас amastigotes на 0,05% / 30 сек. [F] Лечение с 0,05% SDS в течение 20-30 сек вызвано почти полным лизисом THP1 клеток и спас жизнеспособного паразита amastigotes превратить в promastigotes. Нажмите, чтобы увеличить показатель .

Рисунок 3. Флуоресцентные цифровое изображение дифференцированные клетки THP1 инфицированных в пробирке с Leishmanidonovani amastigotes. Характерной kDNA также можно увидеть с каждого ядра паразита. Ядро макрофагов (мН) (1) и паразит ядер (пН) (2) может быть дифференциально отмечены и дифференцированно подсчитываются ImageJ анализ программного обеспечения для количественной оценки инфекции. Количественное было сделано как число amastigotes/100 THP1 клеток.
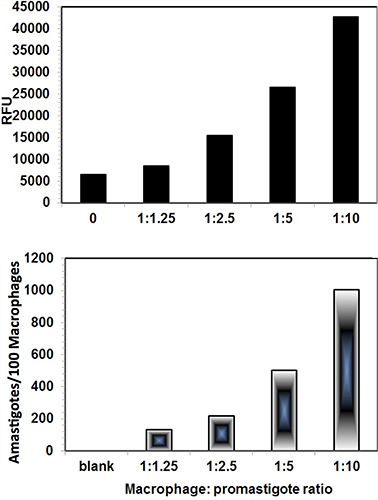
Рисунок 4. Сравнение цифрового анализа изображений-Директ-Счетчик анализа (нижняя панель) и паразитов-Rescue-Преобразование-анализа (верхняя панель). Макрофагов: промастиготы соотношении 1:10 дали оптимальную инфекции. Как показали сопоставимые результаты. Паразит-спасательных анализ показал некоторые фоновые значения. Каждая полоска показывает среднее повторяющиеся значения.

Рисунок 5 THP1 клеток, инфицированных promastigotes Leishmania различных THP1. Промастиготы отношение. Количественные результаты, как число amastigotes/100 THP1 клетки представлены на рисунке 4.

Рисунок 6. Цифровое изображение (флуоресцентный + DIC) из THP1 клеток, инфицированных Leishmania donovani amastigotes после лечения с помощью стандартного анти-leishmanial препаратов для различных периодов времени. Результаты были количественно, как число amastigotes/100 THP1 клеток и используется для вычисления процентов роста по сравнению с необработанным контролем и определения IC 50 значений.

Рисунок 7. Сравнение цифрового анализа изображений-Директ-Счетчик анализа и паразитов-Rescue-Преобразование-анализа на анти-leishmanial скрининга лекарственных средств (Amophotericin B). Инфицированных макрофагов обрабатывают различными концентрациями стандартный анти-leishmanial препарата для разных периодов. IC 50 (мкг / мл) значения были вычислены по кривой доза-ответ по Excelfit. Нажмите, чтобы увеличить показатель .
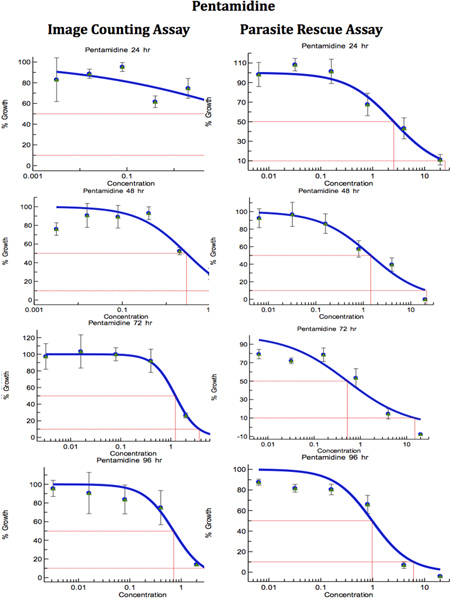
Рисунок 8. Сравнение цифрового анализа изображений-Директ-Счетчик анализа и паразитов-Rescue-Преобразование-анализа дляNTI-leishmanial скрининга лекарственных средств (Пентамидин). Инфицированных макрофагов обрабатывают различными концентрациями стандартный анти-leishmanial препарата для разных периодов. IC 50 (мкг / мл) значения были вычислены из кривых доза-реакция на Excelfit. Нажмите, чтобы увеличить показатель .
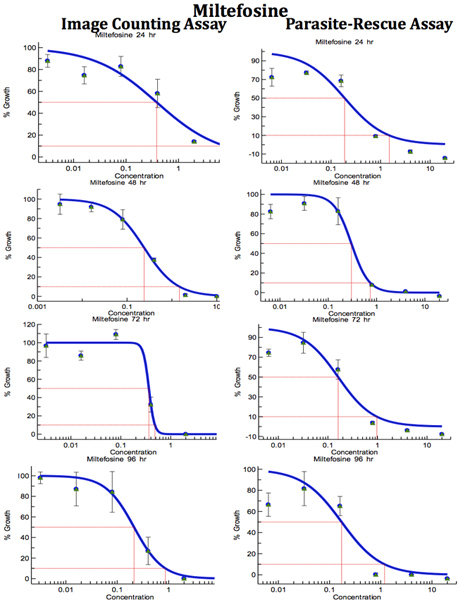
Рисунок 9. Сравнение цифрового анализа изображений-Директ-Счетчик анализа и паразитов-Rescue-Преобразование-анализа на анти-leishmanial скрининга лекарственных средств (Mitefosine). Инфицированных макрофагов обрабатывают различными концентрациями стандартный анти-leishmanial препарата для различных периодов времени. IC 50 (мкг / мл) значения были вычислены из кривых доза-реакция на Excelfit.Нажмите, чтобы увеличить показатель .
| Тест на наркотики | 24 часа в сутки | 48 часов | 72 часа | 96 часов | ||||
| IACA б | PRTA с | IACA б | PRTA с | IACA б | PRTA с | IACA б | PRTA с | |
| Амфотерицин | 0,24 ± 0,03 | 0,17 ± 0,01 * | 0,12 ± 0,04 | 0,20 ± 0,07 | 0,06 ± 0,01 | 0,06 ± 0,01 | 0,11 ± 0,03 | 0,10 ± 0,03 |
| Пентамидин | > 10 | 2,55 ± 1,16 * | 2,88 и плusmn; 0,58 | 1,43 ± 0,91 | 1,24 ± 0,35 | 1,52 ± 0,16 | 0,71 ± 0,63 | 0,98 ± 0,33 |
| Милтефозина | 0,38 ± 0,02 | 0,19 ± 0,08 * | 0,24 ± 0,06 | 0,30 ± 0,08 | 0,36 ± 0,02 | 0,16 ± 0,06 | 0,21 ± 0,15 | 0,17 ± 0,10 |
Таблица 1. Сравнение цифрового анализа изображений-Директ-Счетчик анализа и паразитов-Rescue-Преобразование-анализа на анти-leishmanial наркотиков отбора. Инфицированных макрофагов обрабатывают различными концентрациями стандартный анти-leishmanial препарата для разных периодов. IC 50 (мкг / мл) значения были вычислены из кривых доза-реакция на Excelfit (рис. 7-9) препарат часов после лечения;. IACA б = анализа изображений и прямым подсчетомАнализ, с PRTA = паразитов-спасательных и трансформация анализа. Значения приведены IC 50 (концентрация препарата, вызывающая 50% ингибирование роста паразита) в мкг / мл и среднее значение ± SD, по крайней мере, три эксперимента. * Статистически разные (<0,05) по сравнению с IC 50 значений с IACA.
Обсуждение
Есть несколько методов, доступных для анти-leishmanial скрининга препаратов на основе макрофагов амастигота моделей. Анализы можно сделать с макрофагами, полученная от животных-хозяев именно перитонеального экссудата клетках (PEC), моноцитов периферической крови клеток (МПК) 6 или костного мозга макрофаги (БММ) или в моноцитарного клеточных линий, таких как мышь (J774 и RAW264.7 ) 7 и человека (THP1, U937, HL-60) 8 моноцитов клеток. Анализы, которые используют деление клеток-хозяев, должны гарантировать, что смешанное воздействие препарата деятельности на обоих паразитов и количество клеток-хозяев считаются. Дифференцированной первичной макрофаги, собранных из различных источников, таких как мыши и крысы не являются деления в природе, но эти клеточные препараты могут не иметь однородную клеточных популяций. Моноцитарного клеток-производных клеточных линий являются однородными по своему характеру и лучшие модели для макрофагов амастигота скрининг. Из различных клеточных линиях моноцитов, Diffrentiated THP1 клеток (моноцитов человека острую линию клеток лейкемии) могут образовываться без деления монослоя и предлагают привлекательную альтернативу первичной изолированной макрофагов.
Макрофагов амастигота скрининг можно сделать несколькими способами. Классическая микроскопической оценки основаны на прямом клеток и паразитов подсчета 9 является трудоемким. Отсутствие автоматизации ограничивает полезность этого анализа. Подсчет клеток занимает много времени и может дать неточные определения IC 50 значений, так как определение жизнеспособности паразитов через процедуру окрашивания трудно. Многие флуоресцентных красителей и моноклональные антитела могут быть использованы для проточной цитометрии анализа 10, 11, но эти анализы также ограничены из-за меньшей чувствительности и ограничение интервал времени с наркотиками лечение только один день. Есть несколько ген-репортер анализов доступны для количественного роста внутриклеточных amastigotes 12,13,14. Автоматред скрининга возможно с помощью репортер гены, но эти методы также имеют определенные недостатки. Во-первых, большинство из этих анализов требует выбор препарата для поддержания эписомные выражение репортер генов, которые не могут быть идеально подходит для экспериментов скрининг наркотиков. Путь, по которому репортер ген вводят также может влиять на физиологические свойства паразита и оказывать влияние на обследование. Если репортер ген является частью эписомные плазмиды, относительно выхода репортер может зависеть от числа копий плазмиды трансфицированных (которая варьирует от клетки к клетке), а не на активность препарата 14. Некоторые репортер паразитов, которые трансформируются паразиты не нужно селективного давления для поддержания ген-репортер, однако, не может быть биологические последствия либо, нарушая геномной архитектуры или просто присутствие чужеродных белков Репортер 15. В некоторых ген-репортер на основе анализов, естьвопросы чувствительности и фоновой активности 16. Самое главное, многие из корреспонденту экспрессии генов анализов, особенно один с GFP репортер gene15, не могут различать живые и мертвые внутриклеточных amastigotes. Анализы на основе гена люциферазы репортера и различать живые и мертвые внутриклеточных amastigotes, но подложкой и буфером для лизиса клеток для этих анализов дороги для крупномасштабного скрининга 17. Чтобы преодолеть эти недостатки и ограничения предыдущих макрофагов амастигота на основе скрининга, мы разработали и оптимизировать этот паразит-спасательных и преобразование анализа. Этот анализ основан на THP1 клетки, которые имеют хорошую однородность и без деления в природе, как клетки-хозяина.
Паразит-Rescue-Преобразование-анализа анализа, описанного здесь сравнимы с анализом на основе цифрового анализа изображений-Директ-счетной внутриклеточных amastigotes. Флуоресцентные и DIC микроскопии, цифровых мнимойэлектронной анализов ImageJ для дифференциального подсчета ядер макрофагов и ядер паразитов были доработаны микроскопический анализ счета. Захват изображений с люминесцентным светофильтров и дифференциального интерференционного контраста (DIC) фильтры улучшить качество цифрового изображения для более точного подсчета внутриклеточные паразиты. Оба люминесцентных и DIC изображения могут быть объединены для получения цифровых изображений с четкими контурами макрофагов клетки и внутриклеточные флуоресцентные ядер. Ядрах макрофагов и ядер паразит может быть дифференциально признаны ImageJ. Таким образом, оба Digital-анализа изображений-Директ-Счетчик анализа и паразитов-Rescue-Преобразование-анализа имеют потенциал для автоматизации и применения к крупномасштабной проверки. Важные шаги в паразита-Rescue-преобразования-анализа являются: (а) многократных стирок из THP1 клеточных культур после воздействия Leishmania promastigotes, чтобы обеспечить практически полное удаление не-стажеробобщенные promastigotes и (б) контролируемое лизис инфицированных клеток с THP1 SDS. Обе меры могут также управляться с помощью автоматизации и не должны идти на компромисс с пропускной способностью анализа. Второй этап стирок, после воздействия на Leishmania инфицированных клеток THP1 на тест наркотиков / соединения удаляются оставшиеся без внутреннюю паразитов, если таковые имеются. Паразит-Rescue-Преобразование-анализа дает значительные преимущества по сравнению с существующими микроскопические, ген-репортер и анализы анализа изображений. Анализ простой, надежной и воспроизводимой, может быть автоматизирован для крупномасштабного скрининга и, следовательно, должны иметь важные приложения в скрининг больших библиотек соединений для новых анти-leishmanial лекарственных препаратов. Кроме того, анализ может быть применен и для оценки инфекционной клинической, а также, лабораторных штаммов Leishmania в пробирке.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
NCNPR-USDA-ARS Научно соглашение № 58-6408-2-0009; CDMRP гранта # W81XWH-09-2-0093 американских военно-медицинского исследования и материально-команд.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
| Форболового 12-миристат 13-ацетат (PMA) | Sigma-Aldrich США | P1585 | Требуется для дифференциации THP1 клеток. |
| RPMI-1640, | Invitrogen | 23400021 | |
| Lab-Tek палаты Презентация системы (16 палата) | Thermo Scientific Nunc | 178599 | |
| Ясно, с плоским дном, 96-луночные | BD Falcon | 353075 | Плиты для выполнения 96-луночный планшет анализа |
| Амфотерицин | Sigma-Aldrich США | A4888 | Стандартные анти-leishmanial препарат растворяют в ДМСО (2 мг / мл) |
| Пентамидин изотионат Saл | Sigma-Aldrich США | P 0547 | Стандартные анти-leishmanial препарат растворяют в ДМСО (2 мг / мл) |
| Милтефозина | EMD Biosciences США | 475841 | Стандартные анти-leishmanial препарат растворяют в бессывороточной RPMI-1640 среде (готовить свежий) (2 мг / мл) |
| Натрий Stibogluconate | EMD Biosciences США | 567565 | Стандартный борьбе с наркотиками leishmanial подготовить в RPMI-1640 с 4% FBS. (1 мг / мл) |
| Сульфат натрия додецилсульфата | Sigma-Aldrich США | L 5750 | |
| Флуоресцентного микроскопа | NIKON | ECLIPSE 90i | |
| Флуоресценция Считыватель микропланшетов | BMG | Polar Star Galaxy | |
| Монтаж Средний | Sigma-Aldrich США | M 1289 | |
| lamarBlue | Абд Serotec | BUF012 B | |
| SYBR Green I | Sigma-Aldrich США | S 9430 | |
| Бикарбонат натрия | Fisher Sci. | 523500 | |
| Пируват натрия | Sigma-Aldrich США | P2256 | |
| 2-меркаптоэтанол | Sigma-Aldrich США | M6250 | |
| Плод бычьего сывороточного | Атланта биологические | S11050H | |
| Tween 20 | Sigma-Aldrich США | P9416 | |
| Tween 80 | Sigma-Aldrich США | P6474 | |
| Triton X-100 | Sigma-Aldrich США | T8787 | |
| NP-40 | Calbiochem | 492016 |
Ссылки
- WHO. . Control of the leishmaniasis: report of a meeting of the WHO Expert Committee on the Control of Leishmaniasis. Xii, 22-26 (2010).
- Croft, S. L., Seifert, K., Yardley, V. Current scenario of drug development for leishmaniasis. Indian J. Med. Res. 123 (3), 399-410 (2006).
- Croft, S. L., Sundar, S., Fairlamb, A. H. Drug Resistance in Leishmaniasis. Clinical Microbiology reviews. 19 (1), 111-126 (2006).
- Mikus, J., Steverding, D. A simple colorimetric method to screen drug cytotoxicity against Leishmania using the dye AlamarBlue. Parasitology International. 48 (3), 265-269 (2000).
- Callahan, H. L., Portal, A. C., Devereaux, R., Grogl, M. An Axenic Amastigote System for Drug Screening. Antimicrob. Agents Chemother. 41 (4), 818-822 (1997).
- Seifert, K., Escobar, P., Croft, S. L. In vitro activity of anti-leishmanial drugs against Leishmania donovani is host cell dependent. J. Antimicrob. Chemother. 65 (3), 508-511 (2010).
- Kolodziej, H., Kiderlen, A. F. Antileishmanial activity and immune modulatory effects of tannins and related compounds on Leishmania parasitized RAW 264.7 cells. Phytochemistry. 66 (17), 2056-2071 (2005).
- Maia, C., et al. Infectivity of five different types of macrophages by Leishmania infantum. Acta Tropica. 103 (2), 150-155 (2007).
- Neal, R. A., Croft, S. L. An in vitro system for determining the activity of compounds against the intracellular amastigote form of Leishmania donovani. J. Antimicrob. Chemother. 14, 463-475 (1984).
- Abdullah, S. M., Flath, B., Presber, H. W. Comparison of different staining procedures for the flow cytometric analysis of U-937 cells infected with different Leishmania-species. J. Microbiol Methods. 37 (2), 123-138 (1999).
- Giorgio, C. D., et al. Flow Cytometric Detection of Leishmania Parasites in Human Monocyte-Derived Macrophages: Application to Antileishmanial-Drug Testing. Antimicrob Agents Chemother. 44 (11), 3074-3078 (2000).
- Mandal, S., et al. High throughput screening of Leishmania donovani clinical isolates against drug using a colorimetric β Lactamase assay. Indian J. Exp. Biol. 47 (6), 475-479 (2009).
- Chan, M. M. Y., Bulinski, J. C., Chang, K. P., Fong, D. A. Microplate assay for Leishmania amazonensis promastigotes expressing multimeric green fluorescent protein. Parasitol. Res. 89 (4), 266-271 (2003).
- Buckner, F. S., Wilson, A. J. Colorimetric assay for screening compounds against Leishmania Amastigote Grown in macrophages. Am. J. Trop. Med. 72 (5), 600-605 (2005).
- Sereno, D., et al. Advances and perspectives in Leishmania cell based drug-screening procedures. Parasitol. Int. 56 (1), 3-7 (2007).
- Gupta, S., Nishi, Visceral leishmaniasis: experimental models for drug discovery. Indian J. Med. Res. 133, 27-39 (2011).
- Roy, G., et al. Episomal and stable expression of the luciferase reporter gene for quantifying Leishmania spp. Infections in macrophages and in animal models. Mol. Biochem. Parasitol. 110 (2), 195-206 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены