Method Article
Un test Parasite sauvetage et à la transformation pour le dépistage anti-leishmaniose contre intracellulaire
Dans cet article
Résumé
Un test parasite de sauvetage et de la transformation des cellules infectées THP1 In vitro Avec Leishmania donovani A été optimisé pour le criblage de médicaments anti-leishmania. L'essai implique la différenciation des cellules THP1, l'infection par promastigotes, le traitement par médicaments à l'essai, la lyse contrôlée des macrophages infectés, le sauvetage des amastigotes, la transformation et la croissance des promastigotes de promastigotes de surveillance et la prolifération d'un dosage fluorimétrique.
Résumé
La leishmaniose est l'une des maladies les plus négligées dans le monde, en grande partie touchant les plus pauvres d'entre les pauvres, surtout dans les pays en développement. Plus de 350 millions de personnes sont considérées à risque de contracter la leishmaniose, et environ 2 millions de nouveaux cas se produisent chaque année 1. Leishmania donovani est l'agent causal de la leishmaniose viscérale (LV), la forme la plus mortelle de la maladie. Le choix des médicaments disponibles pour traiter la leishmaniose est limitée 2; traitements actuels fournissent une efficacité limitée et beaucoup sont toxiques à des doses thérapeutiques. En outre, la plupart des médicaments de première ligne de traitement ont déjà perdu leur utilité en raison de la résistance croissante de drogues multiples 3. Le portefeuille actuel de médicaments anti-leishmania est aussi gravement appauvri. Des efforts soutenus sont nécessaires pour enrichir un nouvel anti-leishmaniose pipeline de découverte de médicaments, et cet effort repose sur la disponibilité des modèles adaptés au dépistage in vitro.
En promastigotes in vitro 4 et axéniques essais amastigotes 5 sont principalement utilisés pour le criblage de médicaments anti-leishmaniose peut toutefois ne pas être approprié en raison d'importantes différences physiologiques cellulaires, biochimiques et moléculaires par rapport à amastigotes intracellulaires. Essais avec des macrophages-amastigotes modèles sont considérés comme les plus proches des conditions physiopathologiques de la leishmaniose, et sont donc le plus approprié pour le criblage in vitro. Différenciées ne se divisant aiguës chez l'homme des cellules THP1 (leucémie monocytaire) (crée un attractif) alternative à macrophages primaires isolées et peuvent être utilisées pour doser l'activité anti-leishmanienne de différents composés contre amastigotes intracellulaires.
Ici, nous présentons une analyse parasite de sauvetage et de transformation avec THP1 différenciées des cellules infectées in vitro avec Leishmania donovani pour le criblage de composés purs et produits naturelsduits extraits et détermination de l'efficacité contre les amastigotes intracellulaires. Le dosage comprend les étapes suivantes: (1) la différenciation de cellules THP1 à la non-séparation des macrophages, (2) l'infection des macrophages par L. donovani promastigotes métacycliques, (3) le traitement des cellules infectées avec des médicaments d'essai, (4) la lyse contrôlée de macrophages infectés, (5) la libération / sauvetage d'amastigotes et (6) la transformation d'amastigotes vivants vers promastigotes. Le test a été optimisée à l'aide de détergent pour le traitement de lyse contrôlée infectés par Leishmania cellules THP1 pour atteindre presque totale de sauvetage amastigotes intracellulaires viables avec un effet minimal sur leur capacité à se transformer en promastigotes. Macrophages différente: les ratios de promastigotes ont été testés pour infecter maximum. La quantification de l'infection a été réalisée grâce à la transformation de vivre, sauvé Leishmania promastigotes amastigotes de l'évaluation et de leur croissance par un alamarBlue essai fluorimétrique en microplaques de 96 puits. Ce test est comparable à l'heure actuelle, utiliser microscopique, gène rapporteur transgénique et l'image numérique-tests d'analyse. Ce test est robuste et ne mesure que les amastigotes intracellulaires vivants par rapport à gène rapporteur et tests d'analyse d'images, qui ne peut différencier les amastigotes vivants et morts. En outre, le test a été validé avec un panneau courant de l'anti-leishmania médicaments et a été appliquée avec succès à grande échelle criblage de composés purs et une bibliothèque de fractions de produits naturels (Tekwani et al. Non publié).
Protocole
1. Maintenir et Subculture THP1 culture cellulaire
- Maintenir cellules THP1 en milieu RPMI-1640 (avec 10% de FBS et pH 7,4) à 37 ° C dans un 5% de CO 2 incubateur.
- Subculture cellules deux fois par semaine pour éviter de dépasser le nombre de cellules 1x10 6 cellules / ml. Il est important de maintenir leur capacité de transformation.
2. Maintenir et Subculture Leishmania donovani promastigotes Culture
- Maintenir le L. donovani promastigotes (S1, souche Soudan) en milieu RPMI-1640 (sans bicarbonate de sodium et de pyruvate de sodium) avec 10% de FBS à 26 ° C.
- Subculture L. donovani promastigotes deux fois par semaine, avec la plus forte concentration des cellules dans la plage de 20-25x10 6 promastigotes / ml.Caution: Tous les milieux et solutions doivent être portées à la température ambiante avant utilisation.
3. L'ensemencement et la différenciation des cellules THP1 dans un 96-bien microplaques et 16-chambre de diapositives Culture verre.
- Préparer une dilution THP1 culture avec le nombre de cellules de 2,5.10 5 cellules / ml d'une culture de cellules de quatre jours âgé (nombre de cellules ne doit pas dépasser 10 6 cellules / ml) dans du milieu RPMI-1640 avec 10% de FBS inactivé à la chaleur. Préparé 20 ml de culture pour chaque plaque de 96 puits et 4 ml de culture pour chaque diapositive chambre de 16 puits.
- Ajouter phorbol 12-myristate 13-acétate (PMA) (pour la différenciation des THP1) à la suspension de culture cellulaire diluée (10 ml μl/20 la culture de la souche de 50 pg / ml dans le DMSO) (concentration finale PMA dans la culture des cellules dilué doit être 25 ng / ml).
- Pour comparer le Digital-Image-Analyse-Direct-comptage-test et Parasite-sauvetage-Transformation-test, mettre en place les tests simultanément en clair, à fond plat, plaque de 96 puits et 16-chambre, verre, support de culture microscopique.
- Distribuer 200 ul de cellules THP1-PMA-traités à chaque puits ou de la chambre.
- Incuber la p de 96 puitslates et des diapositives de chambre de 16 puits dans un 37 ° C, 5% de CO 2 incubateur nuit pour permettre une différenciation presque complète des cellules.
Remarque: Les cellules THP1, qui poussent normalement en suspension, se différencient en macrophages adhérents.
4. L'infection des cellules THP1 transformées avec Leishmania donovani promastigotes
- En cas d'infection de la culture cellulaire différencié THP1 par Leishmania donovani promastigotes, la majorité des parasites doivent être au stade métacyclique infectieux (longues formes cylindriques, ~ 5-6 jours vieille culture).
- A 01h10 THP1 cellule ratio parasite est optimale pour l'infection à la fois dans le Digital-image-Analyse-Direct-comptage-test et le Promastigote-sauvetage-Transformation-test.
- Préparer une culture diluée de L. donovani promastigotes avec un nombre de parasites de 2,5.10 6 parasites / ml (pour les cellules THP1: rapport de parasites = 1:10) à partir deune culture de 5 à 6 jours, âgé de milieu RPMI-1640 avec 2% de FBS.
- De l'étape 3.5 (après différenciation nuit de culture de cellules THP1) sortir les plaques et les diapositives de chambre, retirez le support et laver les cultures de cellules une fois avec du RPMI sans sérum-1640.
- Après un lavage soigneux des PMA un traitement avec des cellules THP1 sans sérum, chaud RPMI-1640 (~ 37 ° C) moyenne, remplacer le milieu sans sérum avec 200 ul de la culture diluée de L. promastigotes donovani (2,5.10 6 parasites / ml) à partir de l'étape 4.3. Mettre en place les puits de contrôle de cellules THP1 sans le parasite et les parasites sans cellules THP1 dans chaque plaque et les diapositives de chambre de 16 puits.
- Après l'ajout de parasite à la culture de cellules THP1, incuber la plaque et lames à 37 ° C, 5% de CO 2 pendant 24 heures pour permettre aux parasites d'infecter les cellules THP1 différenciées.
5. Traitement des macrophages infectés avec des médicaments d'essai / composés
- TestL'amphotéricine B, pentamidine et miltéfosine comme standard anti-leishmania médicaments pour le dépistage. Préparer les solutions mères des composés à tester des médicaments / de l'eau ou du DMSO comme indiqué dans le tableau réactif. Testez chaque composé médicamenteux à 6 concentrations.
- Diluer en série (1:5) les médicaments classiques et les composés d'essai dans une nouvelle plaque de 96 puits ou tubes de 2 ml (pour les diapositives de chambre) avec du RPMI-1640 avec 2% de FBS. Les médicaments / concentrations composé d'essai dans cette plaque sont 2X des concentrations finales.
- Laver les plaques de culture et de diapositives de chambre infectés par L. promastigotes donovani (à partir de l'étape 4.5) au moins 5 fois avec de sérum, de milieu RPMI-1640. Ajouter 100 ul milieu de culture (RPMI-1640 avec 2% de FBS) dans chaque puits / chambre. Les multiples lavages sont nécessaires pour assurer l'élimination complète de non internalisés promastigotes.
- Ajouter 100 ul de milieu de série-étalons diluées anti-leishmania médicaments ou les composés à tester à chaque puits ou de la chambre. Mettre en place l'infectionted cellules THP1 contrôle sans médicaments simultanément dans chaque diapositive plaque / chambre.
- Incuber les plaques et les diapositives de la chambre à 37 ° C, 5% de CO 2 pendant 48 heures.
6. Coloration de lames Chambre, imagerie microscope à fluorescence et analyse d'images pour la quantification des maladies infectieuses et Effet de traitement de la toxicomanie
- Après une incubation de 48 heures, laver la chambre de coulissement 3 fois avec du RPMI sans sérum-1640. Décollez les chambres en plastique des diapositives et fixer les cellules par immersion des lames dans du méthanol pendant 30 sec. Laisser les lames dans la bio-hotte sous flux d'air pour le séchage.
- Préparer une solution de coloration SYBR Green I (5X) en diluant (1:2000) le stock (10.000 X) avec de l'eau.
- Colorer les lames dans des conditions sombres avec le SYBR Green I dilué tache solution pendant 15 min à température ambiante, laver une fois avec de l'eau et de laisser les diapositives dans le flux d'air pour le séchage.
- Placez une lamelle de verre sur le stainie diapositive à l'aide d'un milieu de montage.
- Capturez des images numériques des cellules THP1: sans infection (blanc), à l'infection (contrôle), les cellules infectées traitées avec différents médicaments classiques ou composés d'essai à des dilutions différentes (Figure 3, 5 et 6)) à l'aide d'un Nikon Eclipse 90i microscope à fluorescence accompagnée par l'élément logiciel NIS AR 3.2.
- Comptez le noyau des macrophages (gros) et les noyaux du parasite (petit kinétoplaste) en utilisant ImageJ (figure 7), qui est une disposition publiquement-, basée sur Java programme de traitement de l'image développée à l'Institut National de la Santé ( http://rsb. info.nih.gov / ij / download.html ). Exprimer les données comme le nombre d'amastigotes transformé par 100 cellules THP1.
7. Le Parasite-sauvetage-Transformation-test: la lyse contrôlée de L. donovani amastigotes macrophages infectés
- Laver la microplaque de 96 puits d'étape 5.5 trois fois avec du milieu sans sérum culture RPMI-1640.
- Parmi les différents détergents testés à différentes concentrations, 0,05% SDS traitement pendant 30 secondes est optimal pour la lyse contrôlée (lyse cellulaire maximale avec un minimum de perte de la viabilité des parasites sauvés »).
- Retirez le milieu sans sérum dans chaque puits après le dernier lavage et ajouter 20 ul de RPMI-1640 (avec 0,05% de SDS) à chaque puits. Agiter la plaque pendant 30 secondes et ajouter 180 ul complet RPMI-1640 (avec 10% de FBS) à chaque puits.
- Incuber les plaques à 26 ° C pendant 48 h pour la transformation des amastigotes sauvés à promastigotes.
8. Analyse quantitative des Promastigote Transformé (alamarBlue dosage)
- Après une incubation de 48 heures à 26 ° C, tous les amastigotes rescapés vivants se transforment en promastigotes (figure 1D). Ajouter 10 ul de alamarBlue dans chaque puits de la p 96 etlates.
- Incuber les plaques à 26 ° C pendant la nuit.
- Après une nuit d'incubation, lire les plaques de fluorescence standard sur un fluorimètre Fluostar Galaxy (BMG Lab Technologies) d'excitation à 544 nm, émission 590 nm.
- Préparer les courbes dose-réponse (pour cent de croissance par rapport à la concentration du composé médicamenteux ou de test) avec ExcelFit (figures 7-9) et calculer IC 50 / IC 90 valeurs de ces courbes (tableau 1).
9. Normalisation des cellules THP1 Ratio parasites
- Standardiser les cellules THP1 ratio de parasites afin de déterminer la sensibilité du dosage. Remarque: l'infection basse / haute nombres parasites / risque de compromettre la sensibilité et la sélectivité de l'examen.
- Standardiser les cellules THP1 à taux de parasites en suivant le protocole décrit ci-dessus pour l'ensemencement des cellules THP1 et Leishmania promastigotes infection (article 3 & 4), sauf utilisation diffles ratios des cellules THP1 érentes aux parasites que 1:1.25, 1:2.5, 1:5 et 1:10.
- Mettre en place l'expérience à la fois en mode 16-chambre de coulissement (analyse d'image) et plaque de 96 puits (pour les parasites sauvetage dosage) formats à comparer la rescousse des parasites et des tests d'analyse d'images.
10. Normalisation des différents détergents pour la lyse cellulaire programmée
- L'objectif principal de cette expérience est d'optimiser le protocole de lyse contrôlée des cellules THP1 à apporter le maximum / THP1 lyse complète des cellules sans affecter significativement la viabilité des parasites amastigotes sauvés.
- Tester différents détergents tels que le Tween 20, le Tween 80, Triton X-100, NP-40 et SDS à différentes concentrations et différentes durées de traitement (figure 2).
- Cellules THP1 à taux de parasites est 1:10 et les autres conditions sont les mêmes que ci-dessus sections 1-8.
- Testez le traitement SDS à 0,05% de plus pour le temps de traitement différents d'optimiser la lyse cellulaire contrôlée.
Résultats
Une analyse quantitative a été effectuée à la fois numérique-image-Analyse-Direct-comptage-test et Parasite-sauvetage-Transformation-test de 24, 48, 72 et 96 h post-traitement de la toxicomanie
Dans la méthode directe, en comptant l'infection de L. donovani macrophages infectés (cellules THP1) a été calculée par l'équation suivante:
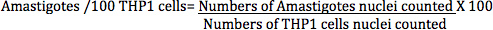
Les amastigotes (déterminé en comptant les noyaux amastigotes) / 100 transformé des cellules THP1 (déterminée par comptage comptée à noyaux de cellules THP1) (figure 7) est une mesure plus précise pour analyser l'effet des normes différentes ou des composés de test que le pourcentage des personnes infectées cellules THP1 , tel que rapporté dans certains articles précédents, car ce nombre est directement lié à l'effet d'ensemble de composés, soit par une diminutiondes parasites dans les cellules macrophages ou la suppression totale des parasites du cells.Infection macrophages a été calculée à partir des images numériques des cellules THP1 infectées traitées avec différents médicaments classiques à des dilutions différentes pour différents intervalles de temps (figure 10 et tableau 1). La lecture pour le Digital-image-Analyse-Direct-comptage-Assay a été amastigotes infection/100 transformé des cellules THP1, tandis que la lecture pour le Parasite-sauvetage-Transformation-test était unités de fluorescence relative (RFU), ce qui est directement proportionnelle au nombre de amastigotes vivants sauvés des macrophages infectés et transformer en promastigotes. Le test alamarBlue est couramment utilisée pour Leishmania promastigotes de dépistage de drogues anti-Leishmania.
Le test a d'abord été standardisé et optimisé pour la lyse contrôlée infectés par Leishmania cellules THP1. L'objectif était d'optimiser les conditions de détergent treatment, ce qui donne une lyse presque complète des cellules THP1 avec un effet minimal sur la viabilité des amastigotes sauvés. Figure 1 représente une vue microscopique du protocole de dosage complet. THP1 intactes les cellules infectées par des amastigotes de Leishmania peut être vu dans la figure 1A. Figure 1B montre la lyse des cellules THP1 après traitement avec un détergent. Figure 1C montre sauvé Leishmania amastigotes, qui ont été partiellement transformée en promastigotes et 1D figure montre la transformation presque complète des amastigotes dans promastigotes et leur prolifération ultérieure. La croissance de ces promastigotes transformées peuvent être quantitativement contrôlé avec plus de alamarBlue et la mesure de la fluorescence sur un lecteur de microplaques. Le traitement par NP-40 (figure 2A) et le Triton X-100 (figure 2B) lysé les cellules infectées par le THP1, mais il a également influencé la viabilité et latransformation des amastigotes sauvés. Le traitement avec du Tween 20 (figure 2C) et du Tween 80 (figure 2D) n'a pas causé la lyse optimale des cellules THP1 résultant en un sauvetage incomplète des amastigotes comme indiqué par un petit nombre de promastigotes transformées. Le traitement avec SDS à 0,05% pendant 30 sec (figure 2E) ont donné une lyse presque complète des infectés par Leishmania cellules THP1 et n'a pas d'incidence sur la viabilité et la transformation des amastigotes sauvés. Optimisation plus poussée a montré que le traitement des cellules avec 0,05% de SDS pendant 20-30 sec donné plus haut sauvetage des amastigotes viables (figure 2F). Dans les expériences ultérieures, le traitement avec 0,05% de SDS pendant 30 sec a été utilisé. Procédure pour le traitement de SDS est le même pour les plaques simples ou multiples. Dans plusieurs plaques, traitement au SDS a été mis colonne par colonne avec une pipette multicanaux. Milieu sans sérum a été enlevé de tous les 8 puits d'une colonne de la plaque et 20 & mu; L de SDS à 0,05% a été ajouté dans les puits 8 de la même colonne et on dilue au bout de 30 secondes avec du RPMI-1640 avec 10% de FBS. Au cours de standardisation initiale de l'essai, les plaques ont été vérifiées sous le microscope pour non internalisés promastigotes. Un minimum de cinq lavages ont été nécessaires pour l'élimination des parasites avant l'étape 5 de traitement de cellules macrophages infectés avec des composés standard et trois lavages ont été nécessaires avant l'étape 7 de traitement au SDS. Ainsi, les cellules ont été lavées 8 fois et pas visibles non internalisés promastigotes restait avant le contrôle de lyse des cellules THP1 infectés.
Analyse d'image numérique et le comptage direct
Les images numériques des infectés par Leishmania cellules THP1 ont été capturés sur Nikon Eclipse 90i microscope à fluorescence après coloration au SYBR Green I. Les deux noyaux macrophages et les noyaux Leishmania intracellulaire de l'ADN du kinétoplaste caractéristique ont été observées dans les filtres fluorescentes (Figure 3). En outre, les images de cellules infectées THP1 ont également été capturés en vertu DIC. Lorsque les deux images ont été fusionnées, les contours des cellules THP1 avec amastigotes intracellulaires ont été vus plus clairement (figure 4). Le logiciel ImageJ a été utilisé pour analyser ces images. ImageJ est un domaine public, basé sur Java, de traitement d'image programme développé à la National Institutes of Health ( http://rsb.info.nih.gov/ij/download.html ). ImageJ a été conçu avec une architecture ouverte qui permet l'extensibilité via des plugins Java et les macros enregistrables. Plugins personnalisés acquisition, l'analyse et le traitement peut être développé en utilisant ImageJ de l'éditeur intégré et un compilateur Java. Pour comptage différentiel des cellules THP1 noyaux et les noyaux du parasite par ImageJ, l'image a été ouvert en ImageJ. Compteur de cellules a été trouvée dans l'option Analyser dans le plugin du logiciel. L'image a été initialisé et le type de cellules compteur 1 a été sélectionné pour THP1 cnoyaux ell et le type de compteur de cellules 2 a été choisi pour les noyaux du parasite (figure 3). Comptage différentiel a été fait pour au moins 200 THP1 noyaux cellulaires et les amastigotes intracellulaires présents dans ces noyaux de cellules THP1. Une comparaison des parasites et de sauvetage dosage Procédé d'analyse d'image a été faite pour évaluer l'infectivité de cellules THP1 avec des macrophages différents:. Rapports promastigotes (Figure 4) Figure 5 représente l'écart-infectieux dans des cellules THP1 en macrophages différent: ratios promastigotes. Les deux méthodes ont donné des résultats comparables et les macrophages: rapport de promastigotes de 1:10 donné infectivité optimale et reproductible.
Lorsque les conditions d'essai parasite-rescue/transformation et l'analyse d'images numériques ont été optimisés, l'utilité de ces tests a été évaluée pour le criblage de médicaments anti-leishmania. Les THP1 infectés par Leishmania cellules ont été traitées avec différentes concentrations de la norme d'unnti-leishmania médicaments à savoir l'amphotéricine B, pentamidine et miltéfosine pour différents intervalles de temps allant de 24 à 96 h. L'expérience de parasite sauvé essai / transformation a été réalisée en triple exemplaire et l'expérience pour les cellules de comptage directs méthode a été fait en double exemplaire. Figure 6 montre des images microscopiques du témoin non infecté, le contrôle infectés non traités et infectés par Leishmania, traité cellules THP1. Les courbes dose-réponse ont été préparés à partir de l'analyse des parasites de sauvetage et de transformation (concentration du médicament contre les parasites transformées) et le test d'analyse d'image (nombre de cellules THP1 amastigotes/100) (figures 7-9). La CI 50 des médicaments ont été calculés par ExcelFit et sont présentés dans le tableau 1. Digital-image-Analyse-Direct-comptage-test et Parasite-sauvetage-Transformation-test a donné des résultats comparables. Digital-image-Analyse-Direct-comptage-test était moins optimal pendant les premiers points dans le temps de 24 à 48 heures de drogue treatments, tandis que le Parasite-sauvetage-Transformation-test a montré des résultats plus cohérents avec les valeurs rapportées à tous les points dans le temps au cours de l'h 24-96 après les traitements médicamenteux. Cette différence de résultats par Digital-image-Analyse-Direct-comptage-test et Parasite-sauvetage-Transformation-dosage peut être dû à la présence de non-viables amastigotes pendant les périodes de début de traitement de la toxicomanie dans Digital-Image-Analyse-Direct-comptage -Essai.

Figure 1. Vue microscopique de la Leishmania donovani amastigotes sauvetage et à la transformation de promastigotes. A - adhérentes THP1 cellules infectées par Leishmania amastigotes, B - adhérentes, les cellules infectées THP1 après lyse ménagée C - Transformée de Leishmania donovani promastigotes des amastigotes sauvés des cellules infectées macrophages THP1 D - croissance et la prolifération des transformed promastigotes de Leishmania donovani.
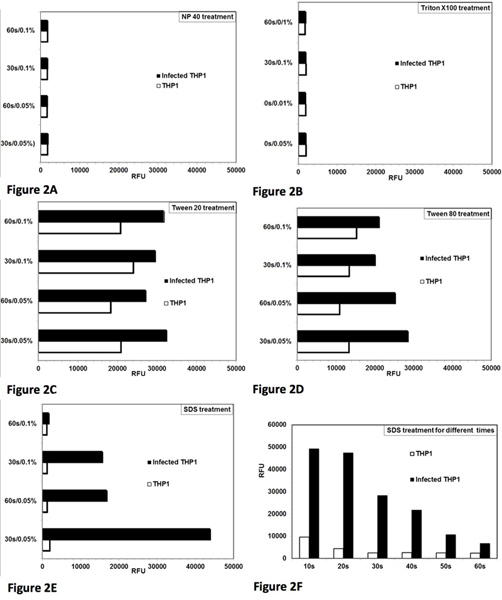
Figure 2. Optimisation de la lyse contrôlée de cellules THP1 infectés d'atteindre sauvetage maximum de amastigotes Leishmania donovani vivantes et leur transformation à promastigotes. Analyse de la lyse des cellules THP1 et de sauvetage des amastigotes de Leishmania THP1 des cellules infectées avec différents détergents. Deux concentrations (0,05% et 0,1%) de détergent et deux périodes de temps (30 sec et 60 sec) pour le traitement ont été testés. RFU = unités relatives de fluorescence. Chaque barre représente la moyenne des observations en double. [A] NP-40 traitement a provoqué la lyse des cellules THP1 et a également affecté la viabilité des parasites amastigotes sauvés. [B] Triton X-100 Treatment causé la lyse des cellules THP1 et a également affecté la viabilité des parasites amastigotes sauvés [C] Tween 80 a causé la lyse partielle des cellules THP1 pour sauver les amastigotes. [D] Tween 80 a causé la lyse partielle des cellules THP1 pour sauver les amastigotes. [E ] SDS traitement a provoqué une lyse presque complète des cellules THP1 et n'a pas d'incidence sur la viabilité des amastigotes sauvés à 0,05% / 30 sec. [F] Traitement avec 0,05% de SDS pendant 20-30 sec causé la lyse presque complète des cellules THP1 et sauvé parasite viable amastigotes de se transformer en promastigotes. Cliquez ici pour agrandir la figure .

Figure 3. Fluorescent image numérique d'une cellule différenciée THP1 infectées in vitro par Leishmaniun donovani amastigotes. Le ADNk caractéristique peut aussi être vu avec chaque noyau parasite. Le noyau des macrophages (mN) (1) et les noyaux parasite (pN) (2) peuvent être marqués de façon différentielle et de manière différentielle en compte par le logiciel d'analyse ImageJ pour l'évaluation quantitative de l'infection. La quantification a été faite que le nombre de cellules THP1 amastigotes/100.
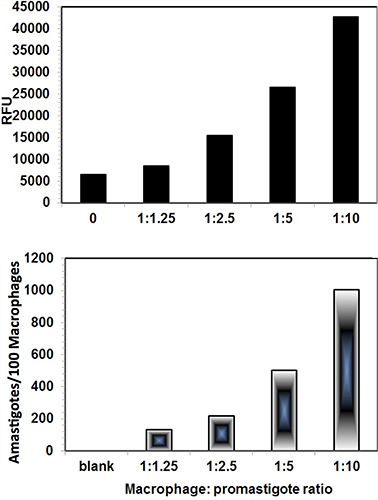
Figure 4. Comparaison entre Digital-image-Analyse-Direct-comptage-Assay (panneau inférieur) et Parasite-sauvetage-Transformation-Assay (panneau supérieur). Le macrophage: rapport de promastigotes de 1:10 cédé infection optimale. Les deux ont donné des résultats comparables. Le test parasite de sauvetage a montré des valeurs de fond. Chaque montre barre moyenne des valeurs en double.

Figure 5 THP1 cellules infectées avec des promastigotes de Leishmania par THP1 différente:. Rapport promastigotes. Les résultats quantitatifs comme le nombre de cellules THP1 amastigotes/100 sont présentés dans la figure 4.

Figure 6. Images numériques (Fluorescent + DIC) de THP1 cellules infectées par Leishmania donovani amastigotes après le traitement avec la norme anti-leishmania médicaments pour différentes périodes. Les résultats ont été quantifiés en nombre de cellules THP1 amastigotes/100 et utilisée pour calculer la croissance pour cent par rapport aux témoins non traités et déterminer les valeurs d'IC 50.

Figure 7. Comparaison de Digital-image-Analyse-Direct-comptage-test et Parasite-sauvetage-Transformation-test pour le dépistage des drogues anti-Leishmania (Amophotericin B). Les macrophages infectés ont été traités avec différentes concentrations de la norme anti-leishmaniose médicament pour des périodes différentes. IC 50 (pg / ml) ont été calculées à partir des valeurs de la courbe dose-réponse par Excelfit. Cliquez ici pour agrandir la figure .
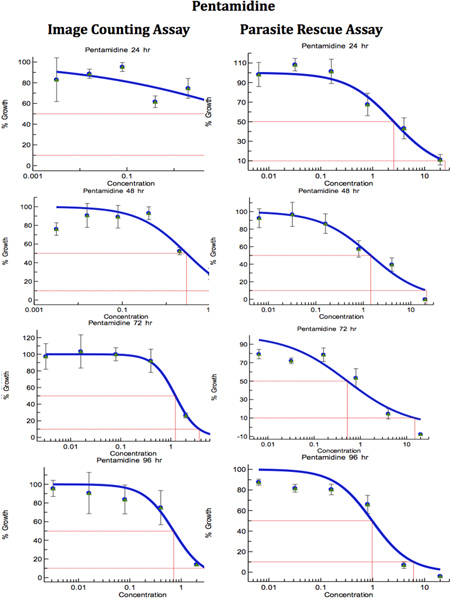
Figure 8. Comparaison de Digital-image-Analyse-Direct-comptage-test et Parasite-sauvetage-Transformation-test pour unedépistage de drogues nti-leishmanienne (pentamidine). Les macrophages infectés ont été traités avec différentes concentrations de la norme anti-leishmaniose médicament pour des périodes différentes. IC 50 (pg / ml) valeurs ont été calculées à partir des courbes dose-réponse par Excelfit. Cliquez ici pour agrandir la figure .
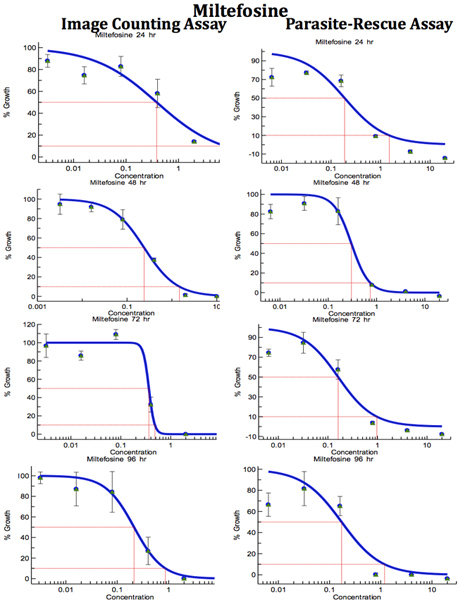
Figure 9. Comparaison de Digital-image-Analyse-Direct-comptage-test et Parasite-sauvetage-Transformation-test pour le dépistage des drogues anti-Leishmania (Mitefosine). Les macrophages infectés ont été traités avec différentes concentrations de la norme anti-leishmaniose médicament pour des périodes de temps différentes. IC 50 (pg / ml) valeurs ont été calculées à partir des courbes dose-réponse par Excelfit.Cliquez ici pour agrandir la figure .
| Drug test | 24 h un | 48 h un | 72 h un | 96 h un | ||||
| B AIAC | C PRTA | B AIAC | C PRTA | B AIAC | C PRTA | B AIAC | C PRTA | |
| L'amphotéricine B | 0,24 ± 0,03 | 0,17 ± 0,01 * | 0,12 ± 0,04 | 0,20 ± 0,07 | 0,06 ± 0,01 | 0,06 ± 0,01 | 0,11 ± 0,03 | 0,10 ± 0,03 |
| La pentamidine | > 10 | 2,55 ± 1,16 * | 2,88 et jusmn; 0,58 | 1,43 ± 0,91 | 1,24 ± 0,35 | 1,52 ± 0,16 | 0,71 ± 0,63 | 0,98 ± 0,33 |
| Miltefosine | 0,38 ± 0,02 | 0,19 ± 0,08 * | 0,24 ± 0,06 | 0,30 ± 0,08 | 0,36 ± 0,02 | 0,16 ± 0,06 | 0,21 ± 0,15 | 0,17 ± 0,10 |
Tableau 1. Comparaison de Digital-image-Analyse-Direct-comptage-test et Parasite-sauvetage-Transformation-test pour le dépistage des drogues anti-Leishmania. Les macrophages infectés ont été traités avec différentes concentrations de la norme anti-leishmaniose médicament pour des périodes différentes. IC 50 (pg / ml) valeurs ont été calculées à partir des courbes dose-réponse par Excelfit (figures 7-9) un traitement Heures médicaments après;. B Comptage AIAC et l'analyse d'image = directEssai; c PRTA = Parasite de sauvetage et essai de transformation. Les valeurs données sont des CI 50 (concentration du médicament provoquant une inhibition de 50% de la croissance du parasite) en pg / ml et sont la moyenne ± écart-type d'au moins trois expériences. * Statistiquement différent (<0,05) par rapport aux valeurs de CI50 avec l'AICA.
Discussion
Il existe plusieurs méthodes disponibles pour le criblage de médicaments anti-leishmaniose basée sur des macrophages amastigotes modèles. Les dosages peut être fait avec les macrophages prélevés chez des animaux hôtes cellules d'exsudat péritonéal savoir (PEC), les cellules monocytes du sang périphérique (PBMC) 6 ou d'os dérivées de la moelle macrophages (BMM) ou dans des lignées cellulaires monocytaires comme la souris (J774 et RAW264.7 ) 7 et humaines (THP1, U937, HL-60) 8 cellules monocytaires. Les analyses, qui utilisent les cellules en division d'accueil, doit s'assurer que les effets confondants de l'activité du médicament à la fois sur les parasites et les cellules hôtes sont considérés comme nombre. Les macrophages différenciés primaires recueillies auprès de diverses sources comme les souris et les rats sont non-division dans la nature, mais ces préparations cellulaires peuvent ne pas être des populations cellulaires homogènes. Lignées de cellules monocytaires cellules dérivées sont-homogène dans la nature et sont un meilleur modèle pour le dépistage des macrophages amastigote basée. Sur les différentes lignées de cellules monocytaires, différentiated cellules THP1 (aiguë humaine ligne cellulaire de leucémie monocytaire) peuvent former une monocouche non de division et d'offrir une alternative intéressante aux primaires des macrophages isolés.
Le dépistage des macrophages amastigotes base peut être fait de plusieurs façons. Classique évaluation microscopique basé sur la cellule directe et parasite de comptage 9 est un travail intensif. L'absence d'automatisation limite l'utilité de cet essai. Le comptage des cellules prend du temps et peut donner de détermination inexacte des valeurs de CI50 puisque la détermination de la viabilité du parasite à travers une procédure de coloration est difficile. Beaucoup de colorants fluorescents et les anticorps monoclonaux peuvent être utilisés pour des essais de cytométrie en flux 10, 11, mais ces tests sont également limitées en raison de moins de sensibilité et de limitation de l'intervalle de temps de traitement de la toxicomanie à une seule journée. Il existe plusieurs tests de gènes rapporteurs disponibles pour quantifier la croissance des amastigotes intracellulaires 12,13,14. Un automateed dépistage peut être possible en utilisant des gènes rapporteurs, mais ces essais ont aussi certains inconvénients. Tout d'abord, la majorité de ces tests nécessitent la sélection des médicaments pour le maintien de l'expression épisomique des gènes rapporteurs, qui ne peut être idéal pour une expérience de dépistage de drogue. La manière par laquelle le gène rapporteur est introduit peut également influer sur les propriétés physiologiques du parasite et avoir un impact sur le dépistage. Si le gène rapporteur est la partie d'un plasmide épisomique, la sortie relative de rapporteur peut dépendre du nombre de copies du plasmide transfecté (qui varie de cellule en cellule), plutôt que sur l'activité de la drogue 14. Certains parasites journaliste qui se transforment parasites n'avez pas besoin de maintenir la pression sélective du gène rapporteur, mais il pourrait y avoir des conséquences biologiques soit en perturbant l'architecture génomique ou tout simplement par la présence des protéines reporters étrangers 15. Dans certains dosages de gènes rapporteurs base, il yales questions de sensibilité et l'activité de fond 16. Plus important encore, un grand nombre de dosages de rapporteur de l'expression génique, spécialement celui avec la GFP journaliste gene15, ne peut pas différencier entre les amastigotes intracellulaires vivants et morts. Tests basés sur le gène rapporteur de la luciférase peut discerner entre vivants et morts amastigotes intracellulaires, mais substrat et un tampon de lyse cellulaire pour ces tests sont coûteux pour dépistage à grande échelle 17. Pour remédier à ces inconvénients et limitations des tests de criblage précédentes macrophages amastigotes base, nous avons développé et optimisé ce test parasite de sauvetage et de transformation. Ce test est basé sur des cellules THP1, qui ont une bonne homogénéité et ne sont pas de division dans la nature, comme cellules hôtes.
Le test Parasite-sauvetage-Transformation-test décrit ici est comparable à l'analyse fondée sur Digital-image-Analyse-Direct-comptage des amastigotes intracellulaires. Microscopie à fluorescence et DIC, imagerie numériqueanalyses par e ImageJ pour comptage différentiel des noyaux macrophages et les noyaux du parasite ont affiné l'analyse comptage microscopique. Capturer les images sous filtres fluorescents et le contraste d'interférence différentiel (DIC) filtres ont amélioré la qualité de l'image numérique pour le comptage plus précis des parasites intracellulaires. Images fluorescentes et DIC peuvent être fusionnées afin d'obtenir des images numériques avec des contours clairs de cellules macrophages et les noyaux fluorescent intracellulaire. Les noyaux des macrophages et des noyaux parasite peut être différemment reconnu avec ImageJ. Par conséquent, à la fois numérique-image-Analyse-Direct-comptage-test et Parasite-sauvetage-Transformation-test ont le potentiel pour l'automatisation et l'application à grande échelle de dépistage. Les étapes essentielles de l'Parasite-sauvetage-Transformation-test sont les suivants: (a) des lavages répétés des cultures de cellules THP1 après exposition à promastigotes de Leishmania, pour assurer une élimination presque complète de la non-stagiairelisés promastigotes et (b) de lyse contrôlée des cellules infectées avec THP1 SDS. Les deux étapes peuvent également être contrôlée grâce à l'automatisation et ne doit pas compromettre avec un débit de l'essai. La deuxième étape de lavage, après exposition des cellules THP1 infectées de Leishmania aux médicaments d'essai / supprime les autres composés non internalisés parasites, le cas échéant. Le Parasite-sauvetage-Transformation-test offre des avantages significatifs sur existants gène rapporteur microscopique et des tests d'analyse d'images. Le test est simple, robuste et reproductible, peut être automatisé à grande échelle de dépistage et devrait donc avoir des applications importantes dans le criblage de banques de composés grands pour la découverte de nouveaux médicaments anti-leishmania. En outre, le dosage peut également être appliqué pour l'évaluation de l'infectiosité de clinique, ainsi que, isolats de laboratoire de Leishmania in vitro.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
L'accord NCNPR-USDA-ARS scientifique n ° 58-6408-2-0009; CDMRP subvention Award # W81XWH-09-2-0093 par l'US Army Medical Research et le Commandement du matériel.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| Phorbol 12-myristate 13-acétate (PMA) | Sigma-Aldrich USA | P1585 | Nécessaire à la différenciation des cellules THP1. |
| Milieu RPMI-1640 | Invitrogen | 23400021 | |
| Lab-Tek Chamber système Diaporama (16 chambre) | Thermo Scientific Nunc | 178599 | |
| Claires, à fond plat, plaques à 96 puits | BD Falcon | 353075 | Plaques d'effectuer essai sur plaque de 96 puits |
| L'amphotéricine B | Sigma-Aldrich USA | A4888 | La norme anti-drogue leishmaniose se dissoudre dans du DMSO (2 mg / ml) |
| La pentamidine iséthionate de Salt | Sigma-Aldrich USA | P 0547 | La norme anti-drogue leishmaniose se dissoudre dans du DMSO (2 mg / ml) |
| Miltefosine | EMD Biosciences USA | 475841 | La norme anti-drogue leishmaniose se dissoudre dans du RPMI sans sérum-1640 (à préparer) (2 mg / ml) |
| Stibogluconate de sodium | EMD Biosciences USA | 567565 | La norme anti-drogue leishmaniose préparer dans du RPMI-1640 avec 4% de FBS. (1 mg / ml) |
| Dodécyl sulfate de sodium | Sigma-Aldrich USA | L 5750 | |
| Microscope à fluorescence | NIKON | ECLIPSE 90i | |
| Lecteur de microplaques à fluorescence | BMG | Polar Star Galaxy | |
| Milieu de montage | Sigma-Aldrich USA | M 1289 | |
| unlamarBlue | AbD Serotec | BUF012 B | |
| SYBR Green I | Sigma-Aldrich USA | S 9430 | |
| Bicarbonate de sodium | Fisher Sci. | 523500 | |
| Pyruvate de sodium | Sigma-Aldrich USA | P2256 | |
| 2-mercaptoéthanol | Sigma-Aldrich USA | M6250 | |
| Fetal Bovine Serum | Atlanta Biologicals | S11050H | |
| Tween 20 | Sigma-Aldrich USA | P9416 | |
| Tween 80 | Sigma-Aldrich USA | P6474 | |
| Triton X-100 | Sigma-Aldrich USA | T8787 | |
| NP-40 | Calbiochem | 492016 |
Références
- WHO. . Control of the leishmaniasis: report of a meeting of the WHO Expert Committee on the Control of Leishmaniasis. Xii, 22-26 (2010).
- Croft, S. L., Seifert, K., Yardley, V. Current scenario of drug development for leishmaniasis. Indian J. Med. Res. 123 (3), 399-410 (2006).
- Croft, S. L., Sundar, S., Fairlamb, A. H. Drug Resistance in Leishmaniasis. Clinical Microbiology reviews. 19 (1), 111-126 (2006).
- Mikus, J., Steverding, D. A simple colorimetric method to screen drug cytotoxicity against Leishmania using the dye AlamarBlue. Parasitology International. 48 (3), 265-269 (2000).
- Callahan, H. L., Portal, A. C., Devereaux, R., Grogl, M. An Axenic Amastigote System for Drug Screening. Antimicrob. Agents Chemother. 41 (4), 818-822 (1997).
- Seifert, K., Escobar, P., Croft, S. L. In vitro activity of anti-leishmanial drugs against Leishmania donovani is host cell dependent. J. Antimicrob. Chemother. 65 (3), 508-511 (2010).
- Kolodziej, H., Kiderlen, A. F. Antileishmanial activity and immune modulatory effects of tannins and related compounds on Leishmania parasitized RAW 264.7 cells. Phytochemistry. 66 (17), 2056-2071 (2005).
- Maia, C., et al. Infectivity of five different types of macrophages by Leishmania infantum. Acta Tropica. 103 (2), 150-155 (2007).
- Neal, R. A., Croft, S. L. An in vitro system for determining the activity of compounds against the intracellular amastigote form of Leishmania donovani. J. Antimicrob. Chemother. 14, 463-475 (1984).
- Abdullah, S. M., Flath, B., Presber, H. W. Comparison of different staining procedures for the flow cytometric analysis of U-937 cells infected with different Leishmania-species. J. Microbiol Methods. 37 (2), 123-138 (1999).
- Giorgio, C. D., et al. Flow Cytometric Detection of Leishmania Parasites in Human Monocyte-Derived Macrophages: Application to Antileishmanial-Drug Testing. Antimicrob Agents Chemother. 44 (11), 3074-3078 (2000).
- Mandal, S., et al. High throughput screening of Leishmania donovani clinical isolates against drug using a colorimetric β Lactamase assay. Indian J. Exp. Biol. 47 (6), 475-479 (2009).
- Chan, M. M. Y., Bulinski, J. C., Chang, K. P., Fong, D. A. Microplate assay for Leishmania amazonensis promastigotes expressing multimeric green fluorescent protein. Parasitol. Res. 89 (4), 266-271 (2003).
- Buckner, F. S., Wilson, A. J. Colorimetric assay for screening compounds against Leishmania Amastigote Grown in macrophages. Am. J. Trop. Med. 72 (5), 600-605 (2005).
- Sereno, D., et al. Advances and perspectives in Leishmania cell based drug-screening procedures. Parasitol. Int. 56 (1), 3-7 (2007).
- Gupta, S., Nishi, Visceral leishmaniasis: experimental models for drug discovery. Indian J. Med. Res. 133, 27-39 (2011).
- Roy, G., et al. Episomal and stable expression of the luciferase reporter gene for quantifying Leishmania spp. Infections in macrophages and in animal models. Mol. Biochem. Parasitol. 110 (2), 195-206 (2000).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon