Method Article
Una modificación de la EPA Método 1623 que utiliza el flujo tangencial de fibra hueca de ultrafiltración y la Plaza de calor de disociación para detectar a base de agua
En este artículo
Resumen
Este protocolo se describe el uso de un flujo tangencial de fibra hueca sistema de ultrafiltración concentración de la muestra y una disociación calor como pasos alternativos para la detección de vías acuáticas Cryptosporidium Y Giardia Las especies que utilizan el método EPA 1623.
Resumen
Especies de Cryptosporidium y Giardia son dos de los más comunes los protozoos que causan brotes de enfermedades diarreicas transmitidas por el agua en todo el mundo. Para caracterizar mejor la prevalencia de estos patógenos, el Método EPA 1623 fue desarrollada y utilizada para controlar los niveles de estos organismos en el agua potable EE.UU. suministra 12. El método consta de tres partes principales: la primera es la concentración de la muestra en el que se filtra al menos 10 L de agua de la superficie en bruto. Los organismos y restos atrapados se eluyen a continuación del filtro y se centrifuga para concentrar aún más la muestra. La segunda parte del método utiliza un procedimiento de separación inmunomagnética donde se aplica la muestra de agua concentrada a perlas inmunomagnéticas que se unen específicamente a los ooquistes de Cryptosporidium y quistes de Giardia permitiendo la eliminación específica de los parásitos de los escombros se concentró. Estos quistes (oo) luego se desprende de las partículas magnéticas por un procedimiento de disociación del ácidoDuré. La parte final del método consiste en la tinción de inmunofluorescencia y la enumeración, donde (oo) quistes se aplicó a un portaobjetos, se tiñe y se enumeran con el microscopio.
Método 1623 tiene cuatro sistemas de concentración de la muestra lista para capturar los ooquistes de Cryptosporidium y quistes de Giardia en el agua: Los filtros de Envirochek (Pall Corporation, de Ann Arbor, MI), Envirochek filtros Pall Corporation (AT), filtros Filta-Max (IDEXX, Westbrook, MA), o centrifugación de flujo continuo (Haemonetics, Boston, MA). Sin embargo, Cryptosporidium y Giardia (oo) quistes recuperaciones han variado considerablemente en función de la matriz de las fuentes de agua y los filtros utilizados 1,14. Un nuevo flujo tangencial de fibra hueca de ultrafiltración (HFUF) del sistema se ha demostrado recientemente para ser más eficiente y más robusta a la recuperación de los ooquistes de Cryptosporidium Los quistes de Giardia y de diferentes matrices de agua y, además, es menos costosa que la opción de cápsula de otro filtros, y se pueden concentrar los agentes patógenos de forma simultánea 1-3,5-8,10,11. Además, estudios previos realizados por Hill y sus colegas demostraron que la HFUF mejoró significativamente la recuperación de ooquistes de Cryptosporidium cuando se compararon directamente con los filtros Envirochek AT 4. Las modificaciones adicionales a los actuales métodos también han sido reportados para mejorar el funcionamiento del método. Sustitución del ácido procedimiento de disociación con calor disociación ha demostrado ser más eficaz en la separación de Cryptosporidium de las perlas magnéticas en algunas matrices de 9,13.
Este protocolo describe un método modificado 1623 que utiliza el sistema de filtración HFUF nuevo con el calor paso disociación. El uso de HFUF con este método modificado es una alternativa menos costosa que las actuales opciones de filtrado método EPA 1623 y ofrece más flexibilidad al permitir la concentración de múltiples organismos.
Protocolo
1. Flujo tangencial de fibra hueca de ultrafiltración Procedimiento
- Preparación de tampones y soluciones:
La elución de soluciones (1 l):
Para 1 L de agua de grado reactivo añadir 0,1 g de polifosfato de sodio, 0,1 ml de Tween-80 y 0,01 ml de antiespumante S-30. - Preparar el conjunto del filtro (Figura 1) en una cabina de seguridad biológica:
- Inserte Masterflex I / P 73 tubos de laboratorio a través de una Masterflex I / P cabezal de la bomba Carga fácil conectarse a una Masterflex I / P de la unidad sin escobillas de precisión.
- Fijar el tubo a un 0-60 psi, manómetro lleno de glicerina equipado con una rama TNP conector en T aguas arriba de la cabeza de la bomba con una abrazadera de tornillo, y un conector en T HDPE aguas abajo de la cabeza de la bomba.
- Montar la botella retenido por la instalación de un Nalgene 53-B de llenado / venteo tapa con Masterflex L / S tubo de laboratorio de 15 y un conector en T y lo fija en un 1 botella de Nalgene L polipropileno pesada obligación.
- Montar Masterflex L / S 24 tubos won una pizca de la abrazadera (clamp pizca 2) y conectarlo de la botella de polietileno de alta densidad de retenido a la T-conector.
- Conectar el Masterflex L / S 24 tubos de laboratorio del manómetro a la Kasei Asahi Rexeed 25S de alto flujo dializador con una abrazadera de tornillo, y desde el dializador a la botella retenido. Utilice los productos a medida adaptadores DIN diseñadas para dar cabida a ¼ "tubo de ID para conectar la tubería a la ultrafiltro de fibra hueca.
- Montar Masterflex L / S 24 tubos de laboratorio con una pinza de pellizco (pinch clamp 1) y conectarlo a una pipeta de plástico de 10 ml con el tapón de la punta y el algodón eliminado para actuar como la línea de absorción de la muestra y luego conecte el tubo de polietileno de alta densidad a la T- conector.
- Colocar un extremo del tubo Masterflex laboratorio L/S-36 con una rampa de abrazadera y conecte la tubería al puerto efluente situado cerca del extremo de salida del filtro. Coloque el otro extremo en el contenedor de desechos.
- Añadir 0,01% (w / v) de polifosfato de sodio a la muestra 10 L de agua y se mezcla durante 3 min.
- Cierre la abrazadera pizca 2y quitar la tapa de ventilación de la botella retenido. Todas las abrazaderas de otros deben estar abiertos.
- Ajuste la dirección de la bomba para mover el fluido desde el conector en T para el manómetro de presión (a la derecha a izquierda Figura siguiente 1). Ajustar la velocidad de la bomba a 25% de la velocidad máxima y activar la bomba.
- Cuando la botella está retenido de 2/3 de la abrazadera, una pizca abierto 2 y volver a colocar rápidamente la tapa de ventilación de la botella retenido. Revise todas las líneas y conexiones para garantizar que no haya fugas.
- Lentamente aumentar la velocidad de la bomba a la tasa de filtración deseada (aproximadamente 1,5 l / min), la comprobación de fugas. Usando un cilindro graduado y un metro temporizador o flujo, comprobar la tasa de filtrado del agua que sale desde la línea de efluente (azul L / S 36 tubos en la Figura 1). Las burbujas de aire típicamente pueden formar en el extremo de salida del filtro por lo que es difícil de lograr una presión estable y la tasa de filtración. Esto se corrige apretando la línea de efluente con la mano por un momento. Esta accióngeneralmente coaxial la burbuja de aire al puerto filtrado y para salir a través de la línea de efluente. Repita cuantas veces sea necesario, teniendo en cuenta que las burbujas de aire del tamaño de guisante son a menudo inevitables.
- Supervisar el proceso de filtración. Medir y registrar la presión y la velocidad de filtración según sea necesario. La presión no debe exceder los 20 psi. Se recomienda que la tasa de filtración no debe exceder de 2,0 L / min. Es importante que el volumen de agua en la botella retentato ser controlados para asegurar que nunca se vacía. Es normal que el volumen para aumentar o disminuir ligeramente. Si el volumen de agua retenido en la botella cae por debajo de 1/3 lleno, a continuación, retire la tapa de ventilación y una pizca cerca de la abrazadera 2 en la línea de botella retenido. Llevar el volumen de nuevo a cerca de 2/3 de su capacidad, abra la pinza y volver a colocar rápidamente la tapa de ventilación, lo que garantiza un cierre hermético. Si el volumen retenido en la botella se cae de forma rápida y continua, a continuación, asegurar la tapa de la botella retenido es escaso y la tapa de ventilación es segura en su lugar, y que el tubing es todavía en contacto con la muestra de agua. Si estas cuestiones no se están produciendo, entonces es probable que el sello en la tapa de la botella retenido es malo y debe ser reemplazado.
- Cuando el recipiente de la muestra está vacía, la abrazadera pellizco inmediatamente cerrar 1, reducir la velocidad de la bomba a 20% de su máximo, retirar la tapa de ventilación de la botella retenido y cerrar la pinza rampa.
- Ajuste el volumen de la muestra en la botella de retenido hasta aproximadamente 200 ml por apretar o aflojar la abrazadera de la rampa. Después de que el volumen es de aproximadamente 200 ml, apretar la abrazadera de la rampa de los pasos de elución (1.11 a 1.12).
- Añadir 500 ml de solución de elución para el contenedor de muestras y enjuagar el interior del recipiente. Colocar la pipeta 10 ml conectada a la línea de absorción de la muestra en el recipiente que contiene la solución de elución. Asegúrese de que la abrazadera de la rampa está cerrada. Pinza sujetar una pinza y una pizca cerca de 2 por un momento de elaborar la solución de elución.
- Después de los 500 ml de solución de elución se redacta, Cerca de una abrazadera de apriete y la abrazadera pizca abierto 2. Dejar que la solución de elución para circular durante 5 minutos con una velocidad de bombeo de 20% de su valor máximo.
- Ajustar el volumen de la muestra en la botella retenido a aproximadamente 100 ml por apretar o aflojar la abrazadera rampa en la línea de efluente. Apretar la abrazadera rampa y dejar que la muestra a circular durante 1 minuto. Evite tirar del aire en el tubo, asegurando el volumen de la muestra en la botella retenido es lo suficientemente alta para cubrir la L / S 15 tubos de entrar en la botella retenido.
- Invertir la dirección de la bomba que obliga a la muestra en la botella retenido. Permitir que la bomba funcione en sentido inverso durante 20 segundos resultantes en un total de ~ 225 ml en la botella retenido. Apague la bomba.
- Retire el Masterflex I / P 73 tubo de la cabeza de la bomba y desconectar el medidor de presión. Desconecte el Masterflex L / S 24 tubos de salida de la ultrafiltro de fibra hueca. Mantener la tubería por encima de la botella retenido para obligar a cualquier muestra restante en elretenido botella.
- Desconecte todos los tubos de la botella y coloque la tapa de ventilación con una tapa no-ventilación.
- Continuar con el procedimiento de IMS / IFA con el ~ 225 ml de retenido.
2. Procedimiento de separación inmunomagnética
- Preparación de tampones y soluciones:
- Permitir que los topes incluidos en las Dynabeads: Cryptosporidium / Giardia kit combinado para alcanzar la temperatura ambiente.
- SL-1X tampón A: Añadir 1 ml de 10X SL-tampón A a 9 ml de agua de grado reactivo.
- Transferir la ~ 225 ml de líquido de la botella retenido a una etiqueta 250 ml de tubo de centrífuga cónico. Lavar la botella retenido dos veces con 10 ml de agua de grado reactivo, y añadir los enjuagues para el tubo de centrífuga cónico. Centrifugar la suspensión a 1500 xg durante 15 min a 4 ° C sin freno.
- Aspirar cuidadosamente el sobrenadante de la interfase aire-agua a 5 ml por encima de la pastilla embalado por cada 0,5 ml de volumen de precipitado (es decir aspirado a 15 ml por encima de un volumen de pellets de 1,3 ml, y aspirado a 5 ml de una pastilla de 0,5 ml o menos).
- Fondo resuspender el sedimento en el sobrenadante por vórtex y / o una pipeta de mezcla. Transferir cada volumen de 5 ml del líquido a la cara plana Dynal L10 tubo que contiene 1 ml de cada uno de 10X tampón de SL-A y SL-10X tampón B. Lavar el tubo de centrífuga cónico dos veces con 2,5 ml de agua y añadir el reactivo de enjuague para el tubo L10, con lo que el volumen total en el tubo ml L10 a 12, incluyendo los tampones.
- Añadir 100 l cada uno de los bien mezclados Dynabeads resuspendidas contra el Cryptosporidium y Giardia, contra el tubo L10. Girar el tubo L10 a 18 rpm durante 1 hora a temperatura ambiente en un mezclador rotatorio.
- Coloque el lado plano del tubo L10 contra el imán MPC-6 y la roca suavemente la mano del tubo de extremo a extremo, 180 ° C durante 2 minutos.
- Manteniendo el tubo L10 en el imán MPC-6 con la cara de imán hacia arriba, decantar el sobrenadante lejos de la perla / (oo) quistes complejos bouº al imán. Retirar el tubo L10 del imán y añadir 0,5 ml de 1X SL-tampón A al tubo. Transferir la suspensión mediante dos lavados adicionales de 0,5 ml de 1X SL-tampón A en un tubo de microcentrífuga de 1,5 ml a cabo en el MPC-S con el imán en la posición vertical.
- Agite suavemente el tubo en el MPC-S del imán 180 ° durante 1 minuto. Con el imán en su lugar, aspirar el sobrenadante utilizando una pipeta Pasteur dirigido a la parte inferior del tubo de microcentrífuga.
- Añadir 1 ml de 1X PBS a la parte frontal del tubo de microcentrífuga, eliminar el imán y oscilar suavemente el tubo hasta que las perlas se volvieron a suspender. Sustituir el imán en la posición vertical y mueva suavemente el tubo 180 ° C durante 1 minuto. Aspirar el PBS enjuague, sin perturbar el sedimento talón, utilizando una pipeta Pasteur para eliminar desechos como sea posible.
- Eliminar el imán y añadir 50 l de agua de grado reactivo al lado posterior del tubo de microcentrífuga. Vórtice del tubo a toda velocidad durante 50 segundos,a continuación, se incuba el tubo a 80 ° C durante 10 minutos seguido por un segundo vórtice 30. Sustituir el imán en el MPC-S en la posición inclinada, la unión de las perlas para el imán y dejando los quistes (oo) en el líquido. Aplicar la suspensión del quiste (oo) a una diapositiva SingleSpot bien.
- Repetir paso 2,10, aplicando el líquido al mismo pozo que contiene la primera disociación. Colocar el portaobjetos en una diapositiva 37 ° C más caliente durante 1 hora para secar la suspensión a la diapositiva bien.
3. Tinción y examen
- Preparación de tampones y soluciones:
Solución de trabajo DAPI: Añadir 25 l de solución madre DAPI (2 mg / ml en metanol) a 25 ml de 1X PBS. Tienda de acciones y soluciones de trabajo entre 1 ° C y 10 ° C en la oscuridad. - Aplicar 50 l de metanol a la diapositiva y así permitir que se seque a temperatura ambiente.
- Añadir 50 ml de la solución DAPI de trabajo a la diapositiva bien y se incuba durante 2 minutos a temperatura ambiente.
- Use un KimwiPE a la mecha de la DAPI del pozo. Aplique 50 l de EasyStain. Incubar a 35 ° C durante 30 minutos.
- Seque la mancha de el pozo con una Kimwipe, y luego, lentamente, añadir 300 l de tampón frío EasyStain fijación, permitiendo que fluya sobre el borde bien. Incubar durante 2 minutos a temperatura ambiente.
- Use un Kimwipe que absorbe y expulsa el buffer del pozo y aplicar 10 l de medio EasyStain montaje.
- Aplique con cuidado una hoja de cubierta, la eliminación de las burbujas que se producen. Selle la hoja de la cubierta con esmalte de uñas transparente.
- Digitalizar toda la diapositiva utilizando el filtro FITC, en el aumento total de 200X, de ovoides o esférica color verde manzana objetos fluorescentes que se asemejan a un ooquiste o quiste. Examine todos esos objetos con el filtro de DAPI en un aumento total de 1000X y luego con la CID, también en un aumento total de 1000X. Anote el tamaño utilizando un micrómetro ocular calibrado y características morfológicas.
- Documentar los resultados.
Nota: información adicionalinformación sobre el procedimiento original se puede encontrar en diciembre de 2005 la versión del método de la EPA 1623 12. El flujo tangencial de fibra hueca de ultrafiltración procedimiento descrito se utiliza en lugar de la sección de 12,0 método EPA 1623. La disociación de calor modifica la Sección 13.3.3 del método EPA 1623. El procedimiento también describe un enjuague adicional PBS durante el proceso de IMS que se puede insertar en la versión de diciembre 2005 Método 1623 después de la sección 13.3.2.16. La lista completa de consumibles, reactivos y equipos utilizados para el método EPA 1623 la inclusión de estas modificaciones se enumeran en la lista de equipo.
4. Los resultados representativos
Ooquistes de Cryptosporidium y quistes de Giardia recuperados a través de los procesos de filtración y separación inmunomagnética se detectan mediante un análisis microscópico. En una ampliación de 200X total, cada organismo exhibe un patrón de tinción típica, el tamaño y la forma como se muestra en la Figura 2 se observó, además, usando aceite de inmersión con un aumento total de 1000X. Esto permitirá que para la medición y la identificación de cualquiera de las características típicas que definen o características atípicas que descartar una identificación positiva. El Cryptosporidium es un ovoide con objeto esférico de 4 a 6 m de diámetro que exhibe brillantes de color verde manzana de fluorescencia FITC con bordes brillantes señalados (figura 3A ). Con DAPI UV, un ooquiste exhibirá una de las categorías siguientes características típicas: la luz azul que se mancha interna con un borde verde y sin núcleos distintos (DAPI negativo), una intensa coloración interna de azul, o hasta cuatro distintas, de color azul celeste núcleos (DAPI positivo - Figura 3B). Características atípicas incluyen las desviaciones en el color, estructura o DAPI fluorescencia (por ejemplo, núcleos teñidos de más, de color rojo fluorescente las estructuras internas). Si el objeto fluorescente ha cumplido los criterios para la FITC típica y DAPI, se examina por medio de Con interferencia diferencialcontraste (CID). El objeto se examinaron para atípicas características morfológicas externas o internas, tales como la ornamentación de la pared celular, o una o dos grandes núcleos de llenado de la célula. Si las estructuras atípicas no se observan, el objeto se registra en el recuento total de IFA y se categorizan como una estructura amorfa vacío o con uno a cuatro esporozoitos presentes (Figura 3C). Del mismo modo, Giardia-como los objetos son examinados con respecto a la tinción con FITC y DAPI, así como las características de DIC, como axonemas, los organismos de la mediana, y los núcleos de los quistes de Giardia son redondos u ovoides objetos brillantes de color verde manzana, 8 -. 18 micras de largo por 5 - 15 micras de ancho con bordes vivos resaltados (Figura 3D). Con DAPI UV, el quiste de Giardia exhibirá DAPI tinción negativa, o DAPI-positivas características (Figura 3E). El objeto fluorescente es examinado por DIC para las características típicas y atípicas en la misma manera descrita para Cryptosporidium.Si las características atípicas no se observan, el objeto se registra en el recuento total de IFA y la categoría de estructura amorfa que contiene vacíos, o con uno o más tipos de estructuras internas presentes (Figura 3F).
Cualquier organismo que se observa que tienen características atípicas no debe ser considerado como un quiste (oo). El análisis microscópico de muestras ambientales puede ser un reto, ya que hay organismos que pueden auto-fluorescentes o de una reacción cruzada con el FITC-conjugado anti-Cryptosporidium y / o anti-Giardia anticuerpos 1. Se recomienda que un analista de estar familiarizado con los microbios acuáticos y decenas de revisión de las diapositivas para ganar experiencia la identificación de Cryptosporidium y Giardia. Por lo menos tres (oo) quistes en la diapositiva de la tinción de control positivo debe ser caracterizado antes de cada período de sesiones en el microscopio.
Muestras de control de calidad puede ser enriquecida con (oo) quistes para determinar el por ciento de recOvery para cada protozoo mediante el cálculo:
(Oo) quiste porcentaje de recuperación = ((recuento de muestras de control de calidad - Cuenta de la Muestra sin marcar) / Spike) x 100.
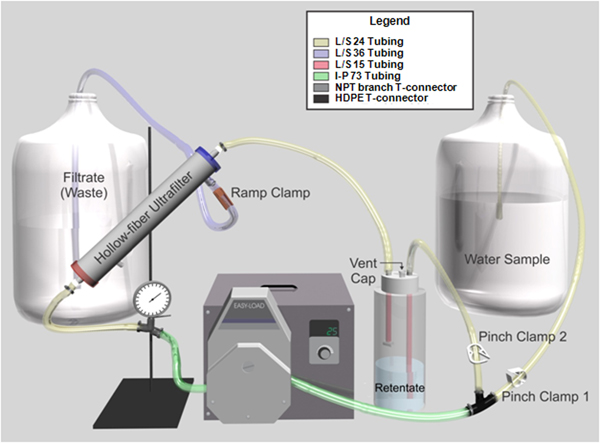
Figura 1. Representación gráfica del sistema de ultrafiltración de flujo tangencial de fibra hueca. El tubo está codificada en color para ayudar es el montaje del sistema.
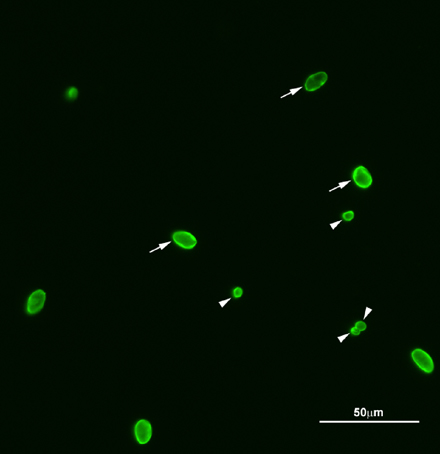
Figura 2. Imagen representativa de fluorescencia de Cryptosporidium y Giardia (oo) quistes. Ooquistes de Cryptosporidium y quistes de Giardia fueron teñidas con FITC anti-Cryptosporidium / Giardia anticuerpos. Flechas, quistes de Giardia, puntas de flecha, ooquistes de Cryptosporidium. Un total de cuatro ooquistes de Cryptosporidium y quistes de Giardia seis fueron encontrados en el plano de enfoque. Las muestras observablesed bajo una ampliación de 200X.

. Figura 3 representativas imágenes microscópicas de los ooquistes de Cryptosporidium y quistes Giaridia utilizados para la caracterización de ooquistes de Cryptosporidium (a - c).. Brillante de color verde manzana FITC fluorescencia de objetos esféricos de 4 a 6 micras de diámetro con bordes brillantes resaltados (A) que contiene hasta cuatro distintas, de color azul celeste núcleos con DAPI (B) y de uno a cuatro esporozoitos (S) por ooquistes (C). quistes de Giardia (D - F). Brillante de color verde manzana con FITC fluorescencia de vuelta a los objetos ovoides 8 - 18 micras de largo por 5 a 15 micras de ancho con bordes vivos resaltados (D) que contienen hasta cuatro azul celeste núcleos DAPI (E) y con una o más estructura discernible tales interna como núcleos (N), el cuerpo de la mediana (M) y axonemas o (A) (F). Las flechas blancas y brillantes manzanas verdes ooquistes de Cryptosporidium y tinción de fluorescencia quistes de Giardia walls, puntas de flecha blanca, núcleos DAPI positivas. Las muestras se observa bajo magnificación 1000X.
Discusión
De flujo tangencial de fibra hueca de ultrafiltración es una técnica alternativa y eficaz para la concentración inicial de los ooquistes de Cryptosporidium y quistes de Giardia de agua. Ultrafiltración de fibra hueca es menos costoso que los filtros tradicionales. Puesto que tiene la capacidad de concentrar ooquistes de Cryptosporidium y quistes de Giardia de una variedad de matrices de agua diferentes, es una alternativa útil para las técnicas de filtración actuales utilizados para el método de la EPA 1623. Como con la mayoría de los otros métodos de filtración, ultrafiltración de fibra hueca es propenso a la suciedad con muestras extremadamente turbios. Presión de agua de alta resultaría de las incrustaciones de filtro, por lo tanto se recomienda para controlar la presión durante la carrera de filtración. Además de ooquistes de Cryptosporidium y quistes de Giardia, de fibra hueca de ultrafiltración ha demostrado ser capaz de concentrar las bacterias y los virus 1-3,5,8. De fibra hueca de ultrafiltración outlined en este método puede utilizarse para concentrar múltiples organismos en una sola muestra. Es de notar que la obtención de un volumen final entre 200 y 250 ml es el paso crítico final en el procedimiento de concentración para que los pasos de centrifugación extra, que puede provocar la pérdida quiste (oo), se evitan (paso 2,2). Sin embargo, lo que permite que el volumen de la botella a caer demasiado bajo, puede tener efectos desfavorables en las recuperaciones, ya que no será suficiente volumen de líquido para obligar a todos los ooquistes y quistes en la botella retenido. Por lo tanto se recomienda mantener un volumen final entre 200 y 250 ml.
El calor de disociación es una alternativa a la etapa de disociación ácida en el Método 1623. Este paso alternativo se ha demostrado que mejora la recuperación de ooquistes de Cryptosporidium y reducir la variación del método, cuando sea aislado de agua de río o reactivo 9. Una comparación lado a lado de ácido y los métodos de calor de disociación demostrado que el uso de calor a la disociaciónte los organismos de las bolas inmunomagnéticas producido las mayores recuperaciones medias de Cryptosporidium y Giardia. Además, la precisión de las recuperaciones de Cryptosporidium y Giardia fue mejor en las muestras procesadas con calor en comparación con la disociación de disociación ácida 9.
La incorporación de HFUF como la etapa de concentración permite una mayor flexibilidad al proporcionar la capacidad de concentración de múltiples organismos. Además, es una alternativa menos costosa a las opciones actuales método de filtración 1623.
Divulgaciones
La Agencia de Protección Ambiental de Estados Unidos a través de su Oficina de Investigación y Desarrollo en colaboración con la Oficina de Agua Subterránea y Agua Potable del Centro de Apoyo Técnico ha financiado la investigación que se describe aquí. Todo el trabajo fue apoyado en el sitio de la EPA de los EE.UU., Cincinnati, Ohio. Aunque la información descrita en este artículo ha sido financiado en su totalidad o en parte por la Agencia de Protección Ambiental de Estados Unidos bajo contrato (Contrato PE-C-06-031) a Shaw Ambiental y de Infraestructura, Inc, no reflejan necesariamente los puntos de vista de la Agencia y ningún endoso oficial debe ser deducido. Se ha sometido a una revisión Agencia y aprobado para su publicación.
Agradecimientos
Nos gustaría dar las gracias a Ann Zimmerman Michael Grimm y por la revisión crítica de este manuscrito y Doug Hamilton, por su apoyo técnico.
Materiales
| Name | Company | Catalog Number | Comments |
| Equipos / Reactivo | Vendedor | Catálogo # | |
| Asahi Kasei Rexeed 25 S / R húmedas de fibra hueca ultrafiltros | Marque Médico | REXEED25S / R | |
| I / P 73 (Masterflex R-3603), o equivalente | Cole Parmer | EW-06408-73 | |
| L / S 24 (Masterflex curada al platino), o equivalente | Cole Parmer | EW-96410-24 | |
| L / S 15 (Masterflex curada al platino), o equivalente | Cole Parmer | EW-96410-15 | |
| L / S 36 (Masterflex curada al platino), o equivalente | Cole Parmer | EW-96410-36 | |
| E / P Precision Drive sin escobillas | Cole Parmer | EW-77410-10 | |
| I / P Easy Load cabeza de la bomba | Cole Parmer | EW-77601-10 | |
| Negro T HDPE, 1/4 "x 3/8" x 3/8 " | EE.UU. Plásticos | 62064 | |
| Masterflex T-conector L / S 15-25 | Cole Parmer | EG-30613-12 | |
| Nalgene pesado pp 1 l botella | Cole Parmer | EW-06257 a 10 | |
| 10 ml pipetas | Fisher Scientific | 13 a 678-11C | |
| Nalgene de llenado / venteo de la tapa 1/4 "tubo, 53B | Cole Parmer | EW-06258-10 | |
| Manómetro | Cole Parmer | Una-680-46-10 | |
| Acoplamiento recto, NPT (F), 1/4 " | Cole Parmer | EW-06469 a 18 | |
| TNP rama de T, natural pp | Cole Parmer | A-30610-75 | |
| Abrazaderas de manguito, 1/2 " | Cole Parmer | EW-06833 hasta 00 | |
| CuStom ajuste DIN adaptadores | Moldeado Corp Productos | MPC-855NS.250 | |
| Anillo de soporte | Fisher Scientific | 14-670B | |
| Abrazaderas de soporte de anillo | Fisher Scientific | 05-769-6Q | |
| Keck rampa de pinza, 14mm | Cole Parmer | EW-06835-10 | |
| Polifosfato de sodio | Sigma Aldrich | 305553 | |
| Sodio tiosulfato pentahidratado | Sigma Aldrich | 72050 | |
| Antiespumante S-30 emulsión | Sigma Aldrich | A5758 | |
| Tween-80 | Sigma Aldrich | P1754 | |
| 10 L plegable polietileno de alta densidad Cubitainer | VWR | IR314-0025 | |
| Centrifugar botellero | Fisher Scientific | 05-663-103 | |
| 250 ml tubos de centrífuga cónicos | Corning | 430776 | |
| Embudo desechable | Cole Parmer | U-6122-10 | |
| Botella de lavado | Cole Parmer | U-06252-40 | |
| Centrifugar | Beckman Coulter | Allegra X-15R | |
| Cubo del rotor basculante | Beckman Coulter | ARIES SX4750 | |
| Centrifugar adaptadores de cubo de 250 tubos cónicos | Beckman Coulter | 349849 | |
| 200 l puntas de pipeta de gran diámetro | Fisher Scientific | 02-707-134 | |
| Filtro VacuShield | Gelman | 629-4402 | |
| Pipetas de 5 ml | Fisher Scientific | 13-678-11D | |
| Dynabeads: Cryptosporidium / Giardia combo kit | YoDexx | 73002 | |
| 50 ml tubos de centrífuga cónicos | Halcón | 352098 | |
| Dynal L10 tubos caras planas | IDEXX | 74003 | |
| Temporizador | VWR | 23609-202 | |
| Dynal MPC-6 imán | IDEXX | 12002D | |
| 1 ml pipetas | VWR | 53283-700 | |
| 1,5 ml de baja adherencia tubos de microcentrífuga | Fisher Scientific | 02-681-320 | |
| 1000 l pipeta y consejos correspondientes barrera | Gilson | P1000/DF1000ST | |
| 100 l de pipeta y puntas correspondientes de barrera | Gilson | P100/DF100ST | |
| 9 pulgadas de pipetas Pasteur | VWR | 14672-412 | |
| Dynal MPC-S del imán | IDEXX | 12020D | |
| Vórtice | VWR | 14216-188 | |
| Dynabeads mezclador de los rotadores | IDEXX | 94701 | |
| Calor bloque | Fisher Scientific | 11-718-2 | |
| Laboratorio de perlas Armor | Laboratorio de armadura | 42370-750 | |
| Termómetro digital | Fisher Scientific | 15-077-60 | |
| Fosfato-tampón salino 1X pH 7,4 (PBS 1X) | Sigma | P4417 | |
| Diapositivas individuales al contado | IDEXX | 30201 | |
| Cierre de vidrio | Corning | 287018 | |
| EasyStain kit directa | BTF | - | |
| L 10 de pipeta y puntas correspondientes de barrera | Gilson | P10 y DF10ST | |
| 4 ', 6'-Diamidino-2-fenil indol dihidrocloruro (DAPI) | Sigma | D9542 | |
| Esmalte de uñas transparente | Fisher Scientific | S30697 | |
| El metanol | Fisher Scientific | L6815 | |
| Kimwipes | Kimberly Clark | 34155 | |
| Incubadora | Boekel Scientific | 133000 | |
| deslice más cálido | Fisher Scientific | 11-474-521 | |
| Aceite de inmersión, Tipo A ND = 1,515 | Nikon | MXA20234 | |
| Nikon 90i microscopio con capacidades de DIC | Nikon | MBA 77000 | |
| Plan de APO 100X objetivo de aceite | Nikon | MRD01901 | |
| Planifique Achro 20X | Nikon | MRL00202 | |
| Filtro FITC | Nikon | 96302 | |
| Filtro de DAPI | Nikon | 96301 | |
| X-Cite iluminador de fluorescencia | Nikon | 87540 | |
| Lente de papel | Nikon | 76997 | |
| Bolsa desechable Biohazard | Fisher Scientific | 01-829D | |
| Biohazard recipiente para objetos afilados | Fisher Scientific | 14-827-117 | |
| 3% de peróxido de hidrógeno | VWR | BDH3540-2 | |
| Lejía | Fisher Scientific | 1952030 | |
| Wypall | Kimberly Clark | 34790 |
Referencias
- DiGiorgio, C. L., Gonzalez, D. A., Huitt, C. C. Cryptosporidium and Giardia recoveries in natural waters by using Environmental Protection Agency Method 1623. Appl. Environ. Microbiol. 68, 5952(2002).
- Hill, V. R., Kahler, A. M., Jothikumar, N., Johnson, T. B., Hahn, D., Cromeans, T. L. Multistate evaluation of an ultrafiltration-based procedure for simultaneous recovery of enteric microbes in 100-liter tap water samples. Appl. Environ. Microbiol. 73, 4218-4225 (2007).
- Hill, V. R., Polaczyk, A. L., Hahn, D., Narayanan, J., Cromeans, T. L., Roberts, J. M., Amburgey, J. E. Development of a rapid method for simultaneous recovery of diverse microbes in drinking water by ultrafiltration with sodium polyphosphate and surfactants. Appl. Environ. Microbiol. 71, 6878-6884 (2005).
- Hill, V. R., Polaczyk, A. L., Kahler, A. M., Cromeans, T. L., Hahn, D., Amburgey, J. E. Comparison of hollow-fiber ultrafiltration to the USEPA VIRADEL technique and USEPA method 1623. J. Environ. Qual. 38, 822-825 (2009).
- Holowecky, P. M., James, R. R., Lorch, D. P., Straka, S. E., Lindquist, H. D. Evaluation of ultrafiltration cartridges for a water sampling apparatus. J. Appl. Microbiol. 106, 738-7347 (2009).
- Lindquist, H. D., Harris, S., Lucas, S., Hartzel, M., Riner, D., Rochele, P., Deleon, R. Using ultrafiltration to concentrate and detect Bacillus anthracis, Bacillus atrophaeus subspecies globigii, and Cryptosporidium parvum in 100-liter water samples. J. Microbiol. Methods. 70, 484-492 (2007).
- Polaczyk, A. L., Roberts, J. M., Hill, V. R. Evaluation of 1MDS electropositive microfilters for simultaneous recovery of multiple microbe classes from tap water. J. Microbiol. Methods. 68, 260-266 (2007).
- Rhodes, E. R., Hamilton, D. W., See, M. J., Wymer, L. Evaluation of hollow-fiber ultrafiltration primary concentration of pathogens and secondary concentration of viruses from. 176, 38-45 (2011).
- Shaw, N. J., Villegas, L. F., Eldred, B. J., Gaynor, D. H., Warden, P. S., Pepich, B. V. Modification to EPA Method 1623 to address a unique seasonal matrix effect encountered in some U.S. source waters. J. Microbiol. Methods. 75, 445-448 (2008).
- Simmons, O. D. 3rd, Sobsey, M. D., Heaney, C. D., Schaefer, F. W. 3rd, Francy, D. S. Concentration and detection of Cryptosporidium oocysts in surface water samples by method 1622 using ultrafiltration and capsule filtration. Appl. Environ. Microbiol. 67, 1123-1127 (2001).
- Sobsey, M. D., Glass, J. S. Influence of water quality on enteric virus concentration by microporous filter methods. Appl. Environ. Microbiol. 47, 956-9560 (1984).
- USEPA. Method 1623: Cryptosporidium and Giardia in Water by Filtration/IMS/FA. Office of Water. 815-R-05-002, EPA. (2005).
- Ware, M. W., Wymer, L., Lindquist, H. D., Schaefer, F. W. 3rd Evaluation of an alternative IMS dissociation procedure for use with Method 1622: detection of Cryptosporidium in water. J. Microbiol. Methods. 55, 575-583 (2003).
- Zuckerman, U., Tzipori, S. Portable continuous flow centrifugation and method 1623 for monitoring of waterborne protozoa from large volumes of various water matrices. J. Appl. Microbiol. 100, 1220-1227 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados