Method Article
Uma variante do método EPA 1623 que usa fluxo tangencial ultrafiltração de fibra oca e Passos de calor de dissociação para detectar Waterborne
Neste Artigo
Resumo
Este protocolo descreve o uso de um tangencial de fibra oca de sistema de ultrafiltração de fluxo concentração da amostra e uma dissociação de calor como passos alternativos para a detecção de waterborne Cryptosporidium E Giardia Espécie, utilizando o método EPA 1623.
Resumo
Espécies de Cryptosporidium e Giardia são duas das mais prevalentes protozoários que causam surtos de doenças diarreicas transmitidas pela água em todo o mundo. Para melhor caracterizar a prevalência desses patógenos, o método EPA 1623 foi desenvolvido e utilizado para monitorar os níveis destes organismos na água potável dos EUA fornece 12. O método tem três partes principais: a primeira é a concentração da amostra em que pelo menos 10 L de água da superfície em bruto é filtrado. Os organismos e detritos preso são então eluída a partir do filtro e centrifugado para concentrar ainda mais a amostra. A segunda parte do método utiliza um procedimento de separação imunomagnética onde a amostra de água concentrado é aplicado a esferas imunomagnéticas que se ligam especificamente para os oocistos de Cryptosporidium e de cistos de Giardia permitindo a remoção específica dos parasitas do detritos concentrada. Estes cistos (OO) são, então, separada das esferas magnéticas por uma dissociação de ácido procediDure. A parte final do método é a coloração de imunofluorescência e enumeração onde (oo) cistos são aplicados a um slide manchado, e enumerados por microscopia.
Método 1623 tem quatro sistemas de amostragem listadas concentração para capturar oocistos de Cryptosporidium e cistos de Giardia na água: filtros Envirochek (Pall Corporation, Ann Arbor, MI), filtros Envirochek HV (Pall Corporation), Filta-Max filtros (IDEXX, Westbrook, MA), ou centrifugação de fluxo contínuo (Haemonetics, Braintree, MA). No entanto, Cryptosporidium e Giardia recuperações (oo) cistos têm variado muito, dependendo da matriz de fontes de água e filtros usados 1,14. Um novo fluxo tangencial de fibra oca de ultrafiltração sistema (HFUF) foi recentemente mostrado ser mais eficaz e mais fiável à recuperação de oocistos de Cryptosporidium e cistos de Giardia da água a partir de matrizes diferentes, além disso, é menos caro do que a opção cápsula outro filtroS e pode concentrar-se agentes patogénicos múltiplos simultaneamente 1-3,5-8,10,11. Além disso, estudos anteriores por Hill e colaboradores demonstraram que a HFUF significativamente melhorada recuperações dos oocistos de Cryptosporidium quando comparado directamente com os filtros Envirochek HV 4. Modificações adicionais aos métodos atuais também têm sido relatadas para melhorar o desempenho do método. Substituindo o procedimento de dissociação de ácido com o calor de dissociação foi mostrado ser mais eficaz na separação Cryptosporidium a partir das esferas magnéticas, em alguns 9,13 matrizes.
Este protocolo descreve um método modificado 1623 que utiliza o novo sistema de filtração HFUF com o passo de dissociação de calor. A utilização de HFUF com este método modificado é uma alternativa menos caro para actuais método EPA 1623 opções de filtração e proporciona uma maior flexibilidade, permitindo que a concentração de vários organismos.
Protocolo
1. Processo A ultrafiltração de fluxo tangencial de fibra oca
- Preparação de tampões e soluções:
Solução de eluição (1 L):
A 1 L de água de grau reagente adicionar 0,1 g polifosfato de sódio, 0,1 ml de Tween-80 e 0,01 ml Y-30 anti-espuma. - Prepare filtro de montagem (Figura 1) numa câmara de segurança biológica:
- Insira Masterflex I / P 73 tubos de laboratório através de uma cabeça de bomba Masterflex I / P Easy-carga conectada a uma unidade de brushless Masterflex I / P de precisão.
- Fixar o tubo a uma 0-60 psi manómetro, glicerina-cheia equipado com um ramo TNP conector em T a montante da cabeça da bomba com um grampo de parafuso, e para um HDPE conector em T a jusante da cabeça da bomba.
- Montar o frasco retido pela montagem de uma Nalgene 53-B tampa de enchimento / ventilação com tubo de laboratório Masterflex L / S 15 e um T-conector e prendendo-o a um Nalgene L 1 garrafa de polipropileno resistente.
- Coloque Masterflex L / S 24 tubos wom um grampo da pinça (braçadeira pitada 2) e conectá-lo a partir da garrafa retentado ao PEAD T-conector.
- Ligue o Masterflex L / S tubagem laboratório 24 do medidor de pressão para o Kasei Asahi Rexeed 25S de alto fluxo dialisador com um grampo de parafuso, e desde o dialisador para a garrafa retentado. Use adaptadores custom-made DIN projetados para acomodar ¼ tubulação ID "para conectar o tubo à ultrafiltro de fibra oca.
- Coloque Masterflex L / S tubo de laboratório 24 com uma braçadeira de aperto (braçadeira pitada 1) e conectá-lo a uma pipeta de plástico de 10 ml com o plug ponta e algodão removido para atuar como a linha de absorção da amostra e, em seguida, conectar o tubo de PEAD T- conector.
- Encaixar uma extremidade do tubo de laboratório Masterflex L/S-36 com uma rampa de braçadeira e ligar a tubagem para a porta efluente localizado perto da extremidade de saída do filtro. Coloque a outra extremidade no recipiente de resíduos.
- Adicionar 0,01% (w / v) de polifosfato de sódio para a amostra de água de 10 L e misturar durante 3 min.
- Feche braçadeira pitada 2e remover a tampa da abertura da garrafa retentado. Todos os outros grampos deve ser aberto.
- Definir a direcção da bomba para movimentar o fluido a partir do conector em T para o medidor de pressão (direita para a esquerda Figura seguinte 1). Ajustar a velocidade da bomba a 25% da velocidade máxima e ligar a bomba.
- Quando a garrafa retentado é 2/3 cheio, o grampo de aperto abertas 2 e substituir rapidamente a tampa da abertura para o frasco de retentado. Verifique todas as linhas e acessórios para garantir que não haja vazamentos.
- Lentamente, aumentar a velocidade da bomba para a taxa de filtração desejado (cerca de 1,5 L / min), a verificação de fugas. Usando um cilindro graduado e um medidor de temporizador ou de fluxo, verificar a taxa de filtrado da água que sai a partir da linha de efluente (azul L / S 36 tubagem na Figura 1). As bolhas de ar podem tipicamente formar na extremidade de saída do filtro o que torna difícil alcançar uma pressão estável e taxa de filtração. Isto é corrigido por beliscar a linha de efluentes à mão por um momento. Essa açãogeralmente coaxial a bolha de ar para a porta filtrado e para sair através da linha de efluente. Repita sempre que necessário, tendo em mente que as bolhas de ar de tamanho de ervilha muitas vezes são inevitáveis.
- Monitorizar o processo de filtração. Medir e registar a pressão ea velocidade de filtração, conforme necessário. A pressão nunca deve exceder 20 psi. Recomenda-se que a taxa de filtração não deve exceder 2,0 L / min. É importante que o volume de água na garrafa retentado ser monitorizada para assegurar que nunca se esvazia. É normal para o volume para aumentar ou diminuir ligeiramente. Se o volume de água na garrafa retido cai abaixo de 1/3 cheio, em seguida, remover a tampa da abertura e pitada perto braçadeira 2 na linha de garrafa retentado. Trazer de volta o volume para cerca de 2/3 cheio, abra o grampo e substituir rapidamente a tampa da abertura, garantindo uma perfeita vedação. Se o volume da garrafa retentado cai rapidamente e de forma contínua, em seguida, garantir a tampa do frasco é apertado e retentado a tampa da abertura é segura no lugar, e que a tubing ainda está em contacto com a amostra de água. Se estes problemas não estão a ocorrer, então é provável que a vedação na tampa do frasco retentado é má e deve ser substituído.
- Quando o recipiente da amostra está vazio, o grampo de aperto imediatamente perto 1, reduzir a velocidade da bomba a 20% do seu máximo, remover a tampa da abertura da garrafa retentado e fechar a braçadeira de rampa.
- Ajustar o volume da amostra no frasco de retentado para aproximadamente 200 ml por apertar ou desapertar a braçadeira de rampa. Após o volume é de cerca de 200 ml, apertar a braçadeira de rampa para os passos de eluição (1,11-1,12).
- Adicionar 500 ml de solução de eluição para o recipiente da amostra e lavagem do interior do recipiente. Coloque a 10 ml pipeta ligada à linha de absorção da amostra para o recipiente que contém a solução de eluição. Assegure-se que a braçadeira de rampa é fechada. Pitada aberto apertar 1 e pitada perto Clamp 2 momentaneamente para elaborar a solução de eluição.
- Depois que o de 500 ml de solução de eluição é elaborado, Perto beliscar braçadeira 1 e pinça de aperto aberto 2. Permitir que a solução de eluição para circular durante 5 minutos com uma velocidade da bomba de 20% do seu máximo.
- Ajustar o volume da amostra no frasco de retentado a cerca de 100 ml por apertar ou desapertar a braçadeira de rampa na linha de efluente. Apertar a braçadeira de rampa e permitir que a amostra a circular durante 1 minuto. Evitar a puxar ar para dentro do tubo, assegurando o volume da amostra no frasco de retentado é suficientemente elevada para cobrir a relação L / S 15 tubagem de entrar na garrafa retentado.
- Inverter o sentido da bomba que obriga a amostra no frasco de retentado. Permitir que a bomba para executar em sentido inverso durante 20 segundos, resultando em um total de ~ 225 ml na garrafa retentado. Desligue a bomba.
- Retire o Masterflex I / P 73 tubos da cabeça da bomba e desligue o medidor de pressão. Desligue o Masterflex L / S 24 tubos de sair do ultrafiltro de fibra oca. Segurar o tubo acima da garrafa retentado para forçar qualquer amostra restante noretentado garrafa.
- Desconecte todos os tubos do frasco e coloque a tampa de ventilação com uma tampa não-ventilação.
- Continuar o procedimento IMS / IFA com o retentado ~ 225 ml.
2. Processo de Separação imunomagnética
- Preparação de tampões e soluções:
- Permita que os buffers incluídas nas Dynabeads: Cryptosporidium / Giardia kit de combinação para atingir a temperatura ambiente.
- 1X SL-tampão A: Adicione 1 ml de 10X tampão de SL-A 9 ml de água ao grau de reagente.
- Transferir a ~ 225 ml de líquido a partir da garrafa retentado para um 250 ml rotulados tubo de centrífuga cónico. Lavar o frasco retentado duas vezes com 10 ml de água reagente, e adicionar as lavagens ao tubo de centrífuga cónico. Centrifugar a suspensão a 1500 xg durante 15 min a 4 ° C sem travagem.
- Aspirar cuidadosamente o sobrenadante a partir da interface ar-água a 5 ml acima da pelete embalado para cada 0,5 ml de volume de sedimento (aspirado isto é, para 15 ml acima um volume de sedimento de 1,3 ml, e aspirado para 5 ml de uma pelota de 0,5 ml ou menos).
- Exaustivamente ressuspender o sedimento para o sobrenadante por centrifugação e / ou pipeta de mistura. Transferir cada volume de 5 ml do líquido para o apartamento lados L10 tubo Dynal contendo 1 ml cada de tampão 10X SL-A e 10X SL-tampão B. Lavar o tubo de centrífuga cónico duas vezes com 2,5 ml de água e adicionar o reagente de lavagem ao o tubo de L10, elevando o volume total no ml L10 tubo para 12, incluindo os buffers.
- Adicionar 100 ul cada um dos bem misturados ressuspensos Dynabeads anti-Cryptosporidium e anti-Giardia ao tubo de L10. Girar o tubo L10 a 18 rpm durante 1 hora à temperatura ambiente em um misturador rotor.
- Coloque o lado plano do tubo de L10 contra o magneto MPC-6 e rocha suavemente a mão do tubo de ponta a ponta, 180 °, durante 2 minutos.
- Mantendo o tubo L10 no magneto MPC-6 com o lado magneto-se, decantar o sobrenadante para longe do grânulo / (oo) cisto complexos Bound ao ímã. Remover o tubo L10 do íman e adicionar 0,5 ml de SL-1X tampão A para o tubo. Transferir a suspensão usando duas lavagens adicionais de 0,5 ml de SL-1X tampão A para um tubo de microcentrífuga de 1,5 ml realizada na MPC-S com o íman na posição vertical.
- Agite suavemente o tubo no MPC-S ° ímã 180 para 1 minuto. Com o magneto no lugar, aspirar o sobrenadante com uma pipeta de Pasteur dirigida para a parte inferior do tubo de microcentrífuga.
- Adicionar 1 ml de PBS 1X para o lado frontal do tubo de microcentrifugação, remover o magneto e agitar suavemente o tubo apenas até que as esferas são ressuspensas. Substituir o ímã na posição vertical e agite o tubo de 180 ° por 1 minuto. Aspirar o PBS enxaguar, sem perturbar o sedimento do grânulo, usando uma pipeta de Pasteur para remover detritos como tanto quanto possível.
- Remover o íman e adicionar 50 uL de água reagente para o lado de trás do tubo de microcentrífuga. Vórtice do tubo em plena velocidade durante 50 segundos,em seguida, o tubo de incubar a 80 ° C durante 10 minutos, seguido por um vórtice de 30 segundos. Substituir o íman na MPC-S na posição inclinada, ligando os grânulos para o íman e deixando os cistos (OO) no líquido. Aplicar a suspensão cisto (oo) para um slide SingleSpot bem.
- Repetir o passo 2,10, aplicando o líquido para o mesmo poço contendo a primeira dissociação. Corrediça lugar em um 37 ° C lâmina quente durante 1 hora para secar a suspensão ao poço da lâmina.
3. Coloração e Exame
- Preparação de tampões e soluções:
Solução de trabalho DAPI: Adicionar 25 ul de solução-mãe DAPI (2 mg / ml em metanol) a 25 ml de PBS 1X. Estoque da loja e soluções de trabalho entre 1 ° C e 10 ° C no escuro. - Aplicar 50 uL de metanol ao poço da lâmina e deixar secar à temperatura ambiente.
- Adicionar 50 ul da solução de DAPI de trabalho para o diapositivo poço e incubar durante 2 minutos à temperatura ambiente.
- Usar uma Kimwipe a pavio o DAPI do poço. Aplicar 50 uL de EasyStain. Incubar a 35 ° C durante 30 minutos.
- Wick a mancha do poço com uma Kimwipe, e então lentamente adicionar 300 uL de tampão frio de fixação EasyStain, permitindo que ela flua ao longo da borda bem. Incubar durante 2 minutos à temperatura ambiente.
- Use um Kimwipe a pavio o tampão do poço e aplicar 10 ul de EasyStain Meio de Montagem.
- Cuidadosamente aplicar uma lamela, removendo as bolhas que ocorrem. Selar a lamínula com unhas polonês claro.
- Digitalizar todo o slide usando o filtro FITC, com ampliação de 200X total, para ovóides ou esféricas maçã verde-fluorescentes objetos que se assemelham a um oocisto ou cisto. Examine todos os objetos com o filtro DAPI a ampliação total 1000X e depois com DIC, também a ampliação total 1000X. Anote o tamanho utilizando um micrômetro ocular calibrada e características morfológicas.
- Resultados de documentos.
Nota: informações adicionaismação sobre o procedimento original pode ser encontrada em Dezembro de 2005 versão do método EPA 1623 12. O procedimento de ultrafiltração de fluxo tangencial de fibra oca de descrita é usado no lugar da secção de EPA 12,0 Método 1623. A dissociação calor modifica Seção 13.3.3 do método EPA 1623. O procedimento também descreve uma PBS adicional enxaguar durante o processo de IMS, que pode ser inserido em Dezembro de 2005 versão do Método 1623 após a secção 13.3.2.16. A lista completa de consumíveis, reagentes e equipamentos utilizados para o método EPA 1623 incluindo essas modificações está listado na lista de equipamentos.
4. Os resultados representativos
Oocistos de Cryptosporidium e cistos de Giardia recuperados através dos processos de filtração e separação imunomagnética são detectados por análise microscópica. No 200X total, cada organismo exibindo um padrão de coloração típica, o tamanho ea forma como mostrado na Figura 2 deverá continuar a ser observada por meio imersão em óleo e ampliação total 1000X. Isto irá permitir a medição e identificação de características que definem quer típicos ou características atípicas que excluiria a identificação positiva. Cryptosporidium é um ovóide a objecto esférico 4 a 6 m de diâmetro, que apresenta uma brilhante verde-maçã fluorescência FITC com arestas vivas destacadas (Figura 3A ). Com DAPI UV, um oocisto irá apresentar uma das seguintes categorias: característica típica de coloração azul claro interna com um aro de verde e não núcleos distinta (DAPI negativo), a coloração azul intenso interno, ou até quatro distinta, os núcleos céu azul-(DAPI positivos - Figura 3B). Características atípicas incluem desvios na estrutura, cor ou fluorescência DAPI (por exemplo, muitos núcleos corados, vermelho fluorescente estruturas internas). Se o objeto fluorescente tiver cumprido os critérios para FITC típico e coloração DAPI, ela é examinada através de con interferência diferencialcontraste (DIC). O objecto é examinada para atípicos externas ou internas características morfológicas, tais como ornamentação da parede celular, ou um ou dois núcleos grandes de enchimento da célula. Se as estruturas atípicos não são observados, o objecto é gravado na contagem total de IFA e classificados como uma estrutura amorfa ou vazia com um a quatro esporozoítos presentes (Figura 3C). Da mesma forma, Giardia, como os objetos são examinados com relação ao FITC e coloração DAPI, bem como características DIC, como axonemes, órgãos mediana, e núcleos de cistos de Giardia são redondos a ovóides objetos brilhantes verde-maçã, 8 -. De 18 mM de comprimento por 5 - 15 mm de largura, com arestas vivas destacadas (Figura 3D). Com DAPI UV, o cisto Giardia exibirão DAPI-negativa de coloração, ou DAPI-positivos características (Figura 3E). O objecto fluorescente é examinado por DIC para as características típicas e atípicas da mesma maneira como descrito para Cryptosporidium.Se características atípicas não são observados, o objecto é gravado na contagem total de IFA e classificados como estrutura contendo vazio amorfo, ou com um ou mais tipo de estruturas internas presentes (Figura 3F).
Qualquer organismo que se observa características atípicas não deve ser contado como um cisto (oo). A análise microscópica das amostras ambientais pode ser um desafio como existem organismos que podem auto-fluorescem ou reagem de forma cruzada com o conjugado com FITC anti-Cryptosporidium e / ou anti-anticorpos Giardia 1. Recomenda-se que um analista estar familiarizado com os micróbios aquáticos e dezenas de revisão de lâminas para ganhar experiência identificação Cryptosporidium e Giardia. Pelo menos três (oo) cistos no slide positivo coloração de controle deve ser caracterizado antes de cada sessão no microscópio.
Amostras de controle de qualidade pode ser enriquecida com (oo) cistos para determinar o rec por centoOvery para cada protozoário utilizando o cálculo:
(Oo) Porcentagem de Recuperação cisto = ((Conde Amostra QC - Contagem da Amostra Unspiked) / Spike) x 100.
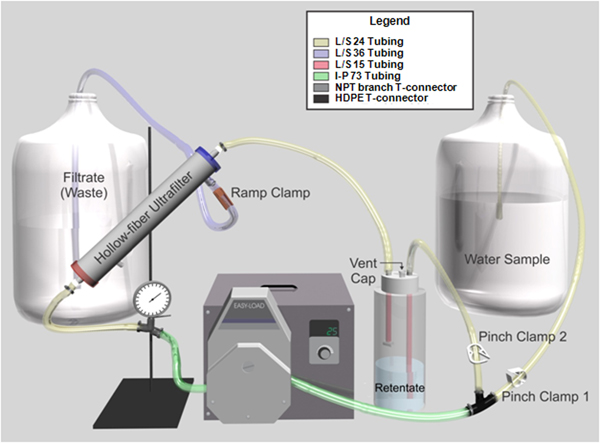
Figura 1. Representação gráfica da tangencial sistema de ultrafiltração de fluxo de fibra oca de. O tubo é código de cores para auxiliar é a montagem do sistema.
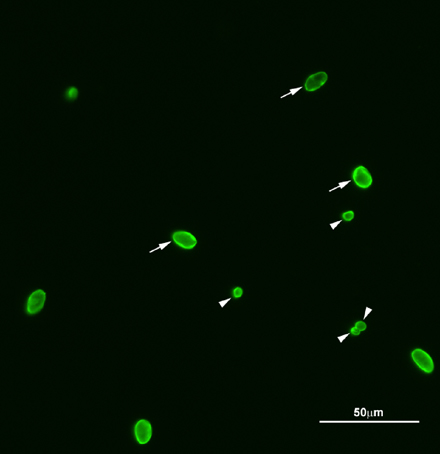
Oocistos Figura 2. Representante imagem da fluorescência de cistos (oo) Cryptosporidium e Giardia. Cryptosporidium e cistos de Giardia foram corados com FITC anti-Cryptosporidium / Giardia anticorpos. Setas, Giardia cistos; pontas de flechas, oocistos de Cryptosporidium. Um total de quatro oocistos de Cryptosporidium e seis cistos de Giardia foram encontrados no plano do foco. Amostras observed sob 200X.

Figura 3. Representante imagens microscópicas de oocistos de Cryptosporidium e cistos Giaridia utilizados para a caracterização oocistos de Cryptosporidium (A - C).. Brilhante verde-maçã fluorescência FITC de objectos esféricos 4 a 6 m de diâmetro com arestas vivas destacadas (A) contendo até quatro distinta, os núcleos DAPI céu-azul (B) e de uma a quatro esporozoítos (s) por oocistos (C). cistos de Giardia (D - F). Brilhante verde-maçã FITC de fluorescência de volta para objectos ovóides 8 - 18 uM de comprimento por 5 - 15 mM de largura, com arestas vivas destacadas (D), contendo até quatro núcleos DAPI céu azul-(E) e com um ou mais de estrutura interna discernível tais como núcleos (N), o corpo de mediana (M) e ou axonemes (A) (F). As setas brancas, brilhantes Fluorescência verde maçã oocistos de Cryptosporidium e cistos de coloração Giardia walls; setas brancas, DAPI núcleos positivos. As amostras observadas sob aumento de 1000x.
Discussão
Ultrafiltração de fluxo tangencial de fibra oca de é uma técnica alternativa e eficaz para a concentração inicial de oocistos de Cryptosporidium e de cistos de Giardia de água. De fibra oca de ultrafiltração é menos dispendioso do que os filtros tradicionais. Uma vez que tem a capacidade de concentrar oocistos de Cryptosporidium e de cistos de Giardia a partir de uma variedade de matrizes de água diferentes, é uma alternativa útil para as técnicas de filtração de corrente utilizados para o método EPA 1623. Tal como acontece com a maioria dos métodos de filtração outros, de fibra oca de ultrafiltração é propenso a incrustação com amostras extremamente turvos. Pressão de água de alta que resultaria da incrustação de filtro;, por conseguinte, é recomendado para monitorizar a pressão durante a execução de filtração. Além oocistos de Cryptosporidium e de cistos de Giardia, de fibra oca de ultrafiltração foi mostrado para ser capaz de se concentrar bactérias e vírus 1-3,5,8. De fibra oca de ultrafiltração outlined neste método pode ser utilizado para concentrar organismos múltiplos numa única amostra. É digno de nota que a obtenção de um volume final entre 200 e 250 ml é o passo crítico final no processo de concentração, de forma que os passos de centrifugação extra, que pode resultar em (oo) perda do cisto, são evitados (passo 2.2). No entanto, permitindo que o volume da garrafa para deixar cair demasiado baixo pode ter efeitos nefastos sobre as recuperações desde que não haverá volume de líquido suficiente para obrigar todos os oocistos ou cistos dentro da garrafa retentado. Portanto, recomenda-se a manter um volume final entre 200 e 250 ml.
O calor de dissociação é uma alternativa ao passo de dissociação de ácido no Método 1623. Esta etapa alternativa tem sido mostrado para melhorar a recuperação de oocistos de Cryptosporidium e reduzir a variação do método, quando isolado a partir de qualquer rio ou água reagente 9. Uma comparação lado-a-lado de ácido e os métodos de calor de dissociação demonstrado que o uso de calor para dissociaçãote os organismos a partir das esferas imunomagnéticas produzido mais elevadas recuperações médios para ambos Cryptosporidium e Giardia. Além disso, a precisão de recuperações de Cryptosporidium e Giardia foi melhor nas amostras processadas com calor dissociação em comparação com o ácido 9 dissociação.
A incorporação de HFUF como o passo de concentração permite mais flexibilidade, proporcionando a capacidade de concentrar vários organismos. Além disso, é uma alternativa menos dispendiosa aos actuais Método 1623 opções de filtragem.
Divulgações
Os Estados Unidos Agência de Proteção Ambiental através de seu Escritório de Pesquisa e Desenvolvimento, em colaboração com o Escritório das águas subterrâneas e do Centro de Água Potável de Suporte Técnico da financiou a pesquisa aqui descrita. Todo o trabalho foi apoiado no local da EPA dos EUA, Cincinnati, Ohio. Embora as informações descritas neste artigo tenha sido financiado integralmente ou em parte, pela Agência de Proteção Ambiental dos Estados Unidos sob contrato (Contrato EP-C-06-031) para Shaw Ambiental e Infra-estrutura, Inc, que não refletem necessariamente a posição do Agência e nenhum endosso oficial deve ser inferida. Tem sido submetido a análise Agência e aprovado para publicação.
Agradecimentos
Gostaríamos de agradecer a Ann Grimm e Michael Zimmerman para revisão crítica deste manuscrito e Doug Hamilton para o seu suporte técnico.
Materiais
| Name | Company | Catalog Number | Comments |
| Equipamentos / Reagente | Vendedor | Catalogo | |
| Asahi Kasei Rexeed 25 S / R molhadas de fibra oca ultrafiltros | Disque Medical | REXEED25S / R | |
| I / P 73 (Masterflex R-3603), ou equivalente | Cole Parmer | EW-06408-73 | |
| L / S 24 (Masterflex Platinum cured), ou equivalente | Cole Parmer | EW-96410-24 | |
| L / S 15 (Masterflex Platinum cured), ou equivalente | Cole Parmer | EW-96410-15 | |
| L / S 36 (Masterflex Platinum cured), ou equivalente | Cole Parmer | EW-96410-36 | |
| I / P Unidade Brushless Precision | Cole Parmer | EW-77410-10 | |
| I / P Cabeça da bomba de carga fácil | Cole Parmer | EW-77601-10 | |
| T preto PEAD, 1/4 "x 3/8" x 3/8 " | EUA Plásticos | 62064 | |
| Masterflex T-conector L / S 15-25 | Cole Parmer | EG-30.613-12 | |
| Nalgene pesado pp garrafa L 1 | Cole Parmer | EW-06257-10 | |
| 10 pipetas ml | Fisher Scientific | 13-678-11C | |
| Nalgene enchimento / descarga de tampa para 1/4 tubos ", 53B | Cole Parmer | EW-06258-10 | |
| Manômetro | Cole Parmer | Um-680-46-10 | |
| Acoplamento Direto, NPT (F), 1/4 " | Cole Parmer | EW-06469-18 | |
| NPT tee ramo, natural pp | Cole Parmer | A-30610-75 | |
| Grampos do Pinch, 1/2 " | Cole Parmer | EW-06833-00 | |
| CuStom ajuste DIN adaptadores | Moldado Produtos Corp | MPC-855NS.250 | |
| Posição Anel | Fisher Scientific | 14-670B | |
| Suporte grampos Anel | Fisher Scientific | 05-769-6Q | |
| Keck rampa grampo, 14mm | Cole Parmer | EW-06835-10 | |
| Polifosfato de sódio | Sigma Aldrich | 305553 | |
| Tiossulfato de sódio penta-hidratado | Sigma Aldrich | 72050 | |
| Antifoam Y-30 emulsão | Sigma Aldrich | A5758 | |
| Tween-80 | Sigma Aldrich | P1754 | |
| 10 L cubitainer polietileno de alta densidade colapsável | VWR | IR314-0025 | |
| Centrifugar garrafeira | Fisher Scientific | 05-663-103 | |
| Cónico de 250 ml de tubos de centrifugação | Corning | 430776 | |
| Funil descartável | Cole Parmer | U-6122-10 | |
| Esguicho | Cole Parmer | U-06252-40 | |
| Centrifugar | Beckman Coulter | Allegra X-15R | |
| Rotor de caçamba móvel | Beckman Coulter | ARIES SX4750 | |
| Centrifugar adaptadores de caçamba para 250 tubos cônicos ml | Beckman Coulter | 349849 | |
| 200 mL de grosso calibre ponteiras | Fisher Scientific | 02-707-134 | |
| VacuShield Filtro | Gelman | 629-4402 | |
| 5 pipetas ml | Fisher Scientific | 13-678-11D | |
| Dynabeads: Cryptosporidium / Giardia combinação kit | EuDEXX | 73002 | |
| Cónico de 50 ml de tubos de centrifugação | Falcão | 352098 | |
| Dynal L10 planas tubos lados | IDEXX | 74003 | |
| Cronômetro | VWR | 23609-202 | |
| Dynal ímã MPC-6 | IDEXX | 12002D | |
| 1 pipetas ml | VWR | 53283-700 | |
| 1,5 ml tubos de microcentrífuga de baixa aderência | Fisher Scientific | 02-681-320 | |
| 1000 Pipetar e dicas de barreira correspondentes | Gilson | P1000/DF1000ST | |
| 100 Pipetar e dicas de barreira correspondentes | Gilson | P100/DF100ST | |
| 9 polegadas pipetas Pasteur | VWR | 14672-412 | |
| Dynal ímã MPC-S | IDEXX | 12020D | |
| Vórtice | VWR | 14216-188 | |
| Dynabeads misturador rotador | IDEXX | 94701 | |
| Bloco de calor | Fisher Scientific | 11-718-2 | |
| Armaduras Beads Lab | Lab Armadura | 42370-750 | |
| Termômetro digital | Fisher Scientific | 15-077-60 | |
| De tampão fosfato pH-1X salina 7,4 (PBS 1X) | Sigma | P4417 | |
| Único lâminas spot | IDEXX | 30201 | |
| Tampa de vidro | Corning | 287018 | |
| EasyStain kit direto | BTF | - | |
| 10 Pipetar e dicas de barreira correspondentes | Gilson | P10 & DF10ST | |
| 4 ', 6'-Diamidino-2-fenil-indol, dicloridrato (DAPI) | Sigma | D9542 | |
| Limpar unha polonês | Fisher Scientific | S30697 | |
| Metanol | Fisher Scientific | L6815 | |
| Kimwipes | Kimberly Clark | 34155 | |
| Incubadora | Boekel Científico | 133000 | |
| deslizar mais quente | Fisher Scientific | 11-474-521 | |
| Óleo de imersão, tipo A ND = 1,515 | Nikon | MXA20234 | |
| Nikon 90i microscópio com capacidade de DIC | Nikon | MBA 77000 | |
| Plano APO objetivo óleo 100X | Nikon | MRD01901 | |
| Planeje Achro 20X | Nikon | MRL00202 | |
| FITC filtro | Nikon | 96302 | |
| DAPI filtro | Nikon | 96301 | |
| X-citar iluminador de fluorescência | Nikon | 87540 | |
| Papel da lente | Nikon | 76997 | |
| Saco descartável Biohazard | Fisher Scientific | 01-829D | |
| Biohazard recipiente para objectos cortantes | Fisher Scientific | 14-827-117 | |
| Peróxido de hidrogénio a 3% | VWR | BDH3540-2 | |
| Alvejante | Fisher Scientific | 1952030 | |
| Wypall | Kimberly Clark | 34790 |
Referências
- DiGiorgio, C. L., Gonzalez, D. A., Huitt, C. C. Cryptosporidium and Giardia recoveries in natural waters by using Environmental Protection Agency Method 1623. Appl. Environ. Microbiol. 68, 5952(2002).
- Hill, V. R., Kahler, A. M., Jothikumar, N., Johnson, T. B., Hahn, D., Cromeans, T. L. Multistate evaluation of an ultrafiltration-based procedure for simultaneous recovery of enteric microbes in 100-liter tap water samples. Appl. Environ. Microbiol. 73, 4218-4225 (2007).
- Hill, V. R., Polaczyk, A. L., Hahn, D., Narayanan, J., Cromeans, T. L., Roberts, J. M., Amburgey, J. E. Development of a rapid method for simultaneous recovery of diverse microbes in drinking water by ultrafiltration with sodium polyphosphate and surfactants. Appl. Environ. Microbiol. 71, 6878-6884 (2005).
- Hill, V. R., Polaczyk, A. L., Kahler, A. M., Cromeans, T. L., Hahn, D., Amburgey, J. E. Comparison of hollow-fiber ultrafiltration to the USEPA VIRADEL technique and USEPA method 1623. J. Environ. Qual. 38, 822-825 (2009).
- Holowecky, P. M., James, R. R., Lorch, D. P., Straka, S. E., Lindquist, H. D. Evaluation of ultrafiltration cartridges for a water sampling apparatus. J. Appl. Microbiol. 106, 738-7347 (2009).
- Lindquist, H. D., Harris, S., Lucas, S., Hartzel, M., Riner, D., Rochele, P., Deleon, R. Using ultrafiltration to concentrate and detect Bacillus anthracis, Bacillus atrophaeus subspecies globigii, and Cryptosporidium parvum in 100-liter water samples. J. Microbiol. Methods. 70, 484-492 (2007).
- Polaczyk, A. L., Roberts, J. M., Hill, V. R. Evaluation of 1MDS electropositive microfilters for simultaneous recovery of multiple microbe classes from tap water. J. Microbiol. Methods. 68, 260-266 (2007).
- Rhodes, E. R., Hamilton, D. W., See, M. J., Wymer, L. Evaluation of hollow-fiber ultrafiltration primary concentration of pathogens and secondary concentration of viruses from. 176, 38-45 (2011).
- Shaw, N. J., Villegas, L. F., Eldred, B. J., Gaynor, D. H., Warden, P. S., Pepich, B. V. Modification to EPA Method 1623 to address a unique seasonal matrix effect encountered in some U.S. source waters. J. Microbiol. Methods. 75, 445-448 (2008).
- Simmons, O. D. 3rd, Sobsey, M. D., Heaney, C. D., Schaefer, F. W. 3rd, Francy, D. S. Concentration and detection of Cryptosporidium oocysts in surface water samples by method 1622 using ultrafiltration and capsule filtration. Appl. Environ. Microbiol. 67, 1123-1127 (2001).
- Sobsey, M. D., Glass, J. S. Influence of water quality on enteric virus concentration by microporous filter methods. Appl. Environ. Microbiol. 47, 956-9560 (1984).
- USEPA. Method 1623: Cryptosporidium and Giardia in Water by Filtration/IMS/FA. Office of Water. 815-R-05-002, EPA. (2005).
- Ware, M. W., Wymer, L., Lindquist, H. D., Schaefer, F. W. 3rd Evaluation of an alternative IMS dissociation procedure for use with Method 1622: detection of Cryptosporidium in water. J. Microbiol. Methods. 55, 575-583 (2003).
- Zuckerman, U., Tzipori, S. Portable continuous flow centrifugation and method 1623 for monitoring of waterborne protozoa from large volumes of various water matrices. J. Appl. Microbiol. 100, 1220-1227 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados