Method Article
Dos registros electrofisiológicos de sinápticamente respuestas evocadas neuronal y astroglial en agudas rodajas de hipocampo
En este artículo
Resumen
La preparación de cortes de cerebro de agudos de hipocampo aislado, así como los registros simultáneos electrofisiológicas de los astrocitos y las neuronas en Estrato radiado Durante la estimulación de Schaffer colaterales se describe. El aislamiento farmacológico de potasio astroglial y corrientes transportador de glutamato se demuestra.
Resumen
Los astrocitos forman junto con las sinapsis neuronas tripartitos, donde se integran y modulan la actividad neuronal. De hecho, los astrocitos detectar entradas neuronales a través de la activación de los canales iónicos y receptores de neurotransmisores y procesar información, en parte, a través de la actividad dependiente de la liberación de gliotransmitters. Además, los astrocitos constituyen el sistema de captación principal para el glutamato, contribuir a tamponamiento espacial de potasio, así como el aclaramiento de GABA. Estas células tanto, un seguimiento constante de la actividad sináptica y, por lo tanto, son indicadores sensibles de las alteraciones en el glutamato sinápticamente-lanzado, los niveles de GABA y potasio extracelular. Además, las alteraciones en la actividad de captación astroglial o capacidad tampón puede tener efectos graves en las funciones neuronales, y podría pasar por alto la hora de caracterizar situaciones fisiopatológicas o ratones knock-out. Grabación Dual de actividad neuronal y astroglial tanto, es un método importante para estudiar las alteraciones enla fuerza sináptica asociada a los cambios concomitantes en la absorción y la capacidad de tamponamiento astroglial. Aquí se describe cómo preparar cortes de hipocampo, la forma de identificar estrato astrocitos radiatum, y cómo registrar las respuestas electrofisiológicas simultáneamente neuronal y astroglial. Por otra parte, se describe cómo aislar las corrientes farmacológicamente sinápticamente evocados astroglial.
Protocolo
1. Preparación del líquido cefalorraquídeo artificial y la solución intracelular
- Antes de iniciar el experimento, se necesita para preparar la solución interna para las grabaciones de patch clamp, así como el líquido cefalorraquídeo artificial (ACSF) para la preparación hipocampo. Usted, además, necesitará un kit de disección quirúrgica que consiste en tijera y fina tijera iris, dos espátulas y pinzas (herramientas de Bellas ciencia), un dispositivo de gasificación de vidrio (micro-filtro de vela, ROBU Alemania) y la rejilla de tejido (mosquitero o nylon apretado), así como superglue (Dent Uhu). La configuración de la configuración de parche electrofisiología rebanada fue descrito por Finkel y Bookman, 2001 1.
- Para la solución interna, disolver (en mM): 105 K-gluconato, 30 KCl, 10 HEPES y EGTA 0,3 en agua desionizada (en el 70-80% del volumen final). Enfriar la solución a 4 ° C y se añade (en mM): 4 ATP-Mg, 0,3 GTP-Tris y fosfocreatina 10. Ajustar el pH a 7,4 con KOH y u rellenop con agua desionizada hasta el volumen final. (Osmolaritiy: ~ 280 mOsm). Filtrar esta solución (tamaño de poro de 0,2 micras). Alícuotas solución es estable durante 3-4 semanas a - 20 ° C. Por un día experimental, ~ 1 ml de solución interna que se necesita.
- A menos que se indique lo contrario, la ACSF utilizado para la preparación hipocampo y grabaciones de células en la región CA1, contiene (en mM): 119 NaCl, KCl 2,5, 2,5 CaCl 2, 1,3 MgSO 4, 1 NaH 2 PO 4, 26,2 NaHCO 3 y 11 glucosa. Disolver estas sales en agua desionizada (~ Osmolaridad 320 mOsm) y solución de este compuesto oxigenado durante al menos 10 min (pH ~ 7,3 a 7,4) con carbógeno (95% O 2 y 5% de CO 2). Preparar al menos 1 litro de solución por cada experimento. En particular debe ser tomado para la preparación de tejido de hipocampo que se utilizará para llevar a cabo experimentos en la región CA3 del hipocampo. En efecto, esta región es propensa a la actividad epileptiforme y la muerte neuronal posterior. Así SYNAPTactividad IC debe ser fuertemente reducido durante la preparación rebanada, y esto se logra mediante la realización de la disección hipocampo en helado de solución de sacarosa que contenía (en mM): 87 NaCl, 2,5 KCl, 0,5 CaCl 2, 7 MgCl 2, 1 NaH 2 PO 4 , 25 NaHCO 3, 10 glucosa y sacarosa 75. En esta solución, la combinación de bajo contenido de sodio, de calcio y altas concentraciones de magnesio reducir masivamente cocción presináptica y la probabilidad de liberación, así como la actividad postsináptica del receptor de NMDA, minimizando así la actividad espontánea y la muerte celular. Una vez preparadas, las rebanadas de hipocampo utilizados para las grabaciones de las células de la región CA3 son perfundidos con ACSF modificado, que contiene 4 mM CaCl 2 y 4 MgSO 4, para minimizar la actividad polisináptico.
2. Preparación aguda corte del hipocampo
- Enfriar ~ 300 ml de ACSF para la cámara de corte, así como la preparación, a 4 ° C, mientras que constantemente oxigenar concarbógeno. Preparar un vaso de precipitados pequeño con ACSF a temperatura ambiente (RT) para el almacenamiento de rebanada, que también se oxigenada con carbógeno (Figura Esquema 1).
- Se anestesia el ratón bajo una campana con una toalla de papel empapada con isoflurano pequeño de 1 ml que se añade en la jaula.
- Después de que el ratón esté profundamente anestesiado, le cortaron la cabeza y agrégalo directamente en un plato pequeño con helado de ACSF oxigenada. Eliminar el cuero cabelludo con una tijera pequeña y transferir la cabeza sobre el tejido para las etapas siguientes. Iniciar para diseccionar el hipocampo, como se ilustra y describe en la figura 1.
- Cortar 300-400 micras transversales rodajas gruesas a baja velocidad (3 m / seg) y la frecuencia de vibración de 70 Hz en el frío hielo oxigenada ACSF y transferirlos a una cámara de almacenamiento. Dejar reposar a temperatura ambiente rebanadas durante al menos 1 hora antes de la grabación. De segmentos para los experimentos CA3 se almacenan 25 min a 34 ° C y al menos 30 min a TA, para recuperarse del proceso de corte.
3. Grabación Dual de astroglial evocó corrientes y potenciales neuronales de campo
Se describen cómo grabar sinápticamente respuestas evocadas neuronal y astroglial es decir, las respuestas inducidas por la activación de las sinapsis a través de la estimulación aferencia usando un electrodo extracelular.
- Constantemente perfundir la cámara de registro con ACSF oxigenada (1.5-2 ml / min, RT), que contiene 100 mM picrotoxina (GABA Un antagonista) para aislar respuestas excitadoras. Transferir una rebanada en una poli-L-lisina (1,5 a 3 mg / ml) cubreobjetos recubiertos, empapar el líquido para conseguir una adhesión buena rebanada y añadir una gota de ASCF en la parte superior de la rebanada. Colocar el cubreobjetos en la cámara de registro. El bloqueo de la transmisión inhibitoria por picrotoxina puede resultar en actividad epileptiforme, es decir espontánea, disparo sincrónico de poblaciones neuronales, que distorsiona la medición de los eventos evocados. Por lo tanto, para prevenir la actividad epileptiforme, hacer unacorte plano (sólo la superficie) entre las regiones CA1 y CA3 para prevenir la propagación a través de la colaterales Schaffer (como se indica en la Figura 2a).
- Estrato radiatum astrocitos pueden ser identificados por su tamaño soma pequeño (~ 10 m) y del proceso de montaje estrellado. Elija una célula al menos 20-30 micras por debajo de la superficie de loncha. Montar un electrodo de estimulación de vidrio (resistencia punta ~ 1 MW) en el alambre de plata que está conectado a la caja de aislamiento de estímulos y conectado a tierra para el baño (simplemente envolviendo el alambre de plata alrededor de la segunda pipeta de vidrio). Colocar el electrodo de estimulación en la región colateral Schaffer, como se indica en la Figura 2A, a una distancia de 200-300 m de distancia del astrocito elegido. Montar el electrodo de registro de campo (~ 2-5 mW) sobre un cable de plata clorada conectado a la headstage del amplificador. Ambos electrodos se llena antes con ACSF. Elija el modo en MultiClamp I = 0, que desactiva com externocomando de entrada y colocar el electrodo de ~ 50 m de distancia del astrocito en la región estrato radiado (Figura 2A). Registrar las respuestas con ganancia de 2 a 10 y con un filtro de 2 kHz del filtro de Bessel. Inyección de corriente eléctrica en el cerebro rebanada desencadena potenciales de acción en los axones colaterales que rodean Schaffer y la liberación posterior del transmisor en las terminales presinápticas que se proyectan hacia postsinápticos neuronas piramidales CA1. Los transmisores liberados provocará un flujo de carga positiva en las células a través de receptores ionotrópicos postsinápticos, que es mensurable extracelularmente como un potencial negativo pequeño. Este campo potencial postsináptico excitatorio (fEPSP) integra la actividad de un grupo de neuronas activas simultáneamente, mientras que la transmisión inhibidora se bloquea farmacológicamente. Aplicar algunos pulsos de prueba (0,1 mseg de duración) para evocar una fEPSP, algunos reposicionamiento del electrodo de estimulación podría ayudar a aumentar la fEPSP. Un típico CA1 estrato radiatum fEPSP se ilustra en la Figura 2B. Detalles adicionales sobre el posicionamiento y formas de onda de respuesta se puede encontrar en Yuan et al. 2003 2. La amplitud fEPSP en una rebanada hipocampo saludable por lo general debe ser más de dos veces mayor que la amplitud de la volea de fibra. Para la cuantificación exacta de la amplitud fEPSP o pendiente, la reponse evocada debería ser monosináptico, como actividad polisináptico (detectable como una respuesta multi-pico) indica la actividad sináptica independiente de la estimulación eléctrica, que podría ser una señal para hiperexcitabilidad. Para los experimentos realizados en la región CA3 del hipocampo, la estimulación y pipetas de registro se colocan como se ilustra en la Figura 3C. Para identificar claramente los insumos musgo de fibra, que son fuertemente facilitadores, dos a dos pulsos de estimulación (50 mseg intervalo entre impulsos) y 1 Hz de estimulación durante unos segundos se aplican para mejorar enormemente la amplitud inicialmente bajo evocado fEPSP responses.At finaldel experimento, DCGIV, un antagonista del receptor mGluR2 / 3, se puede lavar para verificar además que las entradas de fibras musgosas de hecho fueron estimuladas. La aplicación de este antagonista debe disminuir la fEPSP por ~ 90% debido a la alta expresión de mGluR2 / 3 receptores, inhibiendo la liberación presináptica de boutons fibras musgosas.
- Llenar una pipeta de parche (~ 2-5 mW) con solución filtrada interna y montarlo sobre un cable de plata clorada conectado a la headstage segundo, aplicar presión positiva con una jeringuilla, que está conectado mediante un tubo a su soporte de pipetas. Constantemente aplicar un pulso de 20 mseg de prueba de 10 mV y mover la pipeta en el tejido hasta llegar a la superficie de la célula y una flexión en la membrana se vuelve visible. El cero de la pipeta de desplazamiento, eliminar la presión positiva, y la abrazadera de la membrana a - 80 mV. Espere hasta que gigaseal (al menos 1 GΩ) se alcanza (no debería llevar más de unos segundos). Aplicación suave de una cierta presión negativa podría ayudar a alcanzar agigaseal. Romper en la célula se consigue mediante una aplicación breve de presión negativa o el uso de la función múltiple de zap en. Inicie la grabación simultánea de la garantía Schaffer evocado fEPSP y la respuesta astroglial en la abrazadera de tensión (Vhold - 80 mV, frecuencia 0,1 Hz ganancia, filtro de Bessel 2 kHz, 10). La respuesta actual astroglial es bifásica: en primer lugar, verá una rápida corriente transitoria de salida, lo que refleja fEPSPs adyacentes generados por las células piramidales. Esto es seguido por un lento aumento y la decadencia de corriente de entrada (segundos persisten varios (> 10 segundos) después de la terminación de las respuestas neuronales). Esta corriente se debe principalmente a la entrada de potasio en astrocitos, después de la liberación por circundante despolarizadas terminales postsinápticos. Una vez activado transportador de glutamato rápida corriente transitoria (GLT), desencadenada por la liberación de glutamato presináptico está enmascarada por la corriente de potasio. El potencial de mantenimiento de la astrocitos, así como la resistencia de acceso del parche debe ser monitored durante todo el experimento y no debe variar más de ~ 20%, para evitar el control incorrecto de reponses astrogliales debido a cambios en las condiciones de grabación. Astrocitos sólo con un potencial de retención inicial> -70 mV debe ser investigado para estudiar las células sanas.
- Cambie de voltaje a corriente-clamp con el fin de registrar la despolarización de membrana evocado los astrocitos. Aislar el transportador de glutamato glial (GLT) actual por perfusión del ácido glutamato ionotrópicos bloqueador del receptor de quinurénico (5 mM), hasta que el fEPSP está totalmente bloqueado y la amplitud GLT ha alcanzado una meseta. Para identificar claramente la LGT actual, aplicar el antagonista específico de DL-treo-β-Benzyloxyaspartatic ácido (DL-TBOA, 200 mM). Incrementar la fuerza estimulación por 2-veces a 5-veces para registrar las respuestas neuronales y astroglial en la fuerza sináptica diferente, y se aplican dos estímulos estrechamente espaciados (50 mseg intervalo) para investigar las respuestas a la estimulación de pulso pareado. Estabilidad de la serie resistencia y potencial de membrana de la célula glial debe ser supervisada durante la grabación.
- Para visualizar la extensión de la brecha de unión mediada redes astrogliales, acoplamiento de colorante experimentos deben realizarse en el modo de abrazadera de corriente, sin ninguna inyección de corriente, para permitir la difusión pasiva de baja tintes molecular (<1,5 kDa), tales como sulforhodamina-B, a través de los canales de salida brecha. Para minimizar el derrame colorante en el tejido circundante, la presión positiva se debe aplicar a través de la pipeta de parche sólo al entrar en el tejido y el parche debe ser alcanzado tan pronto como sea posible.
Resultados
Un representante grabación simultánea de sinápticamente respuestas evocadas astrogliales y neuronal (fEPSPs) en el área CA1 del hipocampo se muestra en la Figura 2 AB. La corriente evocada astroglial es bifásica, es decir, que se compone de una corriente transitoria hacia el exterior y hacia el interior una corriente lenta decadencia (> 10 seg) (Figura 2B). La corriente externa refleja la fEPSP evocado, y se bloquea después de la inhibición de los receptores ionotrópicos de glutamato por el ácido quinurénico (traza gris oscuro, Figura 2B) 3. La mayoría de la corriente de entrada lenta refleja la entrada de potasio en el astrocito despolarización postsináptica siguiente, puesto que también se suprimió por el ácido quinurénico, que inhibe glutamato ionotrópicos postsinápticos la actividad del receptor (Figura 2B y Figura 2C 1) 3-6, sabe que representan la principal fuente (80%) de la liberación de potasio 7. El restante rápido aumento de unad corriente de entrada en descomposición se inhibe por el antagonista GLT DL-TBOA (gris claro traza, la Figura 2B y Figura 2C 2). Post-hoc de la sustracción de la corriente restante lento en TBOA (gris claro traza) de la corriente en ácido quinurénico (traza gris oscuro) permite el aislamiento del transportador de glutamato astroglial puro actual (trazo negro), como se ilustra en la Figura 2C 2. La persistente corriente lenta descomposición en ácido quinurénico y TBOA (gris claro traza, la Figura 2B y Figura 2C 2) puede ser bloqueado por TTX (datos no mostrados), y refleja muy probablemente la acumulación de K + extracelular liberado durante la cocción presináptica aferente 3. Estimulación moderada único de Schaffer colaterales induce una corriente relativamente grande sinápticamente evocado astroglial en comparación con la despolarización evocada pequeño grabado en la misma célula (Figura 2D). Esto es debido a laresistencia de la membrana bajo de los astrocitos. Grabación de los evocados sinápticamente dinámica astrogliales potencial de membrana, como se ilustra en la Figura 2D, es una medida directa de los niveles extracelulares de potasio locales 8. La normalización de las respuestas evocadas astrogliales a la actividad neuronal subyacente permite la comparación directa de diferentes experimentos, como mostrado recientemente 6. Corrientes astrogliales, además, puede controlar de manera muy fiable alteraciones en la transmisión excitatoria, como la corriente total sinápticamente evocado astroglial sigue linealmente el aumento de la fEPSP (2E Figura). Corrientes astroglial también reflejan a corto plazo plasticidad sináptica, ya que muestran, como las neuronas, a la par de impulsos facilitación (Figura 2F). Emparejado de células enteras de grabación de una célula piramidal CA1 y astrocitos revelan un comportamiento electrofisiológico muy diferente en ambos tipos de células, ya que los potenciales de acción de neuronas de visualización en respuesta a un pulso despolarizante,mientras que el astrocito vecino es silenciosa (Figura 3A-B). Sin embargo, la estimulación moderada del Schaffer colaterales pueden evocar simultáneamente un rápido potencial excitatorio posynaptic en la célula piramidal CA1 y unas corrientes rápidas hacia el interior hacia el exterior y lento en el astrocito adyacente (Figura 3B 2). Grabaciones duales de sinápticamente respuestas evocadas neuronal y astroglial también se puede grabar en el área CA3 del hipocampo, como se muestra en la Figura 3C. De hecho, la estimulación única de CA3 fibras musgosas evoca en condiciones basales respuestas neuronales muy pequeños, registrado como fEPSPs locales, asociadas a pequeñas corrientes rápidas hacia el interior hacia el exterior y lento en astrocitos (Figura 3 D 1). En contraste, la estimulación de 1 Hz de CA3 fibras musgosas durante unos segundos fuertemente potencia la fEPSP, mientras que sólo aumenta moderadamente la respuesta astroglial (Figura 3D 2).
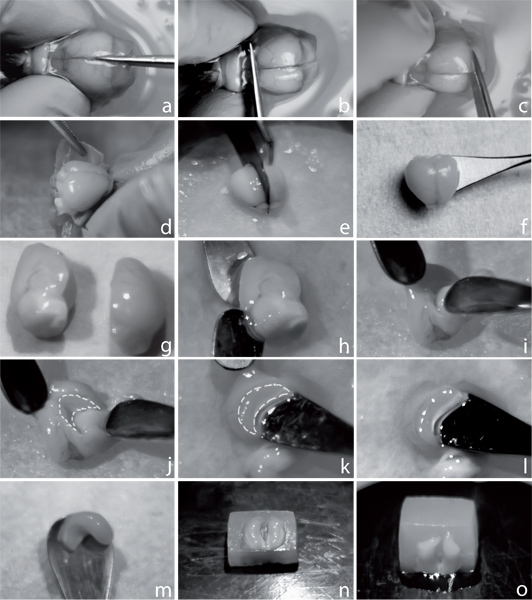
Figura 1. Hippocampus aislamiento para preparar cortes transversales. Para diseccionar el cerebro, cortar el cráneo a lo largo de la línea media (a). Hacer un corte en el plano coronal del bulbo olfatorio (b) y posteriormente a nivel del cerebelo (c). Retire con cuidado el cráneo con la ayuda de una pinza (d), separar los dos hemisferios con una cuchilla (e), y transferirlos en una cuchara pequeña en frío oxigenada ACSF (f). Después de la equilibración ~ 5 min, colocar un hemisferio en el tejido seco con la superficie medial hasta (g). Con la ayuda de dos cucharas eliminar el diencéfalo (hj). El hipocampo es ahora visible, como se ilustra por las líneas de puntos (k). Diseccionar el hipocampo con una cuchara a cabo, a partir de la fimbria, visible como estructura blanco (lm). Transferir el hipocampo de nuevo en la ACSF frío. Prepare un pequeño bloque de agarosa, la posición de los hipocampos dos con la cara hacia arriba y el alveus hippocamp ventralnos enfrenta el borde del bloque de agar, y empapar cuidadosamente todo el líquido lejos para permitir un buen agarre a la agar (n). Pegamento el hipocampo unido al bloque de agar sobre la parte ventral (o).
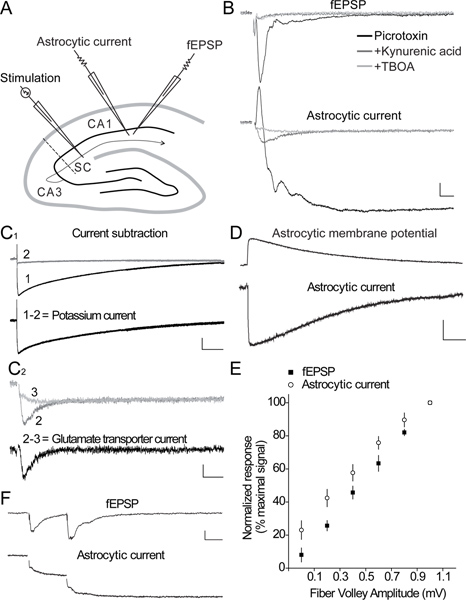
Figura 2. Simultáneas respuestas neuronales y astroglial evocados-sinápticamente en el área CA1 del hipocampo. A) Esquema de la cortes de hipocampo que ilustra la disposición del electrodo de estimulación, para activar el colaterales Schaffer (SC), el electrodo de parche pipeta, para registrar corrientes astrocíticos, y el electrodo extracelular, para grabar fEPSP, evocados por estimulación SC en el hipocampo área CA1. B) rastros representativos de grabaciones simultáneas de fEPSPs (panel superior) y las corrientes astrocíticos (panel inferior) evocada por estimulación sinápticamente-SC en la presence de los medicamentos farmacológicos. Las respuestas se registran primero en la presencia de un bloqueante de los receptores GABA A (picrotoxina, 100 mM, trazas negras) para aislar respuestas excitadoras. La aplicación posterior de un bloqueador de los receptores de glutamato ionotrópicos (ácido quinurénico, 5 mM, huellas oscuras grises), inhibe la fEPSP y la mayor parte de la corriente astroglial de larga duración, desenmascarando un componente transitorio pequeño y rápido de la respuesta actual astrocítico, que es sensible a un bloqueador de transportador de glutamato (TBOA, 200 mM, trazas de color gris claro). Barra de escala, fEPSP 0,1 mV, astrocytic actual 15 pA, 10 ms. C 1). Muestra traza de la corriente de potasio astroglial (1-2), que se puede aislar a partir de la respuesta evocada, que se muestra en B (panel inferior, negro traza), al restar el componente de corriente remanente en ácido quinurénico (2) de la corriente total ( 1). Barra de escala, 20 pA, 1 seg. C 2) La Muestra traza del transportador de glutamato actual (2-3), que se obtiene por sustracción de la i TBOAnsensitive componente lento (3) de la corriente en ácido quinurénico (2). Barra de escala, 2,5 pA, 25 mseg. D) los rastros de ejemplo de una corriente de entrada registrada en fijación de voltaje (panel inferior) y la despolarización de la membrana correspondiente registrado en corriente-clamp (panel superior) inducida en un astrocito por estimulación SC. Barra de escala, la corriente-clamp 1,5 mV, voltaje-clamp 5 pA, 1 seg. E) de entrada-salida curvas que ilustran la relación entre las descargas de fibra presináptica (entrada) y la corriente total astroglial (salida) grabar simultáneamente en respuesta a la estimulación SC (n = 6). Los aumentos astrogliales actuales linealmente con el aumento de descargas de fibra, como la fEPSP neuronal. F) trazas de ejemplo de la respuesta neuronal (fEPSP) y la corriente astrocytic se muestran para la estimulación de pulso pareado en un intervalo de 40 ms entre impulsos. Los sinápticamente evocados exposiciones actuales astrogliales, al igual que las neuronas, dos a dos pulsos de facilitación. Barra de escala, 0,1 mV, 5 pA, 20 ms.
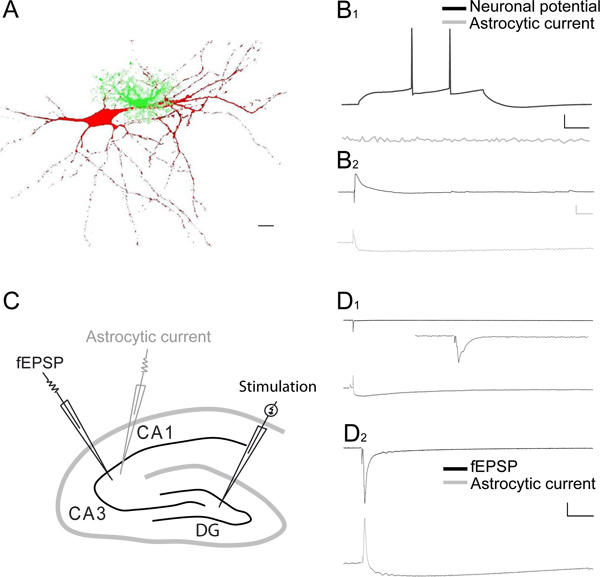
Figura 3. Grabaciones duales de sinápticamente respuestas inducidas neuronales y astroglial en las zonas CA1 y CA3 del hipocampo. A) Reconstrucción de una célula piramidal CA1 inyectado con sulforhodamina-B (rojo, 0,1%) y un astrocito lleno de fluoresceína dextrano (verde, 0,1%), utilizando el conjunto de células patch-clamp técnica. Barra de escala, a 10 m. B 1) restos representativos de simultáneas de células enteras grabaciones de potenciales de membrana registrados en current-clamp de una célula piramidal CA1 y un astrocito adyacente. El disparo neuronal potencial de acción (negro traza), evocados por inyección de un pA 20 despolarizante impulso de corriente, no evoca respuesta en el astrocito adyacente (gris traza). Barra de escala, 20 mV, 10 pA, 100 mseg. B 2) las huellas de muestra de dos células enteras grabaciones de una célula piramidal CA1 en corriente almejap y un astrocito vecino en fijación de voltaje después de la estimulación SC en presencia de picrotoxina (100 mM). Estimulación SC evoca un potencial postsináptico excitador (EPSP, negro traza), asociado a una corriente astrocytic pequeño y de larga duración-(gris traza). Barra de escala, 5 mV, 10 pA, 100 mseg. C) Esquema de la cortes de hipocampo que representa en el giro dentado (DG) y CA3 áreas la disposición del electrodo de estimulación, para activar las fibras musgosas, el electrodo de parche pipeta (gris), para registrar las corrientes astrocíticas, y el electrodo extracelular, a registro fEPSP, evocada por la estimulación de fibras musgosas CA3. D, E) rastros representativos de grabaciones pareadas del CA3 fEPSPs (paneles superiores, trazas negras en D 1 y D 2) y astrocíticos todo respuestas de las células (paneles inferiores, trazas de grises en D 1 y D 2) a la estimulación única de CA3 mossy fibras en 0,02 Hz (zoom en el recuadro) (D 1) o en una frecuencia de estimulación Hz (D 2). Barra de escala para D 1 y D-2, 0,2 mV, 15 pA, hora: D 1 1 seg; D 2 100 ms. Recuadro barra de escala, 0,1 mV, 100 ms.
Discusión
Grabación dual de sinápticamente indujo respuestas neuronales y gliales es un método útil para estudiar las alteraciones en línea en las actividades de pre-y postsinápticos asociados a cambios en las propiedades astrogliales. La despolarización evocada sinápticamente membrana glial es una medida directa del aumento de potasio extracelular 8, debido en parte a la cocción presináptica potencial de acción, pero sobre todo a la despolarización postsináptica 7. Por lo tanto grabaciones de gliales dinámica del potencial de membrana se puede utilizar para investigar modificaciones en la excitabilidad presináptico, actividad postsináptica, volumen de espacio extracelular y la capacidad de tamponamiento de potasio 6, 8. La corriente transportador de glutamato astroglial es una medida sensible de la liberación de glutamato presináptico, capaz de monitorear cambios a corto plazo en la probabilidad de liberación 3, 5, 9. Además, puede ser utilizado para caracterizar las sinapsis funcionales glia-interacciones en las sinapsis diferentes o en st desarrollo diferentemayores de 10 años. Se debe destacar que GLTs son altamente sensibles a la temperatura 11 y son accionados por el gradiente electroquímico de Na +, K + y H +12. Así, la amplitud y cinética de la corriente GLT depende altamente de las condiciones experimentales elegidas. Además, el curso de tiempo real de aclaramiento de glutamato astroglial derivada de la corriente GLT grabada se sabe que está parcialmente oculta. Esto se debe a que el filtrado de las corrientes de GLT por factores tales como las propiedades electrotonic de astrocitos o la liberación del transmisor asíncrono, que distorsionan sus cinéticas 13. Métodos de extracción de las características temporales de los mecanismos de filtrado se han desarrollado y se pueden utilizar para derivar la distancia real de glutamato curso temporal en situaciones fisiológicas o patológicas, como recenly realiza 6,13,14. Además, la grabación simultánea de la despolarización de la membrana astroglial, en la pinza de corriente, puede proporcionar INSIGhts a posibles alteraciones del potasio extracelular transitorios. Astrocitos individuales contacto de hasta 100.000 sinapsis de ~ 100 neuronas diferentes, y por lo tanto se integran y modular la actividad de redes neuronales locales.
Cuando se utiliza la técnica que aquí se presentan, es decir, registro electrofisiológico de células enteras respuestas de los astrocitos para obtener información sobre la actividad sináptica basal, hay que tener en cuenta que en los astrocitos, patch-clamp grabaciones a nivel soma permitir la detección de corrientes en su mayoría procedentes del soma celular o procesos proximales. De hecho, las corrientes detectadas en el soma sólo parcialmente se originan a partir de finos procesos distales cuando una fuerte activación de receptores y canales que ocurren en múltiples procesos finos puede generar corrientes se propagan hacia el soma celular. Así receptor basal y la actividad del canal en los procesos individuales de pequeños compartimentos que cubren astrogliales sinápticas es difícilmente detectable. Esto es debido en parte a la limitada semillaial de control y temporal de las corrientes y tensiones de la membrana de células enteras patch-clamp grabaciones de los astrocitos in situ. Sin embargo, hay que señalar que la superficie de los abundantes procesos astrocíticos diminutas excede con mucho el área de la membrana de los procesos de soma y principal. Además, estos microdominios astrogliales perisynaptic contienen los receptores funcionalmente relevantes y los canales, los cuales probablemente juegan un papel importante en la comunicación neuroglial y regulación sináptica. La técnica que se presenta aquí es por lo tanto sobre todo útil para estudiar la integración astrocytic de actividad sincrónica de conjuntos neuronales, que se producen en particular durante la estimulación aferencia. No debe ser utilizado para estudiar el diálogo entre las sinapsis individuales y adyacentes procesos astrocíticos finas que se producen durante la actividad espontánea basal. Un método alternativo para estudiar las respuestas locales astrogliales inducida por la actividad sináptica basal sería realizar patch-clamp grabaciones de procesos finos, como duno en dendritas 15. Aunque estos procesos astrogliales parches finos es probablemente un reto debido a su pequeño tamaño, es probable que sea una vía que debe seguirse para desentrañar diálogo más estrecho entre microdominios astrogliales y sinapsis individuales. Sin embargo, las probabilidades pequeñas respuestas electrofisiológicas astrogliales resultantes de los procesos individuales de astrogliales finas pueden estar por debajo del umbral de detección, ya que el ruido eléctrico alcanza en promedio 5.3 pA en patch-clamp grabaciones. Otro método para estudiar las respuestas astrogliales a la actividad sináptica es imagen de calcio, ya que la activación de receptores de membrana astrocíticos o transportadores de sustancias neuroactivas puede desencadenar los transitorios de calcio intracelular. Sin embargo, la carga masiva de los astrocitos con indicadores de calcio también puede reflejar principalmente la actividad somática 16. La combinación de imágenes de electrofisiología y calcio también permite detectar pequeñas señales de calcio a partir de los procesos de astrogliales finas, ya sea de forma espontánea o disparada by un mínimo de estimulación sináptica 17, 18. Sin embargo, hay que tener en cuenta que la alta afinidad indicadores calcio podrían actuar como amortiguadores de calcio, inhibidores de las vías de señalización importantes de calcio, mientras que la baja afinidad indicadores pueden trabajar por debajo del nivel de detección. Finalmente, una técnica elegante y no invasivo para estudiar eventos de calcio en finas procesos astrocíticos, que también evita el lavado de moléculas de señalización intracelular durante su conjunto de células patch-clamp, consiste en utilizar una membrana dirigida sensor de calcio, que puede expresarse en astrocitos in situ, así como in vivo 19. Sin embargo, imágenes de calcio sólo puede proporcionar información acerca de molécula de señalización uno, que está implicado en muchas, pero no todas las actividades celulares, mientras que su conjunto de células patch-clamp proporciona información cuantitativa acerca de todas las diferentes corrientes iónicas activadas en canal y activación del receptor. Por lo tanto, los registros electrofisiológicos simultáneas de neuronas y astrocitosson un método único y de gran alcance para desentrañar la dinámica de la línea de señalización neuroglial iónico y su procesamiento cerebral papel de información.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer a Dana Kamalidenova, Autexier Morgan, y Chopier Roch, quien hizo el video y animaciones, así como Florian Beck para las fotografías y la post-producción del video voz en off. Este trabajo ha sido patrocinado por Olympus y apoyado por becas de la HFSPO (Premio de desarrollo profesional), ANR (Programa Jóvenes y el Programa chercheurs Blanc Neurosciences), FRC (Fédération pour la Recherche sur le Cerveau), el INSERM y La Pitié Salpêtrière hospital (investigación traslacional contrato) a NR, del Ministerio francés de Investigación y Deutsche Forschungsgemeinschaft becas postdoctorales para arriba, y de las escuelas de doctorado "Fronteras de la Ciencia de la Vida", Universidad Paris Diderot, Bettencourt Schuller fundación, y FRM (Fondation pour la Recherche Medicale) de becas de doctorado para JS
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| Picrotoxin | Sigma | P1675 | se disuelven en DMSO |
| Ácido quinurénico | Tocris | 0223 | se disuelven a 34 ° C bajo agitación o sonicación |
| DL-TBOA | Tocris | 1223 | DCG IV Tocris 0975 |
Referencias
- Finkel, A., Bookman, R., Crawley, J. N., et al. Chapter 6 The electrophysiology setup. Current protocols in neuroscience. , (2001).
- Yuan, Y. A., Atchison, W. D. Elelctrophysiological studies of neurotoxicants on central synaptic transmission in acutely isolated brain slices. Current Protocols in Toxicology. , (2003).
- Bergles, D. E., Jahr, C. E. Synaptic activation of glutamate transporters in hippocampal astrocytes. Neuron. 19, 1297-1308 (1997).
- Diamond, J. S., Bergles, D. E., Jahr, C. E. Glutamate release monitored with astrocyte transporter currents during LTP. Neuron. 21, 425-433 (1998).
- Luscher, C., Malenka, R. C., Nicoll, R. A. Monitoring glutamate release during LTP with glial transporter currents. Neuron. 21, 435-441 (1998).
- Pannasch, U., et al. Astroglial networks scale synaptic activity and plasticity. Proceedings of the National Academy of Sciences of the United States of America. 108, 8467-8472 (2011).
- Poolos, N. P., Mauk, M. D., Kocsis, J. D. Activity-evoked increases in extracellular potassium modulate presynaptic excitability in the CA1 region of the hippocampus. J. Neurophysiol. 58, 404-416 (1987).
- Amzica, F., Massimini, M., Manfridi, A. Spatial buffering during slow and paroxysmal sleep oscillations in cortical networks of glial cells in vivo. The Journal of neuroscience : the official journal of the Society for Neuroscience. 22, 1042-1053 (2002).
- Diamond, J. S., Jahr, C. E. Transporters buffer synaptically released glutamate on a submillisecond time scale. The Journal of neuroscience : the official journal of the Society for Neuroscience. 17, 4672-4687 (1997).
- Oliet, S. H., Piet, R., Poulain, D. A. Control of glutamate clearance and synaptic efficacy by glial coverage of neurons. Science. 292, 923-926 (2001).
- Bergles, D. E., Jahr, C. E. Glial contribution to glutamate uptake at Schaffer collateral-commissural synapses in the hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 7709-7716 (1998).
- Danbolt, N. C. Glutamate uptake. Prog. Neurobiol. 65, 1-105 (2001).
- Diamond, J. S. Deriving the glutamate clearance time course from transporter currents in CA1 hippocampal astrocytes: transmitter uptake gets faster during development. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 2906-2916 (2005).
- Scimemi, A., Tian, H., Diamond, J. S. Neuronal transporter regulate glutamate clearance, NMDA receptor activation, and synaptic plasticity in the hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 14581-14595 (2009).
- Davie, J. T., et al. Dendritic patch-clamp recording. Nature. 1, 1235-1247 (2006).
- Reeves, A. M., Shigetomi, E., Khakh, B. S. Bulk loading of calcium indicator dyes to study astrocyte physiology: key limitations and improvements using morphological maps. The Journal of neuroscience : the official journal of the Society for Neuroscience. 31, 9353-9358 (2011).
- Panatier, A., et al. Astrocytes are endogenous regulators of basal transmission at central synapses. Cell. 146, 785-798 (2011).
- Castro, M. A. D. i., et al. Local Ca2+ detection and modulation of synaptic release by astrocytes. Nature. 14, 1276-1284 (2011).
- Shigetomi, E., Kracun, S., Sofroniew, M. V., Khakh, B. S. A genetically targeted optical sensor to monitor calcium signals in astrocyte processes. Nature. 13, 759-766 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados