Method Article
急性海馬スライスにおけるシナプス誘発アストログリアとニューロン活動の二重の電気生理学的記録
要約
隔離された海馬から急性脳スライスだけでなく、アストロサイトとニューロンの同時電気生理学的記録の準備地層放線シェーファー担保の刺激中には記述されている。アストログリアカリウムとグルタミン酸トランスポーター電流の薬理学的な分離が実証されている。
要約
アストロサイトは、彼らが統合ニューロン三シナプス、一緒に形成し、神経活動を調節する。確かに、アストロサイトはそれらのイオンチャネルと神経伝達物質受容体の活性化を介して神経細胞の入力を感知し、gliotransmittersの活動依存リリースを通じて、部分的に情報を処理する。また、アストロサイトはカリウム空間バッファリングと同様、GABAのクリアランスに寄与し、グルタミン酸のメイン取り込み系を構成している。これらの細胞は、従って絶えずシナプス活動を監視し、シナプス、放出されたグルタミン酸の変化、GABAおよび細胞外カリウム濃度のために、それによって敏感な指標である。また、アストログリア取り込み活性または緩衝能の変化は、神経細胞の機能に重大な影響を持つことができ、生理病理学的状況やノックアウトマウスを特徴付ける際に見落とされてしまう可能性がある。ニューロンとグリア細胞の活動のデュアル録音ゆえに変化を研究するための重要な方法であるアストログリア取り込みおよびバッファ容量の変化を付随する関連したシナプスの強さ。ここでは、 地層放線アストロサイトを識別する方法と、同時に神経細胞およびグリア細胞の電気生理学的応答を記録する方法を、海馬スライスを準備する方法について説明します。さらに、我々は薬理学的にシナプス誘発アストログリア電流を分離する方法について説明します。
プロトコル
1。人工脳脊髄液と細胞内液の調製
- 実験を始める前に、1つは、パッチクランプ記録だけでなく、海馬の準備のための人工脳脊髄液(ACSF)の内部溶液を調製する必要があります。ガラスガス発生装置(マイクロフィルターキャンドル、ROBUドイツ)および組織グリッド(蚊帳やナイロンタイト)、あなたはさらに外科用ハサミと罰金アイリスはさみ、2へらや鉗子(ファイン科学ツール)で構成された解剖キットが必要になります同様に瞬間接着剤(UHUデント)。電気生理学スライスパッチセットアップの設定はフィンケル&ブックマン2001年1によって記述されていた。
- 内部溶液は、(mMで)溶解:105 K-グルコン酸、30のKCl、脱イオン水で10 HEPESおよび0.3 EGTA(最終体積の70〜80%で)。 4℃への解決策を冷やすと(mm)を追加:4 ATP-Mgの、0.3、GTP-トリスと10クレアチンリン酸。 KOHとフィルuでpHを7.4に調整し最終容積を脱イオン水でp。 (Osmolaritiy:〜280 mOsm)。このソリューションを(孔径0.2μm)をフィルタリングします。等分ソリューションは、少なくとも3-4週間は安定である - 20℃ 1日の実験では、内部の溶液〜1mlを必要とされている。
- 特に明記しない限り、CA1領域における海馬の準備と細胞の録音に使用ACSFは、(mMで)含まれています:119のNaCl、2.5のKCl、2.5のCaCl 2、1.3のMgSO 4、1のNaH 2 PO 4、26.2 NaHCO 3および11グルコース。 carbogen(95%O 2および5%CO 2)で-少なくとも10分間(7.4 pH約7.3)のために、脱イオン水(浸透圧〜320 mOsm)と酸素を送り込むこのソリューションでは、これらの塩を溶かす。実験ごとに溶液の少なくとも1リットルを用意します。特定のケアは、海馬のCA3領域で実験を行うために使用される海馬組織の調製のために取られるべきである。確かに、この地域は、活動とその後の神経細胞死をてんかんになりやすい。したがってSYNAPTIC活性が強くスライス標本中に低減されるべきであり、これを含有する氷冷スクロース溶液(mMで)で海馬の郭清を行うことによって達成されます:87のNaCl、2.5のKCl、0.5のCaCl 2、7のMgCl 2、1のNaH 2 PO 4 、25のNaHCO 3、10グルコースおよびスクロース75。このソリューションでは、低ナトリウム、低カルシウム·高マグネシウム濃度の組み合わせが膨大にこうして自発的活性および細胞死を最小限に抑え、シナプス前焼成と放出確率と同様、後シナプスNMDA受容体の活性を低下させる。一度準備、CA3領域からの細胞の録音に使用海馬スライスは多シナプス活動を最小限に抑えるために、4 mM CaCl 2および4 MgSO 4を含む、変更されたACSFを灌流されています。
2。急性海馬スライス標本
- 常にで酸素化しながら、約300スライスチャンバ用ACSF mlのと同様に、4℃で準備のためのクールダウンcarbogen。またcarbogen(スキーム図1)と酸素化スライス記憶、室温(RT)でACSFた小さなビーカーを準備します。
- ケージの中に追加された1mlイソフルランに浸し小さなペーパータオルで、ボンネットの下にマウスを麻酔。
- マウスが深く麻酔した後、頭を切り落とし、氷冷酸素ACSFで小皿に直接追加します。小さなはさみで頭皮を外し、後続のステップのための組織の上に頭を転送します。 図1に示すように、説明した海馬を解剖するために開始します。
- 氷の寒さの中低速(3μM/秒)と70 Hzの振動周波数で300から400μmの厚さの横のスライスをカットACSFを酸素化し、貯蔵室に移す。少なくとも1時間前に記録をRTでスライス休止してください。 CA3の実験のためのスライスは34℃で25分を保存されており、室温で少なくとも30分間は、スライス工程から回復する。
3。誘発アストログリアカレンツと神経電場電位のデュアル録画
我々はここで、シナプス誘発細胞外電極を用いafference刺激を通じてシナプス活性化により誘導される、すなわち応答をアストログリアとニューロンの応答を記録する方法について説明します。
- 常に興奮性応答を分離するために、100μMのピクロトキシン(GABAアンタゴニスト)を含む、酸素化ACSFた記録室(1.5-2 ml /分、RT)を灌流する。ポリ-L-リジン(1.5から3 mg / ml)をコーティングしたカバースリップ上にスライスを移し、良いスライス密着性を達成するために、液体を浸して、スライスの上にASCFのドロップを追加。録音室にカバースリップを置きます。ピクロトキシンによって抑制性伝達の遮断は、誘発イベントの測定を歪曲するニューロン集団のてんかん様活動、 すなわち自発的、同期発火をもたらす可能性がある。したがって、てんかん様活動を防止するために、作るシャファー側枝( 図2aに示されている)を介して伝播を防止するために、CA1およびCA3領域の間のフラットカット(表面のみ)。
- 地層放線アストロサイトは、その小さな細胞体のサイズ(〜10μm)と星状プロセスアセンブリによって識別することができます。少なくとも20〜30μmのスライス面の下のセルを選択してください。刺激隔離ボックスに接続し、お風呂(単にガラスピペットの周りに第二の銀線をラップして)に接地されている銀線にガラス刺激電極(チップ抵抗〜1MΩ)を取付けてください。離れて選ば れたアストロサイト200から300μmの距離で、図2Aに示すように、シャファー担保領域に刺激電極を置きます。アンプのヘッドステージに接続された塩素化銀線上にフィールド記録電極(MΩ〜2-5)をマウントします。両方の電極がACSFと前に満たされている。外部COMを無効にし、私は= 0、モードをmulticlampで選ぶmandは、入力および電極を配置〜50μm程度離れて星状膠細胞から角質放線領域 ( 図2A)に。ゲイン2から10と2 kHzのベッセルフィルタとフィルタとの応答を記録。脳切片に電流注入がプロジェクトシナプス後のCA1錐体細胞へのシナプス前終末における周囲のシャファー担保軸索およびその後の伝達物質の放出に活動電位をトリガーします。リリーストランスミッタは小さな負電位と細胞外で測定可能であるシナプス後のイオンチャネル型受容体を介して細胞内に正電荷の流れを、トリガされます。抑制性伝達を薬理学的にブロックされている間に、このフィールド興奮性シナプス後電位(fEPSP)は、同時にアクティブニューロンのグループの活動を統合しています。 fEPSPを喚起するために、いくつかのテストパルス(持続時間0.1ミリ秒)を適用し、刺激電極の一部の再配置はfEPSPを高めるために役立つかもしれない。典型的なCA1 層radiatUM fEPSP は 、 図2Bに示されている。位置決めと応答波形のさらなる詳細はYuan らで見つけることができます2003年2。健康海馬スライスにおけるfEPSP振幅が通常繊維ボレーの振幅の2倍の大きさ以上である必要があります。 fEPSP振幅又は勾配の正確な定量化のために、誘発reponseは単シナプスであるべき、多シナプス活動として(マルチピーク応答などの検出)過剰興奮のために兆候かもしれない電気的な刺激の独立シナプス活性を示します。海馬のCA3領域で行われた実験では、刺激と記録ピペットは、図3Cに示すように配置されている。明らかに数秒間強く促進している、対パルス刺激(50ミリ秒パルス間間隔)と1Hz刺激を大量fEPSP responses.At終わり誘発当初は低振幅を強化するために適用される苔状線維入力を識別するにはの実験、DCGIV、mGluR2 / 3受容体拮抗薬は、さらに確かに苔状線維入力が刺激されたことを確認するために洗浄することができる。この拮抗薬の適用はmGluR2 / 3受容体の高発現に起因〜90%、苔状線維シナプス前抑制見るboutonsから放出によってfEPSPを減らす必要があります。
- フィルタリング内部溶液とパッチピペット(MΩ〜2-5)を記入し、第二ヘッドステージに接続された塩素化銀線上にマウントすると、ピペットホルダにチューブを介して接続されているシリンジ、正の圧力をかける。常に10mVの20ミリ秒の試験パルスを印加して、細胞表面に到達し、膜中のたわみが見えるようになるまで組織の中にピペットを移動します。オフセットピペットをゼロ、正圧を除去し、膜へのクランプ - 80 mVです。ギガシール(少なくとも1GΩ)(それは数秒よりも長い時間がかかるべきではない)になるまで待ちます。いくつかの負圧の穏やかなアプリケーションでは、AGに到達するために役立つかもしれないigaseal。細胞に侵入する負圧またはmulticlampでザップ関数を使用しての簡単なアプリケーションによって達成される。 fEPSPと電圧クランプでアストログリア応答( - ;周波数0.1 Hzで、ベッセルフィルタ2kHzで、ゲイン10〜80 mVのVHOLD)誘発シャファー担保の同時録画を開始します。アストログリア電流応答は二相性である:まず、隣接する錐体細胞で生成されたfEPSPsを反映して、高速の一過性外向き電流が表示されます。これはゆっくりと立ち上がりと減衰内向き電流(神経細胞応答の終了後に数秒持続(> 10秒))が続きます。この電流は脱分極後シナプスの端末を囲むことによって、放出後、アストロサイトへのカリウムエントリが主な要因です。シナプス前グルタミン酸放出によってトリガ電流を同時にアクティブに高速過渡グルタミン酸トランスポーター(GLT)は、カリウム電流によってマスクされます。アストロサイトと同様に、パッチのアクセス抵抗の保持電位は、MOであるべき実験を通じてnitoredや撮影状況の変化によりアストログリアreponsesの不正確な監視を避けるために、約20%以上のものを変化させるべきではありません。初期保持電位> -70 mVの持つ唯一のアストロサイトは、健康な細胞を研究するために調査する必要があります。
- 誘発アストロ膜の脱分極を記録するために、電圧から電流クランプに切り替えます。 fEPSPが完全にブロックされているとGLT振幅がプラトーに達するまで、イオンチャネル型グルタミン酸受容体拮抗キヌレン酸(5mM)の灌流によってグリア型グルタミン酸トランスポーター(GLT)は、現在分離してください。はっきりGLT電流を識別するために、特異的アンタゴニスト、DL-スレオ-β-Benzyloxyaspartatic酸(DL-TBOA、200μM)を適用します。別のシナプス強度に神経およびグリア細胞の応答を記録し、対になったパルス刺激に対する応答を調べるために2つの近接した刺激を(50ミリ秒間隔)を適用することを5倍〜2倍で刺激強度を高める。シリーズRの安定性グリア細胞のesistanceと膜電位が記録全体を監視する必要があります。
- ギャップ結合の程度がアストログリアネットワークを媒介視覚化するために、色素結合実験は、そのようなローダミン-Bのような低分子色素(<1.5 kDa)は、の受動拡散を可能にするために、任意の電流注入せず、電流クランプモードで実行する必要がありギャップ結合チャネルを介して。周囲組織への色素漏出を最小限にするために、正圧が組織に入るときだけパッチピペットを介して適用されるべきであり、パッチはできるだけ早く到達しなければならない。
結果
海馬のCA1領域におけるシナプス誘発アストログリアとニューロン応答の代表同時記録(fEPSPs)は、 図2、ABに示されている。誘発アストログリア現在は二相性であり、すなわち、それは一過性外向き電流と( 図2B)(> 10秒)徐々に減衰向き電流で構成されています。外向き電流が誘発fEPSPを反映し、キヌレン酸(濃いグレーのトレース、 図2B)3によるイオンチャネル型グルタミン酸受容体の阻害後にブロックされます。それはまた、メインを表現するために知られているシナプス後イオンチャネル型グルタミン酸受容体活性を阻害キヌレン酸、( 図2B、図2C 1)3-6、により廃止されているので遅い内向き電流の大半は、アストロサイトの以下のシナプス後脱分極にカリウムエントリを反映カリウムリリース7のソース(80%)。残りが急速に上昇dは減衰する内向き電流は、GLT拮抗DL-TBOA(ライトグレーのトレースは、 図2B及び図2C 2)によって阻害される。キヌレン酸で現在からTBOAの残りの遅い現行の事後減算(ライトグレーのトレース)(濃いグレーのトレース)は、 図2C 2に示す現在の純粋なアストログリア型グルタミン酸トランスポーター(黒のトレース)の単離を可能にする。キヌレン酸とTBOA(ライトグレーのトレースは、 図2B及び図2C 2)で徐々に減衰し、現行の永続はTTX(データは図示せず)によってブロックされ、最も可能性の高い細胞外Kの蓄積を反映している+シナプス前求心性発射3の間に解放することができます。シェーファー担保の適度な刺激は、単一の同じセル( 図2D)に記録された小さな誘発脱分極に比べて相対的に大きいシナプス誘発アストログリア電流を誘導する。これはためである星状膠細胞の膜抵抗値が低い。シナプス誘発アストログリア膜電位動態の記録は、 図2Dに示すように、地元の細胞外カリウム濃度8の直接の尺度である。最近6に示すように、基礎となる神経活動に誘発アストログリア応答の正常化は、異なる実験の直接比較を可能にします。合計シナプス誘発アストログリア電流は直線的にfEPSPの増加( 図2E)を次のようにアストログリア電流はさらに、非常に高い信頼性興奮性シナプス伝達の変化を監視することができます。彼らが示すのでアストログリア電流はまた、短期シナプス可塑性を反映して、神経細胞のように、対になったパルス促進( 図2F)。 CA1錐体細胞とアストロサイトのペアリングホールセル記録は、脱分極パルスに応答して、ニューロンの表示活動電位ので、両方のタイプの細胞で非常に異なる電気生理学的挙動を明らかに一方、隣接するアストロサイトが沈黙している( 図3A-B)。しかし、シェーファー担保の適度な刺激が同時にCA1錐体細胞と隣接するアストロサイト( 図3B 2)の速い外側にゆっくりと内向き電流の速い興奮posynaptic潜在能力を呼び起こすことができます。 図3(c)に示すようにシナプス誘発ニューロンとグリア細胞応答のデュアル録音はまた、海馬のCA3領域に記録することができます。確かに、CA3苔状線維の単一刺激は基底状態においてアストロサイトにおける小さな速い外側にゆっくりと内向き電流( 図3D 1)に関連付けられているローカルfEPSPsとして計上非常に小さな神経応答を呼び起こす。それだけで適度にアストログリア応答( 図3D 2)を増加しながらそれとは対照的に、数秒間CA3苔状繊維の1 Hzの刺激が強く、fEPSPを増強する。
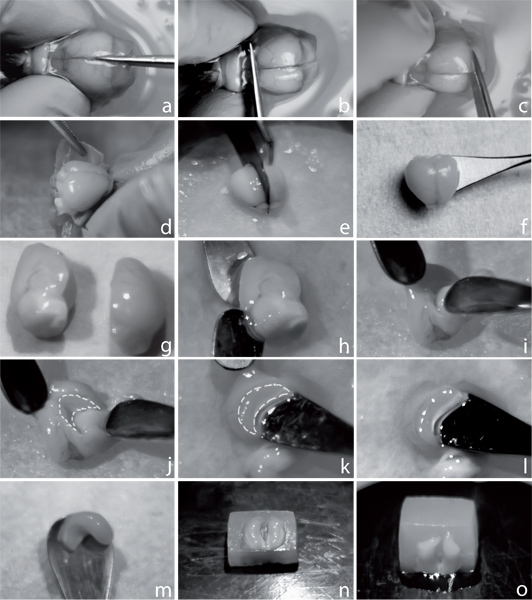
横方向のスライスを準備するために図1海馬分離。脳を解剖し、正中線()に沿ってスカルを切った。嗅球(b)のレベルで、その後、小脳の(c)レベルでの冠状カットを行う。慎重にピンセット(d)の助けを借りてスカルを外し、ブレード(電子)を持つ2つの半球を分離し、冷たい酸素ACSF(f)に小さなスプーンに移す。 〜5分間平衡化した後、アップ内側面(g)を乾いたティッシュに1つの半球を置く。 2本のスプーンの助けを借りて、間脳(HJ)を取り外します。破線(k)によって示されるように海馬は、表示されるようになりました。白い構造(LM)として目に見える、采から出発して、スプーンで海馬を解剖する。寒いACSFに戻し海馬を転送します。 alveusサイドアップと腹hippocamp持つ小さなアガロースブロック、位置2海馬を準備私たちは、寒天ブロックのエッジに直面して、寒天(n)に良い添付ファイルを許可するように離れて慎重にすべての液体を浸します。のり海馬は腹側(O)に寒天ブロックに取り付け。
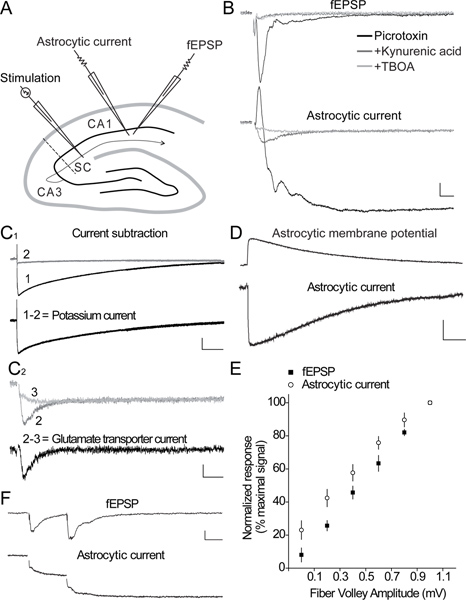
図2:海馬のCA1領域に-シナプス誘発同時ニューロンおよびアストログリア応答。海馬にSC刺激により誘発fEPSPを記録するために、アストロサイト電流、および細胞外電極を記録するシャファー側枝(SC)、パッチピペット電極を活性化する刺激電極の配置を示す海馬スライスのA)は、スキーム、 CA1領域。 B)はfEPSPsの同時録音(上のパネル)および誘発シナプスpresenc-SCの刺激によってアストロサイト電流(下のパネル)の代表的なトレース薬理学薬のe。レスポンスは最初興奮応答を分離するために、GABA A受容体拮抗薬(ピクロトキシン、100μM、黒いトレース)の存在下で記録されています。イオンチャネル型グルタミン酸受容体拮抗薬(キヌレン酸、5mMの、濃いグレーのトレース)、その後のアプリケーションは、星状膠細胞の電流応答の小型·高速過渡成分であり、マスクを解除、fEPSPと長続きアストログリア現在の主要な部分を抑制するグルタミン酸トランスポーターブロッカー(TBOA、200μM、ライトグレーのトレース)に敏感。スケールバー、fEPSP 0.1 mVの、アストロサイトの現在の15 PA、10ミリ秒。 C 1)。合計電流からキヌレン酸(2)に残りの電流成分を減算することにより、Bに示すように誘発反応、(下のパネル、黒いトレース)から単離することができるアストロカリウム電流(1-2)のサンプル·トレース( 1)。スケールバー、20 pA以下、1秒。 TBOA iの引き算によって得られた現在のグルタミン酸トランスポーター(2-3)のC 2)サンプル·トレースキヌレン酸(2)の電流からnsensitive遅い成分(3)。スケールバーは、2.5 pAを、25ミリ秒。 D)の内向き電流のサンプルトレースは電圧クランプ(下のパネル)とSC刺激によるアストロサイトに誘導された電流クランプ(上のパネル)で記録された対応する膜の脱分極に記録されます。スケールバーは、現在のクランプ1.5 mVの電圧クランプ5 PA、1秒。 E)はシナプス前線維ボレー(入力)と(出力)の合計アストログリア電流の関係を示す入出力曲線はSCの刺激(N = 6)に応答して、同時に記録した。神経fEPSPとして直線的に増加したファイバーボレーとアストログリア電流が増加。 F)のニューロンの応答(fEPSP)とアストロサイトの現在のサンプル·トレースは40ミリ秒パルス間間隔でペアパルス刺激のために示されている。シナプス誘発アストログリア現在の展示、ニューロン、対パルスの円滑化のような。スケールバーは、0.1 mVの、5 PA、20ミリ秒。
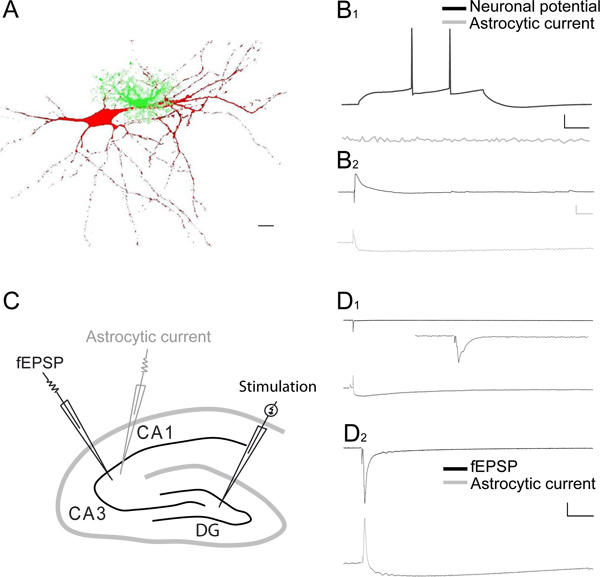
図3:海馬のCA1およびCA3領域におけるシナプス誘発性神経細胞とグリア細胞応答のデュアル録音。 A)はローダミン-B(赤、0.1%)、ホールセルパッチクランプ法を用いて、フルオレセインデキストラン(緑、0.1%)を充填したアストロサイトで注射CA1錐体細胞の再構築。スケールバーは、10μmである。 B 1)CA1錐体細胞と隣接するアストロサイトからの電流クランプで記録膜電位の同時ホールセル記録の代表痕跡。電流パルスを脱分極20 pAの注入によって誘発神経活動電位の発火(黒トレース)、隣接するアストロサイト(グレーのトレース)には応答を呼び起こすん。スケールバーは、20 mVの、10、PA、100ミリ秒。電流ハマグリのCA1錐体細胞の二重の全細胞記録のB 2)サンプル·トレースpとピクロトキシン(100μM)の存在下でのSC刺激後の電圧クランプ内の隣接するアストロサイト。 SCの刺激は(グレーのトレース)が小さいと長期的なアストロサイトの電流に関連した興奮性シナプス後電位(EPSP、黒いトレース)、呼び起こす。スケールバーは、5 mVの、10、PA、100ミリ秒。 C)は海馬スライスのスキームに苔状線維、パッチピペット電極(グレー)、アストロサイトの電流を記録し、そして細胞外電極を活性化するために、歯状回(DG)とCA3領域刺激電極の配置に描いたCA3苔状線維の刺激により誘発される記録fEPSP、。苔状CA3の単一刺激にCA3 fEPSPs(上部パネル、D 1及びD 2の黒いトレース)とアストロサイトの細胞全体の応答(下のパネル、D 1及びD 2のグレーのトレース)のペアの録音のA、D、E)代表トレースが0.02 Hz(はめ込みでズーム)(D1)または1 Hzの刺激頻度(D2)で繊維。 Dのスケールバー 1とD 2、0.2 mVの、15 pAの時間D:1秒、D 2は 、100ミリ秒。はめ込みスケールバー、0.1 mVの、100ミリ秒。
ディスカッション
シナプス誘発性神経細胞とグリア細胞応答のデュアル録音がアストログリアプロパティの変更に関連付けられた事前とシナプス後活動にオンラインでの変化を研究するための有用な方法である。シナプス誘発グリア膜の脱分極は細胞外カリウムシナプス前の活動電位の発火に一部起因する上昇8、が、そのほとんどはシナプス後脱分極7への直接の尺度である。したがってグリア膜電位動態の録音は前シナプスの興奮性、シナプス後の活動、細胞外空間のボリュームとカリウム緩衝容量6,8の修正を調査するために使用することができます。アストログリア型グルタミン酸トランスポーター電流が放出確率3の短期的な変動を監視することがシナプス前グルタミン酸放出、、5、9の敏感な指標である。それは、さらに別のシナプスで、または異なる発達世紀における機能的シナプス·グリア相互作用を特徴づけるために使用することができます10歳。それはGLTsは非常に温度に敏感な11アールとNa +、K +およびH 12の電気化学的勾配によって駆動されていることを強調すべきである。したがってGLT電流の振幅と速度論は非常に選ばれた実験条件に依存しています。さらに、記録されたGLT電流由来アストログリア型グルタミン酸クリアランスの実際の時間経過は、部分的に隠れていることが知られている。これは、13彼らの動態を歪めるアストロサイトのelectrotonicプロパティまたは非同期の伝達物質放出、などの要因によってGLT電流のフィルタリングに起因します。フィルタリングメカニズムの時間的特徴を抽出する方法が開発されているとrecenly行わ6,13,14のように、生理的または病理学的な状況で、実際のグルタミン酸クリアランス時間のコースを導出するために使用することができます。また、アストログリア膜の脱分極の同時記録は、電流クランプで、insig提供することができます細胞外カリウム過渡変化の可能性にHTS。シングルアストロサイトは約100の異なるニューロンの100,000シナプスまで連絡し、従って統合ないし、地元の神経回路網の活性を調節する。
すなわち、基礎シナプス活性の洞察を得るためにアストロサイトからの電気生理学的細胞全体の応答を記録し、ここで紹介したテクニックを使用する場合は、1は、アストロサイトでは、ソーマ·レベルでのパッチクランプ記録は主に細胞体から発する検出電流が許可されていることを心に留めておくべきまたは近プロセス。多数の微細プロセスで発生して受容体やチャネルの強い活性化が細胞体に伝播する電流を生成することができたときに確かに、相馬で検出された電流は、部分的にしか細かい先端プロセスに由来する。したがってシナプス区画をカバーする個々の小グリア細胞プロセスにおける基底受容体とチャネル活性はほとんど検出可能である。これは、一部に限られたスパッツが原因ですin situで星状細胞からのホールセルパッチクランプ記録法による膜電流と電圧のIALと時間的制御。しかし、それは豊富な小さな星状膠細胞の突起の表面が断然ソーマとメインプロセスの膜面積を超えていることに留意すべきである。さらに、これらのperisynapticアストログリアマイクロドメインは、おそらく神経膠コミュニケーションとシナプス制御に重要な役割を果たしている機能的に関連する受容体やチャネルが含まれています。我々はここで紹介する手法は、したがってafference刺激中に特定で発生、神経のアンサンブルから同期アクティビティのアストロサイトの統合を研究する際に便利です。それは、個々のシナプスと基底自発的活動中に発生した隣接細かい星状膠細胞の突起の間の対話を研究するために使用すべきではありません。基礎シナプス活動によって誘発される局所アストログリア応答を研究するための代替方法は、dのように、細かいプロセスからパッチクランプ記録を行うことであろう樹状突起15の1。パッチこれらの罰金アストログリアのプロセスはおそらくその小さなサイズのために挑戦しているが、それはおそらくアストログリアマイクロドメインおよび個々のシナプス間のより親密な対話を解明するために追求する道である。電気的ノイズのパッチクランプ記録で平均3から5 Paで到達するので、しかし、個々の細かいアストログリアのプロセスに起因する可能性が小さい電気生理学アストログリア応答は、しきい値検出を下回ることがあります。神経活性物質によるアストロサイトの細胞膜受容体やトランスポーターの活性化は細胞内カルシウムトランジェントをトリガすることができますので、シナプス活動にアストログリア応答を研究するためのもう一つの方法は、カルシウムイメージングである。しかし、カルシウムインジケータ付きのアストロサイトのバルク·ロードは、主に身体的活動16を反映するかもしれません 。電気生理学およびカルシウムイメージングの組み合わせは、どちらも自発的に発生するまたはbを引き起こした、細かいアストログリアのプロセスから小さなカルシウムシグナルを検出可能yの最小のシナプス刺激17,18。しかし、人は低親和性の指標は検出レベル以下に働くかもしれない一方、高親和性カルシウム指示薬は、カルシウム·バッファ、阻害する重要なカルシウムシグナル伝達経路のように作用するかもしれないことを心に留めておくべきである。最後に、また全細胞パッチクランプ時に細胞内シグナル伝達分子の洗い出しを回避細かい星状膠細胞の突起におけるカルシウムイベントを勉強するための洗練された非侵襲的な手法は、アストロサイトに発現させることができる膜標的カルシウムセンサーを使用することにある上皮内だけでなく、 生体内で 19インチ全細胞パッチクランプ、チャネルおよび受容体活性化の際にトリガーされたすべての異なるイオン電流の定量的な情報を提供し、一方、しかし、カルシウムイメージングのみ、1シグナリング多くに関与している分子は、すべてではなく細胞の活動に関する情報を提供できます。ニューロンやアストロサイトからしたがって同時電気生理学的記録神経膠イオンシグナリングとその役割の脳の情報処理のオンラインダイナミクスを解明するためのユニークで強力な方法です。
開示事項
特別な利害関係は宣言されません。
謝辞
著者は写真とナレーションビデオのポストプロダクションのためにダナKamalidenova、モーガンAutexier、とロッシュChopier、ビデオやアニメーションを作っただけでなく、フローリアン·ベックに感謝したいと思います。この作品は、オリンパスがスポンサーとなってHFSPO(キャリア開発賞)、ANR(プログラムジュンヌchercheursとプログラムブラン神経科学)は、FRC(フェデレーション注ぐラRECHERCHEシュールルCerveau)、INSERM、ラPitiéSalpêtrière病院(トランスレーショナルリサーチからの補助金によって支えられてJSにNRに契約)、フランス研究省とドイツ学術振興ポスドクのフェローシップからのUP、博士学校 "生命科学の最前線"から、パリ·ディドロ大学、ベッテンコートシュラー基盤、およびFRM(財団流動ラRECHERCHEMédicale)博士フェローシップ
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | コメント(オプション) |
| ピクロトキシン | シグマ | P1675 | DMSOに溶解 |
| キヌレン酸 | Tocris | 0223 | 34°Cで溶解撹拌又は超音波処理 |
| DL-TBOA | Tocris | 1223 | DCG IV Tocris 0975 |
参考文献
- Finkel, A., Bookman, R., Crawley, J. N., et al. Chapter 6 The electrophysiology setup. Current protocols in neuroscience. , (2001).
- Yuan, Y. A., Atchison, W. D. Elelctrophysiological studies of neurotoxicants on central synaptic transmission in acutely isolated brain slices. Current Protocols in Toxicology. , (2003).
- Bergles, D. E., Jahr, C. E. Synaptic activation of glutamate transporters in hippocampal astrocytes. Neuron. 19, 1297-1308 (1997).
- Diamond, J. S., Bergles, D. E., Jahr, C. E. Glutamate release monitored with astrocyte transporter currents during LTP. Neuron. 21, 425-433 (1998).
- Luscher, C., Malenka, R. C., Nicoll, R. A. Monitoring glutamate release during LTP with glial transporter currents. Neuron. 21, 435-441 (1998).
- Pannasch, U., et al. Astroglial networks scale synaptic activity and plasticity. Proceedings of the National Academy of Sciences of the United States of America. 108, 8467-8472 (2011).
- Poolos, N. P., Mauk, M. D., Kocsis, J. D. Activity-evoked increases in extracellular potassium modulate presynaptic excitability in the CA1 region of the hippocampus. J. Neurophysiol. 58, 404-416 (1987).
- Amzica, F., Massimini, M., Manfridi, A. Spatial buffering during slow and paroxysmal sleep oscillations in cortical networks of glial cells in vivo. The Journal of neuroscience : the official journal of the Society for Neuroscience. 22, 1042-1053 (2002).
- Diamond, J. S., Jahr, C. E. Transporters buffer synaptically released glutamate on a submillisecond time scale. The Journal of neuroscience : the official journal of the Society for Neuroscience. 17, 4672-4687 (1997).
- Oliet, S. H., Piet, R., Poulain, D. A. Control of glutamate clearance and synaptic efficacy by glial coverage of neurons. Science. 292, 923-926 (2001).
- Bergles, D. E., Jahr, C. E. Glial contribution to glutamate uptake at Schaffer collateral-commissural synapses in the hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 7709-7716 (1998).
- Danbolt, N. C. Glutamate uptake. Prog. Neurobiol. 65, 1-105 (2001).
- Diamond, J. S. Deriving the glutamate clearance time course from transporter currents in CA1 hippocampal astrocytes: transmitter uptake gets faster during development. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 2906-2916 (2005).
- Scimemi, A., Tian, H., Diamond, J. S. Neuronal transporter regulate glutamate clearance, NMDA receptor activation, and synaptic plasticity in the hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 14581-14595 (2009).
- Davie, J. T., et al. Dendritic patch-clamp recording. Nature. 1, 1235-1247 (2006).
- Reeves, A. M., Shigetomi, E., Khakh, B. S. Bulk loading of calcium indicator dyes to study astrocyte physiology: key limitations and improvements using morphological maps. The Journal of neuroscience : the official journal of the Society for Neuroscience. 31, 9353-9358 (2011).
- Panatier, A., et al. Astrocytes are endogenous regulators of basal transmission at central synapses. Cell. 146, 785-798 (2011).
- Castro, M. A. D. i., et al. Local Ca2+ detection and modulation of synaptic release by astrocytes. Nature. 14, 1276-1284 (2011).
- Shigetomi, E., Kracun, S., Sofroniew, M. V., Khakh, B. S. A genetically targeted optical sensor to monitor calcium signals in astrocyte processes. Nature. 13, 759-766 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved