Method Article
Dual-Elektrophysiologische Recordings synaptisch-evozierte astrogliale und neuronale Antworten in Acute Hippocampusschnitte
In diesem Artikel
Zusammenfassung
Die Herstellung von akuten Hirnschnitten aus isolierten hippocampi, sowie die gleichzeitige elektrophysiologischen Ableitungen von Astrozyten und Neuronen in Stratum radiatum Während der Stimulation der Schaffer-Kollateralen beschrieben. Die pharmakologische Isolation astrogliale Kalium und Glutamat-Transporter Ströme demonstriert.
Zusammenfassung
Astrozyten bilden zusammen mit Neuronen dreigliedrigen Synapsen, wo sie zu integrieren und zu modulieren neuronalen Aktivität. Tatsächlich spüren Astrozyten neuronale Eingänge durch Aktivierung ihrer Ionenkanäle und Neurotransmitter-Rezeptoren, und Prozess-Informationen in Teil durch Aktivitäts-abhängigen Freisetzung von gliotransmitters. Weiterhin Astrozyten die Haupt-Aufnahme-Systems bilden für Glutamat, Kalium räumlichen Pufferung wirken, sowie an GABA Clearance. Diese Zellen beobachten daher fortwährend synaptische Aktivität und sind dabei sensible Indikatoren für Veränderungen in synaptisch-released Glutamat, GABA und extrazellulären Kaliumspiegel. Darüber hinaus können Änderungen in astrogliale Aufnahme Aktivität oder Pufferkapazität schwerwiegende Auswirkungen auf neuronale Funktionen und vielleicht übersehen bei der Charakterisierung physiopathologische Situationen oder Knockout-Mäusen werden. Dual-Aufzeichnung von neuronalen und astrogliale Aktivitäten ist daher eine wichtige Methode zur Veränderungen in studierensynaptischen Stärke assoziiert Änderungen in astrogliale Aufnahme und Pufferung Kapazitäten Vorsicht geboten. Hier beschreiben wir, wie man Hippocampusschnitte, wie stratum radiatum Astrozyten zu identifizieren, und wie gleichzeitig neuronalen und astrogliale elektrophysiologischen Reaktionen aufzeichnen vorzubereiten. Darüber hinaus beschreiben wir, wie man pharmakologisch isolieren synaptisch-evozierte astrogliale Ströme.
Protokoll
Ein. Herstellung künstlicher Liquor und intrazelluläre Lösung
- Vor dem Start des Experiments ist es nötig, die interne Lösung für die Patch-Clamp-Aufnahmen sowie die künstliche Zerebrospinalflüssigkeit (ACSF) für den Hippocampus präparieren. Sie werden darüber hinaus brauchen eine Dissektion Kit bestehend aus chirurgischen Schere und feine Iris Schere, zwei Spatel und Pinzette (Fine Science Tools), ein Glas Begasungseinrichtung (Mikro-Filterkerze ROBU Deutschland) und Gewebe Grid (Moskitonetz oder Nylon fest), sowie Sekundenkleber (Uhu Dent). Die Konfiguration der Patch-Setup Elektrophysiologie Scheibe wurde durch Finkel & Bookman, 2001 1 beschrieben.
- Für die interne Lösung, aufzulösen (in mM): 105 K-gluconat, 30 KCl, 10 HEPES und 0,3 EGTA in entionisiertem Wasser (in 70-80% des Endvolumens). Man kühlt die Lösung auf 4 ° C und addiert (in mM): 4 ATP-Mg, 0,3 GTP-Tris und 10 Phosphokreatin. Der pH-Wert auf 7,4 mit KOH und fill up mit deionisiertem Wasser auf das Endvolumen. (Osmolaritiy: ~ 280 mOsm). Filter für diese Lösung (Porengröße 0,2 &mgr; m). Aliquotierte Lösung ist stabil für 3-4 Wochen bei - 20 ° C. Für ein experimentelles Tag, ~ 1 ml der internen Lösung benötigt.
- Sofern nicht anders angegeben, enthält das für ACSF Hippocampus Herstellung und Aufnahmen von Zellen in der CA1-Region verwendet wird, (in mM): 119 NaCl, 2.5 KCl, 2.5 CaCl2, 1.3 MgSO4, 1 NaH 2 PO 4, 26,2 NaHCO 3 und 11 Glucose. Lösen Sie diese Salze in destilliertem Wasser (Osmolarität ~ 320 mOsm) und Sauerstoff dieser Lösung für mindestens 10 min (pH ~ 7,3 - 7,4) mit Carbogen (95% O 2 und 5% CO 2). Planen mindestens 1 Liter Lösung pro Versuch. Besondere Sorgfalt ist bei der Zubereitung von hippocampalen Gewebe, verwendet werden, um Experimente in der CA3 Region des Hippocampus durchführen wird, zu berücksichtigen. Tatsächlich ist diese Region anfällig für Aktivität und anschließende Neuronentod epileptiforme. So SYNAPTic Aktivität sollte stark während slice Vorbereitung reduziert werden, und dies wird erreicht, indem die Hippocampus Dissektion in eiskaltem Saccharose-Lösung enthält (in mM): 87 NaCl, 2,5 KCl, 0,5 CaCl 2, 7 MgCl 2, 1 NaH 2 PO 4 , 25 NaHCO 3, 10 Glucose und 75 Sucrose. Bei dieser Lösung ist die Kombination von niedrigem Natriumgehalt, niedrige Kalzium und hohen Magnesium-Konzentrationen massiv reduzieren präsynaptischen Brenn-und Freisetzungs-Wahrscheinlichkeit sowie postsynaptischen NMDA-Rezeptor-Aktivität, und minimiert so spontane Aktivität und Zelltod. Einmal hergestellt, hippocampalen Schnitten für Aufnahmen von Zellen aus der CA3 Region verwendet werden mit modifiziertem ACSF perfundiert, enthaltend 4 mM CaCl 2 und 4 MgSO4, um polysynaptischen zu minimieren.
2. Akute Hippocampusschnitt Vorbereitung
- Cool down ~ 300 ml ACSF zum Aufschneiden Kammer, als auch für die Vorbereitung bei 4 ° C, während er ständig sauerstoffartig mitCarbogen. Vorbereiten eines kleinen Becherglas mit ACSF bei Raumtemperatur (RT) für Slice Speicherung, die auch mit Carbogen (Schema 1) wird mit Sauerstoff angereichert.
- Anesthetize die Maus unter einer Haube mit einem kleinen Papiertuch mit 1 ml Isofluran, die in den Käfig gegeben wird eingeweicht.
- Nachdem die Maus ist tief narkotisiert, schneiden Sie den Kopf ab und fügen Sie ihn direkt in eine kleine Schüssel mit eiskaltem oxygenierten ACSF. Entfernen Sie die Kopfhaut mit einer kleinen Schere und überweisen Sie den Kopf auf das Gewebe für die nachfolgenden Schritte. Start, um den Hippocampus zu sezieren, wie dargestellt und beschrieben in Abbildung 1.
- Cut 300-400 um dicke Transversalschichten bei niedriger Drehzahl (3 um / sec) und Vibration Frequenz von 70 Hz in eiskaltem Sauerstoff ACSF, und übertragen Sie sie in eine Vorratskammer. Lassen Sie die Scheiben Rest bei RT für mindestens 1 Stunde vor der Aufnahme. Slices für CA3 Experimente werden 25 min bei 34 ° C gelagert und mindestens 30 min bei RT, um aus dem Aufschneidebereich Prozess wiederherzustellen.
3. Dual Recording evozierter astrogliale Currents und neuronale Feldpotentiale
Wir beschreiben hier, wie die Aufnahme astrogliale und neuronalen Reaktionen, dh Reaktionen von synapse Aktivierung durch Afferenz Stimulation mit einer extrazellulären Elektrode induziert synaptisch-evozierte.
- Ständig versorgen die Aufnahme Kammer mit sauerstoffreichem ACSF (1.5-2 ml / min, RT), mit 100 uM Picrotoxin (GABA A-Antagonist) auf exzitatorische Antworten zu isolieren. Übertragen einer Scheibe auf eine Poly-L-Lysin (1,5 bis 3 mg / ml) beschichteten Deckglas, genießen die Flüssigkeit ein gutes Stück Haftung zu erzielen und einen Tropfen ASCF auf der Scheibe. Legen Sie das Deckglas in die Aufnahme Kammer. Blockade der inhibitorischen Übertragung durch Picrotoxin können in epileptiforme Aktivität führen, dh spontan, synchrone Feuern von neuronalen Populationen, die die Messung evozierter Ereignisse verfälscht wird. So zum epileptiforme Aktivität zu vermeiden, stellen einflachen Einschnitt (nur die Oberfläche) zwischen den CA1 und CA3 Regionen zur Verhinderung der Ausbreitung über die Schaffer-Kollateralen (wie in 2a gezeigt).
- Stratum radiatum Astrozyten können durch ihre geringe soma Größe (~ 10 &mgr; m) und sternförmige Prozess der Montage identifiziert werden. Wählen Sie eine Zelle mindestens 20-30 um unterhalb der Scheibenoberfläche. Montieren Sie ein Glas Stimulationselektrode (Kippstabilität ~ 1 M) auf dem Silberdraht, die auf den Reiz Isolation Box verbunden und geerdet, um das Bad (einfach durch Umwickeln des zweiten Silberdraht um die Glaspipette). Platzieren Sie die Stimulationselektrode in die Schaffer Sicherheiten Region, wie in 2A in einem Abstand von 200-300 um weg von der gewählten Astrozyten gekennzeichnet. Montieren Sie die field recording Elektrode (~ 2-5 MOhm) auf einem chlorierten Silberdraht mit dem Headstage des Verstärkers. Beide Elektroden befinden sich vorher mit ACSF gefüllt. Wählen Sie in MultiClamp den Modus I = 0, die externe com deaktiviertBefehls-Eingang und die Elektrode ~ 50 um weg von der Astrozyten in das Stratum radiatum Bereich (2A). Notieren Sie die Antworten mit Gain 2 bis 10 und Filter mit einem 2 kHz Bessel-Filter. Elektrische Strominjektion in die Hirnschnittkultur auslöst Aktionspotentiale in den umliegenden Schaffer Sicherheiten Axonen und anschließende Transmitterausschüttung an den präsynaptischen Enden dieses Projekt an postsynaptische CA1 pyramidalen Neuronen. Die freigesetzten Transmitter löst eine positive Ladung fließen in die Zellen durch postsynaptische ionotropen Rezeptoren, die messbar ist extrazellulär als ein kleines negatives Potential. Dieses Feld exzitatorischen postsynaptischen Potentials (fEPSP) integriert die Aktivität einer Gruppe von gleichzeitig aktiven Neuronen, während hemmende Übertragung pharmakologisch blockiert ist. Gelten einige Testimpulse (0,1 ms Dauer), um eine fEPSP erinnern, einige Neupositionierung der Stimulationselektrode könnte helfen, die fEPSP erhöhen. Ein typisches CA1 Stratum Radiatum fEPSP ist in 2B dargestellt. Weitere Einzelheiten zur Positionierung und Antwort Wellenformen können in Yuan et al. 2003 2. Die fEPSP Amplitude in einem gesunden Hippocampusschnitt sollte in der Regel mehr als doppelt so groß wie die Amplitude der Faser volley. Für eine genaue Quantifizierung der fEPSP Amplitude oder Neigung sollte der evozierten reponse sein monosynaptischen als polysynaptischen Aktivität (detektierbaren als Multi-Spitzenempfindlichkeit) zeigt synaptischen Aktivität unabhängig von der elektrischen Stimulation, die ein Zeichen für Übererregbarkeit sein könnten. Für Experimente in der CA3 Region des Hippocampus durchgeführt werden Stimulation und Ableitung Pipetten positioniert, wie in 3C veranschaulicht. Zur eindeutigen Identifizierung Moosfaser Eingänge, die dringend erleichtert werden, gepaarte-Puls Stimulation (50 Zwischenpulsintervall msec) und 1 Hz Stimulation für einige Sekunden aufgebracht massiv verbessern die anfänglich niedriger Amplitude hervorgerufen fEPSP responses.At das Endeder Versuch DCGIV ein mGluR2 / 3 Rezeptor-Antagonist kann in weiter sicherzustellen, dass tatsächlich Moosfaser Eingänge stimuliert wurden gewaschen werden. Anwendung dieses Antagonisten sollten die fEPSP von ~ 90% aufgrund der hohen Expression von mGluR2 / 3 Rezeptoren hemmen präsynaptischen Freisetzung aus Moosfaser boutons reduzieren.
- Füllen eines Patch-Pipette (~ 2-5 MOhm) mit gefilterter interne Lösung und montieren es auf einem chlorierten Silberdraht mit dem zweiten Headstage gelten Überdruck mit einer Spritze, die über eine Rohrleitung in einen Pipettenhalter verbunden ist. Ständig gilt ein 20 ms Testimpuls von 10 mV und bewegen Sie die Pipette in das Gewebe bis zur Zelloberfläche und erreichen eine Auslenkung der Membran sichtbar. Null der Pipette Offset, entfernen Sie den Überdruck, und klemmen Sie die Membran auf - 80 mV. Warten Sie, bis eine undurchlässige (mindestens 1 G) erreicht ist (es sollte nicht länger dauern als ein paar Sekunden). Sanfte Anwendung einiger negativer Druck könnte helfen, ag erreichenigaseal. Brechen Sie in die Zelle wird durch einen kurzen Anwendung von Unterdruck erreicht oder mit dem zap Funktion Muffe. Starten Sie die gleichzeitige Aufzeichnung der Schaffer Sicherheiten evozierte fEPSP und die astrogliale Antwort in Spannungsklemme (Vhold - 80 mV, Frequenzbereich 0,1 Hz, Bessel-Filter 2 kHz, Verstärkung 10). Die astrogliale aktuelle Antwort ist biphasisch: Zuerst wird eine schnelle transiente Auswärtsstrom zu sehen, was fEPSPs durch benachbarte Pyramidenzellen generiert. Dies wird durch einen langsam ansteigenden und abfallenden Einwärtsstrom (mehrere Sekunden andauernde (> 10 sec) nach Beendigung des neuronalen Antworten) gefolgt. Dieser Strom ist vor allem Kalium Einstieg in Astrozyten, nach der Entlassung von umliegenden depolarisiert postsynaptischen Terminals. Ein gleichzeitig aktiviert schnelle transiente Glutamat-Transporter Strom (GLT), gefolgt von präsynaptischen Freisetzung von Glutamat ausgelöst wird durch die kaliumsparende aktuellen maskiert. Die Haltepotential der Astrozyten, sowie der Zugang Widerstand der Patch sollte sein monitored während des Experiments und sollte nicht um mehr als ca. 20%, zu ungenauen Überwachung astroglialen reponses aufgrund von Veränderungen in den Aufnahmebedingungen vermeiden. Nur Astrozyten mit einer anfänglichen Beteiligung Potenzial> -70 mV sollte untersucht werden, um gesunde Zellen zu studieren.
- Umschalten von Spannungs-Strom-Clamp um die evozierte astrozytären Membrandepolarisierung aufzuzeichnen. Isolieren der glialen Glutamat-Transporter (GLT) Strom durch Perfusion des ionotropen Glutamat-Rezeptor-Blocker Kynurensäure (5 mM), bis die fEPSP vollständig blockiert ist und die Amplitude GLT ein Plateau erreicht. Zur eindeutigen Identifizierung der GLT Strom, gelten die spezifischen Antagonisten DL-threo-β-Benzyloxyaspartatic Säure (DL-TBOA, 200 uM). Steigern der Stimulation igen 2-fach bis 5-fach bis neuronalen und astroglialen Reaktionen bei unterschiedlichen synaptischen Stärke aufzunehmen, und wenden zwei eng beabstandeten Stimuli (50 msec Intervall), um Antworten auf gepaarten Impulses Stimulation untersucht. Stabilität der Serie resistance und Membranpotential des Gliazelle sollte während der Aufzeichnung überwacht werden.
- Zur Visualisierung der Umfang des Gap-Junction vermittelt astroglialen Netzwerken sollte Farbstoff-Kupplung Experimente in Stromklemme Modus durchgeführt werden, ohne Strominjektion auf passive Diffusion niedermolekularer Farbstoffe (<1,5 kDa), wie Sulforhodamin-B zu ermöglichen, durch Gap Junction Kanälen. Farbstoffzubereitungen Übergreifen in das umgebende Gewebe zu minimieren, sollte Überdruck durch die Patch-Pipette aufgetragen werden nur bei der Eingabe des Gewebes und das Pflaster sollte so rasch wie möglich erreicht werden.
Ergebnisse
Eine repräsentative gleichzeitige Aufzeichnung von synaptisch hervorgerufenen astroglialen und neuronale Reaktionen (fEPSPs) in der CA1-Region des Hippocampus wird in Abbildung 2 AB gezeigt. Die evozierte astroglialen zweiphasigen Strom, dh es besteht aus einer transienten Auswärtsstrom und einer langsam abklingenden Einwärtsstrom (> 10 Sekunden) (2B). Die Auswärtsstrom spiegelt die evozierte fEPSP, und nach Hemmung der ionotropen Glutamat-Rezeptoren durch Kynurensäure (dunkelgrau Spur, 2B) 3 blockiert. Die Mehrheit der langsamen Einwärtsstrom reflektiert Kalium Eintritt in den Astrozyten folgenden postsynaptischen Depolarisation, da sie ebenfalls durch Kynurensäure, welche postsynaptische ionotropen Glutamat-Rezeptor-Aktivität hemmt (2B und 2C 1) 3-6, bekannt, den Haupt repräsentieren abgeschafft Quelle (80%) Kalium-Version 7. Die restlichen rapide eind verfallenden innen Strom wird durch die GLT-Antagonisten DL-TBOA (hellgrau Spur, 2B und 2C 2) gehemmt. Post-hoc-Subtraktion des verbleibenden langsamen Strom in TBOA (hellgrau Spur) aus dem Strom in Kynurensäure (dunkelgrau Trace) erlaubt die Isolierung des reinen astroglialen Glutamattransporter Strom (schwarze Kurve), wie in 2C 2 dargestellt. Die persistente langsam abfallenden in Kynurensäure aktuellen und TBOA (hellgrau Spur, 2B und 2C 2) durch TTX (Daten nicht gezeigt) blockiert werden, und spiegelt wahrscheinlich die Anhäufung von extrazellulären K +-Freigabe während präsynaptischen afferenten Feuerung 3. Moderates Stimulation der Schaffer-Kollateralen induziert eine relativ große synaptisch hervorgerufenen astroglialen aktuellen Vergleich zur geringen evozierte Depolarisation in der gleichen Zelle (2D) erfasst. Dies ist auf dieniedrige Membranwiderstände von Astrozyten. Aufzeichnung der synaptisch hervorgerufenen astroglialen Membranpotential Dynamik, wie in 2D dargestellt, ist ein direktes Maß für lokale extrazellulären Kaliumspiegel 8. Normalisierung der evozierten astrogliale Antworten auf die zugrunde liegenden neuronalen Aktivität ermöglicht den direkten Vergleich von verschiedenen Experimenten, wie jüngst 6 dargestellt. Astroglialen Ströme kann weiterhin sehr zuverlässig überwachen Veränderungen exzitatorischen Übertragung, als die Gesamtzahl synaptisch hervorgerufenen astroglialen Strom folgt linear die Erhöhung des fEPSP (2E). Astroglialen Ströme reflektieren auch kurzfristige synaptischen Plastizität, da sie zeigen, wie Neuronen, gepaarten-Puls Erleichterung (2F). Gepaarten Ganzzell-Aufzeichnung eines CA1-Pyramidenzellen und einem Astrozyten offenbaren sehr unterschiedliche elektrophysiologischen Verhalten in beiden Zelltypen, da die Anzeige Neuron Aktionspotentiale in Reaktion auf eine depolarisierende Puls,während die benachbarten Astrozyten schweigt (3A-B). Allerdings kann moderate Belebung des Schaffer-Kollateralen gleichzeitig evozieren eine schnelle exzitatorische posynaptic Potenzial in der CA1-Pyramidenzellen und eine schnelle Hin-und langsam nach innen Ströme in den benachbarten Astrozyten (3B 2). Dual Aufnahmen synaptisch hervorgerufenen neuronalen und astroglialen Reaktionen können auch in der CA3 Region des Hippocampus aufgezeichnet werden, wie in 3C gezeigt. Tatsächlich erinnert einzigen Stimulation der CA3 Moosfasern in basalen Bedingungen sehr kleinen neuronalen Antworten, wie lokale fEPSPs, verbunden mit kleinen schnellen Hin-und langsame Einwärtsströme in Astrozyten (Abbildung 3D 1) aufgezeichnet. Dagegen 1 Hz Stimulation CA3 Moosfasern für einige Sekunden stark potenziert die fEPSP, während sie erhöht die nur mäßig astroglialen Reaktion (3D 2).
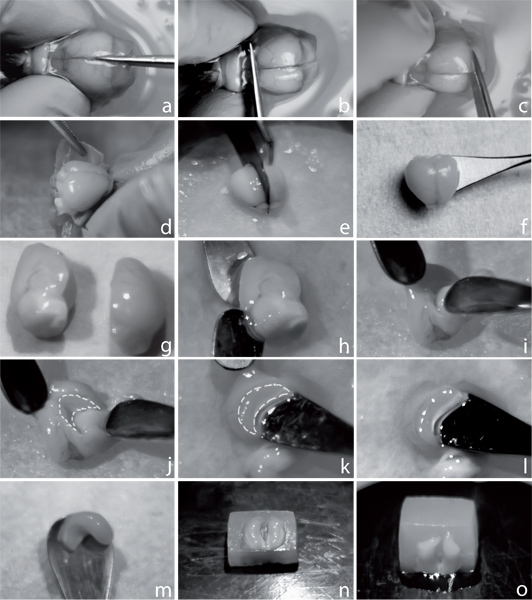
Abbildung 1. Hippocampus Trennung nach transversale Schnitte vorzubereiten. Um das Gehirn sezieren, schneiden Sie den Schädel entlang der Mittellinie (a). Einen Schnitt an der koronalen Ebene der Riechkolben (b) und anschließend auf der Ebene des Cerebellums (c). Entfernen Sie vorsichtig den Schädel mit Hilfe einer Zange (d), trennen die beiden Hemisphären mit einer Klinge (e), und übertragen Sie sie auf einem kleinen Löffel in kaltem Sauerstoff ACSF (f). Nach ca. 5 min Äquilibrierung, legen eine Hemisphäre auf trockenen Gewebe mit der medialen Oberfläche bis (g). Mit Hilfe von zwei Löffeln entfernen Zwischenhirn (hj). Der Hippocampus ist jetzt sichtbar, wie durch die gestrichelten Linien (k) dargestellt. Präparieren des Hippocampus mit einem Löffel aus ausgehend von der Fimbrien, sichtbar als weiße Struktur (lm). Übertragen Sie die Hippocampus zurück in den kalten ACSF. Bereiten Sie eine kleine Agarose-Block, Position der beiden hippocampi mit dem alveus Seite nach oben und der ventralen Hippocampuns zugewandten Rand der Agar-Block und einweichen sorgfältig gesamte Flüssigkeit entfernt, um eine gute Befestigung an den Agar (n) zu ermöglichen. Kleber der Hippocampus der Agar-Block auf das ventrale Teil (o) angebracht ist.
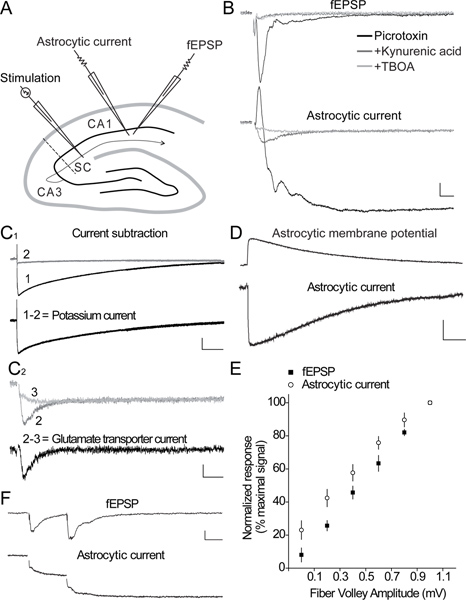
Abbildung 2. Gleichzeitige neuronalen und astrogliale Antworten in der CA1-Region des Hippocampus-synaptisch hervorgerufen. A) Schematische Darstellung des Hippocampusschnitt welche die Anordnung der stimulierenden Elektrode, um die Schaffer-Kollateralen (SC), der Patch-Pipette Elektrode, zu aktivieren, um astrozytären Ströme aufnehmen und die extrazelluläre Elektrode aufnehmen fEPSP, hervorgerufen durch SC Stimulation im hippocampalen CA1-Region. B) Repräsentative Spuren gleichzeitige Aufnahmen fEPSPs (oberes Feld) und astrozytären Ströme (unteres Bild) hervorgerufenen synaptisch von SC Stimulation in der presence pharmakologischer Wirkstoffe. Die Antworten werden zunächst in Gegenwart eines GABA A-Rezeptor-Blocker (Picrotoxin, 100 pM, schwarz Spuren) zu isolieren exzitatorischen Reaktionen aufgezeichnet. Anschließendes Aufbringen eines ionotropen Glutamat-Rezeptor-Blocker (Kynurensäure, 5 mM, dunkelgrau Spuren), hemmt die fEPSP und den größten Teil des lang anhaltenden astroglialen aktuellen und demaskiert eine kleine und schnelle transiente Komponente des astrozytären Stromantwort, das ist empfindlich auf eine Glutamat-Transporter-Blocker (TBOA, 200 uM, hellgrau Spuren). Maßstab, fEPSP 0,1 mV, astrozytären derzeit 15 pA, 10 msec. C 1). Probe Spur des astroglialen Kaliumstrom (1-2), die aus der evozierten Reaktion, in B (untere Tafel, schwarze Kurve) dargestellt ist, durch Subtrahieren der Gleichstromkomponente verbleibenden Kynurensäure (2) von den Summenstrom isoliert werden ( 1). Maßstab, 20 pA, 1 sec. C 2) Probe Spur des aktuellen Glutamattransporter (2-3), durch Subtraktion des erhaltenen TBOA insensitive langsame Komponente (3) aus dem Strom in Kynurensäure (2). Maßstab, 2,5 pA, 25 msec. D) Beispiel Spuren von einer nach innen gerichteten Strom in Spannung-Klammer (untere Tafel) und dem entsprechenden Membrandepolarisierung in den Strom-Klemme (oberes Feld) in einem Astrozyten durch SC Stimulation induziert aufgezeichnet. Maßstab, Strom-klemmen 1,5 mV, Voltage-Clamp-5 pA, 1 sec. E) Eingangs-Ausgangs-Kurven, die die Beziehung zwischen der präsynaptischen Faser Salven (Input) und das Gesamtgewicht astroglialen Strom (Leistung) gleichzeitig aufgenommen in Reaktion auf SC Stimulation (n = 6). Die astrogliale Strom steigt linear mit den erhöhten Faser Salven, wie die neuronale fEPSP. F) Sample Spuren der neuronale Antwort (fEPSP) und der astrozytären Strom werden für gepaarte-Puls-Stimulation bei einer 40 msec Zwischenpulsintervall gezeigt. Die synaptisch-evozierte astrogliale aktuellen Exponaten, wie Neuronen, paired-pulse Erleichterung. Maßstab, 0,1 mV, 5 pA, 20 msec.
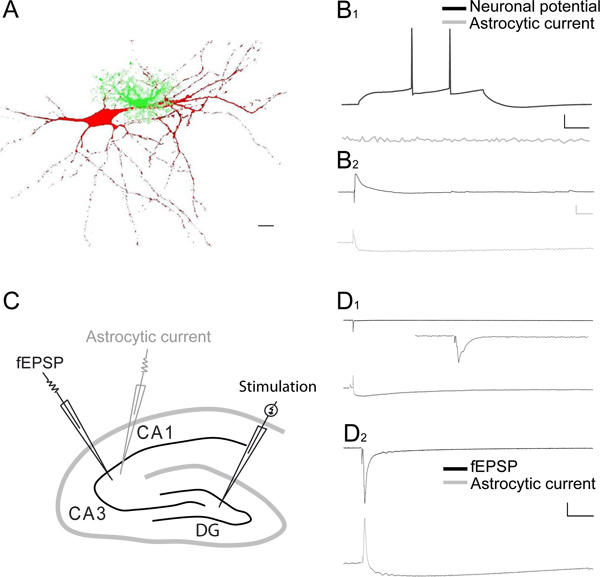
Abbildung 3. Dual Aufnahmen synaptisch-induzierte neuronale und astroglialen Reaktionen in den CA1 und CA3 Bereiche des Hippocampus. A) Rekonstruktion eines CA1 Pyramidenzellen mit Sulforhodamin-B (rot, 0,1%) und einem Astrozyten mit Fluorescein Dextran (grün, 0,1%) gefüllt, mit der whole-cell Patch-Clamp-Technik injiziert. Maßstab, 10 mm. B 1) Repräsentative Spuren der gleichzeitigen Ganzzellableitungen des Membranpotentials in Current-Clamp aus einer CA1 Pyramidenzellen und einem benachbarten Astrozyten aufgenommen. Neuronale Feuern Aktionspotentials (schwarze Kurve), hervorgerufen durch Injektion einer 20 pA depolarisierenden Stromimpulses, evoziert keine Reaktion in dem benachbarten Astrozyten (graue Kurve). Maßstab, 20 mV, 10 pA, 100 msec. B 2) Probe Spuren von zwei Ganzzellableitungen eines CA1 Pyramidenzellen in Strom-clamp und ein benachbarter Astrozyten im Voltage-Clamp nach SC Stimulation in Gegenwart Picrotoxin (100 pM). SC Stimulation evoziert eine exzitatorischen postsynaptischen Potentials (EPSP, schwarze Kurve), verbunden mit einem kleinen und langlebige astrozytären Strom (graue Kurve). Maßstabsbalken, 5 mV, 10 pA, 100 msec. C) Schematische Darstellung des Hippocampusschnitt Darstellung im Gyrus dentatus (DG) und CA3 Bereiche die Anordnung von der stimulierenden Elektrode, um die Moosfasern, die Patch-Pipette Elektrode (grau), um astrozytären Ströme aufnehmen und die extrazelluläre Elektrode zu aktivieren Rekord fEPSP von CA3 Moosfasern Stimulation hervorgerufen. D, E) Repräsentative Spuren von paarweisen Aufnahmen von CA3 fEPSPs (obere Felder, schwarz Spuren in D 1 und D 2) und astrozytären Ganzzell-Reaktionen (untere Felder, grau Spuren in D 1 und D 2), um einzelne Stimulation von CA3 moosigen Fasern bei 0,02 Hz (zoom im Einschub) (D 1) oder bei 1 Hz Stimulationsfrequenz (D 2). Maßstab für D 1 und D 2, 0,2 mV, 15 pA, Zeit: D 1 1 sec; D 2 100 msec. Inset Maßstab, 0,1 mV, 100 ms.
Diskussion
Dual-Aufnahme synaptisch-induzierte neuronale und gliale Reaktionen ist eine nützliche Methode, um Online-Änderungen in prä-und postsynaptischen Aktivitäten verbundenen Änderungen in astrogliale Eigenschaften zu studieren. Die synaptisch hervorgerufenen glialen Membrandepolarisierung ist ein direktes Maß für die extrazelluläre Kalium Anstieg 8, die zum Teil auf präsynaptische Aktionspotential Brennen, aber meist an postsynaptische Depolarisation 7. Deshalb Aufnahmen von Gliazellen Membranpotential Dynamik kann verwendet werden, um Änderungen in präsynaptische Erregbarkeit, postsynaptische Aktivität extrazelluläre Raumvolumen und Kalium Pufferkapazitäten 6, 8 untersucht werden. Die astrogliale Glutamat-Transporter Strom ist ein empfindliches Maß der präsynaptischen Freisetzung von Glutamat in der Lage, kurzfristige Änderungen in Release Wahrscheinlichkeit 3, 5, 9 überwachen. Es kann weiterhin verwendet werden, um die funktionalen synapse-Glia Interaktionen bei verschiedenen Synapsen oder in unterschiedlichen Entwicklungsstadien st charakterisierenim Alter von 10. Es sollte betont werden, dass GLTs stark temperaturempfindlich sind 11 und werden durch die elektrochemische Gradient von Na +, K + und H 12 antreibbar ist. So ist die Amplitude und Kinetik der GLT bisher stark von den gewählten experimentellen Bedingungen abhängen. Ferner ist der zeitliche Verlauf der Ist-astroglialen Glutamat Clearance aus dem aufgezeichneten GLT Strom abgeleitet bekanntermaßen teilweise verdeckt werden. Dies liegt an der Filterung der GLT Ströme durch Faktoren wie den Eigenschaften der elektrotonischen Astrozyten oder dem asynchronen Sender-Mitteilung, welche die Kinetik verzerren 13. Verfahren Extrahieren der zeitlichen Merkmale der Filtermechanismen entwickelt worden und kann zur Ableitung der tatsächlichen Glutamat Räumzeit Kurs in physiologischen oder pathologischen Situationen, wie recenly 6,13,14 durchgeführt. Zusätzlich wird die gleichzeitige Aufnahme des astrogliale Membrandepolarisation, in Stromzange bieten kann INSIGhts zu möglichen Veränderungen der extrazellulären Kalium-Transienten. Einzel Astrozyten Kontakt bis zu 100.000 Synapsen von ~ 100 verschiedene Neuronen und müssen daher integrieren und modulieren die Aktivität der lokale neuronale Netze.
Bei der Verwendung der hier vorgestellte Technik, dh Aufzeichnung elektrophysiologischer whole-cell Antworten von Astrozyten, um Einblicke in basale synaptische Aktivität zu gewinnen, sollte man im Hinterkopf behalten, dass in Astrozyten, Patch-Clamp-Aufnahmen im soma Ebene Erfassen von Strömen meist Ursprung aus der Zelle soma ermöglichen oder proximalen Prozesse. Tatsächlich Ströme am Soma detektiert nur teilweise aus feinen distalen Prozessen stammen, wenn eine starke Aktivierung von Rezeptoren und Kanäle vorkommende in mehreren Prozessen feinen Ströme ausbreitet zum Zellsoma erzeugen kann. So basalen Rezeptor und Kanal-Aktivität in einzelnen kleinen astrogliale Prozesse abdeckt synaptischen Kompartimenten ist kaum nachweisbar. Dies ist zum Teil aufgrund der eingeschränkten Laichial und zeitliche Kontrolle der Membran Ströme und Spannungen durch whole-cell Patch-Clamp-Aufnahmen von Astrozyten in situ. Allerdings ist darauf hinzuweisen, dass die Oberfläche der reichlich vorhandenen winzigen Astrozytenfortsätze bei weitem die Membranfläche der Soma und Hauptprozesse überschreitet. Zusätzlich enthalten diese perisynaptic astroglialen Mikrodomänen die funktionsrelevanten Rezeptoren und Kanäle, die wahrscheinlich eine wichtige Rolle bei der Kommunikation und neuroglialen synaptischen Regulierung. Die Technik, die wir hier vorgestellten ist daher meist sinnvoll, die Astrozyten Integration synchroner Aktivität von neuronalen Ensembles studieren, auftretende insbesondere während Afferenz Stimulation. Es sollte nicht verwendet werden, um den Dialog zwischen den einzelnen Synapsen und benachbarten feinen astrozytären Vorgänge während basal spontane Aktivität zu untersuchen. Eine alternative Methode zur lokalen astrogliale Antworten durch basale synaptische Aktivität induziert studieren wäre Patch-Clamp-Aufnahmen von feinen Prozesse ausführen, wie dein in Dendriten 15. Obwohl Patchen diese feinen astrogliale Prozesse wahrscheinlich herausfordernd ist aufgrund ihrer geringen Größe, ist es wahrscheinlich eine Allee zu verfolgen, um mehr intime Dialog zwischen astrogliale Mikrodomänen und einzelner Synapsen zu entwirren. Allerdings können die Wahrscheinlichkeit kleiner elektrophysiologischen astrogliale Reaktionen aus einzelnen feinen astrogliale Prozesse unter Schwellenwerterkennung sein, da elektrische Störungen erreicht im Durchschnitt 5.3 pA in Patch-Clamp-Aufnahmen. Eine andere Methode zur astrogliale Antworten auf synaptische Aktivität zu studieren, ist Calcium Imaging, da die Aktivierung der Astrozyten Membran-Rezeptoren oder Transporter durch neuroaktive Stoffen intrazellulären Calcium-Transienten auslösen können. Allerdings kann Bulkbeladung von Astrozyten mit Kalzium-Indikatoren ebenfalls hauptsächlich reflektieren somatische Aktivität 16. Die Kombination von Elektrophysiologie und Kalzium-Imaging ermöglicht auch die Erkennung kleiner Calcium-Signale aus feinem astrogliale Prozessen, entweder spontan auftretende oder ausgelöst by minimal synaptischer Stimulierung 17, 18. Allerdings sollte man im Hinterkopf behalten, dass eine hohe Affinität Calcium-Indikatoren könnten wie Kalzium Puffer, hemmen wichtige Calcium Signalwege wirken, wohingegen niedriger Affinität Indikatoren unterhalb der Nachweisgrenze Ebene funktionieren könnte. Schließlich besteht ein elegantes und nicht-invasive Technik, um Calcium Ereignisse in feinen astrozytären Prozesse, die auch unter Umgehung des Auswaschens von intrazellulären Signalmolekülen während Ganzzell-Patch-Clamp, studieren Verwendung einer Membran gezielt Calcium-Sensor, der in Astrozyten ausgedrückt werden kann in situ, sowie in vivo-19. Allerdings können Calcium-Imaging nur Auskunft über ein Signalmolekül, das in vielen beteiligt ist, aber nicht alle zellulären Aktivitäten, während Ganzzell-Patch-Clamp liefert quantitative Informationen über alle verschiedenen Ionenströme auf Kanal und Rezeptoraktivierung ausgelöst. Deshalb gleichzeitige elektrophysiologische Aufnahmen von Neuronen und Astrozytensind eine einzigartige und leistungsfähige Methode zu entwirren Online die Dynamik der neuroglialen ionischen Signalisierung und seine Rolle Gehirn Informationsverarbeitung.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren bedanken sich bei Dana Kamalidenova, Morgan Autexier und Roch Chopier, die das Video und Animationen aus, sowie Florian Beck für die Fotos und die Post-Produktion des Videos Voice-over danken. Diese Arbeit wurde von Olympus gesponsert und unterstützt durch Zuschüsse aus dem HFSPO (Career Development Award), ANR (Programme Jeunes chercheurs und Programm Blanc Neurowissenschaften), FRC (Fédération pour la Recherche sur le Cerveau), INSERM und La Pitié Salpêtrière Krankenhaus (Translationale Forschung Vertrag) NR, aus Französisch Bundesforschungsministerium und die Deutsche Forschungsgemeinschaft Postdoc Stipendien an hoch, und aus den Doctoral School "Frontiers in Life Science", Paris Diderot Universität, Bettencourt Schuller Fundament und FRM (Fondation pour la Recherche Médicale) Promotionsstipendium für JS
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
| Picrotoxin | Sigma | P1675 | lösen sich in DMSO |
| Kynurensäure | Tocris | 0223 | lösen sich bei 34 ° C Rühren oder Ultraschallbehandlung |
| DL-TBOA | Tocris | 1223 | DCG IV Tocris 0975 |
Referenzen
- Finkel, A., Bookman, R., Crawley, J. N., et al. Chapter 6 The electrophysiology setup. Current protocols in neuroscience. , (2001).
- Yuan, Y. A., Atchison, W. D. Elelctrophysiological studies of neurotoxicants on central synaptic transmission in acutely isolated brain slices. Current Protocols in Toxicology. , (2003).
- Bergles, D. E., Jahr, C. E. Synaptic activation of glutamate transporters in hippocampal astrocytes. Neuron. 19, 1297-1308 (1997).
- Diamond, J. S., Bergles, D. E., Jahr, C. E. Glutamate release monitored with astrocyte transporter currents during LTP. Neuron. 21, 425-433 (1998).
- Luscher, C., Malenka, R. C., Nicoll, R. A. Monitoring glutamate release during LTP with glial transporter currents. Neuron. 21, 435-441 (1998).
- Pannasch, U., et al. Astroglial networks scale synaptic activity and plasticity. Proceedings of the National Academy of Sciences of the United States of America. 108, 8467-8472 (2011).
- Poolos, N. P., Mauk, M. D., Kocsis, J. D. Activity-evoked increases in extracellular potassium modulate presynaptic excitability in the CA1 region of the hippocampus. J. Neurophysiol. 58, 404-416 (1987).
- Amzica, F., Massimini, M., Manfridi, A. Spatial buffering during slow and paroxysmal sleep oscillations in cortical networks of glial cells in vivo. The Journal of neuroscience : the official journal of the Society for Neuroscience. 22, 1042-1053 (2002).
- Diamond, J. S., Jahr, C. E. Transporters buffer synaptically released glutamate on a submillisecond time scale. The Journal of neuroscience : the official journal of the Society for Neuroscience. 17, 4672-4687 (1997).
- Oliet, S. H., Piet, R., Poulain, D. A. Control of glutamate clearance and synaptic efficacy by glial coverage of neurons. Science. 292, 923-926 (2001).
- Bergles, D. E., Jahr, C. E. Glial contribution to glutamate uptake at Schaffer collateral-commissural synapses in the hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 7709-7716 (1998).
- Danbolt, N. C. Glutamate uptake. Prog. Neurobiol. 65, 1-105 (2001).
- Diamond, J. S. Deriving the glutamate clearance time course from transporter currents in CA1 hippocampal astrocytes: transmitter uptake gets faster during development. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 2906-2916 (2005).
- Scimemi, A., Tian, H., Diamond, J. S. Neuronal transporter regulate glutamate clearance, NMDA receptor activation, and synaptic plasticity in the hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 14581-14595 (2009).
- Davie, J. T., et al. Dendritic patch-clamp recording. Nature. 1, 1235-1247 (2006).
- Reeves, A. M., Shigetomi, E., Khakh, B. S. Bulk loading of calcium indicator dyes to study astrocyte physiology: key limitations and improvements using morphological maps. The Journal of neuroscience : the official journal of the Society for Neuroscience. 31, 9353-9358 (2011).
- Panatier, A., et al. Astrocytes are endogenous regulators of basal transmission at central synapses. Cell. 146, 785-798 (2011).
- Castro, M. A. D. i., et al. Local Ca2+ detection and modulation of synaptic release by astrocytes. Nature. 14, 1276-1284 (2011).
- Shigetomi, E., Kracun, S., Sofroniew, M. V., Khakh, B. S. A genetically targeted optical sensor to monitor calcium signals in astrocyte processes. Nature. 13, 759-766 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten