Method Article
Establecimiento de hongos entomopatógenos como endófitos: Hacia Control Biológico Endofítico
En este artículo
Resumen
Este protocolo se muestran dos métodos de inoculación para introducir el hongo entomopatógeno Beauveria bassiana Como endofito en el frijol común ( Phaseolus vulgaris), Como preparación para las evaluaciones posteriores de control biológico endofítica.
Resumen
Beauveria bassiana es un hongo entomopatógeno con la capacidad de colonizar plantas endofíticamente. Como B. endófito, bassiana puede jugar un papel en la protección de plantas de herbivoría y enfermedad. Este protocolo se muestran dos métodos de inoculación para establecer B. bassiana endofíticamente en el frijol común (Phaseolus vulgaris), en preparación para las evaluaciones posteriores de control biológico endofítica. Las plantas se cultivan a partir de semillas esterilizadas superficialmente durante dos semanas antes de recibir una B. tratamiento de bassiana 10 8 conidios / ml (o agua) aplicados como una pulverización foliar o tratamiento del suelo. Dos semanas más tarde, las plantas se cosecharon y sus hojas, tallos y raíces se muestrean para evaluar la colonización de hongos endofíticos. Para esto, las muestras son individualmente esterilizadas en superficie, se cortaron en secciones múltiples, y se incubaron en medios de agar de dextrosa de patata durante 20 días. Los medios de comunicación se inspecciona cada 2-3 días para observar el crecimiento de hongos comoasociado con partes de la instalación y registrar la ocurrencia de B. bassiana para estimar el alcance de su colonización endofítica. Los análisis de éxito inoculación comparar la ocurrencia de B. bassiana dentro de una parte de planta dada (es decir, hojas, tallos o raíces) a través de tratamientos y controles. Además del método de inoculación, el resultado específico del experimento puede depender de las especies de cultivo o variedad, las especies de hongos entomopatógenos cepa o aislado utilizada, y las condiciones de crecimiento de la planta.
Introducción
Hongos entomopatógenos son importantes reguladores de las poblaciones de insectos con un potencial considerable como micopesticidas 1. Sólo recientemente, sin embargo, tienen hongos entomopatógenos han demostrado que se producen como endófitos, tanto de forma natural y en respuesta a los métodos de inoculación diferentes 2. La función ecológica de los hongos entomopatógenos endofíticos sigue siendo en gran parte desconocida, pero algunos estudios han implicado en el crecimiento de las plantas 3,4, la resistencia herbívoro 5-8, y la resistencia a la enfermedad 9,10. El objetivo general de los métodos presentados aquí es la introducción de un hongo entomopatógeno como endofito, en preparación para las evaluaciones posteriores de control biológico endofítica.
Beauveria bassiana (Balsamo) Vullemin (Ascomycota: Hypocreales) es el mejor estudiado hongos endofíticos entomopatógeno 5-9,11-19, y está disponible como una mycopesticide comercial. Inoculación probado a establecer B. bassiana como endofito incluyen pociones suelos, revestimientos de semillas 14,17 18 y 14 inmersiones, salsas 13,15 radícula, raíz y rizoma inmersiones 11,16,18, tallo inyecciones de 17 de pulverizaciones foliares 14,17,20 y sprays de flores 19. Utilizando estos métodos, los investigadores han introducido B. bassiana en 11 plátano, frijol 7, 13 cacao, café 17, 7 de maíz, algodón 7, palmera datilera 12 de yute 21 de adormidera 20, calabaza 7, pino radiata 18, sorgo 14, tomate y trigo 7 7. La evidencia reciente sugiere que endofítica B. bassiana tiene el potencial de proteger a las plantas no sólo de las plagas de artrópodos 5-7,22-27, sino también de algunos patógenos de plantas 9.
El frijol común (Phaseolus vulgaris) se encuentra entre los cultivos más vulnerables a las plagasplagas y enfermedades. Puede ser afectado por más de 400 plagas y patógenos 200, cuyo ataque se cree que es el factor más limitante bean producción entre las regiones 28. En consecuencia, la alubia común puede ser un modelo de cultivo excelente para examinar todo el espectro de control biológico endofítica por B. bassiana. Como primer paso en esta dirección, este artículo describe aplicaciones foliares y de suelo pociones como métodos de inoculación para introducir B.bassiana como endofito en el frijol común.
Protocolo
1. Plantas
- Superficie a esterilizar las semillas de frijol (cv. Calima) sumergiéndolos durante dos minutos en hipoclorito de sodio al 0,5% y dos minutos en 70% de etanol. Enjuague las semillas tres veces en agua destilada estéril.
- Evaluar el éxito de su esterilización mediante siembra de 100 l de la última agua de lavado de la papa dextroxe agar (PDA) medios de comunicación, e incubar la placa durante 10 días a 25 ° C. Terminar y reinicie el experimento si cualquier crecimiento se ve en la placa.
- Plantar las semillas en grupos de tres en macetas que contenían una mezcla estéril de tierra y arena en una proporción de 2:1. Transferir las ollas a una cámara de crecimiento a 25 ° C, ca. 50% de humedad relativa y fotoperíodo 12 h. Una semana después de la germinación, eliminar los menos dos plántulas vigorosas. De agua cada 2-3 días con agua destilada estéril y fertilizar 10 y 20 días después de la siembra con una solución de agua 6 g / l de fertilizante NPK 15-15-15.
2. Hongo
- Obtener una comerciacial formulación de Beauveria bassiana cepa GHA (Mycotrol SE, Laverlam, Cali, Colombia).
- Para generar un cultivo de una sola espora, suspender ca. un asa de inoculación completo de conidios en 1 ml de una solución de agua 0,1% de Triton X-100 y agitar durante 10 seg. Entonces, la placa 100 l de la suspensión en 2,5% de agar Noble y se incuba durante 24 horas a 25 ° C. Transferir un conidio germina solo en una PDA 100 mm placa que contiene y crecer hasta que cubra toda la placa (ca. semanas 3-4).
- En condiciones estériles, raspar el crecimiento de los hongos de la superficie del medio y suspenderlo en 10 ml estéril 0,1% de Triton X-100. Vortex durante un minuto. A continuación, se filtra la suspensión a través de una gasa estéril para eliminar las hifas y obtener la suspensión de valores.
- Usar un hemocitómetro para estimar la concentración de la suspensión conidial stock. Para facilitar el recuento de conidios, preparar una dilución serial de 10.000 veces de la población, cada vez que la transferencia de 100 l of suspensión de conidias en 900 l de 0,1% de Triton X-100, y agitación en vórtex durante 10 s antes de la siguiente dilución.
- Para generar el inóculo, ajustar la suspensión de stock a una concentración final de 10 8 conidios / ml, usando la fórmula:
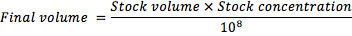
- Para evaluar la viabilidad de conidios, la placa 100 l de la dilución de 10.000 veces en 2,5% de agar Noble y se incuba durante 24 horas a 25 ° C. A continuación, inspeccione tres grupos al azar de 100 conidios para estimar el porcentaje de germinación. Considere un conidio germinado cuando un tubo germinal visible más largo que el diámetro medio de los proyectos de conidios de ella. Utilice únicamente la suspensión cuando el porcentaje de germinación promedio supera el 90%.
3. Inoculación
- Se inoculan las plantas cuando llegan a su etapa primera hoja verdadera (unos 14 días después de la siembra). Plantas de agua a la capacidad del suelo estéril con destilared agua 24 horas antes de inoculaciones.
- Para el método de pulverización foliar, utilizar un atomizador manual para aplicar la suspensión de conidias (tratamiento) o 0,1% Triton X-100 (control) a la adaxial (superior) de la superficie de hojas, hasta alcanzar la saturación. Cubrir la parte superior de la olla con papel de aluminio para evitar la escorrentía conidial para el suelo. Después de la pulverización, las plantas cubren con una bolsa de plástico durante 24 horas para mantener un alto nivel de humedad facilitar la invasión de hongos.
- Para el método de empapamiento de tierra, utilice un cilindro graduado para aplicar 10 ml de suspensión de conidias (tratamiento) o 0,1% Triton X-100 (control) a la superficie del suelo en la base de la planta.
- Después de inoculación, las plantas de volver a las cámaras de crecimiento organizarlos en un diseño de bloques completos al azar. No menos de cuatro bloques experimentales adicionales deben ser instalados para permitir evaluaciones de crecimiento de las plantas, además de las evaluaciones de la colonización endofítica, en el mismo experimento.
4. Evalluaciones
- Evaluar el experimento de un bloque a la vez, la selección de los bloques en orden aleatorio. Esto es particularmente importante para los experimentos de gran tamaño que no pueden ser evaluadas en un solo día.
- Antes de procesar una planta, medir y registrar su altura desde la base hasta el meristemo apical. A continuación, arrancar de raíz con cuidado y lavar abundantemente con agua corriente del grifo.
- De cada planta, muestra dos valvas, dos pedazos de raíz y dos trozos de tallo. Selección de muestras prospecto al azar de la primera hoja verdadera de la planta. A continuación, obtener dos muestras de tallo, 3 cm de largo cada una, a partir de la media de la planta y desde cerca de la superficie del suelo. Finalmente, obtener dos muestras de raíz principal, también de 3 cm de largo cada uno, desde la mitad de la raíz y de 1 cm por detrás de la punta de la raíz. Coloque las muestras en tres bolsas de papel y la etiqueta apropiada.
- Después de lavar y muestreo de todas las plantas en un bloque, comienza el procesamiento de las hojas, luego las raíces, los tallos y, finalmente, los.
- Surface esterilizar tcuestiones en una campana de flujo laminar estéril como en 1,1, por encima. Enjuague cada muestra tres veces por inmersión en agua destilada estéril y dejar secar en una toalla de papel estéril. Entonces, diseccionar y desechar sus bordes exteriores, donde los endófitos podrían haber sido eliminados debido al contacto con desinfectantes.
- Cortar la muestra recortada en seis secciones, con un promedio de 6x6 mm para hojas y 6 mm de longitud de los tallos y raíces. Placa de las seis secciones en un 60 mm placa de Petri con medio PDA suplementado con antibióticos de la tetraciclina, estreptomicina y penicilina a 2 mg / l de cada uno. Sellar la placa con parafilm y se incuba en la oscuridad a 25 ° C. Cada planta produce seis platos, dos por parte de la planta.
- Cambiar el agua de enjuague después de procesar cada bloque de una parte de planta dada. Antes de desechar el agua de lavado utilizado, la placa una muestra de 100 l en los medios de PDA y se incuban durante 10 días a 25 ° C para evaluar el éxito de la esterilización. Si el crecimiento de hongos se produce, no tienen en cuenta las correspondientes muestras para análisis.
- Inspeccione las placas cada 2-3 días durante 20 días para observar y registrar el crecimiento de hongos. Secciones sobre consumos específicos y la transferencia de las plantas exhiben presencia de hongos endófitos de placas que contienen PDA fresco. Esto evitará la contaminación de las secciones de la planta vecinos en la placa original.
- Record B. bassiana crecimiento de secciones de la planta. Beauveria bassiana se pueden identificar por característica micelio blanco denso convertirse en crema a amarillo pálido en el borde. En caso de duda, montar la muestra en una gota de agua e inspeccionar debajo de un microscopio, en busca de globosos conidios y conidióforos en forma de zigzag, característico de la especie.
- Utilice bloques experimentales adicionales para evaluar el impacto de los tratamientos sobre la biomasa vegetal. En primer lugar, medir su altura desde la base hasta la parte superior del meristemo apical. Luego, con cuidado desarraigar las plantas y lavar con agua corriente y dejar secar a 45 º C durante tres días para determinar su peso seco.
Resultados
B. bassiana fue capaz de colonizar endofíticamente-p vulgaris en respuesta a los tratamientos de inoculación demostrados (Figura 1). Ambas aplicaciones foliares y de suelo pociones resultado de la colonización endofítica por B. bassiana en más del 80% de las plantas tratadas (Figura 2). Sin embargo, el alcance de la colonización depende de la parte de la planta evaluada y el método de inoculación utilizado. Hojas respondido mejor a las inoculaciones por pulverización. Raíces, por otra parte, respondieron sólo a empapar inoculaciones. Finalmente, tallos respondieron de manera similar a los dos métodos de inoculación. B. bassiana no se detectó en ninguna de las secciones de control de planta.
Independientemente de los tratamientos, distintos de los endofitos B. bassiana creció de 15% de las secciones de la planta evaluados, pero fueron disecados de las placas de los medios de comunicación antes de que pudieran invadir secciones vecinas e influir en los resultados.
Las plantas de tratamiento y de control eran visiblemente indistinguible dos semanas después de inoculaciones. No se detectaron diferencias en su peso en seco y en su altura.

Figura 1. Los resultados representativos de los tratamientos de inoculación sobre la colonización endofítica de plantas de frijol (Phaseolus vulgaris cv Calima.) Por Beauveria bassiana. Arriba izquierda: control de placas sin crecimiento. Arriba a la derecha: hongos endófitos de una sección de la planta contaminando toda la placa. Abajo a la izquierda: B. bassiana que crece a partir de dos secciones de la planta. Abajo a la derecha: Endofítico B. bassiana conidios y conidióforos como se ve en el microscopio.
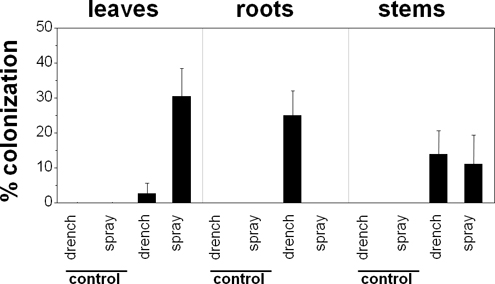
Figura 2. Efecto de los tratamientos de inoculación sobre la colonización endofítica de bean plantas (Phaseolus vulgaris cv. Calima) por Beauveria bassiana, dos semanas después de la inoculación con la cepa GHA. colonización por ciento representa el número de secciones de la planta colonizados dividido por el número de secciones cultivadas.
Discusión
Hay muchos factores que pueden influir en el resultado específico de un experimento para establecer un hongo entomopatógeno como endofito. Nuestros resultados demuestran el método de inoculación es una de ellas. Los factores biológicos incluyen a experimentar con el cultivo de especies o cultivares seleccionados y la cepa del hongo entomopatógeno especies o aislar utilizado. Otros factores a considerar incluyen la manipulación de la concentración del inóculo, la edad de la planta durante inoculaciones, y las condiciones de crecimiento de la planta.
Sería ideal para un método de inoculación para dar lugar a la colonización planta sistémica por un entomopatógeno 14,17,18,21 hongos. En cambio, parece que los métodos de inoculación tienden a favorecer un patrón específico de colonización local. En el café, por ejemplo, pulverizaciones foliares favorecer la colonización hoja mientras que empapa el suelo favorece colonización de la raíz 17. Encontramos el mismo patrón en el frijol común. En última instancia, la elección del método de inoculación debe serguiada por la ubicación prevista de la endofito dentro de una planta, es de suponer que coincida con el lugar de destino o el herbívoro patógeno de la planta.
Aunque comúnmente utilizado, la detección y cuantificación endofito basa en culturas mediáticas puede ser costoso, difícil y propenso a errores. Por ejemplo, un total de 10.800 secciones de la planta (1.800 sembraron en placas de Petri) se evaluaron en un experimento para optimizar B. bassiana inoculaciones de plátano 16. De estos, 4.496 secciones fueron colonizados por un putativo B. bassiana, como se identifica principalmente por la morfología de colonia. Es evidente que una verificación microscópica de la especie para cada colonia habría sido un paso deseable, pero inalcanzable. Por otra parte, 1.176 secciones fueron colonizadas por otros hongos y se descartaron y se trata como datos que faltan 16. La probabilidad existe, sin embargo, que B. bassiana es un mal competidor o más lento para crecer, y eventualmente podría haber surgido de esas secciones si untiempo suficiente llowed. Por lo tanto, los métodos de detección basados en endófitos culturas mediáticas están sujetos a los falsos positivos y falsos negativos. En consecuencia, el desarrollo de una detección más fiable y cuantificación métodos, por ejemplo los basados en la reacción en cadena de la polimerasa (PCR) 20,21,24, está bien justificada.
El objetivo final de los experimentos de inoculación debe ser el desarrollo de un tratamiento eficaz que proporciona una resistencia sistémica duradera contra la herbivoría y / o enfermedad. Una plausible, pero como aún no probado, la hipótesis es que el alcance de la colonización endofítica debe correlacionarse positivamente con el grado de endófito resistencia mediada. Un paso natural después de refinar los métodos de inoculación, por lo tanto, podría ser examinar esta correlación. Varios protocolos de vídeo puede ayudar a los investigadores a diseñar un ensayo de resistencia adecuada para una plaga o patógeno 29-31. En última instancia, este ensayo es lo que determina el éxito de la inoculaciónmétodo ción, y el potencial para el control biológico asociado endofítica.
Divulgaciones
Los autores declaran que no tienen intereses en conflicto financieros.
Agradecimientos
La producción y el trabajo experimental presentado en este documento reflejan la ayuda dedicada y entusiasta de Reynaldo Pareja. Financiado por el Departamento Administrativo de Colombia de Ciencia, Tecnología e Innovación (Colciencias) y por una donación de la Fundación Bill & Melinda Gates Foundation a través de la iniciativa Grand Challenges Exploraciones.
Materiales
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Name of Reagent/Material | Company | Catalog Number | |
| Mycotrol SE | Laverlam | 4167 | |
| Noble agar | Sigma | A5431-250G | |
| Penicillin G sodium salt | Sigma | P3032-25MU | |
| Petri dish (100 x 15 mm) | Fisher | 08-757-12 | |
| Petri dish (60 x 15 mm) | Fisher | 08-757-13A | |
| Potato dextrose agar | Difco | 213400 | |
| Regular bleach (NaOCl) | CLOROX | N/A | |
| Streptomycin sulfate salt | Sigma | S6501-25G | |
| Tetracycline | Sigma | T3258-25G | |
| Triple quince (NPK) | ABOCOL | N/A | |
| Triton X-100 | Sigma | X-100 | |
| EQUIPMENT | |||
| Biological safety cabinet | NuAire | NU-425-600 | |
| Hemocytometer | Fisher | 02-671-10 | |
| Leica DM LB microscope | Leica | N/A | |
Referencias
- Vega, F. E., Meyling, N. V., Luangsa-ard, J. J., Blackwell, M., Vega, F. E., Kaya, H. K. . Fungal entomopathogens in Insect Pathology. , 171-220 (2012).
- Vega, F. E. Insect pathology and fungal endophytes. Journal of invertebrate pathology. 98, 277-279 (2008).
- Sasan, R. K., Bidochka, M. J. The insect-pathogenic fungus Metarhizium robertsii (Clavicipitaceae) is also an endophyte that stimulates plant root development. American journal of botany. 99, 101-107 (2012).
- Elena, G. J., Beatriz, P. J., Alejandro, P. Metarhizium anisopliae (Metschnikoff) Sorokin promotes growth and has endophytic activity in tomato plants. Advances in biological research. 5, 22-27 (2011).
- Bing, L. A., Lewis, L. C. Suppression of Ostrinia nubilalis (Hübner)(Lepidoptera: Pyralidae) by endophytic Beauveria bassiana (Balsamo) Vuillemin. Environmental entomology. 20, 1207-1211 (1991).
- Akello, J., Dubois, T., Coyne, D., Kyamanywa, S. Endophytic Beauveria bassiana in banana (Musa spp.) reduces banana weevil (Cosmopolites sordidus) fitness and damage. Crop protection. 27, 1437-1441 (2008).
- Gurulingappa, P., Sword, G. A., Murdoch, G., McGee, P. A. Colonization of crop plants by fungal entomopathogens and their effects on two insect pests when in planta. Biological. 55, 34-41 (2010).
- Akello, J., Dubois, T., Coyne, D., Kyamanywa, S. Effect of endophytic Beauveria bassiana on populations of the banana weevil, Cosmopolites sordidus, and their damage in tissue-cultured banana plants. Entomologia experimentalis et applicata. 129, 157-165 (2008).
- Ownley, B. H., et al. Beauveria bassiana: Endophytic colonization and plant disease control. Journal of invertebrate pathology. 98, 267-270 (2008).
- Ownley, B. H., Gwinn, K. D., Vega, F. E. Endophytic fungal entomopathogens with activity against plant pathogens: ecology and evolution. BioControl. 55, 113-128 (2010).
- Akello, J., et al. Beauveria bassiana (Balsamo) Vuillemin as an endophyte in tissue culture banana (Musa spp.). Journal of invertebrate pathology. 96, 34-42 (2007).
- Gómez-Vidal, S., Lopez-Llorca, L. V., Jansson, H. B., Salinas, J. Endophytic colonization of date palm (Phoenix dactylifera L.) leaves by entomopathogenic fungi. Micron. 37, 624-632 (2006).
- Posada, F., Vega, F. E. Establishment of the fungal entomopathogen Beauveria bassiana (Ascomycota: Hypocreales) as an endophyte in cocoa seedlings (Theobroma cacao). Mycologia. 97, 1195-1200 (2005).
- Tefera, T., Vidal, S. Effect of inoculation method and plant growth medium on endophytic colonization of sorghum by the entomopathogenic fungus Beauveria bassiana. BioControl. 54, 663-669 (2009).
- Posada, F., Vega, F. E. Inoculation and colonization of coffee seedlings (Coffea arabica L.) with the fungal entomopathogen Beauveria bassiana (Ascomycota: Hypocreales. Mycoscience. 47, 284-289 (2006).
- Akello, J., Dubois, T., Coyne, D., Kyamanywa, S. The effects of Beauveria bassiana dose and exposure duration on colonization and growth of tissue cultured banana (Musa sp.) plants. Biological. 49, 6-10 (2009).
- Posada, F., Aime, M. C., Peterson, S. W., Rehner, S. A., Vega, F. E. Inoculation of coffee plants with the fungal entomopathogen Beauveria bassiana (Ascomycota: Hypocreales). Mycological research. 111, 748-757 (2007).
- Brownbridge, M., Reay, S. D., Nelson, T. L., Glare, T. R. Persistence of Beauveria bassiana (Ascomycota: Hypocreales) as an endophyte following inoculation of radiata pine seed and seedlings. Biological control. 61, 194-200 (2012).
- Posada, F. J., Chaves, F. C., Gianfagna, T. J., Pava-Ripoll, M., Hebbar, P. Establishment of the fungal entomopathogen Beauveria bassiana as an endophyte in cocoa pods (Theobroma cacao L.). Revista U.D.C.A. actualidad & divulgación científica. 13, 71-78 (2010).
- Quesada-Moraga, E., Landa, B. B., Muñoz-Ledesma, J., Jiménez-Díaz, R. M., Santiago-Alvarez, C. Endophytic colonisation of opium poppy, Papaver somniferum, by an entomopathogenic Beauveria bassiana strain. Mycopathologia. 161, 323-329 (2006).
- Biswas, C., Dey, P., Satpathy, S., Satya, P. Establishment of the fungal entomopathogen Beauveria bassiana as a season long endophyte in jute (Corchorus olitorius) and its rapid detection using SCAR marker. BioControl. , 1-7 (2011).
- Bing, L. A., Lewis, L. C. Occurrence of the entomopathogen Beauveria bassiana (Balsamo) Vuillemin in different tillage regimes and in Zea mays L. and virulence towards Ostrinia nubilalis (Hübner). Agriculture, ecosystems & environment. 45, 147-156 (1993).
- Akello, J., Sikora, R. Systemic acropedal influence of endophyte seed treatment on Acyrthosiphon pisum and Aphis fabae offspring development and reproductive fitness. Biological. 61, 215-221 (2012).
- Reddy, N. P., Ali Khan, A. P., Devi, U. K., Sharma, H. C., Reineke, A. Treatment of millet crop plant (Sorghum bicolor) with the entomopathogenic fungus (Beauveria bassiana) to combat infestation by the stem borer, Chilo partellus Swinhoe (Lepidoptera: Pyralidae. Journal of Asia Pacific. 12, 221 (2009).
- Quesada-Moraga, E., Muñoz-Ledesma, F. J., Santiago-Alvarez, C. Systemic protection of Papaver somniferum L. against Iraella luteipes (Hymenoptera: Cynipidae) by an endophytic strain of Beauveria bassiana (Ascomycota: Hypocreales). Environmental entomology. 38, 723-730 (2009).
- Cherry, A. J., Banito, A., Djegui, D., Lomer, C. Suppression of the stem-borer Sesamia calamistis (Lepidoptera; Noctuidae) in maize following seed dressing, topical application and stem injection with African isolates of Beauveria bassiana. International journal of pest management. 50, 67-73 (2004).
- Gurulingappa, P., McGee, P. A., Sword, G. Endophytic Lecanicillium lecanii and Beauveria bassiana reduce the survival and fecundity of Aphis gossypii following contact with conidia and secondary metabolites. Crop protection. 30, 349-353 (2011).
- van Schoonhoven, A., Voysest, O., Schwartz, H. F., Pastor-Corrales, M. A. . Common beans in Latin America and their constraints in Bean production problems in the tropics. , 33-57 (1989).
- De Vos, M., Jander, G. Choice and no-choice assays for testing the resistance of A. thaliana to chewing insects. J. Vis. Exp. (15), e683 (2008).
- Parsa, S., Sotelo, G., Cardona, C. Characterizing herbivore resistance mechanisms: spittlebugs on Brachiaria spp. as an example. J. Vis. Exp. (52), e3047 (2011).
- Atamian, H., Roberts, P., Kaloshian, I. High and low throughput screens with root-knot nematodes Meloidogyne spp. J. Vis. Exp. (61), e3629 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados