Method Article
Établir entomopathogènes fongiques comme endophytes: Vers un contrôle biologique endophytique
Dans cet article
Résumé
Ce protocole illustre deux méthodes d'inoculation d'introduire le champignon entomopathogène Beauveria bassiana L'état endophyte dans le haricot commun ( Phaseolus vulgaris), En préparation pour les évaluations ultérieures de lutte biologique endophyte.
Résumé
Beauveria bassiana est un champignon entomopathogène avec la capacité de coloniser les plantes endophyte. Comme un endophyte, B. bassiana peuvent jouer un rôle dans la protection des plantes contre les herbivores et les maladies. Ce protocole illustre deux méthodes d'inoculation pour établir B. bassiana endophyte dans le haricot commun (Phaseolus vulgaris), en préparation pour les évaluations ultérieures de lutte biologique endophyte. Les plantes sont cultivées à partir de graines stérilisées en surface pendant deux semaines avant de recevoir un B. traitement bassiana de 10 8 conidies / ml (ou l'eau) soit appliqué en pulvérisation foliaire ou par bassinage du sol. Deux semaines plus tard, les plantes sont récoltées et de leurs feuilles, les tiges et les racines sont échantillonnés pour évaluer endophyte colonisation fongique. Pour cela, les échantillons sont individuellement stérilisés en surface, coupé en plusieurs sections, et incubées dans un milieu Potato Dextrose Agar pour 20 jours. Les médias sont inspectés tous les 2-3 jours pour observer la croissance fongiquesociated avec des parties d'installation et d'enregistrer la présence de B. bassiana d'estimer l'ampleur de la colonisation endophyte. L'analyse des succès inoculation comparer la présence de B. bassiana dans une partie de la plante donnée (c.-à-feuilles, tiges ou racines) dans tous les traitements et les contrôles. En plus de la méthode d'inoculation, le résultat spécifique de l'expérience peut dépendre de l'espèce cultivée cibles ou de variétés, les espèces de champignons entomopathogènes souche ou isolat utilisé, et les conditions de croissance de la plante.
Introduction
Entomopathogènes fongiques sont des régulateurs importants de populations d'insectes avec un potentiel considérable en tant mycopesticides 1. Ce n'est que récemment, cependant, ont entomopathogènes fongiques été observé que les endophytes, à la fois naturellement et en réponse à diverses méthodes d'inoculation 2. La fonction écologique des endophytes fongiques entomopathogènes reste en grande partie inconnue, mais certaines études ont mis en cause dans les 3,4 la croissance des plantes, 5-8 résistance herbivore, et 9,10 résistance aux maladies. L'objectif global des méthodes présentées ici est d'introduire un entomopathogène fongique comme endophyte, en préparation pour les évaluations ultérieures de lutte biologique endophyte.
Beauveria bassiana (Balsamo) Vullemin (Ascomycota: Hypocreales) est le mieux étudié entomopathogène fongique 5-9,11-19 endophyte, et il est disponible en tant que mycopesticide commerciale. Méthodes d'inoculation testés pour établir B. bassiana comme endophyte comprennent bassinage du sol, 14,17 enrobages de semences 18 et 14, immersions pansements radicule 13,15 racines, des rhizomes et des immersions 11,16,18, tige injections 17, 14,17,20 pulvérisations foliaires et gerbes de fleurs 19. Grâce à ces méthodes, les chercheurs ont introduit B. bassiana dans la banane 11, haricot 7, cacao 13, café 17, le maïs 7, le coton 7, le palmier dattier 12, jute 21, 20 du pavot à opium, la citrouille 7, pin radiata 18, le sorgho 14, 7 et tomate blé 7. Des données récentes suggèrent que endophyte B. bassiana a le potentiel pour protéger les plantes non seulement des arthropodes nuisibles 5-7,22-27, mais aussi de quelque 9 agents pathogènes des plantes.
Le haricot commun (Phaseolus vulgaris) se classe parmi les cultures les plus vulnérables aux ravageurset les maladies. Il peut être affecté par plus de 400 organismes nuisibles et de 200 agents pathogènes, dont l'attaque est considérée comme le facteur le plus limitant la production de haricots dans les régions 28. En conséquence, le haricot commun peut être une culture excellent modèle pour étudier le spectre de la lutte biologique endophyte par B. bassiana. Dans une première étape dans cette direction, cet article décrit les pulvérisations foliaires et du sol potions que les méthodes d'inoculation d'introduire B.bassiana l'état endophyte dans le haricot commun.
Protocole
1. Plantes
- Surface de stériliser les graines de soja (cv. Calima) en les plongeant pendant deux minutes dans de l'hypochlorite de sodium à 0,5% et à deux minutes dans de l'éthanol à 70%. Rincer trois fois les graines dans de l'eau distillée stérile.
- Évaluer le succès de votre stérilisation en étalant 100 ul de la dernière eau de rinçage sur les pommes de terre gélose dextroxe (PDA) des médias, et l'incubation de la plaque pendant 10 jours à 25 ° C. Terminer et redémarrez l'expérience si aucune croissance est visible sur la plaque.
- Plantez les graines dans des groupes de trois dans des pots contenant un mélange stérile de terre et de sable à un ratio de 2:1. Transférer les pots à une chambre de croissance à 25 ° C, env. 50% HR et photopériode de 12 heures. Une semaine après la germination, éliminer les au moins deux jeunes plants vigoureux. Eau tous les 2-3 jours avec de l'eau distillée stérile et fertiliser 10 et 20 jours après la plantation avec une solution d'eau 6 g / L d'engrais NPK 15-15-15.
2. Fongus
- Procurez-vous un comformulation financière de souche GHA de Beauveria bassiana (Mycotrol SE, Laverlam, Cali, Colombie).
- Pour générer une culture unique stock de spores, de suspendre ca. une inoculation de conidies boucle complète dans 1 ml d'une solution aqueuse à 0,1% de Triton X-100 et vortex pendant 10 sec. Ensuite, la plaque 100 ul de la suspension sur de la gélose Noble 2,5% et incuber pendant 24 heures à 25 ° C. Transférer une seule conidie germant dans un PDA 100 mm et plaque contenant croître jusqu'à ce qu'elle couvre la totalité de la plaque (environ 3-4 semaines).
- Dans des conditions stériles, gratter la croissance fongique à partir de la surface du support et le suspendre dans 10 ml stérile 0,1% de Triton X-100. Vortex pendant une minute. Ensuite, filtrer la suspension à travers une étamine stérile pour éliminer les hyphes et obtenir la suspension stock.
- Utilisez un hémocytomètre pour estimer la concentration de la suspension de conidies stock. Pour faciliter comptes de conidies, préparer une dilution de série 10000 fois du stock, à chaque fois que le transfert de 100 pi of suspension de conidies dans 900 ul de 0,1% de Triton X-100, et vortex pendant 10 secondes avant la dilution suivante.
- Pour générer l'inoculum, ajuster la suspension-mère à une concentration finale de 10 8 conidies / ml, en utilisant la formule:
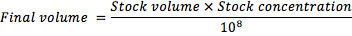
- Pour évaluer la viabilité des conidies, la plaque 100 ul de la dilution de 10.000 fois sur gélose Noble 2,5% et incuber pendant 24 heures à 25 ° C. Ensuite, inspecter trois groupes aléatoires de 100 conidies pour estimer la germination pour cent. Examiner une conidie germé quand un tube germinatif visible de plus de la moitié du diamètre des projets de ce conidie. N'utilisez que la suspension lorsque la germination pour cent en moyenne dépasse les 90%.
3. Inoculation
- Inoculer les plantes quand elles atteignent leur stade première feuille vraie (environ 14 jours après la plantation). Les plantes aquatiques à la capacité du sol à distiller stérilel'eau ed 24 heures avant inoculation.
- Pour la méthode de pulvérisation foliaire, utiliser un pulvérisateur manuel d'appliquer la suspension de conidies (traitement), soit 0,1% de Triton X-100 (contrôle) à l'adaxial (supérieure) de surface de feuilles jusqu'à ce qu'ils atteignent la saturation. Couvrez le dessus du pot avec du papier aluminium pour éviter le ruissellement des conidies au sol. Après la pulvérisation, couvrir les plantes avec un sac en plastique pendant 24 heures afin de maintenir un niveau élevé d'humidité faciliter l'invasion fongique.
- Pour la méthode de trempage du sol, utiliser un cylindre gradué d'appliquer 10 ml de suspension de conidies (traitement), soit 0,1% de Triton X-100 (contrôle) à la surface du sol à la base de la plante.
- Après inoculation, le retour des plantes dans les chambres de croissance en les disposant en blocs aléatoires complets. Pas moins de quatre blocs expérimentaux supplémentaires devraient être installés pour permettre des évaluations de la croissance des plantes, en plus des évaluations de la colonisation endophyte, dans la même expérience.
4. Evaluations
- Évaluer l'expérience d'un bloc à la fois, en sélectionnant les blocs dans un ordre aléatoire. Ceci est particulièrement important pour les grandes expériences qui ne peuvent pas être évalués sur une seule journée.
- Avant de traiter une plante, mesurer et enregistrer la hauteur de la base vers le méristème apical. Puis, déraciner soigneusement et lavez soigneusement à l'eau courante.
- De chaque plante, l'échantillon deux feuillets, deux morceaux de racine et deux morceaux de tige. Sélectionner des échantillons au hasard dans la brochure première vraie feuille de la plante. Ensuite, obtenir deux échantillons de tiges, 3 cm de long chacune, à partir du milieu de la plante et de près de la surface du sol. Enfin, obtenir deux échantillons pivotante, aussi 3 cm de long chacune, à partir du milieu du pied et de 1 cm de l'extrémité de la racine. Placer les échantillons sur trois sacs en papier et d'étiquettes séparées de manière appropriée.
- Après lavage et d'échantillonnage toutes les plantes dans un bloc, commencer par traiter les feuilles, puis les racines, et enfin les tiges.
- Surface stériliser tquestions dans une hotte à flux laminaire stérile comme en 1.1, ci-dessus. Rincer chaque échantillon trois fois par immersion dans de l'eau distillée stérile et laissez-le sécher dans une serviette en papier stérile. Puis, disséquer et jeter ses bords extérieurs, où les endophytes aurait pu être éliminé en raison du contact avec des désinfectants.
- Couper l'échantillon coupé en six sections, avec une moyenne 6x6 mm pour les feuilles et 6 mm de long pour les tiges et les racines. Plaque des six sections sur une plaque de 60 mm de Pétri avec les médias PDA complétées par la tétracycline antibiotiques, la streptomycine et la pénicilline à 2 mg / L chacun. Sceller la plaque avec du parafilm et incuber à l'obscurité à 25 ° C. Chaque plante donne six assiettes, deux pièces par plante.
- Changez l'eau de rinçage après le traitement de chaque bloc d'une partie de la plante donnée. Avant de jeter l'eau de rinçage utilisée, une plaque échantillon de 100 ul sur un support PDA et les incuber pendant 10 jours à 25 ° C pour évaluer le succès de stérilisation. Si la croissance des champignons en découle, ne considérez pas les échantillons correspondants pour les analyses.
- Inspectez les plaques tous les 2-3 jours pendant 20 jours pour observer et enregistrer une croissance fongique. Parties de l'installation d'accise et de transfert présentant présence de champignons endophytes des plaques contenant PDA fraîche. Ceci permettra d'éviter la contamination des parties de l'installation voisins dans la plaque d'origine.
- Enregistrer B. croissance bassiana de parties de l'installation. Beauveria bassiana peuvent être identifiés par caractéristique mycélium blanc dense devient crème à jaune pâle au bord. En cas de doute, monter le spécimen dans une goutte d'eau et inspecter sous un microscope, à la recherche d'globuleux conidies et des conidiophores en forme de zigzag, caractéristique de l'espèce.
- Utilisez d'autres blocs expérimentaux pour évaluer l'impact des traitements sur la biomasse végétale. Tout d'abord, mesurer leur hauteur à partir de la base vers le sommet du méristème apical. Ensuite, bien se laver et déraciner les plantes dans l'eau du robinet et laissez-les sécher à 45 ° C pendant trois jours afin de déterminer leur poids sec.
Résultats
B. bassiana a réussi à coloniser endophyte-p vulgaris en réponse aux traitements d'inoculation ont démontré (figure 1). Les deux pulvérisations foliaires et du sol par arrosage abouti à la colonisation endophyte par B. bassiana dans plus de 80% des plantes traitées (figure 2). Cependant, l'ampleur de la colonisation dépend de la partie de la plante évaluée et la méthode d'inoculation utilisée. Les feuilles ont le mieux répondu aux inoculations de pulvérisation. Racines, d'autre part, a répondu uniquement à des inoculations bassinage. Enfin, les tiges réagi de la même pour les deux méthodes d'inoculation. B. bassiana a été détecté dans aucun des parties de l'installation de contrôle.
Indépendamment des traitements, autres que les endophytes B. bassiana est passé de 15% des sections de l'usine évalués, mais ils ont été disséqués à partir de plaques médias avant qu'ils ne puissent envahir sections voisines et influencer les résultats.
Les usines de traitement et de contrôle étaient visiblement impossibles à distinguer deux semaines après inoculation. Aucune différence n'a été détectée dans leur poids sec et dans leur hauteur.

Figure 1. Les résultats représentatifs de traitements d'inoculation sur la colonisation endophyte des plants de haricot (Phaseolus vulgaris cv Calima.) Par Beauveria bassiana En haut à gauche:. Contrôle des plaques sans croissance. En haut à droite: endophyte fongique à partir d'une section de l'usine contaminer toute la plaque. En bas à gauche: B. bassiana de plus en plus de deux parties de l'installation. En bas à droite: B. endophytique bassiana conidies et les conidiophores comme on le voit sous un microscope.
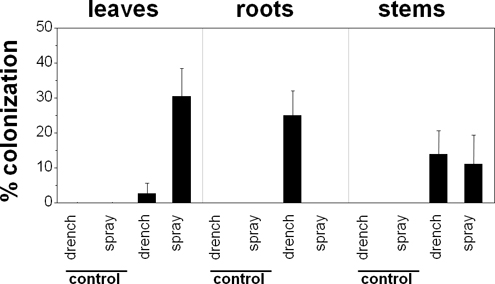
Figure 2. Effet des traitements d'inoculation sur la colonisation endophyte de bean plantes (Phaseolus vulgaris cv. Calima) par Beauveria bassiana, deux semaines après inoculation avec la souche GHA. colonisation pourcentage correspond au nombre de sections de plantes colonisées divisé par le nombre de sections de culture.
Discussion
De nombreux facteurs peuvent influencer le résultat d'une expérience spécifique d'établir un entomopathogène fongique comme endophyte. Nos résultats démontrent la méthode d'inoculation est l'un d'entre eux. Les facteurs biologiques à expérimenter avec notamment la récolte des espèces ou cultivars sélectionnés et la souche de champignon entomopathogène espèces ou d'isoler utilisé. Autres facteurs à considérer comprennent la manipulation de la concentration de l'inoculum, l'âge de la plante lors de vaccinations, et les conditions de croissance de la plante.
Il serait idéal pour une méthode d'inoculation d'aboutir à la colonisation des plantes systémique par un champignon entomopathogène 14,17,18,21. Au lieu de cela, il apparaît que les méthodes d'inoculation ont tendance à privilégier un modèle spécifique de la colonisation locale. Dans le café, par exemple, des pulvérisations foliaires favoriser la colonisation feuilles alors que bassinage du sol favorisent la colonisation des racines 17. Nous avons constaté la même tendance dans le haricot commun. En fin de compte, le choix de la méthode d'inoculation doit êtreguidé par l'emplacement prévu pour l'endophyte dans une usine, probablement correspondant à la niche de la cible ou herbivore phytopathogène.
Bien que couramment utilisé, la détection et la quantification endophyte basé sur les cultures des médias peut être coûteux, difficile et source d'erreurs. Par exemple, un total de 10.800 parties de l'installation (étalées sur des boîtes de Pétri 1800) ont été évalués dans une expérience pour optimiser B. inoculations bassiana sur la banane 16. Parmi ceux-ci, 4.496 articles ont été colonisés par une putative B. bassiana, identifiés principalement par la morphologie des colonies. De toute évidence, une vérification microscopique des espèces pour chaque colonie aurait été souhaitable, mais pas inabordable. D'autre part, 1.176 articles ont été colonisées par des champignons et d'autres ont été rejetées et considérées comme des données manquantes 16. La probabilité existe, cependant, que B. bassiana est un mauvais compétiteur ou plus lent à se développer, et aurait finalement émergé de ces articles, si unllowed suffisamment de temps. Par conséquent, les méthodes de détection endophytes basés sur les cultures des médias sont soumis à des faux positifs et des faux négatifs. En conséquence, le développement de la détection et de quantification plus fiable des méthodes, par exemple ceux basés sur la réaction en chaîne par polymérase (PCR) 20,21,24, est bien justifiée.
Le but ultime des expériences d'inoculation doit être de développer un traitement efficace qui offre une résistance durable contre les herbivores systémique et / ou de la maladie. Une plausible, mais encore non testés, l'hypothèse est que l'ampleur de la colonisation endophyte doit être en corrélation positive avec le degré de résistance médiée par endophyte. Une prochaine étape naturelle après l'affinement des méthodes d'inoculation, par conséquent, pourrait être d'examiner cette corrélation. Plusieurs protocoles vidéo peut aider les chercheurs à concevoir un test de résistance appropriée pour un organisme cible pathogène ou 29-31. En fin de compte, c'est ce test qui va déterminer le succès de l'inoculumtion méthode, et le potentiel associé pour la lutte biologique endophyte.
Déclarations de divulgation
Les auteurs déclarent n'avoir aucun conflit d'intérêts financiers.
Remerciements
La production et le travail expérimental présenté ici reflète l'aide dévouée et enthousiaste de Reynaldo Pareja. Financé par le Département administratif de la Colombie de la Science, de la Technologie et de l'Innovation (Colciencias) et par une subvention de la Fondation Bill & Melinda Gates à travers l'initiative du Grand Challenges Explorations.
matériels
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Name of Reagent/Material | Company | Catalog Number | |
| Mycotrol SE | Laverlam | 4167 | |
| Noble agar | Sigma | A5431-250G | |
| Penicillin G sodium salt | Sigma | P3032-25MU | |
| Petri dish (100 x 15 mm) | Fisher | 08-757-12 | |
| Petri dish (60 x 15 mm) | Fisher | 08-757-13A | |
| Potato dextrose agar | Difco | 213400 | |
| Regular bleach (NaOCl) | CLOROX | N/A | |
| Streptomycin sulfate salt | Sigma | S6501-25G | |
| Tetracycline | Sigma | T3258-25G | |
| Triple quince (NPK) | ABOCOL | N/A | |
| Triton X-100 | Sigma | X-100 | |
| EQUIPMENT | |||
| Biological safety cabinet | NuAire | NU-425-600 | |
| Hemocytometer | Fisher | 02-671-10 | |
| Leica DM LB microscope | Leica | N/A | |
Références
- Vega, F. E., Meyling, N. V., Luangsa-ard, J. J., Blackwell, M., Vega, F. E., Kaya, H. K. . Fungal entomopathogens in Insect Pathology. , 171-220 (2012).
- Vega, F. E. Insect pathology and fungal endophytes. Journal of invertebrate pathology. 98, 277-279 (2008).
- Sasan, R. K., Bidochka, M. J. The insect-pathogenic fungus Metarhizium robertsii (Clavicipitaceae) is also an endophyte that stimulates plant root development. American journal of botany. 99, 101-107 (2012).
- Elena, G. J., Beatriz, P. J., Alejandro, P. Metarhizium anisopliae (Metschnikoff) Sorokin promotes growth and has endophytic activity in tomato plants. Advances in biological research. 5, 22-27 (2011).
- Bing, L. A., Lewis, L. C. Suppression of Ostrinia nubilalis (Hübner)(Lepidoptera: Pyralidae) by endophytic Beauveria bassiana (Balsamo) Vuillemin. Environmental entomology. 20, 1207-1211 (1991).
- Akello, J., Dubois, T., Coyne, D., Kyamanywa, S. Endophytic Beauveria bassiana in banana (Musa spp.) reduces banana weevil (Cosmopolites sordidus) fitness and damage. Crop protection. 27, 1437-1441 (2008).
- Gurulingappa, P., Sword, G. A., Murdoch, G., McGee, P. A. Colonization of crop plants by fungal entomopathogens and their effects on two insect pests when in planta. Biological. 55, 34-41 (2010).
- Akello, J., Dubois, T., Coyne, D., Kyamanywa, S. Effect of endophytic Beauveria bassiana on populations of the banana weevil, Cosmopolites sordidus, and their damage in tissue-cultured banana plants. Entomologia experimentalis et applicata. 129, 157-165 (2008).
- Ownley, B. H., et al. Beauveria bassiana: Endophytic colonization and plant disease control. Journal of invertebrate pathology. 98, 267-270 (2008).
- Ownley, B. H., Gwinn, K. D., Vega, F. E. Endophytic fungal entomopathogens with activity against plant pathogens: ecology and evolution. BioControl. 55, 113-128 (2010).
- Akello, J., et al. Beauveria bassiana (Balsamo) Vuillemin as an endophyte in tissue culture banana (Musa spp.). Journal of invertebrate pathology. 96, 34-42 (2007).
- Gómez-Vidal, S., Lopez-Llorca, L. V., Jansson, H. B., Salinas, J. Endophytic colonization of date palm (Phoenix dactylifera L.) leaves by entomopathogenic fungi. Micron. 37, 624-632 (2006).
- Posada, F., Vega, F. E. Establishment of the fungal entomopathogen Beauveria bassiana (Ascomycota: Hypocreales) as an endophyte in cocoa seedlings (Theobroma cacao). Mycologia. 97, 1195-1200 (2005).
- Tefera, T., Vidal, S. Effect of inoculation method and plant growth medium on endophytic colonization of sorghum by the entomopathogenic fungus Beauveria bassiana. BioControl. 54, 663-669 (2009).
- Posada, F., Vega, F. E. Inoculation and colonization of coffee seedlings (Coffea arabica L.) with the fungal entomopathogen Beauveria bassiana (Ascomycota: Hypocreales. Mycoscience. 47, 284-289 (2006).
- Akello, J., Dubois, T., Coyne, D., Kyamanywa, S. The effects of Beauveria bassiana dose and exposure duration on colonization and growth of tissue cultured banana (Musa sp.) plants. Biological. 49, 6-10 (2009).
- Posada, F., Aime, M. C., Peterson, S. W., Rehner, S. A., Vega, F. E. Inoculation of coffee plants with the fungal entomopathogen Beauveria bassiana (Ascomycota: Hypocreales). Mycological research. 111, 748-757 (2007).
- Brownbridge, M., Reay, S. D., Nelson, T. L., Glare, T. R. Persistence of Beauveria bassiana (Ascomycota: Hypocreales) as an endophyte following inoculation of radiata pine seed and seedlings. Biological control. 61, 194-200 (2012).
- Posada, F. J., Chaves, F. C., Gianfagna, T. J., Pava-Ripoll, M., Hebbar, P. Establishment of the fungal entomopathogen Beauveria bassiana as an endophyte in cocoa pods (Theobroma cacao L.). Revista U.D.C.A. actualidad & divulgación científica. 13, 71-78 (2010).
- Quesada-Moraga, E., Landa, B. B., Muñoz-Ledesma, J., Jiménez-Díaz, R. M., Santiago-Alvarez, C. Endophytic colonisation of opium poppy, Papaver somniferum, by an entomopathogenic Beauveria bassiana strain. Mycopathologia. 161, 323-329 (2006).
- Biswas, C., Dey, P., Satpathy, S., Satya, P. Establishment of the fungal entomopathogen Beauveria bassiana as a season long endophyte in jute (Corchorus olitorius) and its rapid detection using SCAR marker. BioControl. , 1-7 (2011).
- Bing, L. A., Lewis, L. C. Occurrence of the entomopathogen Beauveria bassiana (Balsamo) Vuillemin in different tillage regimes and in Zea mays L. and virulence towards Ostrinia nubilalis (Hübner). Agriculture, ecosystems & environment. 45, 147-156 (1993).
- Akello, J., Sikora, R. Systemic acropedal influence of endophyte seed treatment on Acyrthosiphon pisum and Aphis fabae offspring development and reproductive fitness. Biological. 61, 215-221 (2012).
- Reddy, N. P., Ali Khan, A. P., Devi, U. K., Sharma, H. C., Reineke, A. Treatment of millet crop plant (Sorghum bicolor) with the entomopathogenic fungus (Beauveria bassiana) to combat infestation by the stem borer, Chilo partellus Swinhoe (Lepidoptera: Pyralidae. Journal of Asia Pacific. 12, 221 (2009).
- Quesada-Moraga, E., Muñoz-Ledesma, F. J., Santiago-Alvarez, C. Systemic protection of Papaver somniferum L. against Iraella luteipes (Hymenoptera: Cynipidae) by an endophytic strain of Beauveria bassiana (Ascomycota: Hypocreales). Environmental entomology. 38, 723-730 (2009).
- Cherry, A. J., Banito, A., Djegui, D., Lomer, C. Suppression of the stem-borer Sesamia calamistis (Lepidoptera; Noctuidae) in maize following seed dressing, topical application and stem injection with African isolates of Beauveria bassiana. International journal of pest management. 50, 67-73 (2004).
- Gurulingappa, P., McGee, P. A., Sword, G. Endophytic Lecanicillium lecanii and Beauveria bassiana reduce the survival and fecundity of Aphis gossypii following contact with conidia and secondary metabolites. Crop protection. 30, 349-353 (2011).
- van Schoonhoven, A., Voysest, O., Schwartz, H. F., Pastor-Corrales, M. A. . Common beans in Latin America and their constraints in Bean production problems in the tropics. , 33-57 (1989).
- De Vos, M., Jander, G. Choice and no-choice assays for testing the resistance of A. thaliana to chewing insects. J. Vis. Exp. (15), e683 (2008).
- Parsa, S., Sotelo, G., Cardona, C. Characterizing herbivore resistance mechanisms: spittlebugs on Brachiaria spp. as an example. J. Vis. Exp. (52), e3047 (2011).
- Atamian, H., Roberts, P., Kaloshian, I. High and low throughput screens with root-knot nematodes Meloidogyne spp. J. Vis. Exp. (61), e3629 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon