Method Article
Propiocepción y la tensión en los receptores de cangrejo Limbs: Ejercicios de Laboratorio Estudiante
En este artículo
Resumen
Técnicas fisiológicas y anatómicas se demuestran para abordar la función y la estructura de los propioceptores articulares y los receptores de la tensión muscular en las extremidades para caminar crustáceos.
Resumen
El principal propósito de estos procedimientos es demostrar con fines docentes y de investigación como grabar la actividad de vivir neuronas sensoriales primarias responsables de la propiocepción, ya que son la detección de posición de las articulaciones y el movimiento, y la tensión muscular. La actividad eléctrica de los propioceptores de los crustáceos y los receptores de tensión se registra por la instrumentación neurofisiológica básica, y un transductor se utiliza para medir simultáneamente la fuerza que se genera mediante la estimulación de un nervio motor. Además, demostramos cómo manchar las neuronas para una evaluación rápida de la disposición anatómica o para la fijación permanente. La tinción revela organización anatómica que sea representativo de los órganos chordotonal en la mayoría de los crustáceos. La comparación de las respuestas nerviosas tensión a las respuestas propioceptivas es una herramienta de enseñanza eficaz en la determinación de cómo estas neuronas sensoriales se definen funcionalmente y cómo la anatomía se correlaciona con la función. Tres técnicas de tinciónse presentan permitiendo a los investigadores e instructores para elegir un método que sea ideal para su laboratorio.
Introducción
La propiocepción es la sensación de la posición de las extremidades y el movimiento que permite la conducta motora coordinada. Propioceptores constan de receptores (cinestésicas) posición (estática) y el movimiento. En los insectos y los crustáceos, los órganos chordotonal son las estructuras que proporcionan dicha información al sistema nervioso central 1. No todos los órganos chordotonal abarcan una articulación, pero aún así pueden controlar los movimientos de las articulaciones debido a su apego a las apodemas (tendón como las estructuras), que abarcan todo el conjunto y se mueven en asociación con el músculo esquelético y la articulación conjunta. Patas de cangrejo tienen seis articulaciones, cada uno con uno o dos órganos chordotonal 2. Normalmente, un chordotonal órgano tiene 60-100 o más neuronas sensoriales incrustados dentro de una hebra elástica, las neuronas que señal de posición conjunta estática, dirección y velocidad de movimiento 3-6. La entrada de los órganos chordotonal en cada junta y la pierna es procesada centralmente permitiendo movimientos coordinados por el animal.
Las fuerzas que producen músculos de las piernas durante las contracciones isométricas e isotónicas son detectados por receptores de tensión asociados con las fibras musculares y de sus anexos a apodemes7-9. En los protocolos de las piernas para caminar crustáceos que siguen se presenta la metodología para las grabaciones de las neuronas sensoriales primarias que monitorean la propiocepción y las neuronas que responden a las fuerzas generadas por las fibras musculares. También se presenta una técnica para la activación de movimientos de las piernas y la cuantificación de la generación de fuerza, así como las técnicas anatómicas que pueden ser utilizados para caracterizar la disposición de estas estructuras del sistema nervioso periférico.
Los procedimientos están explicadas más abajo permiten el análisis estructural y funcional de las neuronas que inervan los dos tipos de receptores en relación con su ubicación, en una hebra elástica chordotonal y apodema. Para ilustrar esto, usamos el propodite-dactylopodite (PD) chordotonal órgano, el órgano que se extiende por el segmento más distal de la pierna de cangrejo 3.Aunque los estudios electrofisiológicos detallados se iniciaron en la década de 1930 y todavía se están llevando a cabo hoy en día, algunos aspectos han dado a conocer acerca de las conexiones segmentarias de propioceptores en las distintas articulaciones y su papel en el control coordinado de muscles10-16. El establecimiento de la relación estructura-función entre los órganos de propiocepción, músculos y el sistema nervioso le ayudará aún más a definir estos roles. Por ejemplo, el etiquetado de los cuerpos celulares y terminaciones distales de las neuronas de tensión insertados en el apodema revelará su ubicación con respecto a las fibras musculares 8,17-21.
Se presentan tres técnicas de tinción para las piernas de los crustáceos que se pueden utilizar en la investigación o laboratorios académicos. La tinción con azul de metileno proporciona un contraste adecuado para los músculos y los nervios y se recomienda como una técnica sencilla para que los estudiantes aprendan la anatomía. Laboratorios que tienen configuraciones de microscopía de fluorescencia pueden lograr tinción neuronal más selectivo por la exposición breve de la nervios a colorante vital 4-di-2-ASP. La tercera alternativa es CoCl2 relleno, que se tiñe y fija las neuronas, y no requiere de imágenes de fluorescencia. A pesar de que es la mano de obra y el tiempo de obra, este proceso de tinción da un alto contraste y especificidad para los nervios que están llenos. En conjunto, estas técnicas se pueden utilizar para la comparación de diversos órganos chordotonal, no sólo dentro de una extremidad o entre extremidades, sino también entre otras especies de crustáceos e insectos 20-22. Los cangrejos azules (C. sapidus) utilizados en las grabaciones fisiológicas y para la tinción anatómica están disponibles por todas partes de la frontera sur y el sureste de los Estados Unidos. Esta especie sirve como un representante de los arreglos nerviosas chordotonal y tensión se encuentran en la mayoría de los cangrejos. Laboratorios de la costa oeste preferirán utilizar el cangrejo Dungeness mucho más grande (Cancer magister) para estos experimentos.
Protocolo
1. La disección y la grabación de la actividad eléctrica del nervio Propodite-dactylopodite (PD)
- Sostenga el cangrejo en todo el caparazón por la espalda, y evitar las garras, pellizcar la parte proximal de la meropodite con fórceps. La pierna se autotomize para evitar que el animal desangrándose. Tenga cuidado al manipular los cangrejos azules, ya que son bastante agresivos y muy rápido.
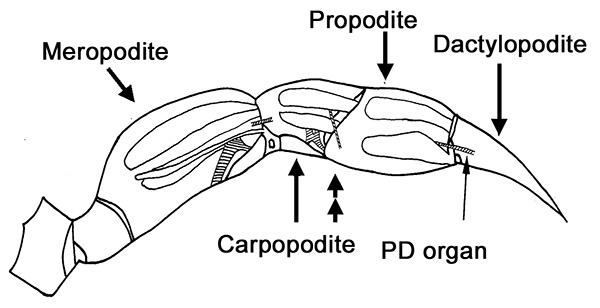
Figura 1. Primera caminando pierna de un cangrejo. La localización anatómica de los órganos chordotonal (regiones sombreadas) se superponen sobre esta esquemática. La punta de la flecha doble indica dónde seccionar la pierna para los experimentos nerviosas PD. Haga clic aquí para ver la imagen más grande . - Haga un corte entre la propodite y carpodite. Deseche el carpopodite yt adjuntó meropodite (Figura 1).
- Cortar una gran ventana en la cutícula en el lado pigmentada (lateral) de la propodite con un escalpelo con una cuchilla # 11 (Figura 2 y 3) Nota:. No corte profundamente.
- Retire la capa de la cutícula deslizando la hoja de bisturí debajo y paralela a la cutícula. Esta corta las fibras musculares unidos a la cutícula.
- Utilizando la misma técnica de cortar una ventana más pequeña en el lado (medial) del propodite pigmentless, pero deje el cóndilo (la rótula o bisagra entre segmentos) de fijación intacto.
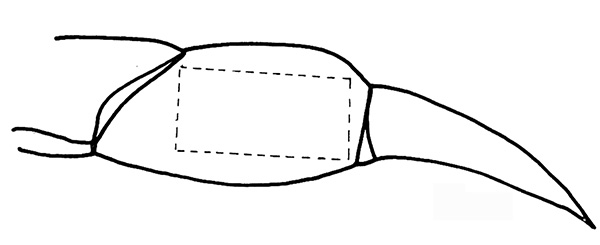
Figura 2. Corte a lo largo de la línea punteada en la propodite. Haz clic aquí para ver la imagen más grande .
n "src =" / files/ftp_upload/51050/51050fig3.jpg "width =" 500px "/>
Figura 3. Exponga el nervio en la ventana (las flechas describen el conjunto de nervios). Haga clic aquí para ver la imagen más grande . - Preparar un plato forrado Sylgard contiene solución salina cangrejo de precisar la preparación abajo Nota:. Véase la Tabla 1 para especies recetas específicas salinos.
- Localice el órgano PD sondeando cuidadosamente con las agujas de vidrio pulido al fuego. El cordón elástico atraviesa la junta tiene un aspecto de plata.
- Eliminar las fibras musculares que oscurecen su visión del órgano de ambos lados del tendón. Tenga mucho cuidado de no dañar el órgano PD o su nervio.
- Una vez que esto se ha logrado, vuelva a colocar firmemente la preparación para el plato con el lado de pigmento (lateral) hacia arriba (Figura 4).

Figura 4. Expuesto órgano PD y el nervio. Haz clic aquí para ver la imagen más grande . - Siga el nervio órgano PD en el propodite en la medida de manera proximal como sea posible con el fin de liberar en marcha una larga longitud de nervio (1.5 cm) para fines de grabación. Esto se hace mejor, mientras que el nervio PD está todavía unido al nervio principal de la pierna.
- Después de separar el nervio PD desde el nervio principal de la pierna con la ayuda de agujas de vidrio, cortar el nervio PD proximal con las tijeras iris Nota:. No estire ni tire del nervio durante la disección.
- Mueva el dactylopodite hasta una posición extendida y totalmente flexionada. Tome nota de dónde las posiciones de flexión y extensión extremas y un punto a mitad de camino para su uso posterior.
- Coloque un cable de tierra en el interior del baño de solución salina.
- Encienda el correohardware de grabación lectrophysiology / software Nota:. Nuestra instalación se ha descrito previamente 23.
- Coloque el microscopio de modo que es con vistas a la platina del microscopio. Una vez que el plato de preparación se coloca en el escenario, tendrá que ajustar la posición del haz de iluminación de alta intensidad para visualizar mejor la preparación.
- Coloque el micromanipulador por lo que el conjunto de electrodos de succión conectado tendrá fácil acceso al baño de solución salina y preparación. El electrodo de succión está construido como se muestra en un video en Internet 24.
- Para detectar la actividad neuronal, tire del extremo cortado del nervio PD en el electrodo de succión.
- Mueva el dáctilo lo largo de las posiciones extendida y flexionada durante varios ciclos con la ayuda de una sonda de vidrio o clavija de madera.
- Siguiente observar la actividad cuando el dáctilo se fija en las posiciones extendidas, flexionados y mediados.
2. Grabación de la Actividad Eléctrica de la tensiónNervio mientras Monitoreo de generación de fuerzas
- Determinar el lado lateral y medial de la pierna. El lado medial tiene una textura suave que se puede sentir pellizcando suavemente en la región meropodite con una uña.
- Coloque esta cutícula suave hacia arriba en el plato. El nervio motor excitador que inerva el músculo abridor también inerva el músculo camilla en el carpopodite.
- Con el fin de estimular el músculo abridor del nervio motor camilla en la región carpodite se aísla y se estimuló con un electrodo de succión. La parte proximal de la pierna se elimina por transección la meropodite con tijeras.
- Eliminar una sección de la cutícula en la región de carpo en el lado interior (lado medial, la Figura 5A).
- Cortar el apodema del músculo doblador y quitar el músculo cuidadosamente como no tirar el nervio principal de la pierna fuera de la cavidad de la pierna (Figura 5 B, C en cuenta las flechas dónde Bender apodema se separa). El nervio de la pierna principal y un sujetadornch al músculo camilla a continuación se puede observar (Figura 5D).
- Encuentre el nervio se ramifica desde el haz principal del nervio al músculo camilla (Figura 5E, en la flecha). Esto puede ser cortada cerca del músculo y se detuvo en un electrodo de succión para estimular (Figuras 5F y G, la flecha representa la rama).
- Se burlan de una sección del nervio que se proyecta hacia el primer partido sin pellizcar el nervio. Seccionar el nervio motor camilla / abridor.
- Tire del nervio motor en el electrodo de succión y luego estimularlo.
- Para descubrir el músculo y el nervio abridor tensión quitar el músculo más cerca y la región ventral del propodite. Cortar el músculo más estrecha con un bisturí con una hoja de # 11 en el propodite (Figura 6) Nota:. No corte profundo en la región proximal, ya que podría dañar el nervio motor abridor.

Figura 5. Etapas de disección para exponer la neurona motora para estimular el músculo abridor. Haz clic aquí para ver la imagen más grande .
Figura 6. Cortar la cutícula en la mitad ventral del propodite para exponer el músculo más cerca por lo que se puede quitar. Haz clic aquí para ver la imagen más grande . - Cambie la solución salina con solución salina enfriada fresca durante todo el proceso de disección de mantener vivas las neuronas. Para más disección, coloque el plato de preparación bajo un microscopio de disección y el uso de iluminación de fibra óptica.
- Corte cuidadosamente el tendón cerca de su unión conDáctilo utilizando tijeras medianas puntiagudas.
- Tenga mucho cuidado de no molestar a las ramas para el músculo abridor desde el nervio principal de la pierna que debe ser claramente visible.
- Retire y deseche el músculo y el tendón más cerca.
- Hacer un agujero en el dáctilo con un pasador de disección. Este agujero se utilizará más adelante para enganchar el pasador de metal en la tensión (fuerza) transductor, pero es necesario para que sea en esta etapa del procedimiento.
- Busque la rama del nervio que se proyecta hacia el músculo abridor y apodema en la región distal del músculo abridor. Sondear con cuidado el nervio con la herramienta de vidrio pulida al fuego.
- Observar el nervio tensión que surge desde el extremo distal de la apodema y procede al haz del nervio motor.
- Para detectar la actividad neuronal, llenar un electrodo de succión con solución salina cangrejo y sacar el extremo del corte de la tensión nerviosa abridor en el electrodo. Asegúrese de que el electrodo de succión se ajusta con firmeza sobre el nervio.
- Examine la neural correlato de la tensión pasiva en la apodema abridor. Durante la grabación de la actividad eléctrica del nervio de la tensión, gire el dáctilo rápidamente en una articulación extendida (es decir, estirar el músculo abridor).
- A continuación, prueba de desarrollo de la fuerza activa en relación con la frecuencia de estimulación.
- Fije firmemente un gancho de metal para que la punta del anzuelo pasa por un pequeño agujero en el dáctilo.
- . Conecte el otro extremo del gancho de metal para el transductor de fuerza Nota: Asegúrese de que el transductor se encuentra en un ángulo de 90 ° cada vez para que el pasador es perpendicular al transductor para la detección máxima de la fuerza generada.
- Tire del gancho y dactyl para que sea en un ángulo de 45 ° de la articulación de abridor.
- Ahora estimular el nervio motor a 100 Hz para 250 ms y medir la fuerza, así como la frecuencia de disparo del nervio tensión.
- Coloque la articulación en una posición totalmente extendida de manera que las fibras musculares abridor son flácida.
- Stimulate el nervio motor a 100 Hz para 250 ms y medir la fuerza, así como la frecuencia de disparo del nervio tensión.
- Bend / flexione la articulación de manera que quede completamente flexionado (~ 90 °). En esta posición, las fibras musculares del abridor están totalmente estirados. Puede haber alguna fuerza medida por el transductor debido a este estiramiento pasivo del músculo.
- Estimular el nervio motor a 100 Hz para 250 ms y medir la fuerza, así como la frecuencia de disparo del nervio tensión.
- Después de medir una fuerza, proceder de una serie de varias frecuencias: 20, 40, 60, 80, y 100 Hz para 8-10 segundos en cada posición de la articulación.
- Mida la respuesta con una liberación de la tensión rápida. Organizar la preparación de modo que el gancho en el transductor de fuerza puede ser fácilmente empujado fuera del agujero en el dáctilo.
- Bend / flexione la articulación de manera que quede completamente flexionado (~ 90 °). Ahora estimular el nervio motor a 100 Hz con una estimulación continua de 5 seg.
- Después de la primera segundad o menos, ya que la tensión se ha acumulado en el músculo del primer partido, empujar el pasador por el agujero en el dáctilo.
- Examine el registro del nervio tensión antes y después de la liberación del pasador de la celebración de la dactyl.
- Los efectos moduladores de sustancias neuroactivos tales como octopamina, serotonina, y proctolin, que altera la salida de las neuronas de tensión, se pueden determinar mediante la adición de estas moléculas a los medios de comunicación de baño sobre el músculo abridor expuesta y la repetición de los experimentos.
- Utilice una pipeta y gotear 1-2 ml durante la preparación.
3. Estructuras del sistema de tinción Nervioso Periférico en Crustáceo Caminar Piernas
- Técnica de azul de metileno
- Diluir una parte de metileno solución de cloruro de azul (0,25%) con dos partes de agua destilada.
- Añadir esta mezcla a cinco partes de solución salina. Completamente irrigar el área de interés.
- Diseccionar una pierna, según el protocolo en la sección 1. Incubar la preparation en la solución de azul de metileno a 12-13 ° C.
- Examinar la preparación cada 10-15 minutos con el microscopio de disección con iluminación baja intensidad para seguir el progreso de la tinción. En algunos casos la tinción se completará en una hora, en otros puede tomar durante la noche.
- Técnica de 4-di-2-ASP
- Los colorantes fluorescentes se pueden utilizar para copia de llenar la neurona PD o manchar directamente la preparación del baño. Sin embargo se requiere un microscopio adecuado con capacidad para ver la mancha fluorescente.
- Diseccionar una pierna de acuerdo con un protocolo en el apartado 1.
- Incubar la preparación en una concentración 10 mM de solución de 4-Di-2-ASP y salir de la preparación en el refrigerador durante 15 min. Use sólo lo suficiente solución para cubrir la preparación.
- Fotografiar los preparativos de forma rápida y evitar la sobre exposición a la luz de mercurio. Este tinte fluorescente se desvanece con relativa rapidez.
- Técnica de cloruro de cobalto
- Exponer el nervio PD de acuerdo con el protocolo en el apartado 1 y mantenerlo sumergido en solución salina fría.
- Hacer una vaselina bien para mantener el CoCl2. Si alguna CoCl2 derrama en el baño de solución salina toda la preparación se mancha negro, y la preparación debe ser desechado.
- Slip un pequeño corte de una hoja de poliestireno, para hacer una plataforma de plástico, y el pin de una manera tal que no se flotar o sumergirse en el baño de solución salina (Figura 7).
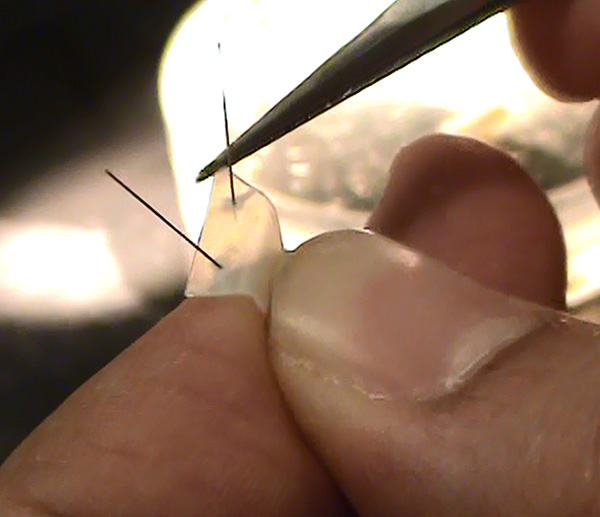
Figura 7. Lámina de poliestireno con alfileres para sujetar en su lugar en el plato. Haga clic aquí para ver la imagen más grande . - Expulsar vaselina de una aguja hipodérmica fina fijada a una jeringa desechable,a continuación, hacer una barrera (un círculo puede funcionar bien), que debería ser de aproximadamente 1 a 1,5 mm de altura a excepción de un poco profunda "V" en el punto medio donde el nervio se cuelga a través de, en la parte superior de la hoja de poliestireno.
- Hacer un pequeño charco de solución salina a cada lado de la barrera cerca de la "V". Teniendo cuidado de no estirar o comprimir el nervio, el nervio levantar cuidadosamente de la placa y se coloca en el charco de solución salina en la vaselina también.
- Trabaje con rapidez para que la sección de los nervios no se seque, cuidadosamente expulsar vaselina para cubrir el nervio expuesto. Ahora pruebe la barrera con solución salina y asegúrese de que no tiene fugas.
- Seque lejos de solución salina en el interior de la barrera y ver si se llena cuando la solución salina de baño es de alto alrededor de la pared de vaselina para estar seguro de que las dos partes están aisladas una de la otra (Figura 8).

ng> Figura 8. Vaselina bien con solución salina y PD nervio atraviesa el pozo. El nervio PD no se ha reducido todavía. Haz clic aquí para ver la imagen más grande . - Wick lejos la solución salina en el pozo utilizando una pieza de papel de seda. Evite que el papel de envolver para arriba el nervio.
- Hacer un nuevo charco usando unas pequeñas gotas de agua destilada, y luego cortar el extremo del nervio. Tenga mucho cuidado de no tirar el nervio a través de la barrera de la hora de hacer el corte. El choque osmótico del agua destilada "globo" de los axones.
- A menos de 30 segundos agregar una pequeña gota de CoCl2 al agua, tomar esta solución, y luego agregue suficiente CoCl2 para formar un charco sobre esta sección reducida de los nervios (Figura 9). Los preparativos se mantienen mejor en refrigeración a 13 ° C durante 12-24 horas.
tp_upload/51050/51050fig9.jpg "width =" 500px "/>
Figura 9. El PD nervio cortado siendo expuesto a CoCl2. El nervio cortado se hincha en presencia de agua que facilita y acelera el movimiento de las moléculas de colorante a través de los axones en los cuerpos celulares de las neuronas. Haga clic aquí para ver la imagen más grande . - Retire los charcos de humidificación. Seque lejos la solución de cobalto utilizando un pañuelo de papel y lavar los restos de cobalto con varios cambios de solución salina.
- Transferir la preparación aislada de una placa de Petri pequeña de vidrio que contiene aproximadamente 10 ml de solución salina de cangrejo. Las neuronas se lavan y los pasos siguientes se llevan a cabo in situ. Herramientas de metal bueno, no se van a utilizar para manejar la preparación después de este paso (usted debe utilizar las herramientas específicas que no se van a utilizar en un momento posterior de la fisiología).
- Añadir 1-2 gotas de sulfuro de amonio (NH4) 2 S a la solución salina. Tape el frasco 2 S (NH 4) firmemente y colocar de nuevo en el capó. Observar la reacción en la preparación bajo un microscopio de disección
- Dentro de 1-2 minutos, las neuronas de cobalto llenas y sus procesos deben comenzar a aparecer, ya que se mancha negro.
- Después de 5-10 minutos, reemplace la solución de desarrollo con solución salina fresca.
- Asegúrese de que la solución de desarrollo que ha vertido en el desagüe del fregadero es seguido por el agua del grifo durante unos minutos o en una botella de residuos con tapa.
- Vierta la solución salina y fijar la preparación nervio durante unos 15 min con dos cambios de solución fijadora de Bouin. Para tejidos más grandes como el músculo abridor (para teñir las neuronas de tensión), aumentar la duración de la fijación a 30 min.
- Deshidratar en una serie de orden ascendente de la concentración de etanol a partir de 70% (es decir, 70%, 80%, 90%, 100%). Acerca de 10 min a cada concentración es suficiente parapequeños tejidos.
- Después de aproximadamente 10-15 minutos en dos cambios de etanol al 100%, eliminar el tejido mediante la sustitución de etanol con 100% de salicilato de metilo. La preparación se quedará en esta solución permanente para la visión repetida. Con el tiempo las células llenas serán más evidentes debido a que el tejido circundante se volverá más clara. Métodos de intensificación se pueden utilizar para ayudar a prevenir la decoloración con el tiempo 25.
- Utilice el mismo proceso para llenar el nervio tensión con CoCl2. Sin embargo, cambiar una solución de etanol varias veces en cada etapa de deshidratación de etanol y se incuba la preparación dentro de alcohol durante aproximadamente 20 minutos para cada paso para deshidratar completamente los músculos y permiten que se borren también.
Resultados
Cuando el órgano PD se estira por la completa extensión de la articulación, la actividad en el nervio PD es robusto durante el movimiento como se muestra para la primera segunda en la Figura 10. Algunos actividad permanece mientras que se mantiene todavía en la posición abierta. Esta actividad es de las neuronas sensibles a la posición estática (segundo medio de la grabación se muestra en la Figura 10). Movimiento evoca una respuesta durante el desplazamiento, y la cocción es principalmente presente durante el estiramiento de la cadena chordotonal (Figura 11).
Un análisis más detallado de los picos se puede abordar fácilmente por la clasificación de las amplitudes relativas. Este es un enfoque para demostrar las diferentes poblaciones de neuronas sensoriales están contratados para puestos o tipos de movimientos 5. Amplitudes típicas varían desde 0,25 hasta 1,5 mV, pero estos valores son dependientes de la resistencia (es decir, la estanqueidad) de la junta de electrodo de succión. La frecuencia de los picos en tque varios intervalos de tamaño también se puede representar gráficamente para el análisis.
Fuerzas generadas por el músculo abridor con respecto a la frecuencia de estimulación se pueden comparar por superposición de los respectivos trazas de tensión-tiempo en la parte superior de cada otra (figuras 13A y B). Esto también se puede realizar para cada posición de la articulación en cada frecuencia de estimulación dada. Actividad del nervio tensión puede entonces ser correlacionada con la cantidad de fuerza relativa generada en cada frecuencia de estimulación, y para cada posición de la articulación. Como en el nervio PD, una variedad de amplitudes de pico se ven en respuesta a la contracción del músculo abridor (Figura 13C).
Disposición anatómica de las neuronas en la pierna para caminar se observó claramente con la tinción de azul de metileno (Figura 14). Tenga en cuenta la elasticidad chordotonal hebra y la tensión de la neurona que está cerca de la apodema. Varios cuerpos celulares con diferentes diámetros de und localizaciones específicas también son visibles en esta figura. Todo el curso del nervio tensión y nervio motor camilla se muestra en la Figura 15. Las neuronas individuales del nervio PD se muestran con mayor contraste usando 4-Di-2-ASP (Figura 16) y CoCl2 (Figura 17) relleno técnicas. A mayor aumento de las terminaciones sensoriales se pueden ver en el interior de los scolopales de apoyo (Figuras 16B) 21,22,26.
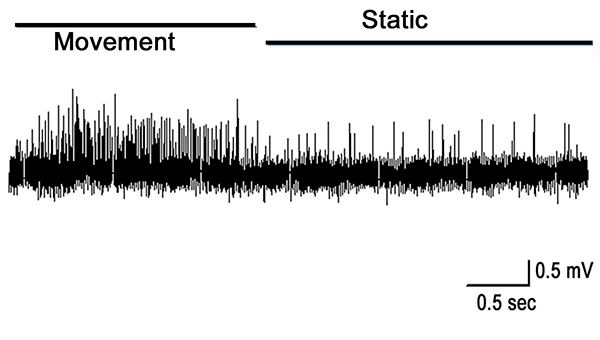
Figura 10. Mueva y mantenga a 0 °. Las neuronas dinámicas son robustos en el tiro durante el movimiento y los picos de las neuronas sensibles a la estática están presentes, mientras que la articulación se mantiene abierta. Haz clic aquí para ver la imagen más grande </ A>.
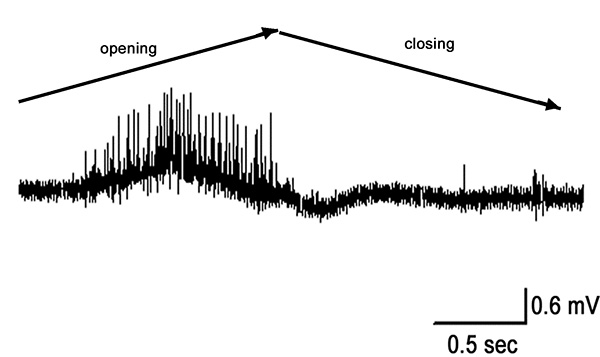
Figura 11. Rápido abrir y cerrar de flexión completa a la posición extendida (90-0 º). Haga clic aquí para ver la imagen más grande .
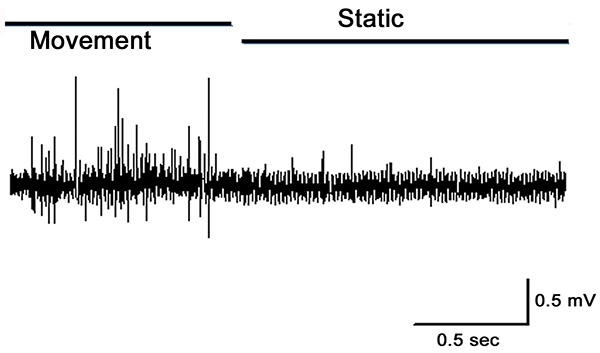
Figura 12. Extracelulares picos registrados a partir del nervio PD. La articulación está totalmente extendido y luego se trasladó rápidamente a una posición flexionada ½ y luego se quedó quieto. Observe la actividad durante el movimiento y la disminución de la actividad en condiciones estáticas. Haz clic aquí para ver más grande image.
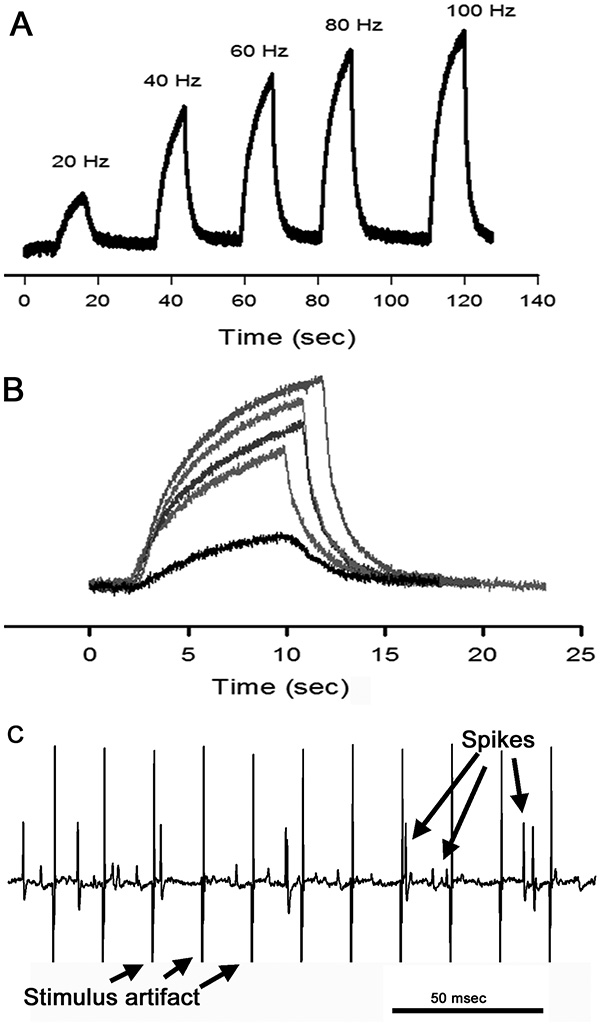
Figura 13. Las fuerzas relativas que se desarrollan con la articulación totalmente flexionadas y estimulados en las distintas frecuencias. (A) Voltaje rastros de tiempo desde el transductor de fuerza se muestran con cada frecuencia de estimulación. (B) Las huellas en el panel A se superponen en diferentes colores para facilitar la comparación. (C) en tiempo de tensión rastros de actividad eléctrica registrado desde el nervio tensión cuando el nervio motor se estimuló a 80 Hz. Tenga en cuenta el patrón regular de los artefactos de estímulo en comparación con la actividad neuronal. Además, tenga en cuenta las diferentes amplitudes de las respuestas neuronales. Haz clic aquí para ver la imagen más grande .
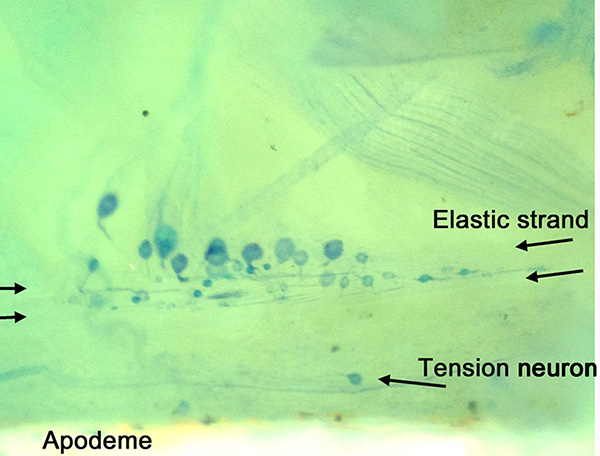
Figura 14. Metileno mancha azul de la preparación de la pierna para caminar. Somas individuales se muestran con sus terminaciones sensoriales que se proyecta en la hebra elástica. Cerca de la apodema una neurona tensión se muestra. Haz clic aquí para ver la imagen más grande .

Figura 15. El nervio tensión derivada del extremo distal (flechas rojas) y unirse al nervio motor (flecha verde). Haga clic aquí para ver la imagen más grande .
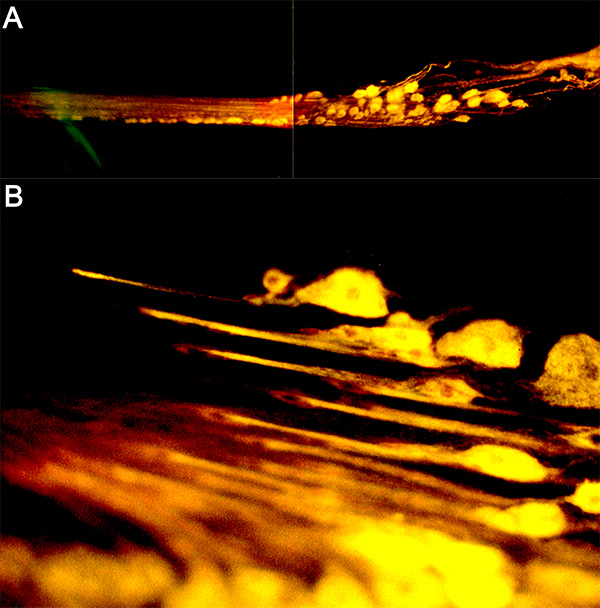
Figura 16. (A) Una copia de llenado del nervio PD en Cancer magister con 4-Di-2-ASP. (B) Un mayor aumento de las terminaciones sensoriales. Haz clic aquí para ver la imagen más grande .
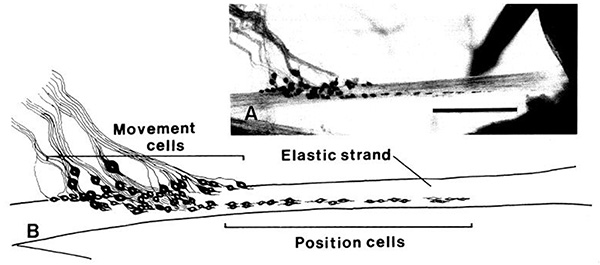
Figura 17. Las neuronas que estaban llenos de CoCl2 y procesados (A). Contorno trazado de la preparación teñida muestra (B). Haga clic aquí para ver la imagen más grande .
| Salina | g / L |
| NaCl | 27.29 |
| KCl | 0.81 |
| MgSO4 • 7H 2 O | 4.81 |
| CaCl2 • 2H 2 O | 1.85 |
| Na 2 SO 4 • 10H 2 O | 0.97 |
| La dextrosa (D-glucosa) | 1.982 |
| Ácido HEPES | 0.476 |
| HEPES sal | 2.08 |
| Ajustar el pH a 8,1 con NaOH o HCl |
Tabla 1. Recetas para solución salina cangrejo.
Discusión
El propósito de esta serie de experimentos es 1) para enseñar y exponer los principios fundamentales de las grabaciones extracelulares de un órgano propioceptivo identificables y nerviosa tensión y 2) hacer hincapié en la importancia de la cartografía anatómica en relación con la función fisiológica de los sistemas sensoriales particulares. Este enfoque experimental y los modelos animales utilizados son baratos y relativamente fácil de llevar a cabo en laboratorios de enseñanza neurofisiología.
Las neuronas de los órganos chordotonal son de dos tipos funcionales específicos, los que responden al movimiento y los que responden a las posiciones estáticas. Registros de células individuales de una variedad de órganos chordotonal, no importa cual se examina conjunta, han demostrado que esto es el caso de 3,5. En efecto, los órganos chordotonal asociados con las articulaciones de las antenas de las langostas revelan los mismos dos tipos sensoriales y anatomía básica 27. Además de ser hay dos tipos de neuronas (movimiento y positien), las neuronas comparten la misma disposición anatómica en sus respectivas hebras elásticas. La gran somata situado proximalmente en la cadena tienden a pertenecer a las neuronas sensibles al movimiento dinámico. Las neuronas que indican posiciones estáticas tienen pequeños cuerpos celulares y se localizan distalmente. Estas células son tónicamente activa. La articulación PD sólo contiene un solo órgano chordotonal mientras que hay dos órganos chordotonal en el carpo-propodio (CP) y merus-carpo (MC) articulaciones.
La disección para exponer estructuras propioceptivos en los cangrejos azules (C. sapidus) para el registro electrofisiológico se requiere una estrategia que permite a los movimientos de la articulación que tienen lugar en las posiciones naturales durante la grabación de las neuronas sensoriales. El nervio de tensión para el músculo abridor en la pierna para caminar es un muy buen nervio formado por varias neuronas. A menos que se tenga cuidado, el nervio tensión, así como el nervio motor que inerva el músculo a estimular, pueden ser dañados durante la disección. Paragrabaciones óptimas de los electrodos de succión deben adaptarse al tamaño del nervio. Las grabaciones son fácilmente accesibles en un laboratorio de los estudiantes usando un microscopio de disección magnificación 30-40X y micromanipuladores de gama baja.
Los futuros experimentos que serían interesantes para perseguir a los órganos chordotonal conjuntas serían para examinar los perfiles estructurales y fisiológicos durante la regeneración de la pierna en varias especies en las diferentes etapas del ciclo de vida como una continuación de un primer estudio que utiliza Cancer magister 19,26 . Preguntas que quedan por abordar son: 1) ¿la distribución y organización de las neuronas regeneradas dependen de la edad del animal cuando regenerar una extremidad, 2) son las proyecciones axonales en el SNC (cordón nervioso ventral) en una extremidad en regeneración funcional o lo hace tomar tiempo y la utilización conjunta de establecer conexiones funcionales, y 3) lo que ocurre con los axones seccionados proximal al plano autotomy cuando la extremidad está AUTOTomized? 28
Los crustáceos se ajustan a las condiciones ambientales y la temperatura de su entorno, pero no está claro cómo mantienen la coordinación dentro de un circuito neural como neuronas alteran su actividad en respuesta a los cambios de temperatura. Una baja tasa de cambio podría permitir que el animal algún tiempo para la aclimatación, mientras que un cambio rápido puede not29, 30. Los cambios fisiológicos en el pH y osmolaridad debido al metabolismo, el comportamiento de 31 años, o de impacto ambiental pueden presentar problemas similares a los circuitos neuronales implicados en la propiocepción. Estas preparaciones de crustáceos son ideales para hacer frente a estos tipos de problemas debido a que su función está bien caracterizado en un único nivel celular.
En este protocolo se ha demostrado la importancia fisiológica de las neuronas de la tensión en la vigilancia de la fuerza generada por el músculo abridor. Estos receptores de tensión se pueden remontar a su ubicación dentro del apodema mediante el uso de procedimientos de tinción. Estosneuronas, como en los mamíferos, detectar la fuerza en los distintos niveles y reclutar neuronas adicionales como la fuerza aumenta. La frecuencia de la actividad está relacionada con la frecuencia de estimulación de la neurona del motor hasta que se alcanza la saturación en la recepción. El uso de un protocolo de liberación rápida con la articulación dactylus flexionada, la actividad de la tensión desaparece rápidamente, pero luego vuelve a recuperar la tensión en una articulación totalmente extendida. Este es un procedimiento experimental clásico para ilustrar la fuerza medida por receptores de tensión. Varios neuromoduladores pueden ser aplicados a la preparación para ver cómo afecta el desarrollo de la fuerza y la respuesta neuronal. Uno de los aspectos importantes es cómo se procesan y se integran en el sistema nervioso central y su impacto en la actividad de las neuronas motoras las respuestas neuronales. Las técnicas que hemos mostrados permiten a uno empezar a abordar más información acerca de la tensión de funcionamiento del circuito de la neurona del nervio motor (sensorial), es decir, la señal en una pata intacta al ganglio y la espaldaal músculo.
Los procedimientos de tinción demostrado son la clave para la comprensión de la fisiología de las neuronas sensoriales que inervan los órganos propioceptivos. Disposición anatómica de las neuronas basadas en la función y el tamaño del soma son similares en los diversos órganos chordotonal dentro de las patas de cangrejo. No se sabe si también se encuentran arreglos neuronales similares en otras especies de crustáceos o insectos. Combinando grabaciones fisiológicas de las células individuales y la cartografía de la ubicación permite relaciones funcionales estructura directa. La conservación a largo plazo de la disposición anatómica con CoCl2 tinción y fijación permite hacer repetitivamente medidas y evaluar la disposición estructural.
La propiocepción y la recepción de tensión de los músculos esqueléticos son modalidades sensoriales que permiten a los comportamientos coordinados y respuestas a entorno externo e interno para los animales articulados en una variedad de configuración de músculo esqueléticos. El órgano receptor de los músculos en el abdomen de los cangrejos de río es otra preparación bien documentada (véase el Proyecto Crawdad; http://www.crawdad.cornell.edu/ ) con fines didácticos de propiocepción con sólo dos neuronas por abdominal hemi-segmento 23 . Ser capaz de grabar de neuronas individuales a las ramificaciones nerviosas sensoriales proporciona más detalles que ayudan en la comprensión de los principios básicos de la recepción sensorial. Estas preparaciones crustáceos relativamente sencillas permiten uno para atender los aspectos fundamentales de la propiocepción y la supervisión de tensión, con la posibilidad de determinar los circuitos neuronales que permiten la integración central de insumos propioceptivas y otras sensoriales 9-12, 32, 33.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Los autores agradecen las contribuciones artísticas de Hyewon Cooper.
Materiales
| Name | Company | Catalog Number | Comments |
| Sylgard | Dow Corning | 182 silicone kit | |
| NaCl | Sigma-Aldrich | S7653 | |
| KCl | Sigma-Aldrich | P9333 | |
| CaCl2 | Sigma-Aldrich | C5670 | |
| HEPES acid | Sigma | 3375 | Free acid, crystalline |
| HEPES base | Sigma | ||
| D-Glucose | Sigma | G7021 | |
| MgSO4•7H2O | Sigma | M2643 | |
| Na2SO4•10H2O | Sigma | 246980 | |
| Bouin’s solution fixative | Sigma | HT10-1-32 | Caution: Hazardous material (Special shipping cost required) |
| CoCl2 | Sigma | Caution: Hazardous material. Please follow proper disposal according to local and federal regulations. | |
| Methylene blue chloride | Matheson Co., Inc | Basic Blue 9, C.I. 52015 | |
| 4-Di-2-ASP | Molecular Probes | 4-(4-diethylaminostyryl)-N-methylpyridinium iodide | |
| Bleach | Sigma-Aldrich | To chloride silver wire | |
| NaOH | Sigma-Aldrich | 221465 | To adjust pH |
| HCl | Sigma-Aldrich | H1758 | To adjust pH |
| Materials | |||
| Dissecting tools | World Precision Instruments | assortment | |
| Intracellular electrode probe | |||
| Faraday cage | |||
| Insect Pins | Fine Science Tools, Inc | 26001-60 | |
| Dissecting microscope (100X) | |||
| Fiber optic lamp | |||
| Small adjustable mirror | To direct light beam toward the preparation. | ||
| Glass electrodes | Sigma-Aldrich | CLS7095B5X | Box of 200, suction electrodes |
| Micromanipulator | World Precision Instruments | MD4-M3-R | Can fix for base or on a metal rod |
| Raised preparation stand | |||
| Silver wire (10/1,000 inch) | A-M Systems | 782500 | |
| Computer | Any company | ||
| AC/DC differential amplifier | A-M Systems | Model 3000 | |
| PowerLab 26T | AD Instruments | 27T | |
| Force transducer | AD Instruments | 0-50g | MLTF050/ST |
| Head stage | AD Instruments | Comes with AC/DC amplifier | |
| LabChart7 | AD Instruments | ||
| Electrical leads | Any company | ||
| Glass tools | Make yourself | For manipulating nerves | |
| Cable and connectors | Any company | ||
| Pipettes with bulbs | Fisher Scientific | 13-711-7 | Box of 500 |
| Beakers | Any company | ||
| Wax or modeling clay | Any company or local stores | ||
| Stimulator | Grass Instruments | SD9 or S88 | |
| Plastic tip for suction electrode | Local hardware store (Watt’s brand) | ¼ inch OD x 0.170 inch ID | Cut in small pieces. Pull out over a flame and cut back the tip to the correct size |
Referencias
- Whitear, M. Chordotonal organs in Crustacea. Nature. 187, 522-523 (1038).
- Alexandrowicz, J. S. The comparative anatomy of leg propriocetors in some decapod Crustacea. J. Mar. Biol. Assoc. U.K. 52 (3), 605-634 (1972).
- Hartman, H. B., Boettiger, E. G. The functional organization of the propys-dactylus organ in Cancer irroratus Say. Comp. Biochem. Physiol. 22, 651-663 (1967).
- Cooper, R. L., Hartman, H. B. Responses of the bender apodeme tension receptors in the Dungeness crab, Cancer magister. Comp. Biochem. Physiol. A Physiol. 109 (2), 479-486 (1994).
- Cooper, R. L. Mapping proprioceptive neurons on chordotonal organs in the crab, Cancer magister. Crustaceana. 81 (4), 447-475 (2008).
- Burke, W. An organ for proprioception and vibration sense in Carcinus maenas. J. Exp. Biol. 31, 127-138 (1953).
- Hill, A. V. . First and Last Experiments in Muscle Mechanics. , (1970).
- Stuart, D. G., Mosher, C. C., Gerlach, R. L., Reinking, R. M. Mechanical arrangement and transducing properties of Golgi tendon organs. Exp. Brain Res. 14 (3), 274-292 (1972).
- Macmillan, D. L., Dando, M. R. Tension receptors on the apodemes of muscles in the walking legs of the crab, Cancer magister. Mar. Behav. Physiol. 1 (1-4), 185-208 (1972).
- Bévengut, M., Simmers, A. J., Clarac, F. Central neuronal projections and neuromuscular organization of the basal region of the shore crab leg. J. Comp. Neurol. 221 (2), 185-198 (1983).
- El Manira, A., Cattaert, D., Clarac, F. Monosynaptic connections mediate resistance reflex in crayfish (Procambarus clarkii) legs. J. Comp. Physiol. A. 168 (3), 337-349 (1991).
- Le Bon-Jego, M., Cattaert, D. Inhibitory component of the resistance reflex in the locomotor network of the crayfish. J. Neurophysiol. 88 (5), 2575-2588 (2002).
- Ray, D. L., Clarac, F., Cattaert, D. Functional analysis of the sensory motor pathway of resistance reflex in crayfish. I. Multisensory coding and motor neuron monosynaptic responses. J. Neurophysiol. 78 (6), 3133-3143 (1997).
- Wiersma, C. A. G. Vergleichende Untersuchungenüber das periphere Nerve-muskelsystem von Crustaceen (Comparative studies on the peripheral nerve-muscle system of crustaceans). J. Comp. Physiol. 19, 349-385 (1933).
- Wiersma, C. A. G. Movement receptors in decapod crustacea. J. Mar. Biol. Assoc. U.K. 38 (01), 01-143 (1959).
- Hartman, H. B. Tension receptors on the closer muscle apodeme in the walking legs of the blue crab Callinectes sapidus. J. Comp. Physiol. A. 157 (3), 355-362 (1985).
- Holsinger, R. . The effect of regional phenotypic differences of Procambarus clarkii opener muscle on sarcomere length, fiber diameter, and force development MSc thesis [dissertation]. , (2013).
- Parsons, D. W. The morphology and ultrastructure of tension receptors in the walking legs of the crab, Carcinus maenas. Cell Tissue Res. 211 (1), 139-149 (1980).
- Parsons, D. W. Responses and central interactions of tension receptors in the leg muscle of Carcinus. Comp. Biochem. Physiol. A Physiol. 72 (2), 391-399 (1982).
- Tryba, A. K., Hartman, H. B. Dynamic responses of series force receptors innervating the opener muscle apodeme in the blue crab, Callinectes sapidus. J. Comp. Physiol. A. 180 (3), 215-221 (1997).
- Whitear, M. The fine structure of crustacean proprioceptors. I. The chordotonal organs in the legs of the shore crab, Carcinus meanas. Philos. Trans. R. Soc. Lond. B Biol. Sci. 245 (725), 291-325 (1962).
- Whitear, M. The fine structure of crustacean proprioceptors. II. The thoracico-coxal organs in Carcinus, Pagurus and Astacus. Philos. Trans. R. Soc. Lond. B Biol. Sci. 248 (752), 437-456 (1965).
- Leksrisawat, B., Cooper, A. S., Gilberts, A. B., Cooper, R. L. Muscle Receptor Organs in the Crayfish Abdomen: A Student Laboratory Exercise in Proprioception. J. Vis. Exp. (45), e2323 (2010).
- Baierlein, B., Thurow, A. L., Atwood, H. L., Cooper, R. L. Membrane Potentials, Synaptic Responses, Neuronal Circuitry, Neuromodulation and Muscle Histology Using the Crayfish: Student Laboratory Exercises. J. Vis. Exp. (47), e2322 (2011).
- Delaney, K., Gelperin, A. Cerebral interneurons controlling fictive feeding in Limaxmaximus; I. Anatomy and criteria for re-identification. J. Comp. Physiol. A. 166, 297-310 (1990).
- Hartman, H. B., Cooper, R. L. Regeneration and molting effects on a proprioceptor organ in the Dungeness crab, Cancer magister. J. Neurobiol. 25 (5), 461-471 (1994).
- Hartman, H. B., Austin, W. D. Proprioceptor organs in the antennae of Decapoda Crustacea. J. Comp. Physiol. 81 (2), 187-202 (1972).
- Cooper, R. L. Development of sensory processes during limb regeneration in adult crayfish. J. Exp. Biol. 201 (Pt 11), 1745-1752 (1998).
- Chung, Y. -. S., Cooper, R. M., Graff, J., Cooper, R. L. The acute and chronic effect of low temperature on survival, heart rate and neural function in crayfish (Procambarus clarkii) and prawn (Macrobrachium rosenbergii) species. Open J. Mol. Int. Physiol. 2 (3), 75-86 (2012).
- Blundon, J. A. Effects of temperature and thermal history on neuromuscular properties of two crustacean species. J. Comp. Physiol. B. 158 (6), 689-696 (1989).
- Cooper, R. M., Schapker, H., Adami, H., Cooper, R. L. Heart and ventilatory measures in crayfish during copulation. Open J. Mol. Int. Physiol. 1 (3), 36-42 (2011).
- Bierbower, S. M., Cooper, R. L. The mechanistic action of carbon dioxide on a neural circuit and NMJ communication. Journal of Experimental Zoology. , (2013).
- Bierbower, S. M., Shuranova, Z. P., Viele, K., Cooper, R. L. Sensory systems and environmental change on behavior during social interactions. Brain Behav. 3 (1), 4-13 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados