Method Article
Проприоцепция и Натяжные Рецепторы в Краб конечностей: Студент лабораторных занятий
В этой статье
Резюме
Физиологические и анатомические методы продемонстрировали обратиться функцию и структуру для совместных проприоцепторов и мышечное напряжение рецепторов в ракообразных пешеходных конечностей.
Аннотация
Основная цель этих процедур состоит в демонстрации в учебных и исследовательских целях, как записывать активность живых первичных сенсорных нейронов, ответственных за проприоцепции как они обнаружения совместную позицию и движение, и напряжение мышц. Электрическая активность от ракообразных проприоцепторов и натяжных рецепторов регистрируется основной нейрофизиологической аппаратуры, и датчик использован для одновременного измерения силы, который создается за счет стимулирования моторный нерв. Кроме того, мы показали, как окрасить нейроны для быстрой оценки их анатомического расположения или для постоянной фиксации. Окрашивание выявляет анатомические организацию, которая является представителем хордотональные органов в большинстве ракообразных. Сравнивая напряженность нервные ответы на проприоцептивными ответов является эффективным инструментом обучения в определении того, как эти сенсорные нейроны определяются функционально и как анатомия коррелирует с функцией. Три окрашивания методыпредставлены позволяет исследователям и преподавателям выбрать метод, который идеально подходит для своей лаборатории.
Введение
Проприоцепция это ощущение положения конечностей и движения, что позволяет согласованное поведение двигателя. Проприоцепторы состоят из позиции (статической) и движения (кинестетические) рецепторов. У насекомых и ракообразных, хордотональные органы являются структуры, которые обеспечивают эту информацию в ЦНС 1. Не все хордотональные органы охватывают совместное но они все еще могут контролировать совместные движения из-за их привязанности на аподем (сухожилия структур), которые охватывают совместное и двигаться в сотрудничестве с скелетных мышцах и суставах артикуляции. Ножки краба есть шесть суставов, каждый из которых имеет один или два хордотональные органы 2. Обычно хордотональные орган имеет 60-100 или более сенсорных нейронов, встроенные в упругой нити, нейроны, которые сигнализируют статический совместную позицию, направление и скорость движения 3-6. Входной сигнал от хордотональные органов на каждом суставе и ноги затем централизованно обрабатываются позволяя координированные движения от животного.
Силы, мышцы ног производят во изометрических и изотонических сокращений обнаруживаются рецепторов растяжения, связанных с мышечными волокнами и с вложениями apodemes7-9. В ракообразных протоколов ходьба ног, которые следуют мы представляем методологию для записей из первичных сенсорных нейронов, которые контролируют проприоцепции и нейронов, которые отвечают на сил, возникающих при мышечных волокон. Методика активизации движений ног и количественного поколение сила также представлены, а также анатомические методы, которые могут быть использованы, чтобы характеризовать расположение этих структур периферической нервной системы.
Процедуры продемонстрированы ниже включить структурную и функциональную анализ нейронов, которые возбуждают обоих типов рецепторов относительно их расположения на хордотональные упругой нити и аподемой. Чтобы проиллюстрировать это, мы используем проподит-dactylopodite (PD) хордотональные орган, орган, который охватывает дистального наиболее сегмент краба ноги 3.Хотя подробные электрофизиологические исследования начались в 1930 году и до сих пор проводятся сегодня, некоторые аспекты стали известно о сегментных соединений проприоцепторов в различных суставах и их роли в координированного управления muscles10-16. Установление структуры-функции отношения между проприоцептивными органов, мышц и нервной системы в дальнейшем поможет определить эти роли. Например, маркировки somata и дистальных окончаний натяжных нейронов, вставленных в аподемой покажет их расположение относительно мышечных волокон 8,17-21.
Мы представляем три окрашивания методы для ракообразных ног, которые можно использовать в исследовательских и академических лабораторий. Метиленовый синий окрашивание предоставляет случае контрастность мышц и нервов и рекомендуется в качестве простого метода для студентов, чтобы узнать анатомию. Labs, которые имеют флуоресцентной микроскопии установок может достичь более избирательный окрашивание нейронов кратко подвергая нервс до витального красителя 4-ди-2-Asp. Третий вариант CoCl 2 засыпки, которая окрашивает и фиксирует нейронов, и не требует визуализации флуоресценции. Хотя это труд и время интенсивного, этот процесс окрашивания дает высокую контрастность и специфичность для нервов, которые заполнены. Вместе эти методы могут быть использованы для сравнения различных хордотональные органы, не только в конечности или между конечностей, но также и среди других ракообразных и видов насекомых 20-22. Голубые крабы (С. Sapidus), используемые в физиологических записей и для анатомической окрашивания легко доступны все вокруг Южного и Юго-Восточной границы Соединенных Штатов. Этот вид служит представителя хордотональные и натяжных механизмов нервных найти в большинстве крабов. Лаборатории на западном побережье предпочитают использовать гораздо больший Dungeness краба (магистерскую Рак) для этих экспериментов.
протокол
1. Вскрытие и запись электрической активности от Проподит-dactylopodite (PD) нерва
- Держите краба через панциря сзади, и избегая когти, щепотка проксимального часть meropodite щипцами. Нога будет autotomize чтобы предотвратить животное от истекая кровью. Будьте осторожны при обращении синих крабов, как они довольно агрессивны и очень быстро.
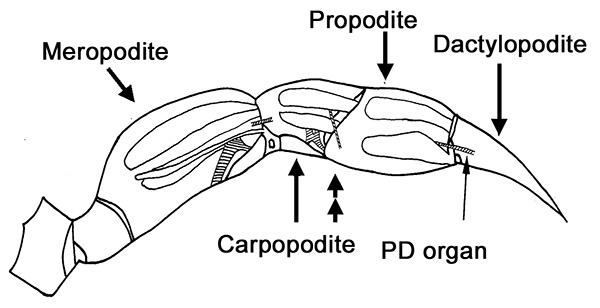
Рисунок 1. Впервые ходить ножку краба. Анатомического расположения хордотональные органов (вылупившиеся регионы) накладываются на этой схеме. Глава двойная стрелка указывает, где секут ногу для ПД нервных экспериментов. Нажмите здесь, чтобы увеличить изображение . - Сделайте надрез между проподита и carpodite. Откажитесь от Карпоподит и т он придает meropodite (рис. 1).
- Вырезать большое окно в кутикулы на пигментной (боковой) стороне проподита скальпелем с # 11 лезвия (рис. 2 и 3). Примечание: Не врезаться глубоко.
- Удалить слой кутикулы, сдвинув лезвие скальпеля ниже и параллельно кутикулы. Это разрывает мышечные волокна, прикрепленные к кутикулы.
- Используя ту же технику вырезать окно меньшего размера на pigmentless (медиальная) стороне проподита, но оставить мыщелок (на шарнир или петель между сегментами) привязанность нетронутыми.
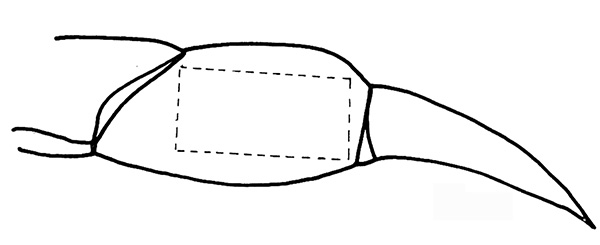
Рисунок 2. Отрежьте по пунктирной линии на проподита. Нажмите здесь, чтобы увеличить изображение .
н "Первоначально" / files/ftp_upload/51050/51050fig3.jpg "ширина =" 500px "/>
Рисунок 3. Expose нерв в окне (стрелки очертить нервного пучка). Нажмите здесь, чтобы увеличить изображение . - Подготовка Sylgard картонных блюдо в содержащий краба физиологический раствор, чтобы прикрепить подготовку вниз Примечание:. См. Таблицу 1 для видов конкретных засоленных рецептов.
- Найдите PD орган тщательно зондирования со стеклянными иглами огневой полировкой. Эластичная нить охватывающих сустав имеет серебряную внешний вид.
- Удалить мышечные волокна, затемняющие ваш взгляд на органе с обеих сторон сухожилия. Будьте очень осторожны, чтобы не повредить PD орган или его нерв.
- Как только это было сделано, твердо прикрепить подготовку к блюду с пигментной части (боковой) вверх (рис. 4).
Рисунок 4. Открытые PD орган и нерв. Нажмите здесь, чтобы увеличить изображение . - Следуйте органов нерв PD в проподита насколько проксимально, насколько это возможно, чтобы освободить вверх длинный длину нерва (1,5 см) для звукозаписи. Лучше всего это делать в то время как ПД нерва все еще прикреплена к основной нерв ноги.
- После отделения PD нерв от главного нерва ноги с помощью стеклянных иголок, разорвать PD нерв проксимально с ножницами ириса Примечание:. Не растягивайте и не тяните нерва во время вскрытия.
- Перемещение dactylopodite в расширенный и полностью согнутом положении. Принять к сведению о том, где крайние сгибание и разгибание позиции и на полпути точкой для дальнейшего использования.
- Поместите провод заземления внутри солевой ванне.
- Включите еЗапись lectrophysiology аппаратного / программного обеспечения. Примечание: Наша установка была описана ранее 23.
- Расположите микроскопа так, чтобы он с видом на столик микроскопа. После того, как подготовительные блюдо ставится на сцене, вам нужно будет отрегулировать положение высокой осветителя пучка интенсивности, чтобы наилучшим образом визуализировать подготовку.
- Расположите микроманипулятор поэтому прилагается узел всасывающей электрод будет иметь легкий доступ к солевой ванне и подготовки. Всасывающий электрод выполнен, как показано в онлайн-видео 24.
- Для обнаружения нервную деятельность, привлечь срез ПФ нерва во всасывающий электрода.
- Перемещение дактиль всей длительных и согнутыми позиций для нескольких циклов с помощью стеклянной зонда или деревянный дюбель.
- Следующая наблюдать активность, когда дактиль закреплен в расширенных, согнутыми и середине позиций.
2. Запись электрической активности от напряженияНерв в то время как мониторинг формирования сил
- Определите латеральной и медиальной стороне ноги. Медиальная сторона имеет мягкую текстуру, что можно почувствовать, зажимая мягко в meropodite области с ногтем.
- Разместите эту мягкую кутикулу стороной вверх в блюдо. Возбудитель двигательного нерва, что иннервирует нож мышцы также иннервирует носилки мышцы в карпоподита.
- В целях стимулирования нож мышцы носилки двигательного нерва в carpodite региона выделяют и стимулировали всасывающим электродом. Ближняя часть ноги снимается, пересекающих meropodite ножницами.
- Удаление раздел кутикулы в регионе запястьевого на внутренней стороне (медиальной стороны, фиг.5А).
- Разрежьте аподема изгибающем мышцы и снять мышцы тщательно, чтобы не тянуть основную нерв ноги из полости ног (рис. 5б, в, обратите внимание на стрелки, где Бендер аподема отделяется). Главный нерв ноги и бюстгальтерNCH на носилках мышцы то можно наблюдать (рис. 5D).
- Найти нерв ветвления от основного нервного пучка в носилках мышцы (рис. 5E, стрелкой). Это может быть срезаны близко к мышце и потянули в всасывающего электрода для стимуляции (рис. 5F и G, стрелка изображает филиал).
- Дразнить сечение нерва, который выступает в направлении открывания без зажимая нерв. Разрез на носилки / нож двигательного нерва.
- Потяните двигательного нерва во всасывающий электрода, а затем стимулировать его.
- Чтобы разоблачить нож мышцы и напряжение нерв удалить ближе мышцы и вентральной области проподита. Отрежьте ближе мышцы с помощью скальпеля с # 11 лопасти в проподита (рис. 6). Примечание: Не врезаться глубоко в проксимальной области, потому что это может привести к повреждению нож двигательного нерва.
Рисунок 5. Шаги Препарирование для разоблачения мотонейрона для стимулирования нож мышцы. Нажмите здесь, чтобы увеличить изображение .
Рисунок 6. Вырезать кутикулу на брюшной половине проподита чтобы разоблачить ближе мышцы, поэтому он может быть удален. Нажмите здесь, чтобы увеличить изображение . - Замените солевой раствор со свежим охлажденным физиологическим раствором на протяжении всего процесса вскрытия сохранить нейроны в живых. Для получения дополнительной вскрытия, поместите подготовки блюдо под микроскопом рассекает и использовать волоконно-оптический освещение.
- Аккуратно вырежьте ближе сухожилие от его привязанности кдактиль используя остроконечные ножницы средних.
- Будьте очень осторожны, чтобы не потревожить ветви к нож мышцы от главного нерва ноги, которая должна быть четко видны.
- Снимите и выбросьте ближе мышцы и сухожилия.
- Сделайте отверстие в пальце с рассечение штифта. Это отверстие будет использовано позднее зацепить металлический штифт на напряженности (силы) преобразователь, но надо сделать это на данном этапе процедуры.
- Найдите нерва филиал, который выступает в нож мышцы и аподемой в дистальной области нож мышцы. Тщательно исследовать нерв со стеклянным инструментом огневой полировкой.
- Соблюдайте нервное напряжение, которое возникает от дистального конца аподемой и переходит к двигателя нервного пучка.
- Для обнаружения нервную деятельность, заполнить всасывающий электрод с крабовым физиологическим раствором и привлечь обрезанный конец натяжения нерва нож в электрод. Убедитесь, что всасывающий электрод плотно на нерв.
- Изучите для Neuraл коррелятом пассивной напряженности на нож аподемой. Во время записи электрической активности от нерва натяжения, поверните дактиль быстро в расширенном сустава (т.е. растяжение нож мышцы).
- Затем тест развитие активной силой в отношении частоты стимуляции.
- Плотно прикрепить металлическую трубку таким образом, чтобы конец крюка проходит через небольшое отверстие в пальце.
- . Подключите другой конец металлическим крючком к датчику силы Примечание: Убедитесь, что датчик является под углом 90 ° каждый раз так, чтобы штифт перпендикулярно к преобразователю для максимального выявления силы, генерируемой.
- Вытяните крюк и дактиль так, чтобы она под углом примерно 45 ° от открывания сустава.
- Теперь стимулировать двигательного нерва при 100 Гц в течение 250 мс и измерения силы, а также огневую частоту нерва натяжения.
- Поместите сустав в полностью выдвинутом положении так, чтобы нож мышечные волокна вялым.
- Stimulate двигательного нерва при 100 Гц на 250 мс и измерить силу, а также огневую частоту нервное напряжение.
- Bend / сгибать сустав так, чтобы она полностью согнуты (~ 90 °). В этом положении мышечных волокон нож полностью растягивается. Там могут быть некоторые сила измеряется датчиком за счет этого пассивного растяжения мышцы.
- Стимулировать двигательного нерва при 100 Гц на 250 мс и измерить силу, а также огневую частоту нервное напряжение.
- После измерения силы, перейти в серии различных частотах: 20, 40, 60, 80, и 100 Гц для 8-10 сек в каждом совместной позиции.
- Измерьте ответ с быстрого освобождения натяжения. Организовать подготовку так, чтобы крючок на преобразователем силы может быть легко вытеснены из отверстия в пальце.
- Bend / сгибать сустав так, чтобы она полностью согнуты (~ 90 °). Теперь стимулировать двигательного нерва при 100 Гц с непрерывным стимуляции 5 сек.
- После первого вторичныхг или менее, как напряженность построена на нож мышцы, нажмите булавку из отверстия в пальце.
- Изучите записи натяжения нерва до и после выпуска штифта держа дактиль.
- Модулирующее воздействие нейроактивных веществ, таких как октопамину, серотонина и proctolin, которые изменяют выходные напряжения нейронов, может быть определена путем добавления этих молекул в купального сред на открытый нож мышцы и повторяя эксперименты.
- Используйте пипетку и закапать 1-2 мл за подготовкой.
3. Окрашивание периферической нервной системы структуры в ракообразных Прогулки Ноги
- Метиленовый синий техника
- Развести одну часть метиленового синего хлорида маточного раствора (0,25%) с двумя частями дистиллированной воды.
- Добавить эту смесь к пяти частях буферным раствором. Тщательно орошения область интереса.
- Проанализируйте ногу в соответствии с протоколом в разделе 1. Выдержите предварительноparation в раствора метиленового голубого на 12-13 ° С.
- Изучите препарату каждые 10-15 минут с микроскопом рассекает использованием низкой освещенности интенсивности, чтобы следить за ходом окрашивания. В некоторых случаях окрашивание будут завершены в течение часа, в других это может занять всю ночь.
- 4-ди-2-ASP техника
- Флуоресцентные красители могут быть использованы для резервного заполнить PD нейрон или непосредственно пятно подготовку из ванны. Однако подходит микроскоп с возможностями для просмотра флуоресцентного пятно требуется.
- Проанализируйте ногу в соответствии с протоколом в разделе 1.
- Инкубировать препарат в концентрации 10 мкМ раствора 4-ди-2-ASP и оставить препарат в холодильнике в течение 15 мин. Используйте достаточно просто решение для покрытия подготовку.
- Сфотографируйте препараты быстро и избежать чрезмерного воздействия ртути света. Это флуоресцентный краситель исчезает довольно быстро.
- Cobalt техника хлорид
- Expose ПФ нерв в соответствии с протоколом в разделе 1, и держать его погружали в холодную физиологического раствора.
- Сделайте вазелин хорошо провести CoCl 2. Если CoCl 2 разливов в солевой ванне вся подготовка будет пятно черный, и подготовка должны быть отброшены.
- Скольжения небольшой разрез листа полистирола, чтобы сделать пластиковую платформу, и контактный его таким образом, что она не будет плавать в сторону или погружения в солевой ванне (рис. 7).
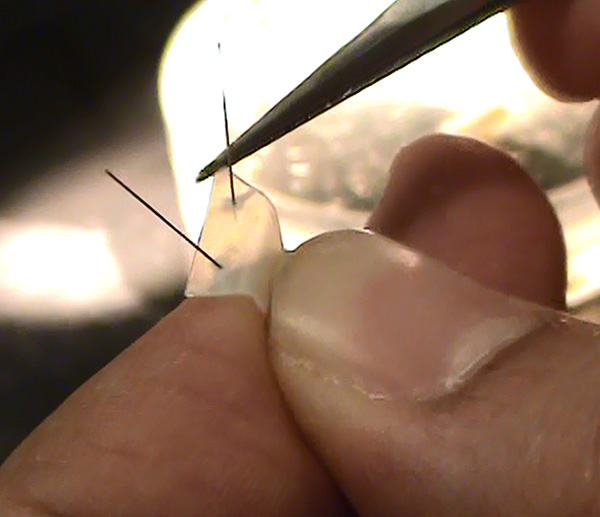
Рисунок 7. Полистирол лист с контактами, чтобы удерживать на месте в блюдо. Нажмите здесь, чтобы увеличить изображение . - Извлеките вазелин от штрафа иглы для подкожных инъекций, прикрепленной к одноразового шприца,затем сделать барьер (круг может хорошо работать), которая должна быть около 1-1,5 мм в высоту для пологой "V" в середине, где нерв будет завернуто в поперечнике, на вершине скольжения полистирола кроме.
- Сделать небольшую лужицу физиологического раствора по обе стороны барьера вблизи "V". Заботясь не растягивать или ущипнуть нерв, поднимите нерв тщательно от блюда и поместите его в солевом лужу в вазелин хорошо.
- Работают быстро, так что часть нерва не высыхает, тщательно извлечь вазелин для покрытия подвергаются нерв. Теперь проверьте барьер с физиологическим раствором и убедиться, что он не протекает.
- Пятно от солевой раствор на внутренней барьера и посмотреть, если он заполняется, когда ванна солевой высока вокруг стены вазелина, чтобы убедиться, что обе стороны изолированы друг от друга (рис. 8).

нг> Рисунок 8. Вазелин хорошо с физиологическим раствором и PD нерва охватывающих хорошо. PD нерв не были сокращены еще. Нажмите здесь, чтобы увеличить изображение . - Фитиль от солевой в скважине с помощью кусок папиросной бумаги. Не позволяйте бумага обернуть нерв.
- Создайте новый лужу используя несколько небольших капель дистиллированной воды, а затем обрежьте нерва. Будьте очень осторожны, чтобы не тянуть нерв через барьер при резке. Осмотического шока дистиллированной воды будет "воздушный шар" аксоны.
- В 30 сек добавить небольшую каплю CoCl 2 к воде, понежиться это решение, а затем добавить достаточно CoCl 2, чтобы сформировать лужу над этим укороченным части нерва (рис. 9). Препараты лучше хранить в холодильнике при температуре 13 ° С в течение 12-24 часов.
tp_upload/51050/51050fig9.jpg "ширина =" 500px "/>
Рисунок 9. ПД нерва вырезать подвергаясь CoCl 2. Разрез нерва опухает в присутствии воды, что облегчает и ускоряет движение молекул красителя через аксонов в нейрон клеточных тел. Нажмите здесь, чтобы увеличить изображение . - Удалите увлажняющие лужи. Пятно от раствора кобальта с помощью ткани и смыть остатки кобальта с несколькими изменениями физиологического раствора.
- Перенести изолированный подготовку к небольшой стеклянную чашку Петри, содержащей около 10 мл краба физиологического раствора. Нейроны промывают и следующие шаги выполняются на месте. Хорошие инструменты металлические, не должны использоваться для обработки подготовку после этого шага (вы должны использовать специальные инструменты, которые не будут использоваться в более позднее время для физиологии).
- Добавить 1-2 капли сульфида аммония (NH4) 2 S к физиологическим раствором. Закройте (NH 4) 2 S бутылку плотно и поместить обратно в капюшоне. Соблюдайте реакцию в подготовке при вскрытии микроскопом
- В 1-2 мин, кобальта заполненные нейроны и их процессы должны начинают появляться, потому что они будет пятно черного цвета.
- После 5-10 мин, замените решение для разработки со свежим раствором.
- Убедитесь, что решение для разработки вы выливают в канализацию раковины следует проточной водопроводной водой в течение нескольких минут или в сточных бутылки с крышкой.
- Вылейте физиологический раствор и фиксировать препарат нерва в течение приблизительно 15 мин с двумя изменениями раствора фиксатором Буэна. Для больших тканей, таких как нож мышцы (для окрашивания натяжных нейроны), увеличивают продолжительность фиксации до 30 мин.
- Высушить в серии порядке возрастания концентрации этанола, начиная с 70% (т.е. 70%, 80%, 90%, 100%). Приблизительно 10 минут при каждой концентрации достаточно длямаленькие ткани.
- Примерно через 10-15 минут в двух сменах 100% этанола, снимите ткань, заменяя этанол с 100% метилсалицилат. Подготовка останется в этом растворе постоянно для повторного просмотра. Со временем заполненные клетки станут более очевидными, поскольку окружающие ткани станут более ясными. Интенсификация методы могут быть использованы для предотвращения выцветания с течением времени 25.
- Используйте тот же самый процесс, чтобы заполнить нервное напряжение с CoCl 2. Тем не менее, изменить растворе этанола несколько раз в каждом стадии дегидратации этанола и инкубировать подготовку внутри алкоголя около 20 мин для каждого шага, чтобы тщательно обезвоживают мышцы и дать им возможность очистить хорошо.
Результаты
Когда орган PD растягивается полностью расширения сустава, активность в PD нерва является надежной во время движения, как показано на первой секунды на рисунке 10. Некоторые активность остается пока оно удерживается еще в открытом положении. Эта деятельность является из статического положения чувствительных нейронов (вторая половина записи, показанной на рисунке 10). Движение вызывает реакцию во время перемещения, и стрельба в основном присутствовали во время растяжения хордотональные нити (рис. 11).
Дальнейший анализ шипы могут быть легко подошел сортировки относительные амплитуды. Это подход, чтобы продемонстрировать различные популяции сенсорных нейронов вербуют на должности или типов движений 5. Типичные амплитуды в диапазоне от 0,25-1,5 мВ, но эти значения зависят от сопротивления (то есть на герметичность) всасывающего электрода печатью. Частота шипами в тон различные диапазоны размеров также может быть графически представлена на анализ.
Сил, генерируемых открывани мышцы по отношению к частоте стимуляции можно сравнить путем наложения соответствующих напряжение времени следы на верхней части друг друга (фиг. 13А и В). Это также может быть выполнена для каждой совместной позиции в каждый данный стимуляции частоты. Активность нерва натяжения затем можно соотнести с количеством относительной силы, генерируемой на каждой частоте стимуляции, и для каждого совместного положении. Как и в PD нерва, различные амплитуды шип видны в ответ на сжатие открывани мышцы (фиг.13С).
Анатомические расположение нейронов в нескольких минутах ноги отчетливо наблюдается мети синего окрашивания (рис. 14). Обратите внимание на упругую хордотональные нити и натяжение нейрон, который близок к аподемой. Несколько somata с различными диаметрамид конкретные места также видны на этом рисунке. Весь ход нерва натяжения и носилок двигательного нерва показаны на рисунке 15. Отдельные нейроны PD нерва показаны с более высокой контрастностью, используя 4-ди-2-ASP (рис. 16) и CoCl 2 (рис. 17) засыпки методы. В большом увеличении сенсорные окончания можно увидеть внутри из поддерживающих scolopales (рис. 16, б) 21,22,26.
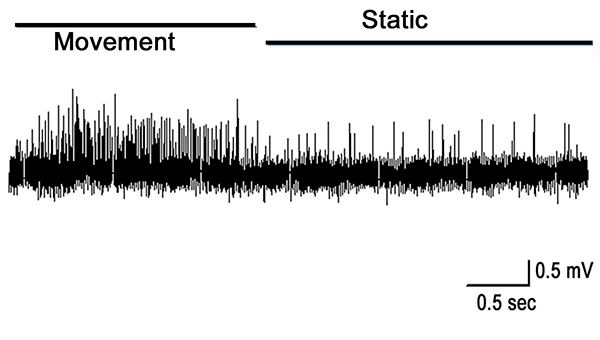
Рисунок 10. Перемещение и удерживайте при 0 °. Динамические нейроны являются надежными в стрельбе во время движения и шипы от статических чувствительных нейронов присутствуют в то время как сустав удерживается открытым. Нажмите здесь, чтобы увеличить изображение </>.
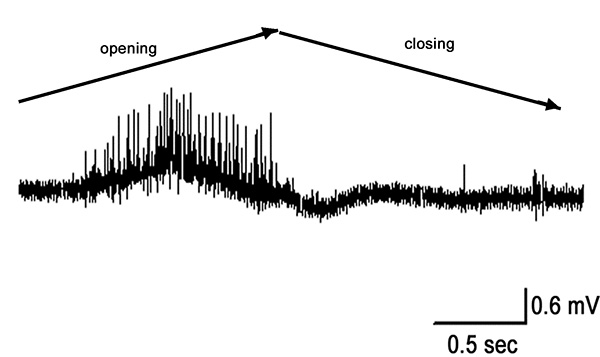
Рисунок 11. Быстрое открытым и заключительный из полностью согнуты выдвинутом положении (90-0 °). Нажмите здесь, чтобы увеличить изображение .
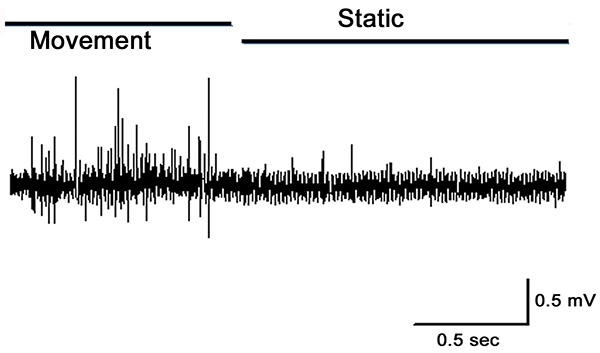
Рисунок 12. Внеклеточные шипы, записанные от PD нерва. Совместное полностью выдвинут, а затем быстро перешел к ½ согнутом положении, а затем провел еще. Обратите внимание на активность во время движения и снижение активности, когда статическая. Нажмите здесь, чтобы увеличить ИмаGE.
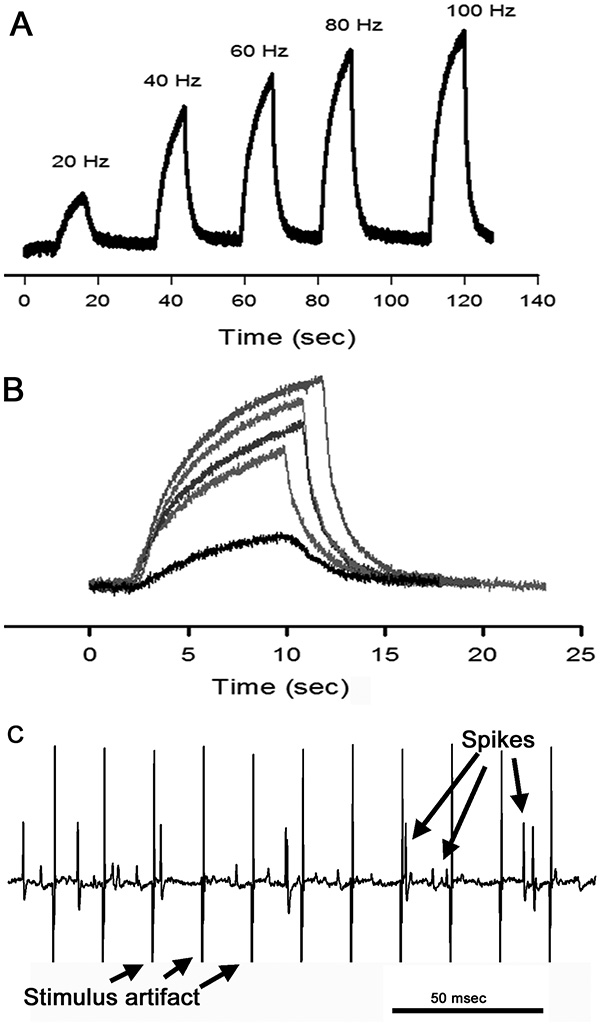
Рисунок 13. Относительные силы, которые разрабатываются с сустава полностью согнуты и стимулировали на различных частотах. (А) Напряжение времени следы от датчика силы показаны с каждой частоты стимуляции. (В) Следы в панели А накладываются в различных цветах для удобства в сравнении. (С) Напряжение времени следы электрической активности, записанные от нерва натяжения, когда двигатель нерв стимулировали при 80 Гц. Обратите внимание на узор из стимула артефактов как по сравнению с нейронной активности. Кроме того, обратите внимание на различные амплитуды нервных реакций. Нажмите здесь, чтобы увеличить изображение .
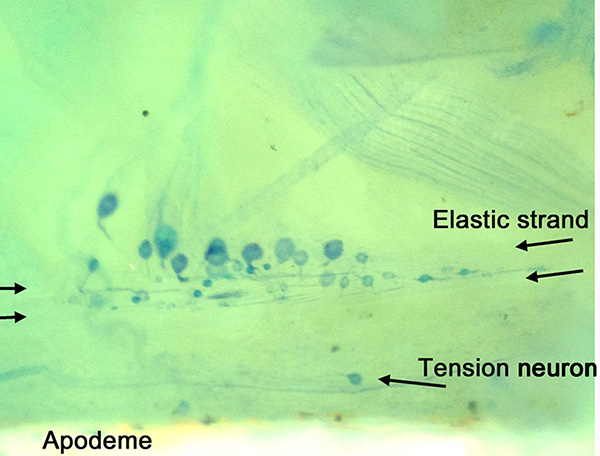
Рисунок 14. Метиленовый синий пятно подготовке ходьба ноги. Индивидуальные Somas показаны с их сенсорные окончания проектирования в упругой нити. Рядом с аподемой нейрон напряжение показано на рисунке. Нажмите здесь, чтобы увеличить изображение .

Рисунок 15. Нервное напряжение, вытекающие из дистального конца (красные стрелки) и вступления в двигательного нерва (зеленая стрелка). Щелкните здесь, чтобы увеличить изображение .
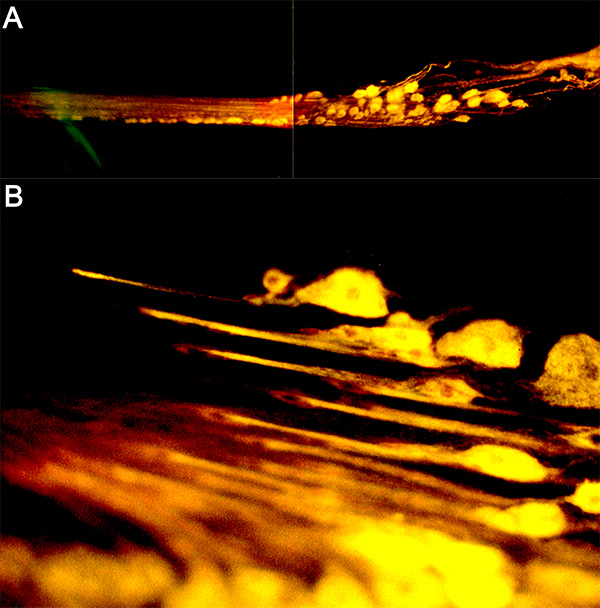
Рисунок 16. (А) назад-заполнения ПФ нерва в магистра рака с 4-ди-2-ASP. (Б) Более высокое увеличение сенсорных окончаний. Нажмите здесь, чтобы увеличить изображение .
Рисунок 17. Нейроны, которые были заполнены с CoCl 2 и обработанные (А). Проследить план окрашенных подготовки, показанной (В). Нажмите здесь, чтобы увеличить изображение .
| Солевой | г / л |
| NaCl | 27.29 |
| KCl | 0.81 |
| MgSO 4 • 7H 2 O | 4.81 |
| CaCl 2 • 2H 2 O | 1.85 |
| Na 2 SO 4 • 10H 2 O | 0.97 |
| Декстроза (D-Глюкоза) | 1.982 |
| HEPES кислота | 0.476 |
| HEPES соль | 2.08 |
| Отрегулируйте рН до 8,1 с помощью NaOH или HCl |
Таблица 1. Рецепты для краба физиологического раствора.
Обсуждение
Цель этой серии экспериментов является 1) учить и демонстрировать основные принципы внеклеточных записи с идентифицируемым проприоцептивной органа и натяжения нерва и 2) подчеркнуть важность анатомическом отображении по отношению к физиологической функции отдельных сенсорных систем. Этот экспериментальный подход и животные модели используются недорогие и относительно легко провести в нейрофизиологии обучения лабораториях.
Нейроны хордотональные органов бывают двух конкретных функциональных типов, те, которые реагирует на перемещения и те, отвечая на статических позиций. Единичных клеток записи с различными хордотональные органов, не важно, какой сустав рассмотрены, не показали, что это дело 3,5. Действительно, хордотональные органы, связанные с усиков суставах омаров выявить те же два сенсорных Типы и основные анатомии 27. В дополнение к там быть два типа нейронов (движение и Positiна), нейроны и тот же анатомические договоренность о своих эластичных нитей. Большой somata расположен проксимально на нити, как правило, относятся к динамическим движения чувствительных нейронов. Нейроны, которые сигнализируют статические позиции имеют небольшой somata и расположены дистально. Эти клетки монотонно активным. PD совместное содержит только одну хордотональные орган в то время как существует два хордотональные органы в запястьевого-propodus (СР) и Merus-запястья (MC) суставов.
Рассечение выставить проприоцептивные структур в синих крабов (С. Sapidus) для электрофизиологические записи требуется стратегию, которая позволит совместные движения пройдет в естественных позиций при записи с сенсорных нейронов. Нерв напряжение для открывания мышцы в минутах ноге очень тонкая нервная состоит из нескольких нейронов. Если не будут приняты меры, нервное напряжение, а также двигательного нерва, иннервирующих мышцы стимулироваться, могут быть повреждены во время этого рассечения. ДляОптимальные записи всасывающие электроды должны быть адаптированы к размеру нерва. Записи были легко доступны в студенческом лаборатории с использованием 30-40-кратном увеличении рассекает микроскопом и низким уровнем конца микроманипуляторами.
Будущие эксперименты, что бы быть интересными для преследовать с совместными хордотональные органов будет изучить структурные и физиологические профили во время регенерации ноги в различных видов на разных стадиях жизненного цикла, как следовать до первоначального исследования, которое используется Рак Magister 19,26 . Вопросы, которые еще предстоит решить: 1) делает распределение и организация регенерированных нейронов зависит от возраста животного при регенерации конечностей, 2) являются аксонов проекции на ЦНС (брюшной нервной) в регенерации конечностей функциональной или делает это потребует времени и совместное использование с целью установления функциональных связей, и 3), что происходит с отрубленными аксонов проксимальнее аутотомии плоскости, когда конечность AUTOTomized? 28
Ракообразные соответствовать условиям окружающей среды и окружающей их температуры, но непонятно, как они утверждают, координации в рамках нейронной цепи, как нейроны изменяют свою деятельность в ответ на изменения температуры. Медленный темп изменения могут позволить животному некоторое время для акклиматизации в то время как быстрое изменение может not29, 30. Физиологические изменения рН или осмолярности за счет обмена веществ, поведения 31 или воздействия на окружающую среду может представить с аналогичными проблемами в нейронных цепей, участвующих в проприоцепции. Эти ракообразных препараты идеально подходят для решения такого рода проблем, потому что их функция хорошо характеризуется на одном уровне клетки.
В этом протоколе мы продемонстрировали физиологическую важность напряжения нейронов в контроле силы, генерируемой открывани мышцы. Эти рецепторы растяжения можно проследить в их месте в аподемой с помощью процедуры окрашивания. Этинейроны, как у млекопитающих, обнаруживать силу на различных уровнях и набору дополнительных нейронов при увеличении силы. Частота в деятельность связана с частотой стимуляции двигательного нейрона до насыщения в приеме не будет достигнута. Использование быстрый протокол релиз с согнутой Дактилюс сустава, деятельность напряженность быстро исчезает, но затем возвращается на восстановлении напряжения в полностью выдвинутом сустава. Это классический экспериментальная процедура для иллюстрации силы, измеренной напряженности рецепторов. Различные нейромодуляторы могут быть применены к подготовке видеть, как это влияет на развитие силы и нейрональной реакции. Одним из важных аспектов, как нервные отклики обрабатываются и интегрированы в центральной нервной системе и их влияние на активность двигательных нейронов. Методы Мы показали, позволяют приступить к решению более подробную информацию о напряженности (сенсорная) нервно-двигательной функции нейрон цепи, т.е. сигнала в неповрежденной ноги на ганглии и обратнок мышце.
Процедуры окрашивания продемонстрировали являются ключом к пониманию физиологии сенсорных нейронов, которые возбуждают проприоцептивные органы. Анатомический расположение нейронов на основе функции и размера сомы схожи в различных хордотональные органов внутри ножек краба. Не известно, если подобные нейронные механизмы находятся также в других ракообразных и насекомых. Сочетание физиологических записей с отдельных клеток и отображение местоположения позволяет функции прямой структура отношений. Долговременное сохранение анатомической договоренности с CoCl 2 окрашивания и фиксации позволяет повторно сделать меры и оценить структурную компоновку.
Проприоцепция и прием натяжение скелетных мышц являются сенсорные модальности, которые позволяют скоординированные поведения и ответов на внешней и внутренней среды для сочлененных животных в различных скелетных конфигурации мышцс. Мышцы рецепторов органов в брюшной полости раков еще один хорошо документированный подготовка (см. Crawdad проект; http://www.crawdad.cornell.edu/ ) в учебных целях проприоцепции только с двумя нейронами в брюшной геми-сегменте 23 . Возможность записи от отдельных нейронов в сенсорных нервных пучков предоставляет подробную информацию, что помощь в понимании основных принципов сенсорной рецепции. Эти относительно простые ракообразных препараты позволяют решать фундаментальные аспекты проприоцепции и мониторинга напряжения, с потенциалом, чтобы определить нейронных цепей, которые позволяют центральную интеграции проприоцептивными и других сенсорных входов 9-12, 32, 33.
Раскрытие информации
Авторы заявляют, что они не имеют конкурирующие финансовые интересы.
Благодарности
Авторы выражают благодарность за художественные вкладов Hyewon Купер.
Материалы
| Name | Company | Catalog Number | Comments |
| Sylgard | Dow Corning | 182 silicone kit | |
| NaCl | Sigma-Aldrich | S7653 | |
| KCl | Sigma-Aldrich | P9333 | |
| CaCl2 | Sigma-Aldrich | C5670 | |
| HEPES acid | Sigma | 3375 | Free acid, crystalline |
| HEPES base | Sigma | ||
| D-Glucose | Sigma | G7021 | |
| MgSO4•7H2O | Sigma | M2643 | |
| Na2SO4•10H2O | Sigma | 246980 | |
| Bouin’s solution fixative | Sigma | HT10-1-32 | Caution: Hazardous material (Special shipping cost required) |
| CoCl2 | Sigma | Caution: Hazardous material. Please follow proper disposal according to local and federal regulations. | |
| Methylene blue chloride | Matheson Co., Inc | Basic Blue 9, C.I. 52015 | |
| 4-Di-2-ASP | Molecular Probes | 4-(4-diethylaminostyryl)-N-methylpyridinium iodide | |
| Bleach | Sigma-Aldrich | To chloride silver wire | |
| NaOH | Sigma-Aldrich | 221465 | To adjust pH |
| HCl | Sigma-Aldrich | H1758 | To adjust pH |
| Materials | |||
| Dissecting tools | World Precision Instruments | assortment | |
| Intracellular electrode probe | |||
| Faraday cage | |||
| Insect Pins | Fine Science Tools, Inc | 26001-60 | |
| Dissecting microscope (100X) | |||
| Fiber optic lamp | |||
| Small adjustable mirror | To direct light beam toward the preparation. | ||
| Glass electrodes | Sigma-Aldrich | CLS7095B5X | Box of 200, suction electrodes |
| Micromanipulator | World Precision Instruments | MD4-M3-R | Can fix for base or on a metal rod |
| Raised preparation stand | |||
| Silver wire (10/1,000 inch) | A-M Systems | 782500 | |
| Computer | Any company | ||
| AC/DC differential amplifier | A-M Systems | Model 3000 | |
| PowerLab 26T | AD Instruments | 27T | |
| Force transducer | AD Instruments | 0-50g | MLTF050/ST |
| Head stage | AD Instruments | Comes with AC/DC amplifier | |
| LabChart7 | AD Instruments | ||
| Electrical leads | Any company | ||
| Glass tools | Make yourself | For manipulating nerves | |
| Cable and connectors | Any company | ||
| Pipettes with bulbs | Fisher Scientific | 13-711-7 | Box of 500 |
| Beakers | Any company | ||
| Wax or modeling clay | Any company or local stores | ||
| Stimulator | Grass Instruments | SD9 or S88 | |
| Plastic tip for suction electrode | Local hardware store (Watt’s brand) | ¼ inch OD x 0.170 inch ID | Cut in small pieces. Pull out over a flame and cut back the tip to the correct size |
Ссылки
- Whitear, M. Chordotonal organs in Crustacea. Nature. 187, 522-523 (1038).
- Alexandrowicz, J. S. The comparative anatomy of leg propriocetors in some decapod Crustacea. J. Mar. Biol. Assoc. U.K. 52 (3), 605-634 (1972).
- Hartman, H. B., Boettiger, E. G. The functional organization of the propys-dactylus organ in Cancer irroratus Say. Comp. Biochem. Physiol. 22, 651-663 (1967).
- Cooper, R. L., Hartman, H. B. Responses of the bender apodeme tension receptors in the Dungeness crab, Cancer magister. Comp. Biochem. Physiol. A Physiol. 109 (2), 479-486 (1994).
- Cooper, R. L. Mapping proprioceptive neurons on chordotonal organs in the crab, Cancer magister. Crustaceana. 81 (4), 447-475 (2008).
- Burke, W. An organ for proprioception and vibration sense in Carcinus maenas. J. Exp. Biol. 31, 127-138 (1953).
- Hill, A. V. . First and Last Experiments in Muscle Mechanics. , (1970).
- Stuart, D. G., Mosher, C. C., Gerlach, R. L., Reinking, R. M. Mechanical arrangement and transducing properties of Golgi tendon organs. Exp. Brain Res. 14 (3), 274-292 (1972).
- Macmillan, D. L., Dando, M. R. Tension receptors on the apodemes of muscles in the walking legs of the crab, Cancer magister. Mar. Behav. Physiol. 1 (1-4), 185-208 (1972).
- Bévengut, M., Simmers, A. J., Clarac, F. Central neuronal projections and neuromuscular organization of the basal region of the shore crab leg. J. Comp. Neurol. 221 (2), 185-198 (1983).
- El Manira, A., Cattaert, D., Clarac, F. Monosynaptic connections mediate resistance reflex in crayfish (Procambarus clarkii) legs. J. Comp. Physiol. A. 168 (3), 337-349 (1991).
- Le Bon-Jego, M., Cattaert, D. Inhibitory component of the resistance reflex in the locomotor network of the crayfish. J. Neurophysiol. 88 (5), 2575-2588 (2002).
- Ray, D. L., Clarac, F., Cattaert, D. Functional analysis of the sensory motor pathway of resistance reflex in crayfish. I. Multisensory coding and motor neuron monosynaptic responses. J. Neurophysiol. 78 (6), 3133-3143 (1997).
- Wiersma, C. A. G. Vergleichende Untersuchungenüber das periphere Nerve-muskelsystem von Crustaceen (Comparative studies on the peripheral nerve-muscle system of crustaceans). J. Comp. Physiol. 19, 349-385 (1933).
- Wiersma, C. A. G. Movement receptors in decapod crustacea. J. Mar. Biol. Assoc. U.K. 38 (01), 01-143 (1959).
- Hartman, H. B. Tension receptors on the closer muscle apodeme in the walking legs of the blue crab Callinectes sapidus. J. Comp. Physiol. A. 157 (3), 355-362 (1985).
- Holsinger, R. . The effect of regional phenotypic differences of Procambarus clarkii opener muscle on sarcomere length, fiber diameter, and force development MSc thesis [dissertation]. , (2013).
- Parsons, D. W. The morphology and ultrastructure of tension receptors in the walking legs of the crab, Carcinus maenas. Cell Tissue Res. 211 (1), 139-149 (1980).
- Parsons, D. W. Responses and central interactions of tension receptors in the leg muscle of Carcinus. Comp. Biochem. Physiol. A Physiol. 72 (2), 391-399 (1982).
- Tryba, A. K., Hartman, H. B. Dynamic responses of series force receptors innervating the opener muscle apodeme in the blue crab, Callinectes sapidus. J. Comp. Physiol. A. 180 (3), 215-221 (1997).
- Whitear, M. The fine structure of crustacean proprioceptors. I. The chordotonal organs in the legs of the shore crab, Carcinus meanas. Philos. Trans. R. Soc. Lond. B Biol. Sci. 245 (725), 291-325 (1962).
- Whitear, M. The fine structure of crustacean proprioceptors. II. The thoracico-coxal organs in Carcinus, Pagurus and Astacus. Philos. Trans. R. Soc. Lond. B Biol. Sci. 248 (752), 437-456 (1965).
- Leksrisawat, B., Cooper, A. S., Gilberts, A. B., Cooper, R. L. Muscle Receptor Organs in the Crayfish Abdomen: A Student Laboratory Exercise in Proprioception. J. Vis. Exp. (45), e2323 (2010).
- Baierlein, B., Thurow, A. L., Atwood, H. L., Cooper, R. L. Membrane Potentials, Synaptic Responses, Neuronal Circuitry, Neuromodulation and Muscle Histology Using the Crayfish: Student Laboratory Exercises. J. Vis. Exp. (47), e2322 (2011).
- Delaney, K., Gelperin, A. Cerebral interneurons controlling fictive feeding in Limaxmaximus; I. Anatomy and criteria for re-identification. J. Comp. Physiol. A. 166, 297-310 (1990).
- Hartman, H. B., Cooper, R. L. Regeneration and molting effects on a proprioceptor organ in the Dungeness crab, Cancer magister. J. Neurobiol. 25 (5), 461-471 (1994).
- Hartman, H. B., Austin, W. D. Proprioceptor organs in the antennae of Decapoda Crustacea. J. Comp. Physiol. 81 (2), 187-202 (1972).
- Cooper, R. L. Development of sensory processes during limb regeneration in adult crayfish. J. Exp. Biol. 201 (Pt 11), 1745-1752 (1998).
- Chung, Y. -. S., Cooper, R. M., Graff, J., Cooper, R. L. The acute and chronic effect of low temperature on survival, heart rate and neural function in crayfish (Procambarus clarkii) and prawn (Macrobrachium rosenbergii) species. Open J. Mol. Int. Physiol. 2 (3), 75-86 (2012).
- Blundon, J. A. Effects of temperature and thermal history on neuromuscular properties of two crustacean species. J. Comp. Physiol. B. 158 (6), 689-696 (1989).
- Cooper, R. M., Schapker, H., Adami, H., Cooper, R. L. Heart and ventilatory measures in crayfish during copulation. Open J. Mol. Int. Physiol. 1 (3), 36-42 (2011).
- Bierbower, S. M., Cooper, R. L. The mechanistic action of carbon dioxide on a neural circuit and NMJ communication. Journal of Experimental Zoology. , (2013).
- Bierbower, S. M., Shuranova, Z. P., Viele, K., Cooper, R. L. Sensory systems and environmental change on behavior during social interactions. Brain Behav. 3 (1), 4-13 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены