Method Article
カニ手足の固有感覚と緊張受容体:学生実験室の練習
要約
生理学的および解剖学的技法は甲殻類の歩行手足の関節の固有受容および筋肉の緊張受容体の機能および構造に対処することが実証されている。
要約
これらの手順の主な目的は、彼らは関節位置や動きを検出し、筋肉の緊張しているように固有感覚を担当する一次感覚ニューロンを生きているの活動を記録する方法を教育や研究目的のために実証することである。甲殻類固有受容テンション受容体から電気的活動は、基本的な神経生理学計装によって記録され、トランスデューサは、同時に運動神経を刺激することによって生成される力を測定するために使用される。また、我々は彼らの解剖学的構造の迅速な評価のために、または恒久的な固定のために神経細胞を染色する方法を示します。染色は、ほとんどの甲殻類での弦音器官の代表である解剖学的組織を明らかにする。固有受容応答にテンション神経の応答を比較すると、これらの感覚ニューロンが機能的に定義される方法と解剖学が関数に相関しているか決定する上で効果的な教育ツールである。三つの染色技術研究者やインストラクターが自分の研究室のための理想的な方法を選択することができています。
概要
固有感覚は、協調運動行動を可能に四肢の位置や動きの感覚である。固有受容位置(静的)と動き(運動感覚)の受容体で構成されています。昆虫や甲殻類では、弦音器官は、CNS 1にその情報を提供する構造体である。すべての弦音器官は、関節にまたがるが、彼らはまだ、関節にまたがると、骨格筋や関節の関節に連動して移動するapodemes(構造のような腱)上のそれらの結合のために、関節の動きを監視することができます。カニの脚部は、それぞれが1つまたは2つの弦音器官2を有する、6個の関節を有している。通常、弦音器官は動き3-6の弾性ストランド、静的な関節位置を知らせるニューロン、方向と速度内に埋め込 ま60〜100以上の感覚神経を持っています。各関節と脚の弦音器官からの入力は、その後、集中的に動物による協調の動きを可能に処理される。
足の筋肉が等尺性と等張性収縮時の生産力は、筋線維とapodemes7-9にその添付ファイルに関連付けられたテンション受容体によって検出される。我々は固有感覚を監視一次感覚ニューロンからの記録と筋線維によって発生する力に応答するニューロンのための方法論を提示従っ甲殻類の歩行脚プロトコルでは。足の動きを活性化し、力発生を定量化するための技術も提示、ならびにこれらの末梢神経系構造体の配置を特徴付けるために使用され得る、解剖学的技法れる。
以下に示す手順では、弦音弾性ストランドと内突起上の位置を基準に両タイプの受容体を刺激するニューロンの構造的および機能解析を可能にします。説明するために、我々はpropodite -指節(PD)弦音臓器、カニ脚3の最も遠位のセグメントにまたがる臓器を使用しています。詳細な電気生理学的研究は1930年に始まり、現在も行われているものの、いくつかの側面は、様々な関節とmuscles10-16の協調制御における役割における固有受容の分節の接続については知られるようになった。固有受容器官、筋肉や神経系の間の構造と機能の関係を確立することは、さらに、これらの役割を定義するのに役立ちます。例えば、内突起に挿入細胞体とテンションニューロンの遠位終末を標識化することは、筋繊維8,17-21との相対的な位置を明らかにします。
我々は、学術研究や実験室で使用することができる脚甲殻類のための3つの染色技術を提示する。メチレンブルー染色は、筋肉や神経に適しコントラストを提供し、解剖学を学ぶ学生のための簡単な手法として推奨されます。蛍光顕微鏡のセットアップを持っているラボは簡単に神経を露出させることにより、より選択的な神経細胞の染色を達成することができます生体色素4 - ジ-2-ASPにS。第三の選択肢は、ニューロンを染色すると修正のCoCl 2埋め戻し、であり、蛍光イメージングを必要としません。それは労力と時間集約的でありながら、この染色プロセスが満たされている神経のための高コントラストと特異性を提供します。一緒に、これらの技術は、四肢または四肢内の間だけでなく、他の甲殻類や昆虫種20〜22のうち、種々の弦音器官を比較するために使用することができる。生理的なレコーディングにと解剖学的染色に用いワタリガニ(C.のサピドゥス ) は、すべての米国の南部と南東境界付近容易に入手可能である。この種は、ほとんどのカニで発見弦音と緊張神経手配の代表として機能します。西海岸の研究所では、これらの実験のためにはるかに大きいアメリカイチョウガニ( 蟹座マジスター ) を使用することを好むでしょう。
プロトコル
1。 Propodite - 指節(PD)の神経から切開および録音の電気的活動
- 後ろから甲全体にカニを保持し、爪を避けて、ピンセットで長節の近位部を挟ま。足は死に出血から動物を防ぐために自分の体の一部を切るでしょう。青カニを扱うときは、むしろ積極的かつ非常に高速であるように、十分に注意してください。
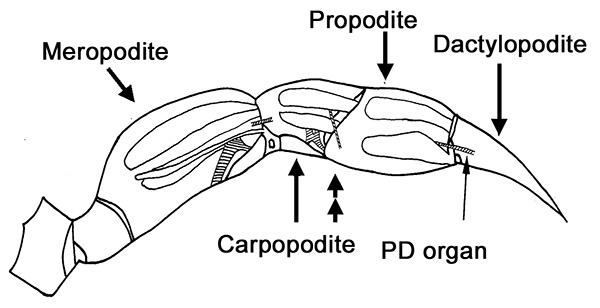
図1まず、カニの足を歩く 。弦音器官(斜線領域)の解剖学的位置は、この回路図に重ねられる。両矢印の頭のPDの神経実験用の脚を横断する場所を示しています。 拡大画像を表示するには、ここをクリックしてください 。 - propoditeとcarpodite間のカットを行います。腕節とtを捨てる彼は長節( 図1)を添付。
- #11のブレード( 図2および3)とメスでpropoditeの色素沈着(横)側にクチクラに大きな窓をカット(注)。深くカットしないでください。
- 下のメスの刃をスライドさせてキューティクル層を除去し、キューティクルに平行である。これはキューティクルに付着した筋線維を切断する。
- 無傷で、色素の上propoditeの(内側)側を小さいウィンドウをカットするが、顆を残し、同じ技術を使用して(ソケットジョイントまたはセグメント間のヒンジ)付属。
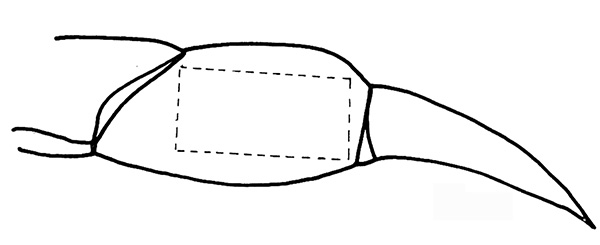
図2。propodite上の点線に沿って切り取ります。 拡大画像を表示するには、ここをクリックしてください 。
N "SRC =" / files/ftp_upload/51050/51050fig3.jpg "幅=" 500px "/>
図3。(矢印は神経束をアウトライン)]ウィンドウに神経を露出 。 拡大画像を表示するには、ここをクリックしてください 。 - ダウンの準備をピンカニ生理食塩水を含有するシルガードが並ぶお料理を準備します(注)。種特異的食塩水のレシピについては、表1を参照してください。
- 慎重にファイアーポリッシュガラス針を用いて探索することによって、PDの臓器の位置を確認します。関節にまたがる弾性ストランドは、銀外観を有している。
- 腱の両側から臓器の表示をあいまいに筋線維を削除します。 PD器官またはその神経を傷つけないよう十分注意してください。
- これが達成されたら、しっかりと( 図4)を上に向け顔料側(横方向)と皿に製剤を再。

図4。のPD臓器や神経を露呈した 。 拡大画像を表示するには、ここをクリックしてください 。 - FREE-UPに神経の長さが長い(1.5 cm)の記録のために順に限り近位にできるだけpropodite内のPD器官の神経に従ってください。 PDの神経が、まだ主脚の神経に接続されている間これが最善に行われます。
- ガラス針を用いて主脚の神経からのPDの神経を分離した後、アイリスはさみで近位に、PDの神経を切断注:解剖の際にストレッチや神経を引っ張らないでください。
- 拡張された、完全に屈曲した位置に指節を移動します。極端な屈曲伸展位置がどこにあるかに関するメモを取り、後で使用するために中間点。
- 生理食塩水浴の中にアース線を配置します。
- Eの電源を入れますlectrophysiology記録ハードウェア/ソフトウェア(注)当社のセットアップは、以前に23に記載されている。
- それは顕微鏡のステージを見下ろすされるように顕微鏡を配置します。予備校ディッシュがステージ上に置かれたら、あなたは最高の準備を可視化するために高強度の照明光の位置を調整する必要があります。
- 付属の吸引電極接合体は生理食塩水浴と準備への容易なアクセスを持つようにマイクロマニピュレータを配置します。オンラインビデオ24に示すように、吸引電極が構成されている。
- 神経活動を検出するために、吸引電極へのPDの神経の切断端を描画します。
- ガラスプローブまたは木製のダボを用いて数サイクルの拡張や屈曲した位置全体に強弱弱格を移動します。
- 強弱弱格は、延長曲げられ、半ば位置に固定されたときに次のアクティビティを観察します。
2。緊張から電気的活動を記録する神経フォース世代を監視しながら、
- 脚の外側および内側側を決定します。内側には、指の爪で長節領域でそっとつまんで感じることができるソフトな風合いを持っています。
- 皿にこのソフトキューティクル側を上にして置きます。オープナーの筋肉を神経支配刺激神経の運動神経も腕節におけるストレッチャ筋肉を神経支配。
- オープナーの筋肉を刺激するためにcarpodite領域のストレッチャー運動神経を単離し、吸引電極を用いて刺激した。脚部の近位部分はハサミで長節を横切開することによって除去される。
- 内側の手根領域でキューティクルのセクションを削除(内側、 図5A)。
- ベンダー筋の内突起を切り取り、足キャビティから主脚神経を引っ張らないように慎重に筋肉を取り外します( 図5B、Cは内突起が分離されているベンダーには、矢印を注意してください)。主脚の神経とブラジャーストレッチャ心筋へNCH次いで、( 図5D)を観察することができる。
- ストレッチャ筋肉(矢印で図5E)にメイン神経束から分岐する神経を見つける。これは近くの筋肉に切断し、刺激するように吸引電極に引き込むことができます( 図5FとGを、矢印は分岐を示している)。
- 神経をつまむことなく、開幕戦に向けて投射する神経の部分を引き出す。ストレッチャ/オープナー運動神経を横断する。
- 吸引電極に運動神経を引いて、それを刺激する。
- オープナーの筋肉とテンション神経を露出することは近い筋肉やpropoditeの腹側領域を除去。 propodite中#11のブレード( 図6)と、メスとの緊密な筋肉を切断注:それはオープナー運動神経を損傷する可能性があるため、近位領域に深くカットしないでください。

図5。オープナーの筋肉を刺激するための運動ニューロンを露出させるための解剖手順 。 拡大画像を表示するには、ここをクリックしてください 。
図6。それは取り外すことができますので、近い筋肉を露出させpropoditeの腹側半分にキューティクルを切った 。 拡大画像を表示するには、ここをクリックしてください 。 - 生きている神経細胞を維持するために解剖プロセス全体を通して、新鮮な冷却生理食塩水で食塩水を交換する。さらに解剖については、解剖顕微鏡下で準備ディッシュを配置し、光ファイバ照明を使用しています。
- 慎重に、その添付ファイルから近い腱を切る先鋭中規模のはさみを使って強弱弱格。
- はっきりと見えるはずです主脚神経からオープナーの筋肉への分岐を乱さないように注意してください。
- 近い筋肉や腱を取り外し、廃棄します。
- 解剖ピンと強弱弱格に穴を作る。この穴はテンション(力)トランスデューサに金属ピンをフックするために後で使用しますが、それは手順のこの段階でそれを作ることが必要である。
- オープナー筋の遠位領域におけるオープナーの筋肉と内突起に突出神経枝の位置を確認します。慎重にファイアーポリッシュガラスツールで神経を探る。
- 運動神経束に内突起や収益の先端部から生じる張力神経を観察します。
- 、神経活動を検知カニ生理食塩水を吸引電極を記入し、電極中にオープナーテンション神経の切断端を描画します。吸引電極が神経にしっかりとフィットしていることを確認してください。
- neuraのために調べるオープナー内突起上の受動的な緊張のL相関する。テンション神経からの電気的活動を記録しながら、( すなわちオープナーの筋肉を伸ばす)、拡張関節内に急速に強弱弱格を回転させる。
- 次に、刺激周波数の関係で積極的な力の開発をテストします。
- フックの先端が強弱弱格に小さな穴を通過するように、しっかりと金属フックを取り付けます。
- 力変換器に金属フックのもう一方の端を接続します(注)。ピンは発生力の最大を検出するための変換器に垂直になるようにするたびに、変換器は、90°の角度であることを確認します。
- それは開幕戦の関節の約45°の角度になるようにフックと強弱弱格を引っ張る。
- 今250ミリ秒、100 Hzで運動神経を刺激し、力だけでなく、テンション神経の発火頻度を測定します。
- オープナーの筋肉繊維が弛緩しているように、完全に延びた位置にジョイントを配置します。
- S250ミリ、100 Hzで運動神経をtimulate力だけでなく、テンション神経の発火頻度を測定します。
- それが(〜90°)に完全に曲げられるようにベンド/ジョイントを曲げる。この位置でオープナーの筋肉繊維が完全に引き伸ばされます。筋肉のこの受動的なストレッチのために変換器によって測定されたいくつかの力があるかもしれません。
- 250ミリ秒のための100Hzで運動神経を刺激し、力だけでなく、テンション神経の発火頻度を測定します。
- 力を測定した後、様々な周波数の一連の手順に従います。各関節の位置に8月10日秒20、40、60、80、および100 Hzのを。
- 迅速なテンションリリースと応答を測定します。力変換器のフックは簡単に強弱弱格の穴から押し出すことができるように準備を手配。
- それが(〜90°)に完全に曲げられるようにベンド/ジョイントを曲げる。今5秒の連続刺激と100Hzで運動神経を刺激する。
- 最初のseconの後にテンションがオープナーの筋肉に蓄積しているようにD以下、強弱弱格にある穴からピンを押してください。
- 強弱弱格を保持しているピンのリリース前と後のテンション神経記録を調べてください。
- 張力ニューロンの出力を変化させるようなオクトパミン、セロトニン、およびproctolinなどの神経活性物質の調節効果は、露出オープナーの筋肉の上に入浴メディアにこれらの分子を添加し、実験を繰り返すことにより決定することができる。
- ピペットを使用して、準備を介して1〜2ミリリットルを滴下する。
3。美脚ウォーキング甲殻類における染色末梢神経系の構造
- メチレンブルー技術
- 蒸留水の二つの部分に1パートメチレンブルークロリドストック溶液(0.25%)を希釈します。
- 緩衝生理食塩水の5つの部分に、この混合物を追加します。徹底的に関心のある領域を灌漑。
- セクション1のプロトコルに従って足を解剖。プレインキュベート12月13日℃のメチレンブルー溶液中paration
- 染色の進行を追跡するために低強度の照明を使用して解剖顕微鏡で準備ごとに10〜15分を調べます。染色は他では、時間内に完了されるいくつかのケースでは、一晩中かかる場合があります。
- 4 -ジ-2 - ASP法
- 蛍光色素は、バック充填PDニューロンを直接浴から製剤を染色するために使用することができる。しかし蛍光染色を表示する能力を持つ、適切な顕微鏡が必要となります。
- セクション1のプロトコルに従って足を解剖。
- 4 - ジ-2-ASPソリューション10μMの濃度の準備をインキュベートし、15分間冷蔵庫に準備しておきます。準備をカバーするだけの十分な解決策を使用してください。
- すぐに準備を撮影し、水銀灯への暴露の上は避けてください。この蛍光色素は比較的早く消え。
- 塩化コバルト法
- セクション1のプロトコルに係るPD神経を露出し、冷生理食塩水に浸漬保管してください。
- のCoCl 2を保持するためにワセリンをよく作る。どんなのCoCl 2が食塩浴にこぼれた場合は、製剤全体が黒く染色し、準備が廃棄されるべきである。
- 、ポリスチレンシートの小さなカットをスリッププラスチックプラットフォームを作るために、それが離れて浮遊するか( 図7)生理食塩水浴中に浸漬にならないようにそれを固定する。
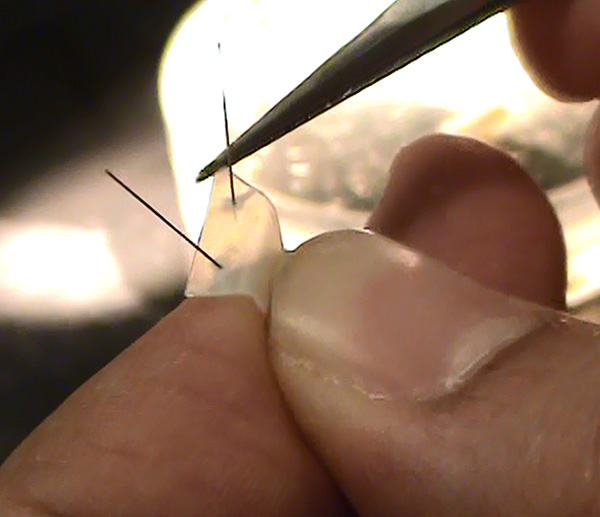
図7。皿に所定の位置に保持するためのピンを有するポリスチレンシート 。 拡大画像を表示するには、ここをクリックしてください 。 - 使い捨て注射器に固定細い皮下注射針からワセリンを取り出し、その後、神経はポリスチレンのスリップの上に、全体のドレープされる中間点で浅い「V」を除いた高さ約1〜1.5ミリメートルでなければならない障壁を(円はうまくいくかもしれません)、作る。
- 「V」に近い障壁のいずれかの側に生理食塩水の小さな水たまりを作る。ストレッチやピンチ神経を、皿から慎重に神経を持ち上げ、ゼリーだけでなく、石油中の生理食塩水溜りに配置しないように注意しながら。
- 神経の部分が露出した神経をカバーするためにワセリンを取り出し、慎重に、乾燥しないように、迅速に作業。今生理食塩水での障壁をテストし、それが漏れていないことを確認してください。
- バリアの内側に生理食塩水を離れてブロットおよび入浴食塩水を2辺は( 図8)互いに分離されていることを確認するためにワセリンの壁の周りに高いときに、それがいっぱいになるかどうかを確認します。

NG>図8。 ワセリンでなく生理食塩水とPD神経がうまくまたがると 。 PDの神経はまだ切断されていません。 拡大画像を表示するには、ここをクリックしてください 。 - ウェルは、組織紙を使用して生理食塩水を吸い取る。紙は神経を包み込むせることは避けてください。
- 蒸留水をいくつかの小さな滴を使用して、新しい水たまりを行い、[神経端をカット。カットの際にバリアを通過神経を引っ張らないよう十分に注意してください。蒸留水意志 "風船"軸索の浸透圧ショック。
- 30秒以内に、水へのCoCl 2の小滴を追加し、このソリューションを吸収した後、神経のこの短縮セクション( 図9)上の水溜りを形成するのに十分のCoCl 2を追加します。調製物は最高の12から24時間、13℃で冷蔵保存されています。
tp_upload/51050/51050fig9.jpg "幅=" 500px "/>
図9。カットのPD神経がのCoCl 2にさらされている 。カット神経は容易になり、神経細胞体に軸索を通って色素分子の動きを加速させ、水の存在下で、最大膨潤する。 拡大画像を表示するには、ここをクリックしてください 。 - 加湿水たまりを削除します。組織を用いたコバルト溶液を離れてブロットおよび生理食塩水を数回交換してコバルトの残骸を洗い流す。
- カニの生理食塩水の約10ミリリットルを含む小さなガラスペトリ皿に単離された調製物を転送します。ニューロンを洗浄し、以下のステップがその場で行われる。良好な金属製のツールは、このステップの後に調製物を(あなたが生理用後で使用されるべきではなく、特定のツールを使用する必要がある)を処理するために使用されるべきではない。
- (硫化アンモニウムの1〜2滴を加え、NH4)生理食塩水に2 S。キャップしっかりと(NH 4)2 S瓶とフードに戻し入れます。解剖顕微鏡下で準備中の反応を観察する
- 1〜2分以内に、コバルトで満たされた神経細胞とそのプロセスが、彼らは黒を染色するため、表示されるように開始する必要があります。
- 5〜10分後、新鮮な生理食塩水で開発ソリューションを交換してください。
- あなたがシンク排水に注ぎました開発ソリューションを数分間、または蓋付きの廃棄ボトルに水道水を実行して続いていることを確認してください。
- 生理食塩水を注ぐと、ブアン液固定液を2回交換しながら約15分間の神経の準備を整えます。 (ステインテンションニューロンへの)オープナーの筋肉のような大規模な組織の場合は、30分までの固定の持続時間を増やします。
- 70%( すなわち、70%、80%、90%、100%)で始まるエタノール濃度の昇順の一連の脱水する。各濃度の約10分のために十分である小さな組織。
- 100%エタノールを2回交換では約10〜15分後、100%のサリチル酸メチルをエタノールに置き換えることによって、組織をオフにします。準備を繰り返し表示するために恒久的にこのソリューションに留まります。周囲の組織が明確になるための時間で満たされた細胞は、より明らかになるだろう。強化法は、時間にわたって25退色防止するために使用することができる。
- のCoCl 2でテンション神経を埋めるために同じプロセスを使用しています。しかし、各エタノール脱水工程でエタノール溶液を複数回変更して、徹底的に筋肉を脱水し、それらをうまくクリアできるように各ステップの約20分間アルコール内側準備をインキュベートする。
結果
PD器官が完全に関節を拡張することにより延伸すると、図10における第1秒間に示すように、PDの神経における活動は、移動中に頑強である。それが開いた位置にまだ保持されている間、いくつかの活性が残っている。この活動は、静止位置感受性ニューロン( 図10に示した記録の後半)からのものである。運動は、移動中の応答を呼び起こす、焼成は弦音鎖( 図11)を延伸する際、主に存在している。
スパイクのさらなる分析が容易に相対的な振幅をソートすることにより近づけることができる。これは運動5の位置や種類のために募集された感覚ニューロンの異なる集団を実証するためのアプローチです。典型的な振幅は0.25〜1.5 mVの範囲が、これらの値は、吸引電極シールの抵抗( すなわち気密性 )に依存している。 T内のスパイクの周波数彼は様々な大きさの範囲はまた、分析のためにグラフィカルに表すことができる。
刺激周波数に対するオープナーの筋肉によって生成された力は、( 図13AおよびB)を互いの上にそれぞれの電圧-時間トレースを重ね合わせて比較することができる。これはまた、それぞれの所与の刺激周波数の各関節位置のために行うことができる。テンション神経の活性を、各刺激周波数で生成された相対力の量と相関しており、各関節位置のためにすることができる。 PDの神経のように、スパイクの振幅の様々なオープナー筋( 図13C)の収縮に応答して見られる。
歩行脚におけるニューロンの解剖学的配置を明確にメチレンブルー染色( 図14)で観察される。内突起に近い弾性弦音ストランドとテンションニューロンに注意してください。直径の異なるいくつかの細胞体D特定の場所では、この図にも表示されます。テンション神経および運動神経ストレッチャーの全過程を図15に示す。 PDの神経の個々のニューロンを、4 -ジ-2-ASP( 図16)とのCoCl 2( 図17)の技術を用いて高コントラストバックフィルで示されている。高倍率での感覚終末は、支持scolopales( 図16B)21,22,26の内側に見ることができる。
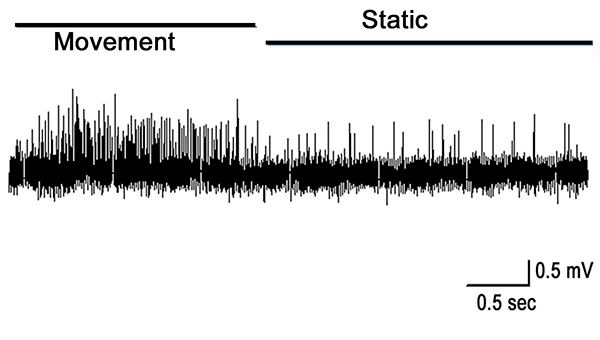
図10は移動し、0℃で保持します 。ダイナミックニューロンは、運動中に焼成時の堅牢で、関節が開いたままにしている間、静的な感受性ニューロンからのスパイクが存在している。 拡大画像を表示するには、ここをクリックしてください</>。
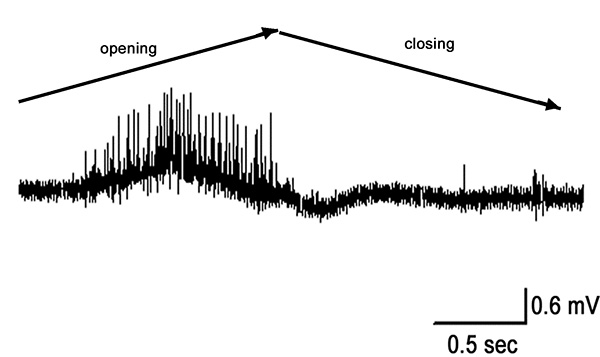
図11。迅速、オープンで完全に伸び(90-0°)の位置に曲げられ終了開始 。 拡大画像を表示するには、ここをクリックしてください 。
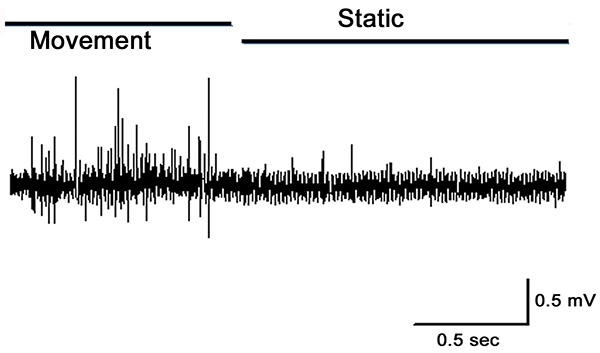
図12。のPDの神経から記録された細胞外スパイク 。関節が完全に伸びてからすぐに½に移動した位置を屈曲してから、まだ開催された。移動中に活動に気づくとき、静的な活動を低下させた。 大きなIMAを見るにはここをクリックしてくださいGE。
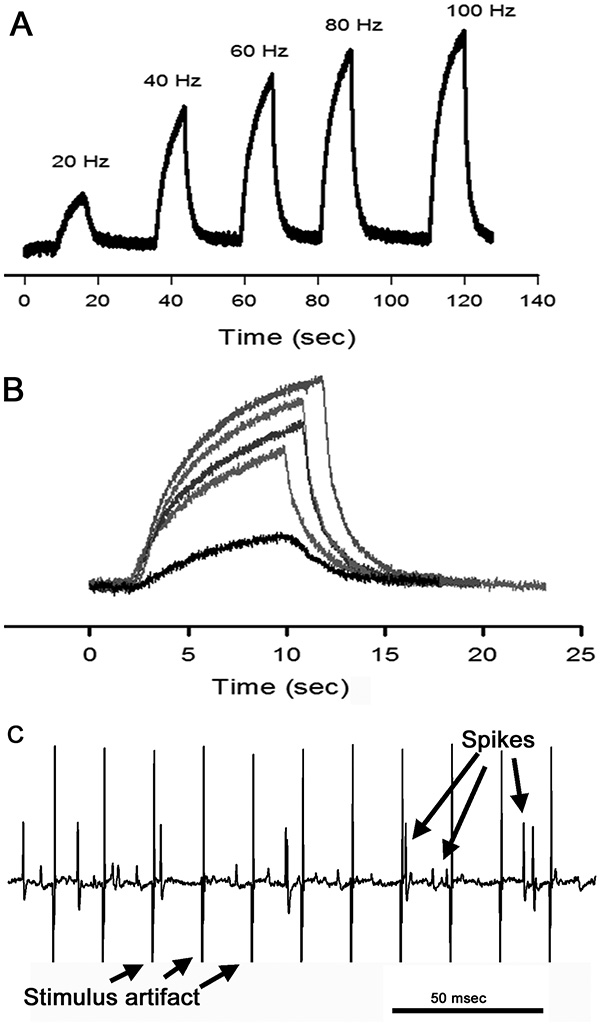
図13。ジョイントを使用して開発された相対的な力は、完全に屈曲し、様々な周波数で刺激した(A)力変換器からの電圧-時間トレースは、各刺激周波数で示されている。 (B)パネルA内のトレースは、比較を容易にするために、異なる色で重ね合わせられる。運動神経は80 Hzで刺激したときの電気的活動(C)電圧-時間トレースは、張力神経から記録した。神経活動と比較して、刺激アーティファクトの規則的なパターンに注意してください。また、神経応答の様々な振幅の点に注意してください。 拡大画像を表示するには、ここをクリックしてください 。
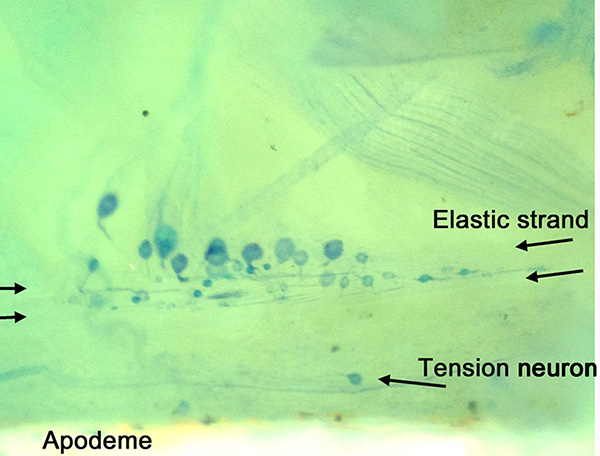
図14。歩行脚の準備のメチレンブルー染色 。個々の細胞体は、弾性ストランドの中に突出彼らの感覚終末で表示されます。テンションニューロンが表示されている内突起があります。 拡大画像を表示するには、ここをクリックしてください 。

図15。テンション神経末端部(赤い矢印)から生じると運動神経(緑の矢印)を結ぶ。 拡大画像を表示するには、ここをクリックしてください 。
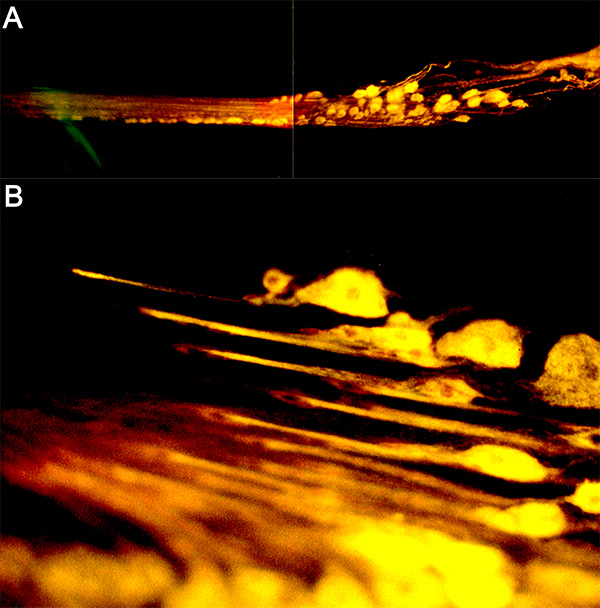
4 -ジ-2-ASPによる癌ネギま内のPD神経の図16(A)バックフィル(B)の感覚終末の高倍率。 拡大画像を表示するには、ここをクリックしてください 。
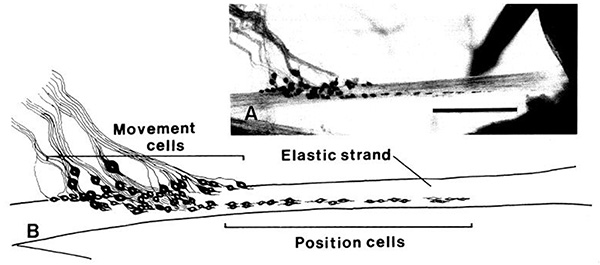
図17。のCoCl 2を充填し、処理したニューロン(A)。示す染色の準備のトレースされた輪郭線(B) 拡大画像を表示するには、ここをクリックしてください 。
| 生理食塩水 | g / Lの |
| NaClを | 27.29 |
| 塩化カリウム | 0.81 |
| 硫酸マグネシウム4•7H 2 O | 4.81 |
| のCaCl 2•2H 2 O | 1.85 |
| のNa 2 SO 4•10H 2 O | 0.97 |
| デキストロース(D-グルコース) | 1.982 |
| HEPES酸 | 0.476 |
| HEPES塩 | 2.08 |
| NaOHまたはHClでpHを8.1に調整し |
表1。カニの生理食塩水のレシピ。
ディスカッション
この一連の実験の目的は、1)特定の感覚系の生理的機能に関連する解剖学的マッピングの重要性を強調するために)識別可能な固有感覚器官の緊張神経と2から細胞外記録の基本原則を教え、示すことである。この実験的なアプローチを利用し、動物モデルは、安価で神経生理学教示実験室で行うことが比較的容易である。
弦音器官のニューロンは2特定の機能タイプ、動きに反応しているものと静的な位置に対応したものである。弦音器官の様々からの単一細胞記録は、関節が検討されているに関係なく、これが事実で3,5であることが示されている。実際、ロブスターの触角の関節に関連した弦音器官が同じ2つの感覚の種類と基本的な解剖学27を明らかにした。そこに二種類のニューロン(運動及びPOSITIであることに加えて)に、神経細胞は、それぞれの弾性ストランドの同じ解剖学的構造を共有しています。鎖上に近位にある大きな細胞体は、ダイナミックな動きに敏感な神経細胞に所属する傾向がある。静的な位置を知らせるニューロンは、小さな細胞体を持ち、遠位に配置されています。これらの細胞は持続的に活躍しています。手根-propodus(CP)と長節-手根(MC)関節の2弦音器官が存在する間は、PDジョイントは、単一の弦音の臓器が含まれています。
電気生理学的記録のためのワタリガニ( クロストリジウム·サピドゥス )に固有受容構造を公開する解剖は、感覚ニューロンから記録しながら、関節の動きが自然な位置で行われることを可能にする戦略が必要です。歩行脚での開幕戦の筋肉のためのテンション神経は、いくつかの神経細胞で構成された非常に細かい神経である。注意を取られていない限り、テンション神経だけでなく、運動神経が刺激される筋肉を支配する、この解剖中に破損することができます。のために最適な記録は、吸引電極が神経のサイズに合わせて調整する必要がある。録音は30-40X倍率解剖顕微鏡およびローエンドのマイクロマニピュレーターを使用して、学生の研究室で容易にアクセスできます。
共同弦音器官を追求するために興味深いものになるだろう将来の実験は、ライフサイクルのさまざまな段階で様々な種での脚再生中の構造や生理的なプロフィールを調べることであろうがんマジ 19,26を使用した初期の研究のフォローアップ。対処すべき残りの質問は、1アール)手足を再生する際、再生さニューロンの分布と組織は2)機能的な再生四肢におけるCNS(腹側神経索)に軸索投射されているか、またはそれをしない、動物の年齢に依存しない手足がautotときに機能的な接続を確立するのにかかった時間との共同使用を取り、3)自切面の近位に切断軸索がどうなるかomized?28
甲殻類は、環境条件およびその周囲の温度に適合するが、それはニューロンは、温度変化に応答してその活性を変化させるように、それらが神経回路内の協調を維持するかは不明である。急激な変化は、30をnot29あり、一方、変化の遅い速度は、動物に順応するためのいくつかの時間を与えることがあります。原因代謝、行動31、あるいは環境への影響へのpHや浸透圧の生理的変化は、固有感覚に関わる神経回路に同様の課題を提示することができる。その機能は、単一細胞レベルで十分に特徴付けられているので、これらの甲殻類の製剤は、この種の問題に対処するための理想的です。
このプロトコルでは、オープナーの筋肉によって生成される力を監視する張力ニューロンの生理学的重要性が実証されている。これらの張力受容体は、染色手順を用いて、内突起内のそれらの位置を追跡することができる。これらのニューロンは、哺乳動物におけるように、様々なレベルでの力を検出する力が増加するにつれて、追加の神経細胞を補充する。受信飽和に達するまで活性の周波数は、運動ニューロンの刺激周波数に関連する。曲げられ指節関節とクイックリリース·プロトコルを使用して、テンション活動は急速に消えますが、その後、完全に拡張された、関節に張りを取り戻す際に返します。これはテンション受容体によって測定された力を説明するための古典的な実験手順である。種々の神経修飾物質は、それが力および神経応答の発生に影響するかを見るために製剤に適用することができる。重要な側面の1つは、神経応答が処理され、中枢神経系および運動ニューロンの活性に及ぼす影響に集積されている方法である。私達が示されている技術には1が神経節とバックにそのまま脚の緊張(感覚)神経運動神経回路機能、 すなわち 、信号の詳細については、対処するために開始できるように筋肉へ。
実証染色手順は、固有受容器官を支配する感覚ニューロンの生理学を理解する鍵である。機能と相馬のサイズに基づいて、ニューロンの解剖学的配置は、カニの足の中の様々な弦音器官で類似している。同様のニューロンの配置は、他の甲殻類や昆虫の種に見出されるかどうかは知られていない。単一細胞からの生理的な録音を組み合わせ、場所をマッピングすることは、直接、構造と機能の関係を可能にします。のCoCl 2染色および固定した解剖学的構造の長期保存には1を繰り返し対策を行い、構造配置を評価することができます。
固有感覚と骨格筋の緊張の受信が骨格筋構成のさまざまな関節動物のための協調行動や、外部および内部環境への対応を可能にする感覚モダリティであるS。 ;ザリガニの腹部の筋肉の受容器官は、別の十分に文書化の準備(Crawdadプロジェクトが表示されhttp://www.crawdad.cornell.edu/腹部半セグメント23ごとに2つのニューロンと固有感覚の教育目的のために) 。感覚神経束への単一ニューロンから記録することができることは、感覚受信の基本原理の理解を助けることが更なる詳細を提供します。これらの比較的単純な甲殻類の製剤は、1が自己受容や他の感覚入力9月12日、32、33の中央統合を可能にする神経回路を決定する可能性のある、固有感覚と緊張の監視の基本的な側面に対処することができます。
開示事項
著者は、彼らが競合する経済的利益を持っていないことを宣言します。
謝辞
著者は、Hyewonクーパーの芸術的な貢献に感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| Sylgard | Dow Corning | 182 silicone kit | |
| NaCl | Sigma-Aldrich | S7653 | |
| KCl | Sigma-Aldrich | P9333 | |
| CaCl2 | Sigma-Aldrich | C5670 | |
| HEPES acid | Sigma | 3375 | Free acid, crystalline |
| HEPES base | Sigma | ||
| D-Glucose | Sigma | G7021 | |
| MgSO4•7H2O | Sigma | M2643 | |
| Na2SO4•10H2O | Sigma | 246980 | |
| Bouin’s solution fixative | Sigma | HT10-1-32 | Caution: Hazardous material (Special shipping cost required) |
| CoCl2 | Sigma | Caution: Hazardous material. Please follow proper disposal according to local and federal regulations. | |
| Methylene blue chloride | Matheson Co., Inc | Basic Blue 9, C.I. 52015 | |
| 4-Di-2-ASP | Molecular Probes | 4-(4-diethylaminostyryl)-N-methylpyridinium iodide | |
| Bleach | Sigma-Aldrich | To chloride silver wire | |
| NaOH | Sigma-Aldrich | 221465 | To adjust pH |
| HCl | Sigma-Aldrich | H1758 | To adjust pH |
| Materials | |||
| Dissecting tools | World Precision Instruments | assortment | |
| Intracellular electrode probe | |||
| Faraday cage | |||
| Insect Pins | Fine Science Tools, Inc | 26001-60 | |
| Dissecting microscope (100X) | |||
| Fiber optic lamp | |||
| Small adjustable mirror | To direct light beam toward the preparation. | ||
| Glass electrodes | Sigma-Aldrich | CLS7095B5X | Box of 200, suction electrodes |
| Micromanipulator | World Precision Instruments | MD4-M3-R | Can fix for base or on a metal rod |
| Raised preparation stand | |||
| Silver wire (10/1,000 inch) | A-M Systems | 782500 | |
| Computer | Any company | ||
| AC/DC differential amplifier | A-M Systems | Model 3000 | |
| PowerLab 26T | AD Instruments | 27T | |
| Force transducer | AD Instruments | 0-50g | MLTF050/ST |
| Head stage | AD Instruments | Comes with AC/DC amplifier | |
| LabChart7 | AD Instruments | ||
| Electrical leads | Any company | ||
| Glass tools | Make yourself | For manipulating nerves | |
| Cable and connectors | Any company | ||
| Pipettes with bulbs | Fisher Scientific | 13-711-7 | Box of 500 |
| Beakers | Any company | ||
| Wax or modeling clay | Any company or local stores | ||
| Stimulator | Grass Instruments | SD9 or S88 | |
| Plastic tip for suction electrode | Local hardware store (Watt’s brand) | ¼ inch OD x 0.170 inch ID | Cut in small pieces. Pull out over a flame and cut back the tip to the correct size |
参考文献
- Whitear, M. Chordotonal organs in Crustacea. Nature. 187, 522-523 (1038).
- Alexandrowicz, J. S. The comparative anatomy of leg propriocetors in some decapod Crustacea. J. Mar. Biol. Assoc. U.K. 52 (3), 605-634 (1972).
- Hartman, H. B., Boettiger, E. G. The functional organization of the propys-dactylus organ in Cancer irroratus Say. Comp. Biochem. Physiol. 22, 651-663 (1967).
- Cooper, R. L., Hartman, H. B. Responses of the bender apodeme tension receptors in the Dungeness crab, Cancer magister. Comp. Biochem. Physiol. A Physiol. 109 (2), 479-486 (1994).
- Cooper, R. L. Mapping proprioceptive neurons on chordotonal organs in the crab, Cancer magister. Crustaceana. 81 (4), 447-475 (2008).
- Burke, W. An organ for proprioception and vibration sense in Carcinus maenas. J. Exp. Biol. 31, 127-138 (1953).
- Hill, A. V. First and Last Experiments in Muscle Mechanics. , Cambridge University Press. Cambridge, U.K. (1970).
- Stuart, D. G., Mosher, C. C., Gerlach, R. L., Reinking, R. M. Mechanical arrangement and transducing properties of Golgi tendon organs. Exp. Brain Res. 14 (3), 274-292 (1972).
- Macmillan, D. L., Dando, M. R. Tension receptors on the apodemes of muscles in the walking legs of the crab, Cancer magister. Mar. Behav. Physiol. 1 (1-4), 185-208 (1972).
- Bévengut, M., Simmers, A. J., Clarac, F. Central neuronal projections and neuromuscular organization of the basal region of the shore crab leg. J. Comp. Neurol. 221 (2), 185-198 (1983).
- El Manira, A., Cattaert, D., Clarac, F. Monosynaptic connections mediate resistance reflex in crayfish (Procambarus clarkii) legs. J. Comp. Physiol. A. 168 (3), 337-349 (1991).
- Le Bon-Jego, M., Cattaert, D. Inhibitory component of the resistance reflex in the locomotor network of the crayfish. J. Neurophysiol. 88 (5), 2575-2588 (2002).
- Ray, D. L., Clarac, F., Cattaert, D. Functional analysis of the sensory motor pathway of resistance reflex in crayfish. I. Multisensory coding and motor neuron monosynaptic responses. J. Neurophysiol. 78 (6), 3133-3143 (1997).
- Wiersma, C. A. G. Vergleichende Untersuchungenüber das periphere Nerve-muskelsystem von Crustaceen (Comparative studies on the peripheral nerve-muscle system of crustaceans). J. Comp. Physiol. 19, 349-385 (1933).
- Wiersma, C. A. G. Movement receptors in decapod crustacea. J. Mar. Biol. Assoc. U.K. 38 (01), 01-143 (1959).
- Hartman, H. B. Tension receptors on the closer muscle apodeme in the walking legs of the blue crab Callinectes sapidus. J. Comp. Physiol. A. 157 (3), 355-362 (1985).
- Holsinger, R. The effect of regional phenotypic differences of Procambarus clarkii opener muscle on sarcomere length, fiber diameter, and force development MSc thesis [dissertation]. , University of Kentucky. (2013).
- Parsons, D. W. The morphology and ultrastructure of tension receptors in the walking legs of the crab, Carcinus maenas. Cell Tissue Res. 211 (1), 139-149 (1980).
- Parsons, D. W. Responses and central interactions of tension receptors in the leg muscle of Carcinus. Comp. Biochem. Physiol. A Physiol. 72 (2), 391-399 (1982).
- Tryba, A. K., Hartman, H. B. Dynamic responses of series force receptors innervating the opener muscle apodeme in the blue crab, Callinectes sapidus. J. Comp. Physiol. A. 180 (3), 215-221 (1997).
- Whitear, M. The fine structure of crustacean proprioceptors. I. The chordotonal organs in the legs of the shore crab, Carcinus meanas. Philos. Trans. R. Soc. Lond. B Biol. Sci. 245 (725), 291-325 (1962).
- Whitear, M. The fine structure of crustacean proprioceptors. II. The thoracico-coxal organs in Carcinus, Pagurus and Astacus. Philos. Trans. R. Soc. Lond. B Biol. Sci. 248 (752), 437-456 (1965).
- Leksrisawat, B., Cooper, A. S., Gilberts, A. B., Cooper, R. L. Muscle Receptor Organs in the Crayfish Abdomen: A Student Laboratory Exercise in Proprioception. J. Vis. Exp. (45), e2323(2010).
- Baierlein, B., Thurow, A. L., Atwood, H. L., Cooper, R. L. Membrane Potentials, Synaptic Responses, Neuronal Circuitry, Neuromodulation and Muscle Histology Using the Crayfish: Student Laboratory Exercises. J. Vis. Exp. (47), e2322(2011).
- Delaney, K., Gelperin, A. Cerebral interneurons controlling fictive feeding in Limaxmaximus; I. Anatomy and criteria for re-identification. J. Comp. Physiol. A. 166, 297-310 (1990).
- Hartman, H. B., Cooper, R. L. Regeneration and molting effects on a proprioceptor organ in the Dungeness crab, Cancer magister. J. Neurobiol. 25 (5), 461-471 (1994).
- Hartman, H. B., Austin, W. D. Proprioceptor organs in the antennae of Decapoda Crustacea. J. Comp. Physiol. 81 (2), 187-202 (1972).
- Cooper, R. L. Development of sensory processes during limb regeneration in adult crayfish. J. Exp. Biol. 201 (Pt 11), 1745-1752 (1998).
- Chung, Y. -S., Cooper, R. M., Graff, J., Cooper, R. L. The acute and chronic effect of low temperature on survival, heart rate and neural function in crayfish (Procambarus clarkii) and prawn (Macrobrachium rosenbergii) species. Open J. Mol. Int. Physiol. 2 (3), 75-86 (2012).
- Blundon, J. A. Effects of temperature and thermal history on neuromuscular properties of two crustacean species. J. Comp. Physiol. B. 158 (6), 689-696 (1989).
- Cooper, R. M., Schapker, H., Adami, H., Cooper, R. L. Heart and ventilatory measures in crayfish during copulation. Open J. Mol. Int. Physiol. 1 (3), 36-42 (2011).
- Bierbower, S. M., Cooper, R. L. The mechanistic action of carbon dioxide on a neural circuit and NMJ communication. Journal of Experimental Zoology. , (2013).
- Bierbower, S. M., Shuranova, Z. P., Viele, K., Cooper, R. L. Sensory systems and environmental change on behavior during social interactions. Brain Behav. 3 (1), 4-13 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved