Method Article
Roedor cerebro microinyección para el Estudio de los sustratos moleculares de Comportamiento Motivado
En este artículo
Resumen
Rodents are an appropriate model to investigate the molecular substrates of behavior and complex psychiatric disorders. Brain microinjection in awake rodents can be used to elucidate disease substrates. An efficient and customizable brain microinjection method as well as the execution of an operant paradigm that quantifies motivation is presented.
Resumen
Brain microinjection can aid elucidation of the molecular substrates of complex behaviors, such as motivation. For this purpose rodents can serve as appropriate models, partly because the response to behaviorally relevant stimuli and the circuitry parsing stimulus-action outcomes is astonishingly similar between humans and rodents. In studying molecular substrates of complex behaviors, the microinjection of reagents that modify, augment, or silence specific systems is an invaluable technique. However, it is crucial that the microinjection site is precisely targeted in order to aid interpretation of the results. We present a method for the manufacture of surgical implements and microinjection needles that enables accurate microinjection and unlimited customizability with minimal cost. Importantly, this technique can be successfully completed in awake rodents if conducted in conjunction with other JoVE articles that covered requisite surgical procedures. Additionally, there are many behavioral paradigms that are well suited for measuring motivation. The progressive ratio is a commonly used method that quantifies the efficacy of a reinforcer to maintain responding despite an (often exponentially) increasing work requirement. This assay is sensitive to reinforcer magnitude and pharmacological manipulations, which allows reinforcing efficacy and/ or motivation to be determined. We also present a straightforward approach to program operant software to accommodate a progressive ratio reinforcement schedule.
Introducción
Rodents and humans respond in remarkably similar ways to behaviorally relevant stimuli1-3. This suggests that rodents are appropriate subjects for elucidating the molecular substrates of behavior and complex psychiatric conditions4. Understanding the molecular substrates of complex behavioral processes, such as motivation, frequently requires brain microinjection. Both the brain microinjection technique and a primary motivation assay will be presented here. Rats will be used as subjects, but these procedures can readily be adapted to well-handled mice. Included herein are procedures for the manufacture of the required cannulae, obturators (dummy cannulae or stylets), and microinjectors. The method presented is significantly more flexible and more cost-efficient than prefabricated implements. This flexibility will prove valuable when optimizing conditions. Importantly, because the microinjection procedure can be used to test a myriad of hypotheses; the techniques presented here should be broadly applicable. For example, receptor ligands can be microinjected to understand neurochemistry3,5,6; cell-permeable peptides and small-molecules can be microinjected to understand intracellular signaling pathways7-10; toxins, ion channel blockers, or antagonist cocktails can be microinjected to understand circuitry1,11,12.
While the generic protocol presented here can be readily adapted by the user for their particular needs, the procedure is particularly well suited for behavioral assays since microinjection occurs in awake rodents that are only under mild hand restraint. No anesthesia or special restraints are required. This is possible because the brain itself lacks pain sensation. However, if anesthesia is not used, microinjection must occur through cannulae that were previously stereotaxically implanted. This is because nociceptors are present on the scalp, meninges,13 which are the membranes surrounding the brain, and the periosteum,14 which is the membrane covering the skull. It should be noted that microinjection under anesthesia is sometimes desirable. One example is when the virus is being injected, and one may wish to inject virus directly through either stainless steal needles15 or glass pipettes because this can reduce tissue damage and improve transduction efficiency.16,17 The microinjectors described below can be modified for this purpose and suggestions on how to do this can be found in the Discussion. Because other JoVE articles have demonstrated stereotaxic brain cannula implantation,18-20 these procedures will not be covered here.
We present these microinjection procedures together with an assay that quantifies motivation. Several rodent models of motivated behavior are currently in use, such as the runway box and barrier scaling. Here, we describe how to use an operant progressive ratio schedule of reinforcement to quantify motivation where operant responding is being maintained by a reinforcer. Responding on the progressive ratio is responsive to reinforcer magnitude.21,22 Accordingly, this assay is routinely used as a proxy for motivation and/or reinforcing efficacy. 21,23-30 Because several excellent reviews have covered this topic in detail,21,24 we will focus mainly on practical concerns.
Protocolo
Procedimientos que involucran sujetos animales han sido aprobados por el Cuidado y Uso de Animales Comité Institucional (IACUC) en la Virginia Commonwealth University y se adhieren a la Guía del NIH para el Cuidado y Uso de Animales de Laboratorio.
1. Preparación de Implementos Antes de la cirugía y la microinyección
- Configuración para la preparación del material:
- Obtener 26 G tubo cánula, 33 G alambre obturador, 33 G tubería de aguja de microinyección, tubería plástica microinyector (PE20 o equivalente), pinzas hemostáticas rectas de dos de peso medio, cinta de laboratorio, regla, marcador permanente, etanol al 70% (v / v), de almacenamiento viales (por ejemplo, de centelleo de vidrio 20 ml), Super Glue, pequeños pesan barcos, y la herramienta rotativa equipadas con un disco de corte deber no pesado.
Nota: Fijación de la herramienta rotativa a una caja de punta de la pipeta usando correas o cintas es útil, ya que eleva la herramienta. El uso de protección para los ojos es importante para evitar lesiones al utilizar una herramienta rotativa. - Coloque una piezade laboratorio o cinta de autoclave para la banca.
- Obtener 26 G tubo cánula, 33 G alambre obturador, 33 G tubería de aguja de microinyección, tubería plástica microinyector (PE20 o equivalente), pinzas hemostáticas rectas de dos de peso medio, cinta de laboratorio, regla, marcador permanente, etanol al 70% (v / v), de almacenamiento viales (por ejemplo, de centelleo de vidrio 20 ml), Super Glue, pequeños pesan barcos, y la herramienta rotativa equipadas con un disco de corte deber no pesado.
- Preparación de cánulas:
Nota: Por lo menos dos cánulas se requieren por rata para una inyección bilateral. Una cánula adicional se utilizará en un paso posterior.- Adquirir una sección del tubo de la cánula de longitud suficiente para evitar la flexión durante el proceso de marcado y de corte.
- Dibuja una línea de referencia 15 mm en la cinta desde el paso 1.1.2 utilizando un bolígrafo de punta fina. Esto servirá como una guía para el marcado de las secciones 15 mm secuenciales en el tubo usando un marcador permanente agudo.
- Toque el tubo de la cánula, en los puntos marcados, al disco giratorio de corte lenta de la herramienta giratoria con el fin de muescas en el tubo. Girar la cánula 180˚ y Notch el lado opuesto de la tubería. No corte a través del tubo por completo, ya que puede conducir a la oclusión.
- Bruscamente doblar el tubo con el fin de dividirlo en secciones ~ 15 mm.
- Mantenga cada extremo cortado de la cánula perpendicular a la línea de cortedisco entre el pulgar y el índice. Girar el tubo de la cánula mientras se toca la punta a la gran superficie delantera del disco de corte (es decir, no el borde). Esto generará una punta embotada. Nota: No doble la cánula, por eso podría producir una inyección fuera de las instalaciones.
- Ream ambos extremos de la cánula con un 26 G aguja biselada (hub marrón) para asegurarse de que todas las rebabas se han eliminado y que la cánula no esté obstruido.
- Pasar una muestra de corte de alambre obturador de ~ 35 mm a través de la cánula de corte para verificar que no hay obstrucciones internas.
- Recoge cada cánula individualmente utilizando pinzas hemostáticas Desblocado y medir cada cánula completado con una regla para asegurarse de que es exactamente 14 mm de longitud.
- Preparación de obturadores:
- Sujete un solo cánula en aproximadamente la mitad de longitud con un peso medio, pinzas hemostáticas rectas. Coloque la pinza hemostática bloqueado en el banquillo. La cánula debe ser perpendicular a la banca.
Nota: Esta cánulano debe ser utilizado en la cirugía después de ser sostenido por pinzas hemostáticas bloqueados, ya que es probable doblada. - Alimentar un extremo del cable del obturador en la cánula hasta que ha llegado a la banca. Rebote el alambre en la cánula para asegurar que una rebaba no está impidiendo que alcance el banco;. Es decir, llegando a la parte inferior de la cánula. Longitud obturador adecuada evitará la obstrucción y la cicatrización del tejido adicional.
- Doble el alambre pellizcando con los dedos hasta que se alcanza un ángulo de ~ 30˚ mientras se mantiene el contacto entre el obturador y el banco. Asegúrese de que el ángulo de la curva es tal que quede a ras de la tapa de la cabeza, y el exceso se enfrenta hacia adelante, haciendo más difícil para la rata de quitar.
- Retire el cable de la cánula y cortar la parte superior a ~ 2,5 mm de la curva con pequeños cortadores diagonales (cortadores de alambre).
Nota: Por lo menos se requieren dos obturadores por rata para una inyección bilateral, ya que cada cánula implantada requiere un obturador. Creaciónuna mitad de camino ~ 35˚ curva adicional a través del obturador también ayudará en la prevención de la eliminación por el animal. Almacenar tanto los cánulas y obturadores en viales separados (por ejemplo., De centelleo de vidrio 20 ml) que contiene 70% de etanol (v / v) hasta su uso, pero al menos O / N.
- Sujete un solo cánula en aproximadamente la mitad de longitud con un peso medio, pinzas hemostáticas rectas. Coloque la pinza hemostática bloqueado en el banquillo. La cánula debe ser perpendicular a la banca.
- Preparación y prueba de microinyectores:
- Obtener un trozo de tubo de aguja microinyector que es ~ 1 m de largo.
- Sostenga un extremo de la tubería microinyector perpendicularmente con pinzas hemostáticas rectas cerradas.
- Girar el hemostato mientras se mantiene la tensión en el tubo para enrollar apretadamente alrededor de la pinza hemostática al menos una vez.
- Mide 32 mm de lo contrario, extremo suelto del tubo microinyector y captar este punto perpendicularmente con un segundo, pinza hemostática de peso medio recto y encerrarlos. Agarre el tubo microinyector con pinzas hemostáticas en el lado de los 32 mm marca más cercana a el extremo suelto en lugar de en el lado más cercano a la pinza hemostática con alambre herida.
- Bend la tubería de ida y vuelta mientras se mantiene la tensión en el tubo hasta que se rompe.
Nota: Una sola curva cerrada, hacia arriba y hacia abajo producirá una ruptura tajante, que es deseable para asegurar que la microinyección se produce en la región del cerebro que desee. - Inspeccione la tubería microinyector para asegurar que ambos extremos son rectas y que el diámetro interior no esté obstruido.
- Adquirir tubo de la cánula que se utilizará para la fabricación de un collar microinyector.
- Mida y marque secuenciales secciones 5 mm de tubo de la cánula con un marcador permanente y una línea de referencia 5 mm dibujado en la cinta (paso 1.1.2).
Nota: Cada microinyector requiere de un collar. Los collares son simplemente cánulas corto adherido al cable microinyector. - Toque tubo cánula, en los puntos marcados, con el disco giratorio de corte lenta de herramienta rotativa con el fin de hacer muescas en el tubo. Girar la cánula 180˚ y Notch el lado opuesto de la tubería. Cortar completamente puede ocluir el tubo.
- Bruscamentecurva tubo de cuello microinyector con el fin de dividirlo en secciones ~ 5 mm.
- Escariar el diámetro interior de ambos extremos del collar con una aguja de 26 G biselado (hub marrón) para asegurar que la mayoría de las rebabas se han eliminado. Algunas pequeñas rebabas se agarra el alambre microinyector y así ayudar en encolado.
- Deslice un collarín en cada tubo microinyector ~ 2 cm del extremo.
- Crear un pequeño charco de pegamento en la esquina de una pequeña pesa barco.
- Utilice tubos de cánula chatarra cortada a ~ 25 mm para aplicar una pequeña cantidad de pegamento al tubo microinyector ~ 5 mm de un extremo. A continuación, deslizar el collar sobre este cordón de pegamento de modo que es ~ 1 mm desde el extremo del tubo de microinyección. Cubra ambos extremos del collar con pegamento.
Nota: Evite una gran acumulación de pegamento en el cuello, ya que evitará que el tubo de plástico de sellado alrededor del microinyector. Si bien es importante para evitar que el pegamento súper en el extremo abierto del tubo microinyector, ya que esto haráel microinyector inutilizable, también es importante para deslizar el collar tan cerca del final como sea posible para minimizar el volumen vacío (no inyectada). - Incline la microinyector completado en el exterior de otro pequeño barco sopesar con la cara cuello y dejar secar durante 24 horas.
- Obtener una ~ 8 cm pedazo de tubo de plástico microinyector (PE20 o equivalente), 1 ml jeringa llena de agua estéril, y 26 G aguja biselada (hub marrón).
- Adjuntar un 26 G (hub marrón) de la aguja a la jeringa y deslice el tubo de corte en la aguja, asegurándose de no perforar el tubo.
- Deslice el tubo de plástico sobre el extremo del collar del secado, microinyector completa.
- Apriete el émbolo de la jeringa llena de agua para la prueba de permeabilidad.
Nota: El agua debe rociar muy lejos y hacia fuera de la punta microinyector. Si la corriente no es recta, la ubicación de inyección no será correcto. La fuente de un spray de lado o difusa es una mala ruptura (paso 1.4.5). Un microinyector debe ningunat ser utilizado si el spray es de lado o difusa. Saline no debe utilizarse, ya que podría obstruir el microinyector o la aguja. - Tire de la jeringa hacia atrás con el fin de eliminar el agua de microinyector. Conservar en un frasco sellado seco; por ejemplo, a 20 ml de centelleo de vidrio del vial.
Nota: microinyectores pueden ser esterilizados en autoclave después de la fabricación con la mayoría de colas súper, 31 pero esto debe ser determinado empíricamente. Técnicas de esterilización alternativos incluyen óxido de etileno y radiación gamma.
2. Preparación y realización del microinyecciones
- Obtener microinyectores completados, tubo de plástico microinyector (PE20 o equivalente), bomba de microinyección, dos pequeños pesan barcos, agua estéril, etanol 70% (v / v), acetona, dos jeringas estanca a los gases 1 l de vidrio con una aguja roma (25 G), punta de algodón aplicadores de madera, obturadores de repuesto, 1 ml jeringa, 26 G (hub marrón) de la aguja, pequeñas pinzas curvas (estilo # 7 se recomienda), y el laboratorio wIPES.
- Preparación microinyectores para inyección:
- Curva completó microinyector 15 mm desde el extremo opuesto al collar de modo que el ángulo entre los dos es ~ 95˚.
Nota: Una localización curva precisa es imprescindible para la localización precisa de la inyección. Usando # 7 pinzas (o similar) para agarrar el microinyector y doblar hacia arriba es útil. Siempre volver a medir la longitud antes de realizar microinyecciones. - Cortar el tubo de plástico (PE20) a ~ 70 cm y se deslizan sobre el cuello microinyector.
Nota: La adición de aletas de cinta a un tubo de plástico cerca tanto el microinyector y cabo suelto es útil al completar inyecciones, sobre todo cuando la inyección de dos soluciones diferentes. Aquí no se recomiendan para los dos tubos a medida que estén incómodos durante la inyección.
- Curva completó microinyector 15 mm desde el extremo opuesto al collar de modo que el ángulo entre los dos es ~ 95˚.
- Preparación de la bomba para microinyecciones:
- Encienda la bomba.
- Establecer diámetro de aguja de microinyección, velocidad de infusión deseado y apuntar volumen de inyección.
Nota: La rata de infusiónE y volumen de inyección depende de las exigencias experimentales. Esto se refirió a la discusión. Algunas bombas tienen mesas de jeringas precargadas. Si no, una mesa de jeringa se puede encontrar en el sitio web (s) de fabricación. - Ajuste el modo de bomba para 'volumen' de modo que un volumen preciso se entrega automáticamente. Si se selecciona el modo 'bomba' en vez, el experimentador debe detener manualmente la bomba.
- Ajuste el tope de la bomba para permitir que la jeringa para llenar el volumen de inyección, más un 0,2 l adicional.
- Preparación de la jeringuilla de microinyección y microinyector para inyección:
- Bloquee cada jeringa microinyección estanca a los gases en el bastidor de la bomba de microinyección.
- Coloque la punta de la jeringa hermética al gas en el agua estéril contenida en una pequeña pesa barco y revolotean suavemente el émbolo para lubricar el cable interno. Uniformemente tire del émbolo para el tope de retención en la bomba para llenar con agua.
- Deslizar el tubo de PE20 que es connected a la microinyector (en el paso 2.2) en una aguja de 26 G (hub marrón) unido a una jeringa de 1 ml que se llena con agua estéril. Rocíe agua estéril a través de la microinyector, e inspeccionar el patrón de rociado y la distancia.
Nota: El agua debe rociar muy lejos y hacia fuera de la punta microinyector. Si la corriente no es recta, la ubicación de inyección no será correcto. - Coloque el microinyector esterilizada en un campo estéril.
- Deslice el tubo fuera de la aguja, manteniendo el tubo microinyector posición vertical para evitar que el agua gotee a cabo al mismo tiempo que el corte de la tubería por debajo de la zona dañada por la aguja.
- Empuje el émbolo de la jeringa microinyección ligeramente hacia adelante para crear una gota en el extremo de la aguja y deslice el tubo PE20 lleno de agua (que está conectado a la microinyector) sobre la aguja.
Nota: Esto creará una conexión de líquido a líquido que permitirá contrapresión apropiada que podría desalojar a una obstrucción que podría formar por lola punta de la microinyector. - Empuje el émbolo completamente hacia delante para prepararse para la muestra de carga y asegurar que ningún etanol queda rastro en el microinyector.
- Compruebe la configuración de fugas al tocar la gota de agua que se ha formado en la punta de microinyector a un laboratorio limpio limpie varias veces.
- Nota: Al tocar al laboratorio limpie, debe formar una sola mancha de humedad. Si hay más gotas, hay una fuga en el sistema.
- Evite fugas mediante el control de la aplicación de pegamento super (Paso 01/04/14) y por el recorte de la tubería PE20 con tijeras afiladas o una hoja de afeitar en cualquier momento que el tubo PE20 se elimina de cualquier conexión. Además, repita los pasos 2.4.3 a través de 2.4.8 para remediar la fuga.
- Tire la jeringa émbolo 0,2 l; creando una burbuja entre el agua estéril en el tubo de PE20 / microinyector y la solución a inyectar.
- Nota: Esta burbuja evita la dilución de la sustancia inyectada, la contaminación del agua, y permitepara el seguimiento del proceso de inyección, ya que se moverá durante la inyección. Un único, burbuja sólida debe ser producido. Si se rompe, una fuga o la punta microinyector es ocluido; lo que indica que el paso 2.4.8 (y la nota adjunta) debe repetirse.
- Coloque el microinyector en el reactivo a inyectar y tire lentamente el émbolo de la jeringa con el tope trasero.
- Preparación de los animales para la inyección:
- Sostenga el pecho de la rata en el pecho del experimentador. Limpie el área alrededor de las cánulas con un aplicador de algodón empapado en etanol al 70% (v / v).
- Nota: Con el manejo adecuado, los ratones se podrá impedir suavemente en una mano ahuecada. De lo contrario, puede ser necesaria Scruffing.
- Retire obturadores utilizando pequeños fórceps y lugar en sopesar barco con etanol al 70% (v / v).
- Inyecciones Realización:
- Coloque microinyector lleno (paso 2.4.10) en la cánula. Pulse Iniciar en la bomba de microinyección y el movimiento de la burbuja del monitor.
- Nota: Se may sea necesario aplicar una ligera presión para asegurar que microinyectores no levantan. La burbuja (formado en el paso 2.4.9) debe avanzar de manera uniforme y entrar de lleno en el microinyector.
- Retire los microinyectores de la cánula y reemplazar obturadores, una vez que la inyección es completa y el período de difusión después de la inyección ha pasado.
- Nota: Los tiempos de difusión después de la inyección típicos son 2-4 min para reactivos farmacológicos y 2-10 min en busca de virus. Dejando el microinyector durante el período posterior a la infusión impide el inyectado de reflujo copia de seguridad de las cánulas en lugar de difusión en el tejido. Coloque los obturadores en el lado de la embarcación etanol llenas pesan para permitir que el etanol se drene antes de reinsertar en la cánula.
3. Post-Inyección de Limpieza
- Obtener un pequeño vial de cada uno: agua estéril, 70% de EtOH, y acetona.
- Limpieza microinyector y microinyección jeringa:
- Retire la jeringa de vidrios de bastidor de la jeringa de la bomba y la tubería de microinyección de jeringa de vidrio.
- Tubo microinyector Desconectar de la jeringa de vidrio y adjuntar una jeringa de 1 ml lleno de agua estéril al tubo microinyector a través de una aguja de 26 G (hub marrón). Empuje el émbolo de la jeringa de 1 ml con interés expulsar a ~ 0,3 ml. A continuación, toque la punta del microinyector a un laboratorio-limpie y saque del aire a través de la microinyector.
Nota: El microinyector y tubos pueden ser re-utilizados para experimentos similares si lo considera prudente. - Coloque la aguja de la jeringa de vidrio en agua estéril y extraer el émbolo completamente hacia atrás. A continuación, empuje el émbolo completamente hacia adelante para enjuagar. Toque la punta de la jeringa de vidrio de un laboratorio de limpiar para asegurar que ningún líquido permanece.
- Repita el paso 3.2.3 con agua estéril, aire, 70% de EtOH, y acetona en el siguiente orden: agua estéril, agua estéril, aire, aire, 70% de EtOH, 70% de EtOH, aire, aire, acetona, acetona, aire, aire. Realización de todos estos pasos de limpieza ayudará a preservar la jeringa microinyección.
- Coloque la jeringa (s) microinyector en el embalaje y tire del émbolo de nuevo a 0,05 l.
Nota: Esto es importante, ya que permite que el émbolo para ser empujado o tirado con el fin de desalojar a un émbolo pegado que pueda ocurrir debe formar los depósitos de sal después del almacenamiento.
4. Programación de Ensayo Motivación
- Inicie sesión en Estado gráfica con credenciales de administrador.
- Seleccione o cree la base de datos correspondiente.
- Creación de programa de razón el fortalecimiento progresivo:
- Seleccione Listas> Listas de nivel de base de datos> Evento Listas Transición parámetro.
- Seleccione "Añadir". Ingrese número apropiado lista (L #) y la descripción.
- Seleccione "Añadir eventos '.
- Introduzca el primer valor programa de reforzamiento y seleccione "Agregar". Repetir.
Nota: Los valores pueden determinarse mediante el uso de una fórmula en la que el programa de razón progresiva = 5e (j * (reforzador obtuvo + 1)) -5 7.Con el fin de adaptar esta ecuación para probar la hipótesis correctamente, el valor de j debe ser determinada u obtenida a partir de la literatura empíricamente. - Seleccione 'En orden "dentro de la caja de la" Orden de Selección'.
- Seleccione 'Hold Valor = a: ____' dentro de la caja "Cuando Terminado '. Introduzca el valor de programa de reforzamiento en el cuadro de texto que supera con creces lo esperado de responder. Este será el esfuerzo que se requiere para todas las entradas posteriores una vez que la lista se ha agotado.
- Creación de un protocolo experimental:
Nota: Estado Gráfico mueve el tema a través de una serie de estados que son salido basa en el tiempo o los criterios de rendimiento. Establezca todas las señales y parámetros discretos y contextuales marcadas a continuación como "$" para probar adecuadamente la hipótesis que se examina.- Seleccione Archivo> Crear Protocolo Experimental.
- Introduzca el número de protocolo deseado y la descripción en la caja de texto apropiado.
- Seleccionar 'Creación Estado ».
- Establezca todos los estímulos, tanto para el 'RDY - Estado Ready' y 'FIN - Estado Terminado'.
- Seleccione "Nuevo Estado" y el nombre de 'S2 - PR respuesta.
- Seleccione "Nuevo Estado" y el nombre de 'S3 -. PR reforzador y Cue'
- Seleccione "Nuevo Estado" y el nombre de 'S4 - Tiempo de espera'.
- Resalte 'S1' y el nombre de 'S1 -. La habituación'
- Seleccione Agregar 'Hora Ir a.'
- Introduzca momento apropiado ($) y las unidades ($), por ejemplo., Minutos y seleccione 'S2' de A S cuadro desplegable. El tiempo de unidad "unidades" se determinó cuando se creó inicialmente la base de datos.
Nota: El tiempo de transición creado debe leer similar a [Después de $ minutos GO P = 100%, a S2] La figura 1 es un ejemplo de este evento, una vez creado.

Figura 1. Programación Representante ejemplo # 1. En este ejemplo se ilustra un estado delimitado tiempo en el que un valor definido por el usuario de $, que se muestra aquí en minutos, indica que el estado actual debe salir al estado 2 (S2).- Resalte 'S2 - PR respuesta.
- Seleccione Add 'Evento Ir a.'
- Ingresa una lista que contiene el programa de razón progresiva que se ha creado en el paso 4.3 en el primer cuadro de texto como L $ (por ejemplo, L1), seleccione la operandum apropiado (por ejemplo., Palanca o empuje nariz) desde el primer cuadro desplegable y seleccione ' S3 "de A S cuadro desplegable.
Nota: El evento creado puede leer similar a [SI L $ 1 - Activo GO P = 100%, A S3]. El identificador 1 - Activo fue designado durante la creación de la base de datos. Aquí, 1 - Activose está refiriendo a la operandum conectado a un interruptor de. - Seleccione 'Agregar Hora Ir a.'
- Marque la casilla del "R", introduzca el tiempo y las unidades apropiadas ($), y seleccione "FIN" de A S cuadro desplegable.
Nota: El evento de tiempo creada puede leer similar a [R (comprobado) SI $ minutos GO P = 100%, A FIN]. Esto asegurará que la sesión se termina si no hay actividad en que operandum después de que el umbral establecido;. Es decir, la sesión será el tiempo de espera después de que el animal retiene responder en el operandum reforzador-emparejado para el período de tiempo establecido. - Seleccione Add 'Evento Ir a.'
- Marque la casilla "R", introduzca 1 en el primer cuadro de texto, seleccione la liberación de operandum apropiada de primera casilla desplegable y seleccione 'S2' de A S cuadro desplegable.
Nota: El evento creado puede leer similar a [R (marcada) Después de $ [1] Activa GO P = 100%, a S2]. Este paso asegura que tras la liberación del operandum(indicado por los soportes anteriores), que el Estado se volvió a entrar, restableciendo así el umbral de tiempo de espera de sesión (4.4.9.4). En este punto, el Estado va a salir cuando la relación progresiva que figura en la lista se completa (paso 4.4.9.2) o los tiempos de espera de la sesión (Paso 4.4.9.4). De este modo, cada vez que el operandum se activa, es puntuable para la relación progresiva. . Y, cada vez que el operandum se inactiva, por ejemplo, la palanca se libera o el empuje de la nariz se sale, el umbral de tiempo de espera de sesión (Paso 4.4.9.4) se restablece la figura 2 representa todas las transiciones programadas para 'S2 - PR respuesta.. '

Figura 2. programación Representante ejemplo # 2. En este caso, el estado se sale a cualquiera de los dos criterios. L $ es el programa de razón progresiva creado en el paso 4.3. A su horario completión, el Estado sale a estado 3 (S3). Tenga en cuenta que este criterio no tiene una R, que permite que el programa para avanzar en lugar de comenzar de nuevo sobre cada reingreso en este estado. El Estado puede también salida después de minutos '$' al estado FIN. Este es el umbral de tiempo de espera predeterminado después de que la sesión se terminará si no hay respuesta se produce dentro de esta ventana. Esto se explica con más detalle en la Discusión. Por último, el umbral de tiempo de espera de la sesión se restablece en cada lanzamiento operandum. Por lo tanto, "[1] 'indica la liberación de la operandum' 1 '.- Resalte 'S3 - PR reforzador y Cue.
- Seleccione 'Agregar Hora Ir a'
- Introduzca el tiempo y las unidades apropiadas para entregar el reforzador ($), y seleccione 'S4' De a cuadro desplegable S.
Nota: El evento de tiempo creada puede leer similar a [Después de $ segundos GO P = 100%, a S4].
- Resalte 'S4 - Tiempo de espera ".
- Seleccione Agregar 'Time Go To'
- Introduzca el tiempo y las unidades apropiadas para permanecer en un estado inactivo ($) después del parto reforzador y seleccione 'S2' de A cuadro desplegable S.
Nota: El evento de tiempo creada puede leer similar a [Después de $ segundos GO P = 100%, a S2]. Estado 'S4 - Tiempo de espera' puede no ser necesaria para todos los diseños.
- Seleccione estados a resolver.
Nota: Este protocolo ya está listo para funcionar.
Resultados
Aquí se ilustran ejemplos de los resultados que se pueden obtener con el procedimiento anterior. Primero que se muestra es una zona típica que se transfectadas por los vectores virales (Figura 3). En general, se obtiene un volumen de ~ 1 transfectadas mm 3 en el tejido estriatal. El volumen de la región transfectadas se puede cuantificar a través de secciones en serie, utilizando el método de Cavalieri 32 Es importante destacar que, el volumen transfectadas depende de muchos factores tales como el tipo de tejido que se está transfectada.; serotipo viral; promotor; velocidad y el volumen inyectado; número de partículas inyectadas; pH inyectado; y si hiperosmolares reactivos, tales como manitol, se utilizaron 33,34. Típicamente, nos microinyectar 10 12 partículas / ml, 1 l / min secundarios sobre 10, y permiten 7 min adicionales antes de reemplazar obturadores. Además, el inyectado es generalmente alrededor de pH 8. A continuación, se muestra que la motivación puede ser manipulado por cualquiera de la expresión del transgen (Figura 4)o microinyección reactivo farmacológico (Figura 5).
En la Figura 4, expresamos un receptor Diseñador Exclusivamente activado por las drogas de diseño (DREADDs). La región codificante del receptor de DREADD fue seguido por un sitio de entrada de ribosoma interno, y una casete mCitrine. El mCitrine permite la visualización conveniente de células transfectadas. El DREADD se acopló a la proteína G heterotrimeric Gαq. La activación de la DREADD acoplado Gαq puede estimular astrocitos, 28,35 y el propio DREADD puede ser activado por la administración sistémica de clozapina-N-óxido (CNO, 3 mg / kg, ip). 14,22,36 Las ratas fueron entrenadas para palanca de responder para el refuerzo de etanol, donde 3 prensas de palanca produjeron 1 oportunidad de beber durante las diarias sesiones de 1 h más de 60 días consecutivos. A continuación, las ratas fueron obligados a la abstinencia, y DREADDs acoplados Gαq se expresaron en el núcleo accumbens astrocitos centrales. Después de 3 semanas de abstinencia, la motivación para la auto-admi etanol Nister se midió por punto de interrupción. 21,27-30 La activación del núcleo accumbens astrocitos fundamentales, a través de la administración sistémica CNO, disminución de la motivación de las ratas para reanudar etanol autoadministración después de la abstinencia en comparación con el vehículo. Es importante destacar que, CNO no tuvo ningún efecto en una cohorte igualmente capacitado que expresaba la proteína fluorescente verde en lugar de la DREADD.
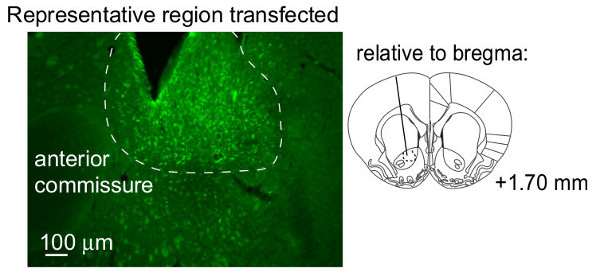
Figura 3. región estriatal ventral Representante transfectadas por el virus de microinyectados. Esta imagen ilustra la región de núcleo accumbens astrocitos que se transfectaron siguiendo el método anterior. Los datos se reimprimieron de Bull et al. 13 con permiso del titular de los derechos de autor. Se pueden encontrar detalles en dicha publicación y el material complementario que acompaña.blank "> Haga clic aquí para ver una versión más grande de esta figura.
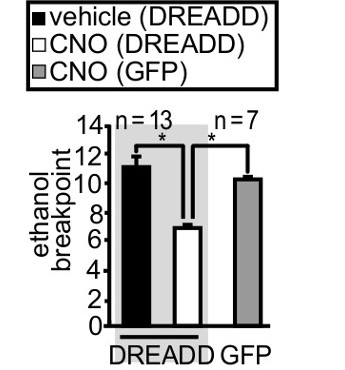
Figura 4. La motivación de las ratas a etanol autoadministrarse se redujo mediante la activación de un transgén que había sobre-expresa en núcleo accumbens astrocitos centrales. Virus se microinyectó y motivación mide a través de punto de interrupción después de permitir una semana para el virus de expresar. El transgén expresó fue un diseñador Receptor Exclusivamente activado por las drogas de diseño (DREADDs). Un ANOVA de una vía (F (2,30) = 3,29, p = 0,04) seguido de un post-hoc de Scheffé revelado que la activación de la DREADD por la administración sistémica de clozapina-N-óxido (CNO, 3 mg / kg, ip ) redujo significativamente la motivación de las ratas a etanol auto-administrarse después de la abstinencia comparación con el vehículo CNO no tuvo ningún efecto en una cohorte igualmente capacitado que expresaba la proteína fluorescente verde (GFP) en lugar del DREADD. Los datos se reimprimieron de Bull et al. 13 con permiso del titular de los derechos de autor. Se pueden encontrar detalles en dicha publicación y el material complementario que acompaña.
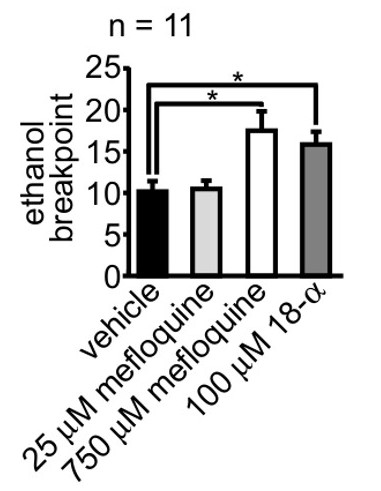
Figura 5. La microinyección de bloqueadores de unión brecha aumentó la motivación de las ratas para autoadministrarse etanol después de la abstinencia Dos bloqueadores brecha cruce fueron evaluados por su efecto sobre la motivación (medido a través de punto de ruptura) de las ratas a autoadministrarse etanol:. Mefloquina y 18- alfa-ácido glicirretínico (18-α). Un ANOVA de dos vías reveló que la microinyección de los bloqueadores de brecha de la salida en el núcleo accumbens de núcleo aumentó la motivación de ratas para autoadministrarse etanol después de la abstinencia (F (3,40) = 5.56, p = 0.003). Los datos se reimprimieron de Bull et al. 13 con permiso del titular de los derechos de autor. Se pueden encontrar detalles en esa publicación yel material complementario que acompaña.
Discusión
El procedimiento que aquí se presenta es un medio eficaz para la fabricación de cánulas microinyección y microinyectores que ayudarán en la aclaración de los sustratos moleculares de la conducta motivada. Este método ofrece varias ventajas. En primer lugar, mediante la fabricación de los propios implantes y microinyectores, nuevos parámetros experimentales se pueden optimizar con rapidez, es decir, uno no necesita esperar a que los componentes a medida que lleguen. En segundo lugar, debido al pequeño diámetro de la cánula, más cánulas pueden ser implantados simultáneamente. Esto acorta el tiempo quirúrgico requerido, lo que puede mejorar la supervivencia, y también permite que múltiples implantes por animal. En tercer lugar, el software utilizado para controlar las cámaras operantes acomoda fácilmente Escala de tasa progresivas desde un paradigma proporción fija se puede convertir rápidamente a un paradigma relación progresiva mediante la simple aplicación de una lista de parámetros de transición caso de que contiene el programa de refuerzo deseado.
Serampliamente útil, un procedimiento de microinyección genérico se presentó que debería ser ampliamente aplicable para la microinyección de casi cualquier reactivo disponible actualmente. En consecuencia, esperamos que esta técnica seguirá siendo de gran utilidad similar en el futuro con pequeñas modificaciones. Por cambiando sólo unas pocas variables, este enfoque se puede aplicar a un amplio número de reactivos. Los parámetros que se pueden manipular más comúnmente incluyen la longitud que el microinyector sobresale de la cánula, el volumen de la inyección, y la velocidad de inyección. Por ejemplo, uno puede desear el inyector sobresalga más lejos de la punta de la cánula para evitar la cicatriz glial que normalmente se forma alrededor de los implantes crónicas. Adicionalmente, se puede desear para inyectar un volumen mayor. Para microinyecciones virus del estriado, un volumen de 1 l se utiliza normalmente y este volumen se inyecta típicamente durante un período de tiempo más largo (con frecuencia 7 - 10 min plus 3 - 10 min tiempo de difusión adicional) en comparación con que el usod para los reactivos farmacológicos (típicamente 0,3 - 0,5 l más de 2 - 3 minutos más 1 - 3 min tiempo de difusión adicional). El usuario debe consultar la literatura y / o empíricamente determinar los parámetros más adecuados para sus necesidades. Independientemente, el éxito de este procedimiento depende críticamente de 4 variables: 1) la longitud de la cánula, 2) longitud microinyector, 3) calidad de patrón de pulverización microinyector, y 4) la integridad del sistema antes de la inyección. Debido a la ubicación microinyección depende de la profundidad que el microinyector sobresale de la cánula, es imperativo que tanto cánulas (Paso 1.2.8) y la longitud microinyector (post-flexión, Paso 2.2.1) son ambos precisamente conocida y uniforme entre todos los sujetos . Esto puede ser fácilmente controlado por fácilmente rechazar cualquier utensilio que no es la longitud requerida en la final de la re-medición. Por otra parte, la ubicación de inyección sólo puede predecirse si se produce inmediatamente por debajo de la cánula guía. Por lo tanto, cualquier microinyector que el DOEs No rocíe un largo arroyo, bien en las pruebas (Pasos 2.4.6) debe ser rechazada. Una inyección de calidad también está relacionada con la integridad del sistema antes de la inyección. Si después de dispensar toda el agua del inyector (antes de llenar con el reactivo) se observan varios puntos en el laboratorio de borrado, entonces una fuga necesita ser remediado (Nota sobre el paso 2.4.8). Además, si la burbuja (Paso 2.4.9) que separa el medicamento del agua en la tubería PE20 es no uno, burbuja única (después de llenar el microinyector con el reactivo), entonces el inyector está parcialmente obstruido. Esta obstrucción puede prevenir o desviar la inyección. Esto también se puede remediar fácilmente (Nota en el paso 2.4.8).
Si uno desea microinyectar mientras el animal está en el marco estereotáxico hay tres alternativas. En primer lugar, se podría aumentar la longitud del collar microinyector tal que puede ser sostenida firmemente por el manipulador estereotáxico y también se extiende lo suficiente para permitir la conexión a un tubo de PE20. En segundo lugar, ene temporalmente podría implantar una cánula y utilizar el microinyector norma que aquí se presenta. En tercer lugar, se podría utilizar dibujado y pipetas de vidrio pulido. 16,17
Una limitación importante del procedimiento que aquí se presenta es que se realiza mejor en ratas bien manejados, que están familiarizados con el procedimiento. Las ratas utilizadas para los datos que se describen en la sección de resultados requieren procedimientos especiales de manipulación debido a que el mismo investigador maneja las ratas sobre una base diaria durante más de 2 meses. Esto incluyó la observación diaria y la manipulación del implante quirúrgico durante al menos 2 semanas. Sin embargo, las ratas se habituaron rápidamente pueden por una serie de técnicas que se utilizan para antes del ensayo de inhibición pre-pulso, que puede verse afectada por el estrés. Estas técnicas especiales de habituación han sido muy bien detallado anteriormente. 43 Además de estos procedimientos, es aconsejable que las ratas se habituaron al procedimiento de microinyección donde se utilizan microinyectores acortados duinyecciones anillo 'farsa'. Durante estas inyecciones simuladas, es fundamental que el microinyector no sobresale en el tejido con el fin de limitar el daño a los tejidos. En otras palabras, el microinyector debe ser de no más de 14 mm se inclinó. Por lo tanto, la habituación a fondo requerida para la aplicación óptima de esta técnica podría ser visto como una limitación.
Si bien existen varios paradigmas de comportamiento para medir la motivación, la relación progresiva se utiliza comúnmente para cuantificar el esfuerzo que el sujeto está dispuesto para ejercer para obtener un reforzador. El paradigma relación progresiva produce una medida conocida como punto de interrupción, que a menudo se define como el número máximo de pulsaciones de palanca en la última relación completado;.. Es decir, máxima respuesta que genera un reforzador 21 La relación progresiva es sensible a reforzador magnitud. Por ejemplo, el aumento de las dosis de cocaína (o sacarosa) producen un mayor punto de interrupción y la cocaína inferior (o sacarosa) dosis producen una breakp menormixto. 21,22 En consecuencia, punto de interrupción es un proxy utilizado habitualmente para la motivación y / o eficacia de refuerzo. 21,23-26 Porque la intención del punto de interrupción es determinar cuando el animal deja de responder, un parámetro importante del paradigma de relación progresiva es duración de la sesión. Duración de la sesión finitos puede poner una tapa falsa en los valores de punto de interrupción y esto puede ser exacerbada por los pre-tratamientos que disminuyen de forma anormal la tasa de auto-administración o que pausa aumento post-refuerzo. Este factor de confusión puede ser superada por cualquier número de enfoques;.. Por ejemplo, las sesiones que terminan cuando el animal ha retenido responder por algún múltiplo del intervalo promedio entre infusión 44 Una variante más comúnmente aplicada de este enfoque es a terminar sesiones vez de responder tiene sido retenida por algún valor determinado empíricamente que se mantiene constante a través de temas. Hemos proporcionado el método para aplicar este enfoque en el Paso 4.4.9.11.
Divulgaciones
None of the authors have competing or conflicting interests.
Agradecimientos
MSB is supported by the Alcohol Beverage Medical Research Foundation, a Center for Translational Research Award (UL1 TR000058), the National Institutes for Alcohol Abuse and Alcoholism (P50 AA022537), and startup funds provided by the Virginia Higher Education Equipment Trust Fund and the VCU School of Medicine.
Materiales
| Name | Company | Catalog Number | Comments |
| Cannula Tubing | Amazon Supply/ Small Parts | HTXX-26T-60 | 26 G, Hypotube S/S 316-TW 26GA |
| Obturator | Amazon Supply/ Small Parts | GWXX-0080-30-05 | 33 gauge, Wire S/S 316LVM 0.008 IN |
| Microinjector Wire | MicroGroup | 33RW 304 | 33 gauge |
| Super Glue | Loctite | 3924AC | Liquid, Non-gel, can be autoclaved |
| Microinjector Plastic Tubing | Becton Dickson | 427406 | PE20 |
| Medium Weight Hemostats | World Precision Instruments | 501241-G | |
| Ruler | Fisher | 09-016 | 150 mm |
| #7 Forceps | Stoelting | 52100-77 | Dumont, Dumostar |
| Rotary Tool | Dremmel | 285 | Two-speeds |
| Cut-off Disc | McMaster Carr | 3602 | 15/16" x 0.025" |
| Microinjection Pump | Harvard Apparatus | PhD 2000 | |
| 1 ul Glass Syringe | Hamilton | 7001KH | Needle Style: 25s/2.75"/3 |
| Cotton Tipped Applicator | Fisher | 23-400-101 | |
| Lab Wipes | Kimwipes | 34133 | |
| Operant Software | Coulbourn | Graphic State | |
| Operant Chambers | Coulborun | Habitest |
Referencias
- Koob, G. F., Volkow, N. D. Neurocircuitry of addiction. Neuropsychopharmacology. 35 (1), 217-238 (2010).
- Kalivas, P. W., Peters, J., Knackstedt, L. Animal models and brain circuits in drug addiction. Mol Interv. 6 (6), 339-344 (2006).
- Bossert, J. M., Marchant, N. J., Calu, D. J., Shaham, Y. The reinstatement model of drug relapse: recent neurobiological findings, emerging research topics, and translational research. Psychopharmacology (Berl). 229 (3), 453-476 (2013).
- Connor, E. C., Chapman, K., Butler, P., Mead, A. N. The predictive validity of the rat self-administration model for abuse liability). Neurosci Biobehav Rev. 35 (3), 912-938 (2011).
- Watson, D. J., et al. Selective blockade of dopamine D3 receptors enhances while D2 receptor antagonism impairs social novelty discrimination and novel object recognition in rats: a key role for the prefrontal cortex. Neuropsychopharmacology. 37 (3), 770-786 (2012).
- Takahashi, A., Shimamoto, A., Boyson, C. O., DeBold, J. F., Miczek, K. A. GABA(B) receptor modulation of serotonin neurons in the dorsal raphe nucleus and escalation of aggression in mice. J Neurosci. 30 (35), 11771-11780 (2010).
- Spencer, R. C., Klein, R. M., Berridge, C. W. Psychostimulants act within the prefrontal cortex to improve cognitive function. Biol Psychiatry. 72 (3), 221-227 (2012).
- Bowers, M. S., et al. Activator of G protein signaling 3: a gatekeeper of cocaine sensitization and drug seeking. Neuron. 42 (2), 269-281 (2004).
- Abudara, V., et al. The connexin43 mimetic peptide Gap19 inhibits hemichannels without altering gap junctional communication in astrocytes. Front Cell Neurosci. 8, 306 (2014).
- Cahill, E., et al. D1R/GluN1 complexes in the striatum integrate dopamine and glutamate signalling to control synaptic plasticity and cocaine-induced responses. Mol Psychiatry. 19 (12), 1295-1304 (2014).
- McFarland, K., Kalivas, P. W. The circuitry mediating cocaine-induced reinstatement of drug-seeking behavior. J Neurosci. 21 (21), 8655-8663 (2001).
- Fuchs, R. A., Branham, R. K., See, R. E. Different neural substrates mediate cocaine seeking after abstinence versus extinction training: a critical role for the dorsolateral caudate-putamen. J Neurosci. 26 (13), 3584-3588 (2006).
- Ebersberger, A. Physiology of meningeal innervation: aspects and consequences of chemosensitivity of meningeal nociceptors. Microsc Res Tech. 53 (2), 138-146 (2001).
- Netter, F. H. . Musculoskeletal System Part I: Anatomy; Physiology, and Metabolic Disorders. 8, (1987).
- Ferguson, S. M., Eskenazi, D., Ishikawa, M., Wanat, M. J., Phillips, P. E., Dong, Y., Roth, B. L., Neumaier, J. F. Transient neuronal inhibition reveals opposing roles of indirect and direct pathways in sensitization. Nat Neurosci. 14 (1), 22-24 (2011).
- Gonzalez-Perez, O., Guerrero-Cazares, H., Quinones-Hinojosa, A. Targeting of deep brain structures with microinjections for delivery of drugs, viral vectors, or cell transplants. J Vis Exp. (46), (2010).
- Inquimbert, P., Moll, M., Kohno, T., Scholz, J. Stereotaxic injection of a viral vector for conditional gene manipulation in the mouse spinal cord. J Vis Exp. (73), (2013).
- Schier, C. J., Mangieri, R. A., Dilly, G. A., Gonzales, R. A. Microdialysis of ethanol during operant ethanol self-administration and ethanol determination by gas chromatography. J Vis Exp. (67), (2012).
- Fornari, R. V., et al. Rodent stereotaxic surgery and animal welfare outcome improvements for behavioral neuroscience. J Vis Exp. (59), e3528 (2012).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable stereotaxic surgery in rodents. J Vis Exp. (20), e880 (2008).
- Richardson, N. R., Roberts, D. C. Progressive ratio schedules in drug self-administration studies in rats: a method to evaluate reinforcing efficacy. J Neurosci Methods. 66 (1), 1-11 (1996).
- Cheeta, S., Brooks, S., Willner, P. Effects of reinforcer sweetness and the D2/D3 antagonist raclopride on progressive ratio operant performance. Behav Pharmacol. 6 (2), 127-132 (1995).
- Roberts, D. C., Morgan, D., Liu, Y. How to make a rat addicted to cocaine. Prog Neuropsychopharmacol Biol Psychiatry. 31 (8), 1614-1624 (2007).
- Arnold, J. M., Roberts, D. C. A critique of fixed and progressive ratio schedules used to examine the neural substrates of drug reinforcement. Pharmacol Biochem Behav. 57, 441-447 (1997).
- Hodos, W. Progressive ratio as a measure of reward strength. Science. 134 (3483), 943-944 (1961).
- Depoortere, R. Y., Li, D. H., Lane, J. D., Emmett-Oglesby, M. W. Parameters of self-administration of cocaine in rats under a progressive-ratio schedule. Pharmacol Biochem Behav. 45 (3), 539-548 (1993).
- Bowers, M. S., et al. Nucleus accumbens AGS3 expression drives ethanol seeking through G betagamma. Proc Natl Acad Sci U S A. 105 (34), 12533-12538 (2008).
- Bull, C., et al. Rat Nucleus Accumbens Core Astrocytes Modulate Reward and the Motivation to Self-Administer Ethanol after Abstinence. Neuropsychopharmacology. 39 (12), 2835-2845 (2014).
- Hopf, F. W., Chang, S. J., Sparta, D. R., Bowers, M. S., Bonci, A. Motivation for alcohol becomes resistant to quinine adulteration after 3 to 4 months of intermittent alcohol self-administration. Alcohol Clin Exp Res. 34 (9), 1565-1573 (2010).
- Hopf, F. W., et al. Reduced nucleus accumbens SK channel activity enhances alcohol seeking during abstinence. Neuron. 65 (5), 682-694 (2010).
- Salerni, C. M. . Engineering Adhesives for Repeated Sterilization. , (2015).
- Gundersen, H. J., Jensen, E. B. The efficiency of systematic sampling in stereology and its prediction. J Microsc. 147 (Pt 3), 229-263 (1987).
- Mastakov, M. Y., Baer, K., Xu, R., Fitzsimons, H., During, M. J. Combined injection of rAAV with mannitol enhances gene expression in the rat brain. Mol Ther. 3 (2), 225-232 (2001).
- Burger, C., Nguyen, F. N., Deng, J., Mandel, R. J. Systemic mannitol-induced hyperosmolality amplifies rAAV2-mediated striatal transduction to a greater extent than local co-infusion. Mol Ther. 11 (2), 327-331 (2005).
- Agulhon, C., et al. Modulation of the autonomic nervous system by acute glial cell Gq-GPCR activation in vivo. J Physiol. 591 (22), 5599-5609 (2013).
- Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., Roth, B. L. Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. PNAS. 104 (12), 5163-5168 (2007).
- Cruikshank, S. J., et al. Potent block of Cx36 and Cx50 gap junction channels by mefloquine. PNAS. 101 (33), 12364-12369 (2004).
- Miguel-Hidalgo, J., Shoyama, Y., Wanzo, V. Infusion of gliotoxins or a gap junction blocker in the prelimbic cortex increases alcohol preference in Wistar rats. J Psychopharmacol. 23 (5), 550-557 (2008).
- Bowers, M. S., Lake, R. W., Rubinchik, S., Dong, J. Y., Kalivas, P. W. Elucidation of Homer 1a function in the nucleus accumbens using adenovirus gene transfer technology. Ann N Y Acad Sci. 1003, 419-421 (2003).
- Mackler, S. A., et al. NAC-1 is a brain POZ/BTB protein that can prevent cocaine-induced sensitization in the rat. J Neurosci. 20 (16), 6210-6217 (2000).
- Geyer, M. A., Swerdlow, N. R. Measurement of startle response, prepulse inhibition, and habituation. Curr Protoc Neurosci. 8, Unit 8.7 (2001).
- Bedford, J. A., Bailey, L. P., Wilson, M. C. Cocaine reinforced progressive ratio performance in the rhesus monkey. Pharmacol Biochem Behav. 9 (5), 631-638 (1978).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados