Method Article
Generación de inmaduras, maduras y tolerogénico células dendríticas con diferentes fenotipos metabólico
En este artículo
Resumen
Immature dendritic cells can be selectively differentiated into tolerogenic or mature dendritic cells to regulate the balance between immunity and tolerance. This work presents a means to generate from immature monocyte derived dendritic cells (moDCs), in vitro tolerogenic and mature moDCs that differ in metabolic phenotypes.
Resumen
resultados de la respuesta inmune de una compleja interacción entre el sistema inmune innato antígeno no específico y el sistema inmune adaptativo antígeno específico. El sistema inmune es un equilibrio constante en el mantenimiento de la tolerancia a la auto-moléculas y reaccionar rápidamente a los patógenos. Las células dendríticas (DC) son potentes células presentadoras de antígenos profesionales que enlazan el sistema inmune innato al sistema inmune adaptativo y equilibrar la respuesta adaptativa entre lo propio y no propio. Dependiendo de las señales de maduración, las células dendríticas inmaduras se pueden estimular selectivamente a diferenciarse en DCs inmunogénicos o tolerogénicas. células dendríticas inmunogénicas proporcionan señales de proliferación de células T específicas de antígeno para la expansión clonal; mientras que las células dendríticas tolerogénicas regulan la tolerancia por la eliminación de células T específica de antígeno o la expansión clonal de las células T reguladoras. Debido a esta propiedad única, las células dendríticas son muy codiciados como agentes terapéuticos para el cáncer y dise autoinmuneASES. Las células dendríticas se pueden cargar con antígenos específicos in vitro y se inyectan en el cuerpo humano para montar una respuesta inmune específica tanto inmunogénica y tolerogénico. Este trabajo presenta un medio para generar in vitro a partir de monocitos, células dendríticas inmaduras derivadas de monocitos (moDCs), tolerogénico y moDCs maduros que difieren en la expresión de marcadores de superficie, la función y fenotipos metabólicos.
Introducción
DC fue descrita por primera vez por Paul Langerhans (células de Langerhans) a finales del siglo XIX, como la que hace referencia Jolles 1 y caracterizado por Ralph Steinman y Cohn Zanvil en 1973 que los reconoce como células presentadoras de antígenos profesionales 2. DCs se encuentran en la sangre periférica y en la mayoría de los tejidos del cuerpo, especialmente abundante en los tejidos que están expuestos al ambiente externo tales como la piel (presente como células de Langerhans) y en las paredes de la nariz, los pulmones, el estómago y los intestinos que permiten que se encuentran con antígenos extrínsecos. Inmaduros países en desarrollo tienen la capacidad endocítica pero relativamente baja capacidad de estimular células T 3. Inmaduros países en desarrollo expresan diferentes receptores de reconocimiento de patrones (RRP) que los patrones de captura asociados a patógenos moleculares (PAMPs) o patrones moleculares asociados a daños (apaga) 4. La activación de las señales de peligro en coche hacia la maduración de las CD inmunogénicas mientras auto-moléculas dan lugar a células T unresponsiveness y la apoptosis 5. DCs inmunogénicas se caracterizan por la regulación positiva de moléculas de MHC y moléculas de superficie coestimuladoras y su capacidad de las células T vírgenes 6,7.
Inmaduros países en desarrollo también puede ser madurado hacia un estado Treg-inducir o tolerogénico en respuesta a la vitamina D3 metabolito 1a, 25 (O) 2 D 3 y ciertos agentes inmunosupresores como la interleucina-10 (IL-10), dexametasona y rapamicina 8-9. DCs tolerogénico se caracterizan por su expresión de los motivos de inhibición basado en tirosina inmunoreceptor (ITIM) que contienen receptores de la superficie y ligandos. La transducción de señales de ITIMs que contienen miembros de la familia ILT, ILT3 y ILT4 en los DC tolerogénicos inhibir alloproliferation y conducir Foxp3 + Treg expansión 10,11. Estas propiedades únicas de los DC tolerogénicos conducen a su profunda potencia in vivo, es decir, la capacidad de inducir tolerancia a los injertos alogénicos durable trasplantados y SupprESS el desarrollo de enfermedades autoinmunes. Tolerogénico DCs se puede ver, por tanto, como un subtipo de DCs maduras polarizada que funcionan de la inhibición de la activación inmune.
Actualmente, hay dos subconjuntos generales de las células dendríticas en la sangre periférica humana: DCs plasmacitoides y CD mieloides 12. DCs circulantes son constituyente rara a menos del 2% de los leucocitos en la sangre humana, y esto supone una dificultad para el aislamiento de un número apropiado de los DC para estudiar sus funciones inmunorreguladoras. Para superar este problema, los monocitos diferenciados DCs se utilizan como un modelo in vitro para el estudio de la función de células dendríticas. Estos países en desarrollo in vitro tienen receptores y funciones similares con respecto a los DC in vivo. Comparación detallada de los DC in vivo, y en los países en desarrollo derivadas de monocitos in vitro (generada moDCs) son investigados por otros laboratorios 13, 14, 15. También se informa de que los moDCs y CD1c + DC fueron equivalentes a presentadora de antígeno y la inducción de la función de las células T 15.
En este trabajo se describe un método para generar moDCs inmaduras a partir de monocitos de sangre periférica y luego diferenciándolos a CD inmunogénicas y tolerogénicas. Estas células dendríticas derivadas de monocitos (moDCs) se caracterizan por sus marcadores de superficie, perfil de citocinas, funciones inmunorreguladoras y estados metabólicos. células dendríticas inmunogénicas y tolerogénicas producen diferentes citoquinas que dan lugar a la expansión de cualquiera de las células T alogénicas o células T reguladoras. En este trabajo, el perfil de citoquinas se realiza con los sistemas que utilizan la tecnología de multiplexación. El medio de crecimiento de las células se incuban con perlas codificadas por colores anticuerpo inmovilizado y leer en un analizador compacto. estados metabólicos de los países en desarrollo se analizan utilizando analizadores de flujo extracelulares que miden la tasa de consumo de oxígeno, un indicador de la respiración celular, y la tasa de acidificación extracelular que refleja glicolíticaflujo en células dendríticas. La medición de estas tasas de bioenergética proporciona un medio para realizar un seguimiento de los cambios en el metabolismo celular que son vitales en el desarrollo de células dendríticas y la función.
Protocolo
Esta investigación fue aprobado por la Junta de Revisión Institucional (IRB NUS-10-250).
1. Aislamiento de células mononucleares de sangre periférica (PBMCs)
- Preparación de Reactivo
- Preparar PBS / EDTA: solución salina tamponada con fosfato (PBS) y se complementa con ácido etilendiaminotetraacético 2 mM (EDTA). Esterilizar esta solución por filtración a través de un filtro de 0,2 micras. Nota para almacenar PBS / EDTA a 4 ° C y se calienta a temperatura ambiente antes de usarla.
- Preparar tampón de tinción: solución salina tamponada con fosfato (PBS) con suero suplemento 2% bovino fetal (FBS), 10 mM ácido 4- (2-hidroxietil) -1-piperazinetanosulfónico (HEPES) y 2 mM de ácido etilendiaminotetraacético (EDTA). Esterilizar esta solución por filtración a través de un filtro de 0,2 micras.
- Recoger la sangre del Cono Sangre
Nota: El cono de sangre contiene componentes de glóbulos blancos recogidos después de la placaletpheresis del hospital. Si la sangre se recoge en tubos de heparina o EDTA, diluir la sangre con PBS en proporción 1: 1 y continúe en el paso 1.3; si no se recibe la capa leucocitaria, diluir la capa leucocitaria con PBS en proporción de 1: 2 y continúe en el paso 1.3.- Cortar los dos extremos del cono para permitir que la sangre fluya hacia fuera en un tubo de 50 ml. Tenga en cuenta que el cono por lo general contiene 10 ml de sangre.
- Usar una jeringa de extremos romos que contiene 30 ml de PBS / EDTA para lavar el cono y recoger en un tubo de 50 ml.
- Diluir la sangre aún más con PBS / EDTA a un volumen final de 80 ml.
- Aislamiento de PBMC por centrifugación de densidad 16
- Alícuota de 15 ml de Ficoll cada uno para 4 frescos tubos de 50 ml.
- Utilice a 25 ml pipeta serológica a añadir 20 ml de sangre diluida sobre la capa de Ficoll. Tome en cuenta para mantener el tubo de 50 ml a un ángulo de 45 y tener cuidado de no perturbar la interfase.
- Centrifugar los tubos a 805 xg sin frenos durante 30 min, 20 ° C.
- Eliminar elcapa de plasma y recoger el anillo de PBMCs se extiende justo debajo de la capa de plasma con una pipeta Pasteur. Combinar cuatro tubos de PBMC en dos tubos de 50 ml. Tenga en cuenta para evitar la recogida de la capa transparente por debajo del CMSP.
- Añadir PBS / EDTA a un volumen final de 50 ml por tubo de PBMCs y centrifugar a 548 xg con frenos de 10 min, 20 ° C.
- Aspirar el sobrenadante y pellet se resuspende en cada tubo con 25 ml de tampón de tinción y se combinan en un tubo de 50 ml.
- Centrifugar a 367 xg con frenos de 5 min, 4 ° C.
- Aspirar el sobrenadante y pellet se resuspende con 10 ml de tampón de tinción.
2. Monocitos de enriquecimiento por separación magnética 17
- Determinar número de la célula
- Tomar 20 l de suspensión de células PBMC y se mezcla con 20 l de azul de tripano para contar el número de células vivas utilizando citómetro.
- suspensión de células Centrifugar a 367 xg con frenosdurante 10 min, 4 ° C.
- Aspirar pellet sobrenadante y resuspender completamente de células a una concentración de 10 7 células por 80 l de tampón de tinción.
- Etiquetado magnética
- Añadir 20 l de microperlas CD14 por 10 7 células, mezclar bien e incubar durante 15 minutos a 2 - 8 ° C.
- Lavar las células mediante la adición de 1 ml de tampón de tinción por 10 7 células y centrifugar a 367 xg con frenos de 10 min, 4 ° C.
- Aspirar pellet sobrenadante y resuspender completamente celular en una concentración de 10 7 células por 50 l de tampón de tinción.
- Separación magnética
- Use la columna de tamaño medio para un máximo de 2 x 10 8 células totales.
Nota: Elija una columna y el separador apropiado de acuerdo con el número de células totales y el número de células CD14 + recomendadas en la hoja de datos. - Colocar la columna en el campo magnético ofa separador adecuado y preparar la columna de lavado con 500 l de tampón de tinción.
- suspensión de células de la pipeta en la columna y recoger las células no marcadas que pasan a través de la columna con un tubo de 15 ml.
- Reemplazar un nuevo tubo de 15 ml en la columna y lavar la columna 3 veces con 500 l de tampón de tinción. Asegúrese de que el depósito de la columna está vacía antes de añadir nueva tampón de tinción entre lavados.
- Retirar la columna del separador y colocarlo en un nuevo tubo de 15 ml.
- Pipetear 1 ml de tampón de tinción en la columna. Inmediatamente eliminar las células marcadas magnéticamente empujando firmemente el émbolo (proporcionado en el kit) en la columna.
- Repetir los pasos 2.3.2 a 2.3.6 usando la fracción eluida en una nueva columna para aumentar la pureza de las células CD14 +. Tenga en cuenta que las cuentas serán liberados de las células en cultivo de forma automática durante el paso 3.2.
- Use la columna de tamaño medio para un máximo de 2 x 10 8 células totales.
3. La diferenciación de las células dendríticas a diferentes activación Sstados
- Preparación del Reactivo (endotoxina nivel tiene que ser menos de 0,1 EU / ml en todos los reactivos)
- Preparar medio de cultivo celular: RPMI 1640 suplementado con 10% de suero bovino fetal (FBS), 1% no aminoácidos esenciales (NEAA) y 0,05 mM 2-mercaptoetanol (2ME). Esterilizar esta solución por filtración a través de un filtro de 0,2 micras.
- Preparar citoquinas: reconstituir IL-4 y GM-CSF en agua de calidad de cultivo celular a una concentración de 0,25 mg / ml respectivamente en condiciones asépticas. citoquinas alícuotas en tubos de microcentrífuga de 200 l y almacenar a -80 ° C.
- Preparar la vitamina D3 existencia: reconstitución de la vitamina D3 en agua de calidad de cultivo celular a una concentración de 100 mM en condiciones asépticas. Alícuota de vitamina D3 en 1,5 ml tubos de microcentrífuga y se almacena a -20 ° C.
- Preparar dexametasona existencia: reconstitución de dexametasona en el agua para cultivos celulares de hasta una concentración de 10 mM en condiciones asépticas. Dexamet alícuotahasOne en 1,5 ml tubos de microcentrífuga y se almacena a -20 ° C.
- Preparar LPS: reconstituir lipopolisacáridos (LPS) en agua de calidad de cultivo celular a una concentración de 1 mg / ml en condiciones asépticas. LPS alícuotas de 1,5 ml en tubos de microcentrífuga y almacenar a -20 ° C.
- La generación de diferentes moDCs
- Seed 4 conjuntos de monocitos CD14 + en la concentración de 0,3 a 0,5 x 10 6 / ml de medio de cultivo celular suplementado con 200 ng / ml de GM-CSF y 200 ng / ml de IL-4 en placas de 6 pocillos. Tenga en cuenta que este es el Día 0 y el volumen de medio en cada 6 bien es de 2 ml.
- Se incuban las células en una incubadora de cultivo de tejidos a 37 ° C con 5% de CO 2.
- Eliminar 850 l de medio de cultivo en el día 4 y se centrifuga a 300 xg durante 5 min, 4 ° C. Aspirar el sobrenadante y pellet se resuspende en 1 ml de medio de cultivo celular que contiene 2x de (200 ng / ml de GM-CSF y 200 ng / ml de IL-4). Añadir esta mezcla de células de vueltaa la cultura. Tenga en cuenta que la concentración 2x añadido para GM-CSF e IL-4 se convertirá en 1x cuando se añade el 1 ml de medio nuevo en la cultura.
- Añadir 1 l de vitamina D3 de valores y 1μl de dexametasona de stock por ml de medio a dos de los conjuntos en el Día 5 para generar moDCs tolerogénicas. Tenga en cuenta que la concentración final de la vitamina D3 es 100 nM y dexametasona es 10 nM; Además de GM-CSF e IL-4 no es necesaria en el día 5.
- Añadir 200 ng / ml de GM-CSF y 200 ng / ml de IL-4 para todos los conjuntos en el Día 6.
- Añadir 1 g / ml de LPS a uno de los conjuntos tratados únicamente con GM-CSF e IL-4 en el Día 6 para generar moDCs maduros.
- Añadir 1 g / ml de LPS a un conjunto de los moDCs tolerogénicas en el día 6 para generar LPS tolerogénicas moDCs.
- Cosecha de los diferentes tipos de moDCs en el día 7 por el lavado de placa de cultivo con PBS, EDTA para citometría de flujo u otros estudios. Tenga en cuenta que sólo se cosechan las células no adherentes. Tome en cuenta que el porcentaje de rendimiento de CD14 + Monocytes para moDCs inmaduros, moDCs maduros, moDCs tolerogénicos y DCS LPS-tolerogénicos son aproximadamente 90%, 50%, 60% y 60%, respectivamente, y varía entre los donantes de sangre y mucho FBS.
4. Citometría de Flujo
- Caracterización de superficie celular marcador en moDCs
- Separar las células de placa de cultivo con la pipeta. Lavar las células una vez con PBS / EDTA y volver a suspender las células en una concentración de 5 x 10 5 células por 50 l de tampón de tinción en 1,5 ml tubo de microcentrífuga.
- Incubar 0,5 x 10 6 alícuotas de células con PerCP conjugado HLADR (1: 100), PE conjugado con CD80 (1:50), PE conjugado con CD83 (1:25), PE conjugado con CD86 (1:50), APC- CD11c conjugado (01:50), CD14 conjugado con PE (01:50) y BDCA3 conjugado con PE (01:50) y ILT3 APC-conjugado (1:25) en la oscuridad durante 30 min a 4 ° C. De igual isotipo PerCP conjugado MAb (1:20), conjugado con PE MAb (1:11), APC-conjugado MAb (1:11) servirá como controles negativos.
- Detectar los niveles de expresión de los marcadores de superficie utilizando un citómetro de flujo 18.
- Análisis de las mitocondrias potencial de membrana de moDCs
- Preparar solución madre de 1 mM Red clorometil-X-rosamine (CMXRos) mediante la adición de 94,1 l de sulfóxido de dimetilo (DMSO) por 50 g de liofilizado CMXRos Red.
- Incubar 2 x 10 5 moDCs con 100 nM Red CMXRos en 1 ml de solución salina equilibrada de Hank (HBSS) durante 30 min a 37 ° C en 15 ml tubo.
- Añadir 2 ml de PBS / EDTA a las células y centrifugar a 300 xg durante 5 min, temperatura ambiente. Repetir 2 veces. Aspirar el sobrenadante y resuspender el sedimento celular en 300 l de PBS, EDTA, 2% de FCS para citometría de flujo análisis. Tome en cuenta para utilizar el canal de PE para analizar la señal roja CMXRos.
- Marcador Caracterización de las células T
- Incubar 50 l de 1,2 x 10 6 CFSE marcado allo células T CD4 + (generado a partir depaso 5,6) con PerCP conjugado con CD3 (1: 200), PE / Cy7 conjugado CD4 (1: 400) y CD25 APC / Cy7-conjugado (1: 100) en la oscuridad durante 30 min a 4 ° C. Las células T de la mancha utilizando un kit comercial con Foxp3-Alexa Fluor 647 (1:50) en la oscuridad durante 1 hora a temperatura ambiente.
5. Estudios Alloreaction
- Preparar 5 mM solución madre de éster de carboxifluoresceína succinimidil (CFSE) mediante la adición de 18 l de DMSO a liofilizada CFSE, según el protocolo del fabricante.
- Purificar CD4 + células T de PBMCs
- Determinar el número de células mediante la adopción de 20 l de suspensión de células PBMC y se mezcla con 20 l de azul de tripano para contar el número de células vivas utilizando un citómetro.
- suspensión de células Centrifugar a 367 xg con frenos de 10 min, 4 ° C.
- Aspirar pellet sobrenadante y resuspender completamente celular en una concentración de 5 x 10 7 células por 1 ml de tampón de tinción en una polysty 5 mlrene tubo.
- Añadir T CD4 + humano Cóctel de enriquecimiento celular en células de 50 l / ml. Mezclar bien e incubar a temperatura ambiente (15-25 ° C) durante 10 min.
- partículas magnéticas vórtice durante 30 segundos y añadir partículas magnéticas en células 100 l / ml. Mezclar bien e incubar a temperatura ambiente durante 5 min.
- Añadir tampón de tinción a la suspensión celular a un volumen total de 2,5 ml. Mezclar las células en el tubo pipeteando suavemente arriba y abajo 2 - 3 veces. Colocar el tubo en el imán y se incuba durante 5 min.
- Invertir imán con tubo y decantar la suspensión (que contiene las células T) en un nuevo tubo de poliestireno de 5 ml.
- Determinar el número de células y se incuba 1,2 x 10 6 células CD4 + T-células con CFSE 5 M en 1 ml de PBS durante 20 minutos a 37 ° C, protegido de la luz.
- Añadir cinco veces el volumen de tinción original de medio de cultivo celular (preparado según la etapa 3.1.1) a las células y se incuba durante 5 min.
- CentrifUGE a 300 xg durante 5 min, 4 ° C y pellet se resuspende en medio de cultivo celular a una concentración de 2 x 10 5 por 75 l.
- Añadir 75 l de 2 x 10 5 células T CD4 + marcadas con CFSE a cada cultivo moDC que contiene 75 l de medio de cultivo celular con 0, 2,5 x 10 3, 5 x 10 3, 10 x 10 3, 20 x 10 3 y 40 x 10 3 moDCs en placas de 96 pocillos de fondo en U. Cultura durante 6 días en una incubadora de cultivo de tejidos a 37 ° C con 5% de CO 2.
- Cosecha pipeteando las células T CD4 + en el tubo de 15 ml y centrifugar a 300 xg durante 5 min, 4 ° C. Recoger el sobrenadante para el análisis de citoquinas y sedimento celular se resuspende en 2 ml de PBS / EDTA y se centrifuga a 300 xg durante 5 min a 4 ° C.
6. Análisis de citoquinas 19
- Recoger los sobrenadantes de los estudios alloreaction como se describe en el paso 5.5.
- Preparación del Reactivo de citoquinas Humano / ChemokinAnálisis e Panel Magnético
- Para la preparación de la mezcla de botella de perlas de anticuerpo inmovilizado para viales individuales de cuentas (incluido en el kit), de vórtice durante 1 min. Añadir 60 l de cada vial de cuentas de anticuerpos a la botella de mezcla (incluido en el kit) y llevar a un volumen final de 3 ml con diluyente de la gota (siempre).
- Para la preparación de los controles de calidad, reconstituyen de Control de Calidad y Control de Calidad 1 2 (incluido en el kit) con 250 ml de agua desionizada.
- Para la preparación de tampón de lavado, diluir 30 ml de 10x tampón de lavado (incluido en el kit) con 270 ml de agua desionizada.
- Para la preparación de citoquina humana Estándar, reconstituir el estándar citoquina humana (incluido en el kit) con 250 l de agua desionizada para dar una concentración de 10.000 pg / ml.
- Añadir 50 l de estándar citoquina humana 10.000 pg / ml a 200 l de tampón de ensayo (incluido en el kit) en un tubo de 1.5 ml para hacer 2.000 pg patrón de trabajo / ml. Transferencia de 50 l de 2000 pg estándar citoquina humana / ml a 200 l de tampón de ensayo (proporcionado en el kit) en un tubo de microcentrífuga de 1,5 ml para hacer 400 estándar de trabajo pg / ml.
- Transferencia de 50 l de 400 pg estándar citoquina humana / ml a 200 l de tampón de ensayo (proporcionado en el kit) en un tubo de microcentrífuga de 1,5 ml para hacer estándar 80 pg / ml de trabajo. Transferencia de 50 l de 80 pg estándar citoquina humana / ml a 200 l de tampón de ensayo (proporcionado en el kit) en un tubo de microcentrífuga de 1,5 ml para hacer estándar 16 pg / ml de trabajo.
- Transferencia de 50 l de 16 pg estándar citoquina humana ml / 200 l de tampón de ensayo (proporcionado en el kit) en un tubo de microcentrífuga de 1,5 ml para hacer estándar 3,2 pg / ml de trabajo. estándar de 0 pg / ml de trabajo sólo tiene 200 l de tampón de ensayo en un tubo de microcentrífuga de 1,5 ml.
- Pre placa húmeda de filtro (incluido en el kit) pipeteando 200 l de tampón de ensayo (suministrado) en cada pocillo de filtroplato. Sellar y colocar la placa de filtro en un agitador de placas durante 10 minutos a temperatura ambiente.
- Aspirar Tampón de Ensayo y añadir 25 l de cada estándar o control de calidad en los pocillos correspondientes.
- Añadir 25 l de medio de cultivo celular (preparado según la etapa 3.1.1) para el fondo, las normas y los pocillos de control.
- Añadir 25 l de tampón de ensayo a los pocillos de muestra y añadir 25 l de muestra en los pocillos de muestra apropiadas.
- Vortex la botella de mezcla que contiene perlas de anticuerpo inmovilizado y añadir 25 l de las perlas mezcladas a cada pocillo. Sellar la placa e incubar con agitación en un agitador de placas durante la noche a 4 ° C.
- Aspirado de líquido y gel de placa 2 veces mediante la adición de 200 l / pocillo de tampón de lavado y aspirar el líquido.
- Añadir 25 l de anticuerpos de detección (incluidos) en cada pocillo. Sellar y se incuba con agitación en un agitador de placas durante 1 hora a temperatura ambiente.
- Añadir 25 l de Estreptavidina ficoeritrina (provided) a cada pocillo que contiene los 25 l de anticuerpos de detección. Sellar y se incuba con agitación en un agitador de placas durante 30 minutos a temperatura ambiente.
- Aspirar y placa de fluido de lavado como se describe en el paso 6.8.
- Añadir 150 l / pocillo de fluido de funda a todos los pocillos y perlas de volver a suspender en un agitador de placas durante 5 min.
- Detectar la intensidad de fluorescencia de perlas usando un sistema de 3D 20. Analizar los datos de intensidad de fluorescencia mediana utilizando un método de ajuste de curvas log-logística cinco parámetros para el cálculo de las concentraciones de citocinas / quimiocinas en las muestras 21.
7. En tiempo real el consumo de oxígeno Rate (OCR) y extracelular acidificación Tasa de mediciones (ECAR)
- Preparación del reactivo / Materiales
- Para preparar el medio de OCR: medio de ensayo suplementado con glucosa 25 mM y piruvato de sodio 1 mM (pH 7,35). Esterilizar esta solución por filtración a través de un filtro de 0,2 micras. Tome en cuenta que este medio es prepared sin FBS porque los componentes en FBS son complejas y varían de un lote a lote de las anteras.
- Preparar medio ECAR: Base medio suplementado con 2 mM L-glutamina (pH 7,35). Esterilizar esta solución por filtración a través de un filtro de 0,2 micras. Tome en cuenta que este medio se prepara sin bicarbonato, glucosa, piruvato y FBS. Tenga en cuenta que FBS tiene capacidad de amortiguación e interferirá con la lectura ECAR.
- Preparar compuestos para las mediciones de OCR: Volver a suspender oligomicina con 630 l de medio de OCR para hacer una solución de 100 mM de stock y se diluye con medio de OCR a 16 mM de concentración de trabajo. Resuspender carbonil cianuro de 4- (trifluorometoxi) fenilhidrazona (FCCP) con 720 l de medio de OCR para hacer una solución de 100 mM de valores y diluir con medio de OCR a 4,5 M de concentración de trabajo. Volver a suspender la rotenona / antimicina A con 540 l de medio de OCR para hacer 50 mM solución madre y diluir con medio de OCR a 10 mM de concentración de trabajo.
- Prepararcompuestos para mediciones ECAR: Resuspender glucosa con 3 ml de medio de ECAR para hacer solución madre 100 mM y diluir a 80 mM la concentración de trabajo. Resuspender oligomicina con 720 l de medio de ECAR para hacer 100 mM solución madre y se diluye a 18 mM de concentración de trabajo. Resuspender 2-desoxi-D-glucosa con 1,5 ml de medio de ECAR para hacer mM solución madre de 1.000.
- Pipetear 200 l de calibrador en cada pocillo del cartucho y se almacena a 37 ° C sin CO 2 un día antes de las mediciones.
- Las mediciones en tiempo real de OCR
- MoDCs Cosecha y resuspender cada tipo de moDCs en medio OCR a una concentración de 60 x 10 3 por cada 150 l de medio de OCR.
- Seed 60 x 10 3 células / pocillo en una placa de fondo plano de 96 pocillos de poli-D-lisina y se incuban en una incubadora de CO no 2 durante 1 hora a 37 ° C. Tome en cuenta para utilizar 50 l de 50 ng / ml de poli-D-lisina a recubrir la placa durante 1 hora y lavar conagua esteralizada. Mantenga placa seca durante 2 horas a temperatura ambiente antes de su uso.
- Pipetear 25 l medio OCR en el puerto de inyección de A para todos los pocillos; 25 l medio de OCR que contiene 16 mM de oligomicina en el puerto de inyección B para todos los pozos; 25 l medio de OCR que contiene 4,5 M de (FCCP) en el puerto de inyección C para todos los pozos y 25 l que contenía medio de OCR rotenona 10 mM / antimicina A en el puerto de inyección D para todos los pozos. Tenga en cuenta que la concentración final bien para oligomicina es 2 M, FCCP es de 0,5 micras y rotenona / antimicina A es 1 mM.
- Colocar la placa en el analizador de flujo extracelular y ejecutar un estudio completo de OCR con todos moDCs simultáneamente en cuatro etapas consecutivas: la respiración basal (después de la inyección del medio de conexión A), la inhibición V complejo mitocondrial (después de la inyección de drogas desde el puerto B), la inducción máxima de la respiración (después de la inyección de drogas desde el puerto C) y la inhibición cadena de transporte electrónico (después de la droga desde el orificio D) 22. Tome en cuenta que hay 3 cycles entre inyecciones y 6 minutos de intervalo entre las mediciones.
- Las mediciones ECAR en tiempo real
- MoDCs Cosecha y resuspender cada tipo de moDCs en medio ECAR a una concentración de 60 x 10 3 por 150 l de medio de ECAR.
- Seed 6 x 10 4 células / pocillo en una placa de fondo plano de 96 pocillos de poli-D-lisina y se incuban en una incubadora de CO no 2 durante 1 hora a 37 ° C.
- Pipeta de 25 l medio ECAR en el puerto de inyección A para todos los pozos; 25 l medio ECAR que contiene 10 mM de glucosa en el puerto de inyección B para todos los pozos; 25 l medio ECAR que contiene 18 mM de oligomicina en puerto de inyección C para todos los pocillos y 25 l medio OCR que contiene 1000 mM 2-desoxi-D-glucosa en el puerto de inyección de D para todos los pocillos. Tenga en cuenta que la concentración final bien para la glucosa es 10 mM, oligomicina es de 2 mM y 2-desoxi-D-glucosa es de 100 mM.
- Colocar la placa en el analizador de flujo extracelular y ejecutar unaestudio completo ECAR con todos moDCs simultáneamente en cuatro etapas consecutivas: la respiración basal (después de la inyección del medio de conexión A), la inducción de la glucólisis (después de la inyección de drogas desde el puerto B), la inducción de la glucólisis máxima (después de la inyección de drogas desde el puerto C) y la inhibición de la glucólisis (después de drogas desde el orificio D) 22.
- Analizar las diferencias estadísticas usando ANOVA de una vía con un post-test de comparación múltiple de Tukey.
Resultados
La purificación de monocitos y la diferenciación de las células dendríticas
Los monocitos se purificaron a partir de PBMC por centrifugación de densidad de la sangre periférica (Figura 1A), seguido de CD14 + selección positiva de separación magnética (Figura 1B) y se cultivaron en medio completo en presencia de GM-CSF e IL-4 para obtener células dendríticas inmaduras ( Figura 2A). La adición de vitamina D3 y post dexametasona GM-CSF e IL-4 dio como resultado la diferenciación de moDCs inmaduras en moDCs tolerogénicas (Figura 2B). Se añadió LPS para inducir la maduración de moDCs inmaduros para madurar moDCs (Figura 2C) y moDCs tolerogénicas fueron estimuladas con LPS para verificar la resistencia a la maduración (Figura 2D). Las muestras de sangre utilizadas en este trabajo fueron obtenidos de donantes sanos con previa informadasconsentimiento.
Caracterización moDC
Caracterización de superficie marcador por Citometría de Flujo
El análisis de marcadores de superficie DC demostró que moDCs maduros expresan los más altos niveles de marcadores de maduración HLA-DR, CD83 y CD86 en comparación con moDCs tolerogénicas tratados con LPS, moDCs tolerogénicas y moDCs inmaduras (Figura 3). Estos resultados demostraron que moDCs tolerogénicas eran resistentes a la maduración, en comparación con moDCs inmaduras después de la estimulación LPS. Además, LPS-tratada moDCs tolerogénicas y moDCs tolerogénicas muestra aumento de la expresión de CD14, BDCA3 (CD141) y la transcripción de tipo inmunoglobulina (ILT) 3 en comparación con moDCs inmaduros y maduros. Los moDCs tolerogénicas que generamos aquí es consistente con informes anteriores 23.
Caracterización funcional de moDCs
moDCs inducidas para la maduración se vuelven inmunogénicas y liberan citoquinas que promueven la proliferación de células T CD4 +. Se evaluó la inmunogenicidad de los diferentes subtipos moDC mediante la medición de la proliferación de células T co-cultivadas. MoDCs tolerogénico eran poco inmunogénico en comparación con moDCs maduros, como se muestra por la baja alloproliferation de las células T CD4 + (Figura 4A). MoDCs tolerogénico se caracterizan por su baja IFN-Γ, bajo la IL-12p40, y la producción de citoquinas alta IL-10 en alloreaction co-cultivos con células T CD4 + (Figura 4B). Por otra parte, aloespecıfica aumentando el número de moDCs tolerogénicas en co-cultivos de moDCs maduras inducida por las células T CD4 + aumentaron la frecuencia de alta Foxp3 + células T reguladoras CD25 (Figura 4C).
Análisis de la actividad mitocondrialRojo CMXRos se utiliza para reflejar la actividad mitocondrial para analizar los niveles de potencial de membrana mitocondrial en moDCs. Se han observado moDCs tolerogénico a tener una mayor actividad mitocondrial en comparación con los otros subtipos moDC diferenciadas (Figura 5A). A continuación, la tasa de consumo de oxígeno mitocondrial (OCR) se evalúa para los diferentes subtipos moDC usando un Bioanalyzer. OCR mediciones permiten penetraciones de alta resolución en el perfil metabólico, proporcionando información, incluyendo pero no limitado a la respiración basal, la capacidad respiratoria de recambio, de fugas de protones y la respiración mitocondrial no. La medición de OCR proporciona un medio para evaluar la capacidad de las células para responder al estrés. Las células se metabólicamente perturbadas por la adición de tres compuestos diferentes en sucesión. La primera inyección es Oligomycin (ATP acoplador) que inhibe el complejo V de la cadena de transporte de electrones (ETC), la inhibición de la síntesis de ATP. Este paso distingue el porcentaje de oxígeno consumido para la síntesis de ATP y el porcentaje de oxígeno consumido para superar fuga de protones a través de la membrana mitocondrial interna. La segunda inyección es FCCP (ETC acelerador) que interrumpe la síntesis de ATP mediante el transporte de iones de hidrógeno a través de la membrana mitocondrial en lugar de a través del canal de protones de V. Complex El colapso del potencial de membrana mitocondrial conduce a un rápido consumo de energía y oxígeno, sin la generación de ATP. tratamiento FCCP se puede utilizar para calcular la capacidad respiratoria de recambio de las células. Mantenimiento de la capacidad respiratoria repuesto en condiciones de estrés es fundamental para la supervivencia celular. Esta capacidad se determina por varios factores, incluyendo la disponibilidad de sustrato y la capacidad funcional de las enzimas implicadas en el ETC. La tercera inyección es una combinación de rotenona, un Complex I inhibidor, y antimicina A, un inhibidor de Complejo III. Esta combinación se apaga la respiración mitocondrial y OCR se observa a disminuir como resultado de la alteración de la función mitocondrial (Figura 5C). MoDCs tolerogénico muestran niveles basales de OCR más altas que moDCs maduros (Figura 5D). Además, tolerogénico, LPS-tolerogénico, y moDCs inmaduros mostró un aumento de la capacidad respiratoria repuesto en comparación con moDCs maduros (Figura 5E).
Caracterización metabólica de moDCs
Dado que el ácido láctico y los protones son liberados de las células durante la glucólisis, analizamos la actividad glucolítica de moDCs mediante la realización de un análisis en tiempo real de la tasa de acidificación extracelular (ECAR) (Figura 6B). En presencia de glucosa, la tasa glucolítica de todos moDCs aumentó en comparación con la etapa basal, conmoDCs maduros que presentan una mayor tasa glucolítica que moDCs inmaduros (Figura 6D). Tolerogénico y moDCs inmaduros exhiben mayor glucólisis máxima (inducida por oligomicina en presencia de glucosa) en comparación con moDCs tratados con LPS (Figura 6B). La capacidad glucolítica de moDCs tolerogénicas e inmaduros fue mayor que moDCs maduros (Figura 6E). En contraste con su alta tasa glucolítica, reserva glicolítica fue la más baja en moDCs maduros (Figura 6F).
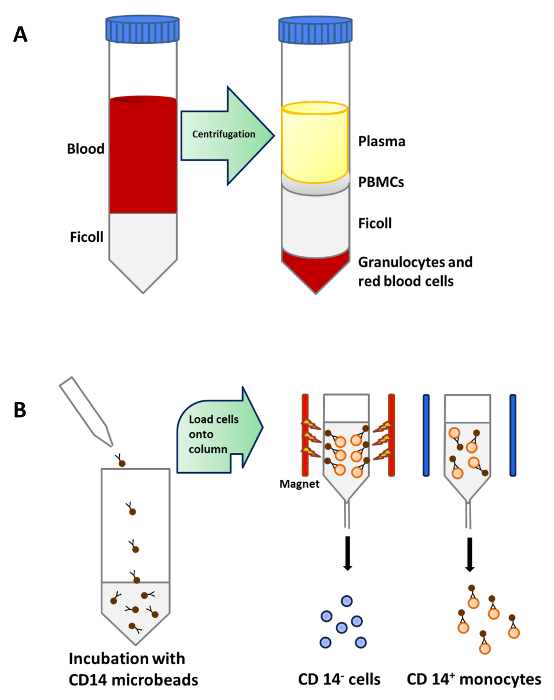
Figura 1:. Purificación de monocitos de sangre periférica (A) 25 ml de sangre es en capas cuidadosamente sobre 15 ml de Ficoll por 50 ml tubo antes de la centrifugación. PBMCs se concentran en una capa debajo de plasma después de la centrifugación de densidad. (B) PBMCs se incubaron con microperlas que son conj ugated a anticuerpos monoclonales CD14 humanos (isotipo: IgG2a de ratón). y luego se cargó en una columna que se coloca en el campo magnético de un separador para aislar los monocitos CD14 + Haga clic aquí para ver una versión más grande de esta figura.
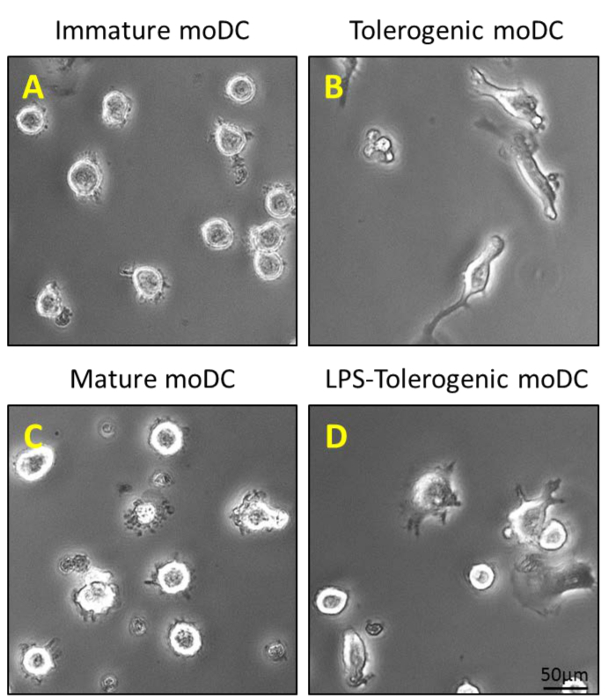
Figura 2: Caracterización morfológica de moDCs. (A) se añaden 200 ng / ml de GM-CSF e IL-4 a + monocitos CD14 purificadas en el Día 0, 4 y 6 para generar moDCs inmaduros; y (B) una etapa adicional de la estimulación con 100 nM de vitamina D3 y 10 nM de dexametasona en el Día 5 genera moDCs tolerogénicas. MoDCs inmaduros y moDCs tolerogénicas son estimuladas con LPS 1 mg / ml en el día 6 de generar (C) y madurar moDCs moDCs (D) LPS-tolerogénicas.TTP: //www.jove.com/files/ftp_upload/54128/54128fig2large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
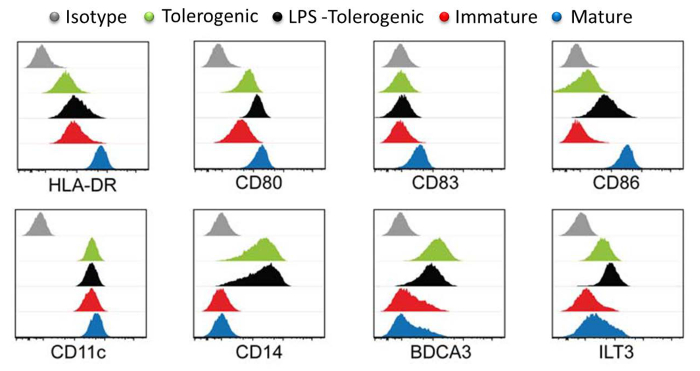
Figura 3:. Superficie marcador Caracterización por citometría de flujo Los niveles de expresión de marcadores de superficie HLA-DR, CD80, CD83, CD86, CD11, CD14, BDCA3 y LT3 en tolerogénico (verde), LPS-tolerogénicas (negro), no maduro (rojo), madura (azul) moDCs. controles de isotipo se muestran en gris. histograma individual para cada tipo de célula se representa con el recuento de células del eje Y frente al log del eje X de la intensidad del fluoróforo y superpuesta. Todos los histogramas son representativos de cuatro experimentos independientes. Esta cifra ha sido modificado a partir de J Immunol 194 (11), 5174 a 5186, doi: 10.4049 / jimmunol.1303316 (1 de junio de 2015). Reproducido y publicado con autorización de derechos de autor. Derechos de autor 2015. La Asociación Americana deLos inmunólogos, Inc. Por favor, haga clic aquí para ver una versión más grande de esta figura.
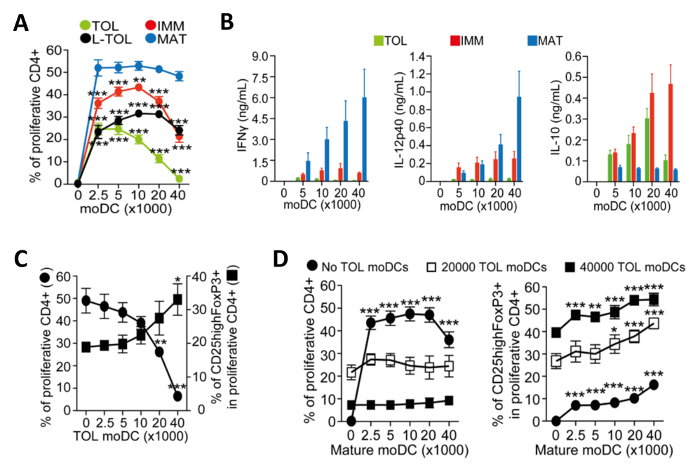
Figura 4: Caracterización funcional de moDCs. (A) La cuantificación de la frecuencia alloproliferation de las células T CD4 + inducidos por la co-cultivo con un número creciente de tolerogénico (TOL; verde), LPS-tolerogénico (L-TOL; negro), inmadura (IMM; rojo) y maduros (MAT ; azul) moDCs. Los datos se agruparon de cuatro experimentos independientes; media + SEM diferencias estadísticas entre todos moDCs frente moDCs maduros fueron analizados por ANOVA de dos vías con Dunnett comparación múltiple post-test. (B) Análisis de citoquinas de IFN-Γ (panel izquierdo), IL-12p40 (panel central) y Il- 10 (panel de la derechal) en los sobrenadantes de alloreactions entre CD4 + T-células co-cultivadas con un número creciente de cualquiera tolerogénico (verde), no maduro (rojo) o azules) moDCs maduros (. Se combinaron los datos de seis experimentos independientes; media ± SEM alloproliferation de células T (C) CD4 + y regulador de expansión de las células T inducida por el co-cultivo con moDCs maduras en presencia de números de moDCs tolerogénicas creciente. Izquierda del eje Y, la frecuencia de la proliferación de células T CD4 +. Derecho del eje Y, la frecuencia de CD25 alta Foxp3 + células cerradas en las células T proliferativa CD4 +. Los datos se agruparon a partir de tres experimentos independientes; media ± SEM diferencias estadísticas entre la presencia o la ausencia de moDCs tolerogénicas fueron analizados por ANOVA de una vía con Dunnett comparación múltiple post-test. (D) alloproliferation de células T CD4 + (izquierda) y la frecuencia de las células CD25highFoxP3 + (Derecha) inducida por la cooperación cultivo con moDCs tolerogénicasen presencia de números de moDCs maduros en aumento. Los datos se agruparon de dos a tres experimentos independientes; media ± SEM diferencias estadísticas entre la presencia o la ausencia de moDCs maduros fueron analizados por ANOVA de dos vías con la comparación múltiple de Dunnett post-test. Esta cifra ha sido modificado a partir de J Immunol 194 (11), 5174 a 5186, doi: 10.4049 / jimmunol.1303316 (1 de junio de 2015). Reproducido y publicado con derechos de autor permiso. Derechos de autor 2015. La Asociación Americana de inmunólogos, Inc. Por favor, haga clic aquí para ver una versión más grande de esta figura.
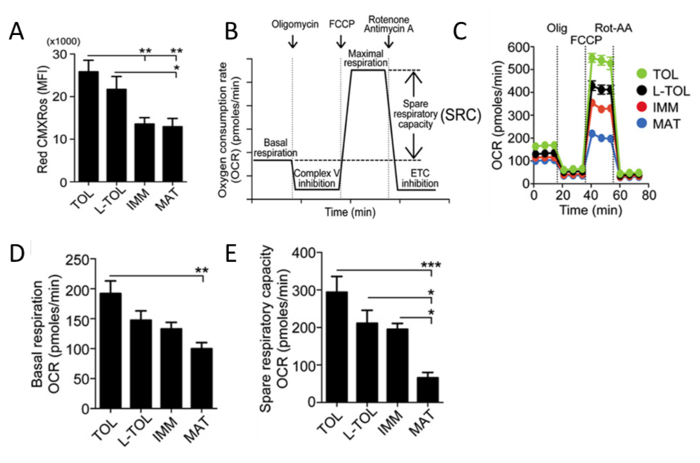
Figura 5: Análisis de la Actividad mitocondrial de moDCs. (A) Los niveles de potencial de membrana mitocondrial (Red CMXRos) en moDCs se obtuvieron por fAnálisis de citometría de baja. Se combinaron los datos de cuatro experimentos independientes. Media ± SEM (B) Representación esquemática de una respiración mitocondrial en tiempo real. análisis OCR a partir de la respiración basal y después de la adición de oligomicina (inhibición V complejo), FCCP (inducción máxima de la respiración), y rotenona / antimicina mezcla (cadena de transporte de electrones inhibición [ETC]). El SRC mitocondrial (basal máxima resta de respiración máxima) se deriva de la curva de OCR. (C) estudio cinético Representante de las mitocondrias OCR (pmol / min) en tolerogénico (TOL, verde), LPS-tolerogénico (L-TOL, negro) , inmadura (IMM, rojo) y maduros (MAT, azul) moDCs mediante la adición secuencial de oligomicina (Olig), FCCP, y la rotenona / antimicina (Rot-AA). (D) OCR cuantificación de respiración basal de moDCs y ( E) las piezas de la capacidad respiratoria de moDCs. Los datos se agruparon a partir de cinco experimentos independientes. Media ± SEM. Esta cifra ha sido modificado a partir de J Immunol 194 (11), 5174-5186, doi: 10.4049 / jimmunol.1303316 (1 de junio de 2015). Reproducido y publicado con derechos de autor permiso. Derechos de autor 2015. La Asociación Americana de inmunólogos, Inc. Por favor, haga clic aquí para ver una versión más grande de esta figura.
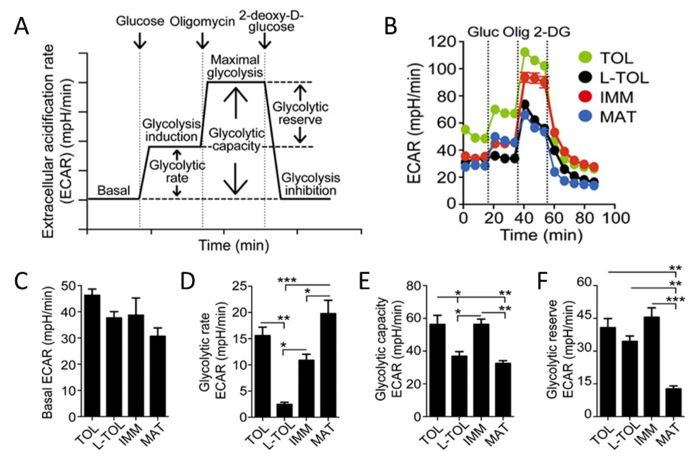
Figura 6: Caracterización metabólica de moDCs. (A) Representación esquemática de la glucólisis en tiempo real. análisis ECAR comienza desde ECAR basal, en el que las células se incubaron en medio libre de glucosa seguido de la adición de glucosa (inducción glucólisis), oligomicina (que induce la glucólisis celular máxima y la inhibición complejo V), y, finalmente, 2-desoxi-D- glucosa(Inhibición glucólisis). Tasa glucolítica (inducción de la glucólisis restarse para ECAR basal), capacidad glucolítica (glucólisis máxima sustraída de ECAR basal), y reserva glucolítica (glucólisis máxima resta para la inducción de la glucólisis) se derivan de la curva de ECAR. (B) estudio cinético Representante de la glucólisis dependiente ECAR (mPH / min) en tolerogénico (TOL, verde), LPS-tolerogénico (L-TOL, negro), inmadura (IMM, rojo), y maduro (MAT, azul) moDCs mediante la adición secuencial de glucosa (gluc), oligomicina (Olig), y 2-DG. Bares (C) muestran niveles basales ECAR (D) tasa glucolítica (e) de capacidad glucolítica, y (f) reserva glucolítica de moDCs. Los datos se agruparon a partir de tres experimentos independientes; significa 6 SEM. Las diferencias estadísticas fueron analizados por ANOVA de una vía con un post-test de comparación múltiple de Tukey. Esta cifra ha sido modificado a partir de J Immunol 194 (11), 5174 a 5186, doi: 10.4049 / jimmunol.1303316 (1 de junio de 2015). Reproducido y publicado con derechos de autor permiso. Derechos de autor 2015. La Asociación Americana de inmunólogos, Inc. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
En este trabajo se describe un método para generar a partir de monocitos inmaduras, moDCs moDCs tolerogénicas y moDCs maduros. Los pasos importantes en este protocolo se discuten en detalle en los siguientes párrafos. Es importante tener en cuenta que la sangre periférica humana se utiliza como material de partida en este protocolo y precauciones universales para el manejo de la sangre humana se debe practicar. Aunque es técnicamente factible para derivar DCs de la médula ósea en los seres humanos 24, la diferenciación in vitro de DC células que se encuentran en la sangre periférica se prefiere debido a la disponibilidad de la sangre periférica en comparación con la médula ósea. Entre las células que se encuentran en la sangre periférica, las células y los monocitos CD34 + madre hematopoyéticas se utilizan comúnmente para la generación in vitro de las DC. CD34 hematopoyéticas + las células madre son cultivadas con GM-CSF y TNF-α para derivar subconjuntos CD1a + y CD14 +, que entonces se diferencian además en Langerhanscomo las células y las células dendríticas. Por el contrario, los monocitos se cultivan en GM-CSF e IL-4 para generar moDCs inmaduros. Varios protocolos se utilizan para el enriquecimiento de los monocitos de sangre periférica; por ejemplo, por adherencia a placas de plástico, elutriación y kits de aislamiento 25, 26 Las ventajas del protocolo de adhesión son el mínimo daño a las células y relativamente rentable sin embargo célula pureza podría verse comprometida.; y un paso adicional se requiere para separar las células para experimentos adicionales. Elutriación es una técnica que separa las células en función de su tamaño y densidad. Las ventajas de elutriación son la viabilidad celular y los monocitos se pueden utilizar fácilmente para experimentos adicionales; sin embargo, esta técnica está limitada por la disponibilidad de un elutriador y la incapacidad para separar las diferentes poblaciones de células (células T y monocitos) con parámetros de sedimentación similares. Comercialmente disponibles kits de aislamiento utilizan microperlas magnéticas para seleccionar ya sea positiva oseleccionar negativamente a la población de monocitos. Algunos protocolos están sesgadas hacia el aislamiento de monocitos mediante la selección negativa, como los monocitos aislados permanecen "sin tocar" (que no esté obligado por marcas o microperlas). En este protocolo, perlas de CD14 se usaron para los monocitos humanos seleccione positivos de PBMCs. CD14 carece de un dominio citoplásmico y unión del anticuerpo a CD14 no desencadena la transducción de señales. Por otra parte, las microperlas se separará de los monocitos después del cultivo y, por tanto, no obstaculiza el proceso de diferenciación. Además, CD14 se expresa fuertemente en la mayoría de los monocitos y débilmente en los neutrófilos y algunas células dendríticas mieloides, por lo tanto, este método de los resultados de aislamiento en una mayor pureza de células que los otros métodos 17.
monocitos de sangre pueden ser diferenciadas en DCs o los macrófagos y el destino de los monocitos depende en gran medida sobre el medio ambiente de citoquinas. En este trabajo, moDCs se generan mediante la adición de factor estimulante de colonias de granulocitos y macrófagos (GM-CSF) Y la interleucina 4 (IL-4) a los monocitos de sangre periférica humana. Se requiere GM-CSF para la supervivencia de monocitos y la IL-4 ejerce una actividad inhibidora sobre la diferenciación de los macrófagos; y la adición combinatoria de GM-SCSF y IL-4 a los monocitos dió un mayor porcentaje de moDCs inmaduras en comparación con citoquinas individuales 27. Hay otros protocolos que generan moDCs mediante la adición de factor de necrosis tumoral alfa (TNF-α), interferón alfa (IFN-α) y la interleucina 13 (IL-13) para monocitos de sangre periférica 28, 29, 30. La combinación de GM-CSF e IL-4 se ha optimizado en la década de 1990 y ahora un protocolo aceptado que genera CD inmaduras de plástico diferenciadas en moDCs inmunogénicos o tolerogénicas y polarizadas en Th1, Th2 o Th17 moDCs promotoras.
moDCs inmaduros se diferencian en moDCs tolerogénicos por la adición de vitamina D3 y dexametasona. Hay varios protocolos para generar los DC tolerogénicos por ejemplo, a través deel factor nuclear kappa B (NF-kB) la inhibición, la activación de β-catenina, vitamina D3, dexametasona y rapamicina 31, 32, 33, 34, 35, 9, 36, 37. Aunque tanto la vitamina D3 y dexametasona sola se han reportado para inducir un efecto tolerogénico en países en desarrollo, la combinación de vitamina D3 y dexametasona resultado en una mayor supresión de la alloproliferation que cuando se utilizan los fármacos individuales. Por lo tanto, el protocolo existente para la generación de DCs tolerogénico se modificó para una combinación de vitamina D3 y dexametasona. Este método está siendo aceptado como un modelo para los países en desarrollo tolerogénicas humanos con una utilidad terapéutica. También es importante tener en cuenta que la vitamina D3 reconstituido y dexametasona tienen una vida útil corta.
En este protocolo, se añadió lipopolisacáridos (LPS) como inductor de la maduración de DC. moDCs inmaduros también pueden ser inducidas a la maduración usando cóctel pro-inflamatoria:(TNF-α), interleucina 1 beta (IL-1β), interleucina 6 (IL-6) y la prostaglandina E2) o citocinas pro-inflamatorias (TNF-alfa y el interferón gamma (IFN-Γ)). Cóctel Pro-inflamatorio genera moDCs maduros con funciones de alto co-estimuladoras y migratorias pero producen niveles relativamente bajos de IL-12 38. TNF-α o IFN-Γ por sí sola no es capaz de inducir un fenotipo dendríticas estable 39. LPS estimula Toll-like receptor 4 (TLR4), media la activación de NF-kB y activadas por mitógenos proteínas quinasas (MAPKs) para inducir la maduración de DC. DC maduración inducida por LPS muestra una sobre regulación de marcadores de maduración DC (CD83, CD86, HLA-DR) y también dio lugar a la producción de IL-12p70. Además, este paso puede ser modificado adicionalmente para emparejar LPS con agonistas de TLR3 para producir CD maduras para vacunas contra el cáncer clínicos. En este papel, los DC tolerogénicos se muestran para ser resistente a la maduración en el tratamiento LPS. Estos semi-maduros, como los países en desarrollo no son inmunogénicas y no lo hacen releaSE citoquinas pro-inflamatorias 40.
Las limitaciones de este protocolo se encuentran en el proceso de diferenciación. El proceso de toma 8 días desde el día 0 al día 7 que plantea una dificultad que ser adaptado en los análisis de alto rendimiento. Una modificación en el protocolo se requiere para acortar el proceso de diferenciación aún producir un gran número de países en desarrollo viables en los diferentes estados. En segundo lugar, los países en desarrollo se generan mediante la adición de citoquinas en este protocolo y estas citoquinas no corroboran la población CC por un largo período de tiempo. Por otra parte, las citoquinas se utilizan en concentraciones mucho más altas que en vivo y podría resultar en el desarrollo parcial de las vías que no son fisiológicamente idénticos a los DC in vivo. Por ejemplo, en cultivos in vitro de precursores de DC se ha demostrado que responder a GM-CSF, que no es una citoquina esencial para la diferenciación normal de DC in vivo 41. Sin embargo, la estimulación de citoquinas puede ser un método útil para genevaluar un gran número de DC in vitro para la experimentación. La posibilidad de someter estas células generadas a partir de este protocolo para otros análisis, tales como la tinción de inmunofluorescencia, citometría de flujo, alo estudios de reacciones metabólicas y estudios aumenta la utilidad de este método. Estos países en desarrollo in vitro sirven como un buen modelo para mejorar el conocimiento del desarrollo de la CC, la maduración y la presentación de antígenos, que es previamente difícil de hacer con los números raros de los DC in vivo.
Capacidad de los países en desarrollo 'para regular la inmunidad inmunológica frente a la tolerancia que los hace candidatos atractivos en la terapéutica contra el cáncer y enfermedades autoinmunes 42, 43, 44, 45. DCs inmunogénicas generados en este protocolo se puede utilizar para mejorar la eficacia de la vacunación contra las enfermedades infecciosas y tumores; mientras que los DC tolerogénicos pueden usarse para controlar las respuestas de células T no deseada y evitar rechazos después del trasplante. el intrincadoequilibrio entre la inmunidad y la tolerancia depende enormemente sobre el estado de diferenciación de DC. DC diferenciación celular es un programa coordinado que se rige por múltiples vías de señalización y destino metabólico. Los diferentes estados de diferenciación de DC difieren en las necesidades bioenergéticos y la biosíntesis; por ejemplo, las DC activadas requieren adaptaciones metabólicas más energéticas importantes para la supervivencia y la migración en comparación con los países en desarrollo en el estado de reposo. Es importante tener en cuenta que la vitamina D3, dexametasona y rapamicina son conocidos por su capacidad para inducir los DC tolerogénicos, se han descrito para influir en el metabolismo de DC. En este trabajo, el metabolismo energético de moDCs de diferentes estados de diferenciación se caracterizaron utilizando analizadores de flujo extracelulares y moDCs tolerogénicas exhibió la más alta maduración inducida por LPS plasticidad metabólica y la disminución de esta plasticidad. Metabolismo anabólico apoya maduración países en desarrollo, mientras que las influencias del metabolismo catabólico tolerogénico DC funciona 46. las CDgenerados a partir de este protocolo se puede utilizar para evaluar si la alteración del estado metabólico de los países en desarrollo son la clave para la modificación de la inmunidad y la tolerancia en la terapéutica. En conclusión, hemos presentado un protocolo para la generación de inmaduros, tolerogénico y moDCs maduros fundamental para el estudio de las funciones inmunorreguladoras PED.
Divulgaciones
Open access fees for this article were provided by, Agilent Technologies.
Agradecimientos
Este trabajo fue apoyado por la Agencia de Ciencia, Tecnología y Financiación Reasearch Core (a JEC).
Materiales
| Name | Company | Catalog Number | Comments |
| Ficoll | GE Healthcare | 17-1440-03 | PBMC isolation |
| Syringe | Becton, Dickinson | 302832 | PBMC isolation |
| 1.5 ml centrifuge tube | Axygen | MCT-150-C | PBMC isolation |
| 15 ml falcon tube | Falcon | 352096 | PBMC isolation |
| 50 ml falcon tube | Falcon | 352070 | PBMC isolation |
| Centrifuge | Eppendorf | 5810R | PBMC isolation |
| 0.2 µm filter | Sartorius stedim biotech | 17597 | PBMC isolation |
| MACs kit | Miltenyi biotec | 130-042-201 | Monocyte enrichment |
| MiniMACS Separator | Miltenyi biotec | 130-042-102 | Monocyte enrichment |
| Cell culture grade water | Invitrogen, Life Technologies | Cell culture | |
| RPMI | Gibco, Life Technologies | 11875-093 | Cell culture |
| FBS | Hyclone | SH30070103 | Cell culture |
| Penicillin-streptomycin | Gibco, Life Technologies | 15140 | Cell culture |
| Phosphate Buffered Saline | Gibco, Life Technologies | 10010-031 | Cell culture |
| NEAA | Gibco, Life Technologies | 11140-040 | Cell culture |
| EDTA | Gibco, Life Technologies | 15575 | Cell culture |
| HEPES | Gibco, Life Technologies | 15630-080 | Cell culture |
| Sodium Pyruvate | Gibco, Life Technologies | 11360-070 | Cell culture |
| GM-CSF | Miltenyi biotec | 130-093-868 | Cell culture |
| IL-4 | Miltenyi biotec | 130-093-924 | Cell culture |
| Vitamin D3 | Sigma | D1530 | Cell culture |
| Dexamethasone | Sigma | D2915 | Cell culture |
| LPS | Sigma | l2755 | Cell culture |
| trypan blue | Gibco, Life Technologies | 15250-061 | Cell culture |
| PerCP-conjugated HLADR | BioLegend | 307628 | Cytometry |
| PE-conjugated CD80 | BD Biosciences | 557227 | Cytometry |
| PE-conjugated CD83 | BD Biosciences | 556855 | Cytometry |
| PE-conjugated CD86 | BD Biosciences | 555665 | Cytometry |
| APC-conjugated CD11c | BD Biosciences | 340544 | Cytometry |
| PE-conjugated CD14 | Miltenyi biotec | 130-091-242 | Cytometry |
| PE-conjugated BDCA3 | Miltenyi biotec | 130-090-514 | Cytometry |
| APC-conjugated ILT3 | eBioscience | 12-5139-73 | Cytometry |
| Isotype matched PerCP- conjugated Mab | BioLegend | 400250 | Cytometry |
| Isotype matched PE- conjugated Mab | Miltenyi biotec | 130-091-835 | Cytometry |
| Isotype matched APC- conjugated Mab | Miltenyi biotec | 130-091-836 | Cytometry |
| BD LSR II Flow Cytometer | BD Pharmingen | BD LSR II | Cytometry |
| cytofix/cytoperm | BD Biosciences | 554714 | Cytometry |
| APC/CY7-conjugated CD25 | BD pharmingen | 557753 | Cytometry |
| PE/CY7-conjugated CD4 | Biolegend | 300512 | Cytometry |
| PerCP-conjugated CD3 | Biolegend | 300428 | Cytometry |
| EasySep Human CD4+ T cell enrichment kit | STEMCELL Technologies | 19052 | Alloreaction study |
| EasySep magnet | STEMCELL Technologies | 18000 | Alloreaction study |
| Cell Trace CFSE cell proliferation kit | Molecular probes | C34554 | Alloreaction study |
| HBSS | Gibco, Life Technologies | 14025092 | Alloreaction study |
| Alexa Fluor 647-conjugated FoxP3 | BD Biosciences | 560889 | |
| Milliplex MAP Human Cytokine/Chemokine magnetic bead panel | Millipore | HCYTOMAG-60K | Cytokine analysis |
| 5 ml Polystyrene tube | Falcon | 352058 | Cytokine analysis |
| Luminex Sheath Fluid | Millipore | SHEATHFLUID | Cytokine analysis |
| FLEXMAP 3D system with xPONENT software | Luminex Corporation | FLEXMAP 3D | Cytokine analysis |
| MitoTracker Red CMXRos | Cell Signalling | 9082 | Mitochondrial activity |
| DMSO | Sigma Aldrich | D2650 | Mitochondrial activity |
| XF Assay Medium (OCR) | Seahorse Bioscience | 102352-000 | Metabolic adaptation |
| Glucose | Sigma Aldrich | G8769 | Metabolic adaptation |
| XF Base Medium (ECAR) | Seahorse Bioscience | 102353-100 | Metabolic adaptation |
| L-glutamine | Gibco, Life Technologies | 25030-081 | Metabolic adaptation |
| Calibrant | Seahorse Bioscience | 100840-000 | Metabolic adaptation |
| XF Cell Mito Stress kit | Seahorse Bioscience | 103015-100 | Metabolic adaptation |
| XF Glycolysis Stress kit | Seahorse Bioscience | 103020-100 | Metabolic adaptation |
| Seahorse | Seahorse Bioscience | XFe96 | Metabolic adaptation |
Referencias
- Jolles, S. Paul Langerhans. J Clin Pathol. 55 (4), 243-24 (2002).
- Steinman, R. M., Cohn, Z. A. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J Exp Med. 137 (5), 1142-1162 (1973).
- Steinman, R. M., Swanson, J. The endocytic activity of dendritic cells. J Exp Med. 182 (2), 283-288 (1995).
- Hemmi, H., Akira, S. TLR signalling and the function of dendritic cells. Chem Immunol Allergy. 86, 120-135 (2005).
- Mueller, D. L. Mechanisms maintaining peripheral tolerance. Nat Immunol. 11 (1), 21-27 (2010).
- Inaba, K., et al. Efficient presentation of phagocytosed cellular fragments on the major histocompatibility complex class II products of dendritic cells. J Exp Med. 188 (11), 2163-2173 (1998).
- Caux, C., et al. B70/B7-2 is identical to CD86 and is the major functional ligand for CD28 expressed on human dendritic cells. J Exp Med. 180 (5), 1841-1847 (1994).
- Paavonen, J., Lehtinen, M. Interactions between human papillomavirus and other sexually transmitted agents in the etiology of cervical cancer. Curr Opin Infect Dis. 12 (1), 67-71 (1999).
- Ohtani, M., et al. Mammalian target of rapamycin and glycogen synthase kinase 3 differentially regulate lipopolysaccharide-induced interleukin-12 production in dendritic cells. Blood. 112 (3), 635-643 (2008).
- Wilde, B., et al. Dendritic cells in renal biopsies of patients with ANCA-associated vasculitis. Nephrol Dial Transplant. 24 (7), 2151-2156 (2009).
- Al-Hello, H., et al. An enterovirus strain isolated from diabetic child belongs to a genetic subcluster of echovirus 11, but is also neutralised with monotypic antisera to coxsackievirus A9. J Gen Virol. 89, 1949-1959 (2008).
- Ziegler-Heitbrock, L., et al. Nomenclature of monocytes and dendritic cells in blood. Blood. 116 (16), 74-80 (2010).
- Osugi, Y., Vuckovic, S., Hart, D. N. Myeloid blood CD11c(+) dendritic cells and monocyte-derived dendritic cells differ in their ability to stimulate T lymphocytes. Blood. 100 (8), 2858-2866 (2002).
- Reynolds, G., Haniffa, M. Human and Mouse Mononuclear Phagocyte Networks: A Tale of Two Species. Front Immunol. 6, (2015).
- Jefford, M., et al. Functional comparison of DCs generated in vivo with Flt3 ligand or in vitro from blood monocytes: differential regulation of function by specific classes of physiologic stimuli. Blood. 102 (5), 1753-1763 (2003).
- Menck, K., et al. Isolation of human monocytes by double gradient centrifugation and their differentiation to macrophages in teflon-coated cell culture bags. J Vis Exp. (91), (2014).
- Zhou, L., et al. Impact of human granulocyte and monocyte isolation procedures on functional studies. Clin Vaccine Immunol. 19 (7), 1065-1074 (2012).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Faresjo, M. A useful guide for analysis of immune markers by fluorochrome (Luminex) technique. Methods Mol Biol. 1172, 87-96 (2014).
- Baker, H. N., Murphy, R., Lopez, E., Garcia, C. Conversion of a capture ELISA to a Luminex xMAP assay using a multiplex antibody screening method. J Vis Exp. (65), (2012).
- Defawe, O. D., et al. Optimization and qualification of a multiplex bead array to assess cytokine and chemokine production by vaccine-specific cells. J Immunol Methods. 382 (1-2), 117-128 (2012).
- Nicholls, D. G., et al. Bioenergetic profile experiment using C2C12 myoblast cells. J Vis Exp. (46), (2010).
- Chunharas, A., Pabunruang, W., Hongeng, S. Congenital self-healing Langerhans cell histiocytosis with pulmonary involvement: spontaneous regression. J Med Assoc Thai. 85, 1309-1313 (2002).
- Bai, L., Feuerer, M., Beckhove, P., Umansky, V., Schirrmacher, V. Generation of dendritic cells from human bone marrow mononuclear cells: advantages for clinical application in comparison to peripheral blood monocyte derived cells. Int J Oncol. 20 (2), 247-253 (2002).
- Felzmann, T., et al. Monocyte enrichment from leukapharesis products for the generation of DCs by plastic adherence, or by positive or negative selection. Cytotherapy. 5 (5), 391-398 (2003).
- Berger, T. G., et al. Efficient elutriation of monocytes within a closed system (Elutra) for clinical-scale generation of dendritic cells. J Immunol Methods. 298 (1-2), 1-2 (2005).
- Sallusto, F., Lanzavecchia, A. Efficient presentation of soluble antigen by cultured human dendritic cells is maintained by granulocyte/macrophage colony-stimulating factor plus interleukin 4 and downregulated by tumor necrosis factor alpha. J Exp Med. 179 (4), 1109-1118 (1994).
- Pace, S. T., Gelman, B. B., Wong, B. R. Primary Langerhans cell histiocytosis of the lacrimal gland in an adult. Can J Ophthalmol. 50 (3), 40-43 (2015).
- Ravanfar, P., Wallace, J. S., Pace, N. C. Diaper dermatitis: a review and update. Curr Opin Pediatr. 24 (4), 472-479 (2012).
- Gebhardt, C., et al. A case of cutaneous Rosai-Dorfman disease refractory to imatinib therapy. Arch Dermatol. 145 (5), 571-574 (2009).
- Vazquez, P., Robles, A. M., de Pablo, F., Hernandez-Sanchez, C. Non-neural tyrosine hydroxylase, via modulation of endocrine pancreatic precursors, is required for normal development of beta cells in the mouse pancreas. Diabetologia. 57 (11), 2339-2347 (2014).
- Pellacani, G., et al. Distinct melanoma types based on reflectance confocal microscopy. Exp Dermatol. 23 (6), 414-418 (2014).
- Shi, Y., et al. Hepatic involvement of Langerhans cell histiocytosis in children--imaging findings of computed tomography, magnetic resonance imaging and magnetic resonance cholangiopancreatography. Pediatr Radiol. 44 (6), 713-718 (2014).
- Haustein, M., Terai, N., Pablik, J., Pillunat, L. E., Sommer, F. Therapy-resistant swelling of the upper eyelid in childhood. Ophthalmologe. 111 (1), 53-57 (2014).
- Haidinger, M., et al. A versatile role of mammalian target of rapamycin in human dendritic cell function and differentiation. J Immunol. 185 (7), 3919-3931 (2010).
- Macedo, C., Turquist, H., Metes, D., Thomson, A. W. Immunoregulatory properties of rapamycin-conditioned monocyte-derived dendritic cells and their role in transplantation. Transplant Res. 1 (1), 16 (2012).
- Fischer, R., Turnquist, H. R., Taner, T., Thomson, A. W. Use of rapamycin in the induction of tolerogenic dendritic cells. Handb Exp Pharmacol. 188 (188), 215-232 (2009).
- Nicolette, C. A., et al. Dendritic cells for active immunotherapy: optimizing design and manufacture in order to develop commercially and clinically viable products. Vaccine. 25, 47-60 (2007).
- Han, T. H., et al. Evaluation of 3 clinical dendritic cell maturation protocols containing lipopolysaccharide and interferon-gamma. J Immunother. 32 (4), 399-407 (2009).
- Paananen, A., et al. Molecular and biological analysis of echovirus 9 strain isolated from a diabetic child. J Med Virol. 69 (4), 529-537 (2003).
- HC, O. N., Wilson, H. L. Limitations with in vitro production of dendritic cells using cytokines. J Leukoc Biol. 75 (4), 600-603 (2004).
- Mest, H. J., et al. Glucose-induced insulin secretion is potentiated by a new imidazoline compound. Naunyn Schmiedebergs Arch Pharmacol. 364 (1), 47-52 (2001).
- Puc, J., et al. Mitochondrial activity after cold preservation of pancreatic islet cells treated with pefloxacin (PFX). Ann Transplant. 3 (1), 38-41 (1998).
- Alarcon, C., Serna, J., Perez-Villamil, B., de Pablo, F. Synthesis and differentially regulated processing of proinsulin in developing chick pancreas, liver and neuroretina. FEBS Letters. 436 (3), 361-366 (1998).
- Jekunen, A. P., Kairemo, K. J., Paavonen, T. Imaging of Hand-Schuller-Christian syndrome by a monoclonal antibody. Clin Nucl Med. 22 (11), 771-774 (1997).
- Pearce, E. J., Everts, B. Dendritic cell metabolism. Nat Rev Immunol. 15 (1), 18-29 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados