Method Article
대사 표현형을 각기 다른 미성숙, 성숙 및 Tolerogenic 수지상 세포의 생성
요약
Immature dendritic cells can be selectively differentiated into tolerogenic or mature dendritic cells to regulate the balance between immunity and tolerance. This work presents a means to generate from immature monocyte derived dendritic cells (moDCs), in vitro tolerogenic and mature moDCs that differ in metabolic phenotypes.
초록
항원 비특이적 선천 면역 항원과 특정 적응성 면역계 사이의 복잡한 상호 작용으로부터 면역 반응 결과. 면역계는 분자 자체에 대한 내성을 유지하고 병원체에 빠르게 반응에서 일정한 균형이다. 수지상 세포 (DCS)는 적응 면역 시스템에 선천 면역 연결자가 아닌 자기의 적응 응답 균형 강력한 전문 항원 제시 세포이다. 성숙 신호에 따라, 미성숙 수지상 세포를 선택적으로 또는 면역 원성 tolerogenic 수지상 세포로 분화하도록 자극 할 수있다. 면역 수지상 세포 클론 확장 항원 특이 적 T 세포 증식에 신호를 제공한다; tolerogenic 수상 세포는 항원 특이 적 T 세포 결실 또는 조절 T 세포의 클로 날 팽창에 의해 내성을 조절하면서. 이 때문에 고유 한 속성으로, 수지상 세포는 높은 암과자가 면역 dise 용으로 치료제 수요가있다ASE에. 수지상 세포는 시험관 내에서 특정 항원에 면역 원성 및로드 tolerogenic 모두 특정 면역 반응을 탑재 인체에 주입 할 수있다. 이 작품은 표면 마커의 발현, 기능과 신진 대사 표현형에 차이가 단핵 세포, 미성숙 단핵구 유래 수지상 세포 (moDCs), tolerogenic 성숙 moDCs에서 체외에서 생성 할 수있는 수단을 제공한다.
서문
Jolles 1 참조하고 전문적인 항원 제시 세포 2로 인정 1973 년 랄프 된 Steinman과 Zanvil 콘을 특징으로 DC 먼저 19 세기 후반에 폴 랑게르한스 (랑게르한스 세포)에 의해 설명되었다. 수지상 세포는 말초 혈액에서와 같은 (랑게르한스 세포와 같은 현재) 피부로와 활성화 코, 폐, 위의 라이닝과 내장의 외부 환경에 노출 된 조직에 특히 풍부한 몸, 대부분의 조직에서 발견된다 그들은 외부 항원을 발생합니다. 미성숙 수지상 세포는 T 세포 (3)을 자극하는 세포 내 이입 능력이 있지만, 상대적으로 낮은 용량을 가지고있다. 미성숙 수지상 세포는 다양한 패턴 인식 수용체 (PRRS) 캡처 병원체 관련 분자 패턴 (PAMPs가) 손상 관련 분자 패턴 (감쇠)를 4 표현한다. 자기 분자가 T 세포 unresponsivene 될 동안 활성화 위험 신호 원성 수지상으로 성숙 이용시SS 및 세포 사멸 5. 면역 원성 수지상 세포는 MHC 분자와 공동 자극 표면 분자 및 주요 나이브 T 세포 6,7에 자신의 능력의 상향 조절을 특징으로한다.
미성숙 수지상 세포는 비타민 D3 대사 산물 (1A), 25 (O)이 D (3) 및 특정 면역 억제제 인터루킨 10 (IL-10) 등의 덱사메타손 및 8-9 라파 마이신에 반응 TREG 유도 또는 tolerogenic 상태 향해 숙성 될 수있다. Tolerogenic 수지상은 표면 수용체 및 리간드를 함유하는 면역 수용체 티로신 계 억제 모티프 (ITIMs)의 발현을 특징으로한다. tolerogenic 수지상에 ILT의 가족, ILT3 및 ILT4를 포함 ITIMs의 신호 전달은 alloproliferation을 억제 Foxp3의 + TREG 확장 (10, 11)를 구동한다. tolerogenic 수지상 세포의 이러한 독특한 특성은 생체 내에서 자신의 깊은 힘, 이식 된 동종 이식과 suppr에 내구성이 뛰어난 내성을 유도하는, 즉 능력으로 이어질자가 면역 질환의 발전을 ESS. Tolerogenic 수지상 세포는 면역 활성화의 억제 기능 성숙 편광 수지상의 하위 유형으로, 따라서 볼 수 있습니다.
형질 수지상 세포와 골수 수지상 12 : 현재, 인간의 말초 혈액에서 수지상 세포의 두 가지 일반적인 부분 집합이 있습니다. 순환 수지상 세포는 인간 혈액 중 백혈구의 2 % 미만으로 구성하는 희귀하고 이것은 그들의 면역 기능을 연구하는 수지상의 적절한 수의 분리에 어려움을 야기. 이 문제를 극복하기 위해, 단핵구 분화 된 수지상 세포는 수지상 세포의 기능 연구를위한 시험 관내 모델로서 사용된다. 이 시험관의 DC는 생체 내 수지상 세포에 비해 유사 수용체와 기능을 가지고 있습니다. 생체 내 수지상의 체외 생성 된 단핵구 유래 수지상 세포 (moDCs)에서 자세한 비교는 다른 실험실 13, 14, 15에 의해 조사한다. 또한 그 moDCs와 CD를보고1C + 수지상 세포는 항원 제시 및 T 세포의 기능 (15)을 유도에 상당 하였다.
본 논문에서는 말초 혈액 단핵 세포에서 미숙 moDCs를 생성 한 후 면역 원성 및 tolerogenic 수지상 세포로 분화하는 방법을 설명합니다. 이 단핵구 유래 수지상 세포 (moDCs)는 그 표면 마커, 사이토 카인 프로필, 면역 기능과 신진 대사 상태를 특징으로한다. 면역 원성 tolerogenic 수지상 세포는 동종 T 세포 또는 조절 T 세포 중 확대 될 다른 사이토 카인을 생산한다. 본 논문에서는 사이토 카인의 프로파일 링은 멀티 플렉스 기술을 사용하는 시스템으로 수행된다. 세포의 성장 매체는 항체 고정화 색상 코드 구슬 배양 및 소형 분석기에서 읽습니다. 수지상 세포의 대사 상태 당분 반영 산소 소모율, 세포 호흡의 지표 및 세포 외 산성화 속도를 측정 외 플럭스 분석기를 이용하여 분석수지상 세포에 플럭스. 이러한 생체 에너지 비율의 측정은 수상 세포 발달과 기능에 필수적인 세포 대사의 변화를 추적하는 수단을 제공한다.
프로토콜
이 연구는 임상 시험 심사위원회 (NUS-IRB 10-250)에 의해 승인되었다.
말초 혈액 단핵 세포의 1. 분리 (PBMC를)
- 시약의 제조
- 인산 완충 식염수 (PBS)를, 2 mM의 에틸렌 디아민 테트라 아세트산 (EDTA)로 보충 : PBS / EDTA를 준비한다. 0.2 μm의 필터를 통해 여과에 의해이 솔루션을 소독. 4 ° C에서 PBS / EDTA를 저장하는 데 참고 사용하기 전에 실온에 따뜻한.
- 2 % 태아 소 혈청 (FBS)을 인산 완충 식염수 (PBS) 보충 된 10 mM 4- (2- 히드 록시 에틸) -1- 피페 라진 에탄 술폰산 (HEPES), 2 mM의 에틸렌 디아민 테트라 아세트산 (EDTA) 염색 버퍼를 준비한다. 0.2 μm의 필터를 통해 여과에 의해이 솔루션을 소독.
- 혈액 콘에서 혈액을 수집
주 : 혈액 콘 플레이트 후 수집 백혈구 성분을 포함병원에서 letpheresis. 1 비율을 1.3 단계로 진행; 혈액을 헤파린 또는 EDTA 튜브에 수집 된 경우, 1 PBS로 혈액을 희석 버피 코트가 수신되는 경우, 1 PBS와 버피 코트를 희석 : 2 비율과 1.3 단계로 진행합니다.- 혈액은 50 ㎖ 튜브로 유출 할 수 있도록 콘의 양단을 잘라. 콘은 일반적으로 혈액 10 ㎖가 포함되어 있습니다.
- 50 ㎖의 튜브에 콘 씻어 수집 PBS / EDTA의 30 ㎖를 함유하는 뭉툭한 단부 주사기를 사용한다.
- 80 ㎖의 최종 부피로 더 PBS / EDTA와 혈액 희석.
- 밀도 원심 분리 (16)에 의해 PBMC를의 분리
- 나누어지는 15 ml의 4 신선한 50 ㎖ 튜브에 피콜 각.
- 피콜 층 위에 희석 된 혈액 20 ㎖를 추가하는 25 ml의에게 혈청 학적 피펫을 사용합니다. 45 각도로 50 ML 튜브를 보유하고 계면을 방해하지 않도록주의를 기울여야 할주의하세요.
- 30 분, 20 ° C에 대한 브레이크없이 805 XG에 튜브를 원심 분리기.
- 제거플라즈마 층 단지 파스퇴르 피펫으로 플라즈마 층 아래에 누워 PBMC를의 반지를 수집합니다. 이 50 ㎖ 튜브에 PBMC를 네 튜브를 결합합니다. PBMC를 아래의 투명 레이어를 수집하지 않도록합니다.
- 10 분, 20 ° C에 대한 브레이크와 548 XG에서 PBMC를의 튜브와 원심 분리기 50 ML의 최종 볼륨 PBS / EDTA를 추가합니다.
- 염색 버퍼의 25 mL 및 각 튜브의 대기음 뜨는 및에 resuspend 펠렛 한 50 ㎖ 튜브에 결합한다.
- 5 분, 4 ° C에 대한 브레이크와 367 XG에 원심 분리기.
- 기음 뜨는 및 염색 버퍼 10 ㎖에 재현 탁 펠렛.
자기 분리 17 2. 단핵구 심화
- 세포 수를 계산
- PBMC 세포 현탁액 20 μL를 취하여 사이토하여 생균 수를 계산하기 위해 트립 판 블루 20 μL와 혼합한다.
- 브레이크와 367 XG에 원심 분리기 세포 현탁액10 분, 4 ° C에 대한.
- 염색 완충액 80 μL 당 107 세포 농도로 대기음 완전히 상청 재현 탁 세포 펠렛.
- 자기 라벨링
- 10 7 세포 당 CD14 마이크로 비드의 20 μl를 추가 잘 혼합 2에서 15 분 동안 품어 - 8 ° C를.
- 10 분, 4 ° C에 대한 브레이크와 367 XG에서 염색 10 7 세포 당 버퍼와 원심 분리기 1 ㎖를 첨가하여 세포를 씻으십시오.
- 염색 완충액 50 μL 당 107 세포 농도로 대기음 완전히 재현 탁하고 상등액 세포 펠렛.
- 자기 분리
- 2 × 10 8 전체 세포의 최대 중간 크기의 열을 사용합니다.
전체 세포의 수와 데이터 시트에서 권장하는 CD14 + 세포의 수에 따라 적절한 열과 구분을 선택합니다. - 자기장 O를 열 배치FA 적합한 분리 및 염색 버퍼 500 μL로 세척하여 열을 준비합니다.
- 피펫 셀 열 상 서스펜션과 15 ML 튜브에 열을 통과 레이블이없는 세포를 수집합니다.
- 열에서 새로운 15 ML 튜브를 교체하고 얼룩 버퍼 500 μL와 컬럼 3 회 씻는다. 열 저장이 세척 사이에 새로운 염색 버퍼를 추가하기 전에 비어 있는지 확인합니다.
- 분리기에서 열을 제거하고 신선한 15 ML 튜브에 놓습니다.
- 피펫 열 위에 염색 버퍼 1 ㎖. 즉시 단단히 열로 (키트에 제공됨) 플런저를 밀어 자기 표지화 된 세포를 세척.
- 반복 CD14 + 세포의 순도를 높이기 위해 새로운 컬럼에 용출 된 부분을 사용하여 2.3.6에 2.3.2 단계를 반복합니다. 구슬 단계 3.2 동안 문화에 자동으로 세포에서 발표 될 예정이다 있습니다.
- 2 × 10 8 전체 세포의 최대 중간 크기의 열을 사용합니다.
다른 정품 인증 S에 수지상 세포의 분화 (3)tates
- 시약의 제조 (내 독소 수준에 모든 시약 0.1 EU / ㎖이어야한다)
- 세포 배양 배지를 준비 : RPMI 1640, 10 % 소 태아 혈청 (FBS), 1 % 비 필수 아미노산 (NEAA) 0.05 mM의 2- 머 캅토 에탄올 (2ME)로 보충. 0.2 μm의 필터를 통해 여과에 의해이 솔루션을 소독.
- 사이토킨 준비 : 0.25 mg의 농도로 세포 배양 등급의 물에서 IL-4 및 GM-CSF를 재구성 / 각각 무균 조건 하에서 ml로. 나누어지는 200 μL의 microcentrifuge 튜브로 사이토 카인 및 저장 -80 ° C에서.
- 비타민 D3 주식을 준비 : 무균 상태에서 100 mm의 농도로 세포 배양 등급 물에 비타민 D3를 재구성. -20 ° C에서 나누어지는 비타민 1.5 ml의 마이크로 원심 튜브에 D3 및 저장.
- 덱사메타손 재고를 준비 : 무균 조건에서 10 mm의 농도로 세포 배양 등급 물에 덱사메타손을 재구성. 나누어지는 dexamet-20 ° C에서 1.5 ml의 마이크로 원심 튜브에 hasone 및 저장.
- LPS 준비 : 무균 조건에서 1 ㎎ / ㎖의 농도로 세포 배양 등급의 물 리포 다당류 (LPS)를 재구성한다. 나누어지는 1.5 ml의 마이크로 원심 튜브에 LPS 및 저장 -20 ° C에서.
- 다른 moDCs 생성
- 시드 0.3 농도의 CD14 + 단핵구 4 세트 - GM-CSF 중에는 200ng / ㎖, 6 웰 플레이트에서 IL-4 중에는 200ng / ㎖로 보충 된 세포 배양 배지에 0.5 × 106 / ㎖. 이 날 0 각 6 잘 매체의 볼륨 2 ml의 있음을 유의하십시오.
- 5 % CO 2와 37 ° C에서 조직 문화 인큐베이터에서 세포를 품어.
- 5 분, 4 ° C 300 XG에 4 일 원심 분리기에서 문화 매체의 850 μl를 제거합니다. 대기음 상청 (GM-CSF 중에는 200ng / ml의 IL-4 및 중에는 200ng / ㎖)의 2 배를 함유하는 세포 배양 배지 1 ㎖에 재현 탁 펠릿. 다시이 세포 혼합물을 추가문화에. 배지 1 ㎖를 다시 배양에 첨가 될 때 1X해질 것이다 GM-CSF 및 IL-4를 첨가 그 2 배 농도를 참고.
- tolerogenic moDCs를 생성하는 날 5 세트의 두 가지로 비타민 D3 재고 및 배지 1 ㎖ 당 덱사메타손 주식의 1μL의 1 μl를 추가합니다. 비타민 D3의 최종 농도는 100 ㎚이다 및 덱사메타손은 10 ㎚이다 참고; GM-CSF 및 IL-4를 첨가 5 일에 필요하지 않다.
- 6 일에 모든 세트에 GM-CSF의 200 ng를 / ㎖ 및 IL-4의 200 ng를 / ㎖를 추가합니다.
- 성숙한 moDCs를 생성하는 제 6 일에 전용 GM-CSF 및 IL-4로 처리 된 세트 중 하나에 LPS 1 ㎍ / ㎖의 추가.
- LPS-tolerogenic moDCs을 생성하기 위해 6 일에 tolerogenic moDCs 한 세트에 LPS의 1 μg의 / ㎖를 추가합니다.
- 유동 세포 계측법 또는 다른 연구에 PBS, EDTA와 배양 접시를 세척하여 7 일에서 moDCs의 다른 유형을 수확. 만 비 부착 세포를 수확합니다. CD14 +의 monoc에서 그 비율 수율을 알아미성숙 moDCs, 성숙한 moDCs, tolerogenic moDCs 및 LPS-tolerogenic DC에 대한, 킬로바이트는 약 90 %, 50 %, 60 %와 60 %를 각각하고 혈액 기증자와 FBS 로트 사이에 다릅니다.
4. 유동 세포 계측법
- moDCs에 세포 표면 마커 특성
- 피펫으로 배양 접시에서 세포를 분리합니다. 1.5 ml의 마이크로 원심 튜브에 염색 완충액 50 μL 당 5 × 105 세포의 농도로 한번 PBS / EDTA 재현 탁하고 세포를 세포를 세척 하였다.
- 를 PerCP - 복합 HLADR (1 : 100)로 0.5 × 10 6 세포 씩을 품어, PE-복합 CD80 (1시 50분), PE-복합 CD83 (1시 25분), PE-복합 CD86 (1시 50분), APC- 접합하는 CD11c (1시 50분), PE-복합 CD14 (1시 50분)와 PE - 복합 BDCA3 (1시 50분), 4 ℃에서 30 분 동안 어둠 속에서 APC - 복합 ILT3 (1시 25분). 이소 일치를 PerCP - 복합은 단클론 항체 (1:20)을 수행, PE 접합 된 단클론 항체 (1시 11분), APC - 복합 단클론 항체 (1:11)와 같은 부정적인 컨트롤을 제공합니다.
- (18) 플로우 사이토 미터를 사용하여 표면 마커의 발현을 검출한다.
- moDCs의 미토콘드리아 막 잠재력 분석
- 동결 건조 레드 CMXRos 50 μg의 당 디메틸 설폭 사이드 (DMSO) 94.1 μl를 첨가하여 1 mM의 레드 클로로-X-rosamine (CMXRos)의 스톡 용액을 제조 하였다.
- 15 ㎖의 튜브 37 ° C에서 30 분 동안 행크의 균형 잡힌 염 용액 (HBSS) 1 ㎖ 100nm의 붉은 CMXRos 2 × 105 moDCs 부화.
- 5 분, 실온 300 XG에 세포를 원심 분리기에 PBS / EDTA 2 ㎖를 추가합니다. 2 번 반복합니다. 기음 뜨는 및 유동 세포 계측법 분석을위한 PBS, EDTA, 2 % FCS 300 μL에에 resuspend 세포 펠릿. 레드 CMXRos 신호를 분석하기 위해 PE 채널을 사용하도록주의하세요.
- T 세포 마커 특성
- 1.2 50 μl를 품어 × 106 (에서 생성 된 CD4 + T 세포 동종 CFSE 표지200), PE / Cy7 접합 된 CD4 (1 : 400)와 APC / Cy7 - 복합 CD25 (1 : 4 ° C에서 30 분 동안 어둠 속에서 100)를 PerCP - 복합 CD3 (1) 5.6 단계. 실온에서 1 시간 동안 어둠 속에서-Foxp3의 형석 알렉사 647 (1시 50분)과 상업용 키트를 사용하여 염색 T 세포.
5. Alloreaction 연구
- 제조사의 프로토콜에 따라, 동결 건조 할 CFSE DMSO 18 μL를 첨가하여 카르복시 숙신 이미 딜 에스터 (CFSE) 5 mM의 스톡 용액을 제조 하였다.
- 한 PBMC로부터 CD4 + T 세포를 정제하여
- PBMC 세포 현탁액 20 μL를 취하여 세포 수를 결정하고 세포 계측기를 사용하여 살아있는 세포의 개수를 계산하는 트리 판 블루 20 μL와 혼합한다.
- 10 분, 4 ° C를위한 브레이크와 367 XG에 원심 분리기 세포 현탁액.
- 5 ml의 polysty의 염색 완충액 1 ㎖ 당 5 × 107 세포의 농도로 대기음 완전히 재현 탁하고 상등액 세포 펠렛르네 관.
- 50 μL / ml의 세포에서 인간의 CD4 + T 세포 농축 칵테일을 추가합니다. 잘 섞어 실온에서 부화 - 10 분 동안 (15 ~ 25 °의 C).
- 소용돌이 자성 입자 30 초 동안 100 μL / ㎖의 세포에 자성 입자를 추가합니다. 잘 혼합하고 실온에서 5 분간 배양한다.
- 2.5 ml의 총 부피로 세포 현탁액을 염색 버퍼를 추가한다. 3 회 - 부드럽게 아래로 둘을 피펫 팅에 의해 튜브에 세포를 섞는다. 자석에 튜브를 삽입하고 5 분 동안 품어.
- 튜브를 자석을 전환하고 새로운 5 ㎖ 폴리스틸렌 튜브에 현탁 (T 세포를 포함) 가만히 따르다.
- 휴대폰 번호를 결정하고 빛으로부터 보호, 37 ° C에서 20 분 동안 PBS 1 ml의 5 μM의 CFSE 1.2 × 10 6 CD4 + T 세포를 품어.
- 세포에 (단계 3.1.1에 따라 제조 됨)을 세포 배양 배지 5 배 원래 염색 볼륨을 추가 5 분 동안 배양한다.
- Centrif75 μL 당 2 × 105의 농도로 세포 배양 배지에서 5 분, 4 ℃에서 재현 탁 펠릿 300 XG에 UGE.
- 0 세포 배양액 75 μl를 각각 함유 moDC 배양 2 × 105 CFSE 표지 된 CD4 + T 세포의 75 μL를 추가 한 2.5 × 103, 5 × 3, 10 × 103 20 × 10 (3) 96 웰 U 바닥 판에 40 × 10 3 moDCs. 5 % CO 2와 37 ° C에서 조직 문화 인큐베이터 6 일 동안 문화.
- 5 분, 4 ° C 300 XG에 15 ML 튜브와 원심 분리기에 CD4 + T 세포를 피펫 팅하여 수확. 4 ℃에서 5 분 동안 300 XG에 2 PBS / EDTA ㎖의 원심 분리기에서 사이토 카인 분석에 resuspend 세포 펠렛을위한 뜨는 수집합니다.
6. 사이토 카인 분석 (19)
- 단계 5.5에 설명 된대로 alloreaction 연구에서 상층 액을 수집합니다.
- 인간의 사이토 카인 / Chemokin 용 시약의 조제전자 마그네틱 패널 분석
- 구슬의 개별 유리 병에 대한 항체 고정화 비드의 병을 혼합 준비를 위해, 1 분 동안 소용돌이 (키트에 포함). (키트에 포함) 혼합 병에 각 항체 비드 바이 얼에서 60 μl를 추가하고 구슬 희석제 3 ML의 최종 부피를 가지고 (제공).
- 품질 관리의 준비, 품질 관리 (1) 및 품질 관리 (2) 탈 이온수 250 μL와 (키트에 포함) 재구성.
- 세척 완충액의 준비를위한 탈 이온수 270 mL를 (키트에 포함) 배 세척 완충액 30 mL로 희석한다.
- 인간 사이토 카인의 표준 제제를 들어, 10,000 pg / ml 인 농도를 제공하기 위해 탈 이온수로 250 μL (키트에 포함됨), 인간 사이토 카인 수준을 재구성한다.
- 2,000 pg / ml 인 표준 작업을 위해 1.5 ml의 마이크로 원심 튜브 (키트에 제공됨) 분석 완충액 200 μL 10,000 pg / ml 인 인간 사이토 카인의 표준의 50 μL를 추가. 전송 1.5 ml의 microcentrifuge 관에서 (키트에 제공) 분석 완충액 200 μL 2,000 pg / ml 인 인간의 사이토 카인 표준의 50 μl를 400 pg / ml 인 작업 표준을 확인합니다.
- 전송 1.5 ml의 microcentrifuge 관에서 (키트에 제공) 분석 완충액 200 μL 400 pg / ml 인 인간의 사이토 카인 표준의 50 μl를 80 pg / ml 인 작업 표준을 확인합니다. 전송 1.5 ml의 microcentrifuge 관에서 (키트에 제공) 분석 버퍼의 200 μl를 80 pg / ml 인 인간의 사이토 카인 표준의 50 μl를 16 pg / ml 인 작업 표준을 확인합니다.
- 전사 3.2 pg / ml 인 표준 작업을 위해 1.5 ml의 마이크로 원심 튜브 (키트에 제공됨) 분석 완충액 200 ㎕를 16 pg / ml 인 인간 사이토 카인의 표준의 50 μL. 0 pg / ml 인 작업 표준은 1.5 ml의 microcentrifuge 관에서 분석 버퍼의 200 μl를 가지고있다.
- 필터의 각 웰에 분석 완충액 (제공) 200 ㎕를 피펫 팅하여 (키트에 포함되는) 전 젖은 필터 판플레이트. 밀봉하고 실온에서 10 분 동안 플레이트 쉐이커에 판상 필터를 배치했다.
- 대기음 분석은 버퍼 적절한 우물에 각 표준 또는 품질 관리의 25 μl를 추가합니다.
- 세포 배양 배지의 25 μL를 추가 배경, 표준 및 대조군 웰에 (단계 3.1.1에 따라 제조 됨).
- 샘플 우물에 분석 버퍼 25 μl를 추가하고 적절한 샘플 우물에 샘플의 25 μl를 추가합니다.
- 소용돌이는 혼합 항체 고정화 비드를 포함하는 병이 각 웰에 혼합 구슬의 25 μl를 추가합니다. 플레이트를 밀봉하고 4 ℃에서 하룻밤 플레이트 진탕 기에서 교반 배양한다.
- 기음 유체 및 세척 접시 버퍼 200 μL / 잘 세척의 추가 및 유체를 흡입하여 2 회.
- 각 웰에 (제공) 검출 항체의 25 μl를 추가합니다. 밀봉하고, 실온에서 1 시간 동안 플레이트 진탕 기에서 진탕 배양한다.
- (잠 Streptavidin- 피코 에리 트린의 25 μl를 추가잘 검출 항체 25 μL를 각각 포함하는) ided. 밀봉하고 실온에서 30 분 동안 플레이트 진탕 기에서 진탕 배양한다.
- 단계 6.8에 설명 된대로 대기음 유체 및 세척 접시.
- 5 분 동안 접시 통에 모든 우물에 resuspend 구슬 150 μL / 웰 시스의 유체를 추가합니다.
- 3 차원 시스템 (20)를 이용하여 비드의 형광 강도를 검출한다. 샘플 21 사이토킨 / 케모카인의 농도를 산출하는 다섯 가지 파라미터 로그 로지스틱 곡선 피팅 방법을 사용하여 평균 형광 강도 데이터를 분석한다.
7. 실시간 산소 소비 속도 (OCR) 및 세포 외 산성화 속도 (ECAR) 측정
- 시약의 제조 / 소재
- OCR 매체를 준비한다 : 25 mM의 포도당 및 1mM의 피루브산 나트륨 (PH 7.35)로 보충 분석 매체. 0.2 μm의 필터를 통해 여과에 의해이 솔루션을 소독. 홍보이 매체는 것을주의 깊게 살펴FBS의 구성 요소가 복잡하고 밥을 많이 한 많이 다를 수 있기 때문에 FBS없이 epared.
- ECAR 매체를 준비 : 보통 2 mM L- 글루타민 (pH를 7.35)로 보충 자료. 0.2 μm의 필터를 통해 여과에 의해이 솔루션을 소독. 이 매체는 수소 나트륨, 포도당, 피루브산 및 FBS없이 준비가되어 있다는 사실을. FBS는 완충 능력을 가지고 있으며 ECAR 독서를 방해합니다.
- OCR 측정을위한 화합물을 제조 : 100 μM 원액을 농축 작업 16 μM에 OCR 배지로 희석 OCR 매체의 630 μL와 oligomycin를 Resuspend. OCR 배지 720 μL로 재현 탁 보닐 시아 나이드 4- (트리 플루오 로메 톡시) 페닐 (FCCP)은 100 μM 원액을 농축 작업 4.5 μM로 OCR 배지로 희석한다. 재현 탁의 로테 / OCR 매체의 540 μL와 antimycin A는 50 μM 원액을 농축 작업 10 μM에 OCR 배지로 희석한다.
- 준비ECAR 측정을위한 화합물 : 재현 탁 포도당 ECAR 매체의 3 ㎖와 100 mM의 원액을 만들고 농도를 작동하는 80 mm로 희석한다. 100 μM 원액을 만들고 농도를 작동하는 18 mm로 희석 ECAR 매체의 720 μL와 oligomycin 재현 탁. ECAR 배지 1.5 mL를 재현 탁 -2- 데 옥시 -D- 글루코스 1,000 mM의 스톡 용액을 제조한다.
- 피펫 측정 전에없이 CO 2 일일 37 ° C에서 카트리지 및 저장의 각 웰에 calibrant 200 μL.
- 실시간 OCR 측정
- 수확 moDCs 및 OCR 배지 150 ㎕를 60 × 103의 농도로 OCR 매체 moDCs의 각 유형을 재현 탁.
- 시드 60 × 103 세포 / 웰의 폴리 D 라이신 코팅 된 96- 웰 평면 바닥 플레이트에서 37 ℃에서 1 시간 동안 비 CO 2 인큐베이터에서 배양한다. 1 시간 동안 코트에 폴리 D 라이신의 50 ng를 / ㎖ 플레이트의 50 μl를 사용하여 세척을 알아멸균. 사용하기 전에 실온에서 2 시간 동안 판 건조한 상태로 유지하십시오.
- 모든 우물 용 분사 포트 A에 피펫 25 μl의 OCR 매체; 모든 웰을위한 주입 포트 B에서 oligomycin 16 μM을 함유하는 25 ㎕의 OCR 매체; 4.5 모든 우물 용 분사 포트 C에 (FCCP)의 μM, 25 10 밀리미터 로테 / 모든 우물 용 분사 포트 D에 antimycin A를 포함 μL OCR 매체를 포함하는 25 μl의 OCR 매체. oligomycin에 대한 최종 웰 농도가 2 μM되어 있습니다, FCCP 0.5 μM 및 로테 인 / antimycin A는 1 μM이다.
- 세포 외 플럭스 분석에 접시를 놓고 연속 4 단계에서 동시에 모든 moDCs과 완벽한 OCR 연구를 실행 기저 호흡을, (포트 B에서 약물 주입 후) 미토콘드리아 복잡한 V 억제, 최대 호흡 유도 (포트 A에서 매체 주입 후) (후 포트 C에서 약물 주입) 및 포트 D에서 약) 22 후 전자 수송 체인 억제 (. 3 C가 있다는 사실을주사 및 측정 사이의 6 분 간격 사이에 ycles.
- 실시간 ECAR 측정
- 수확 moDCs 및 ECAR 매체의 60 × 103 150 μL의 당 농도 ECAR 매체 moDCs의 각 유형을 재현 탁.
- 시드 6 × 104 세포 / 웰의 폴리 D 라이신 코팅 된 96- 웰 평면 바닥 플레이트에서 37 ℃에서 1 시간 동안 비 CO 2 인큐베이터에서 배양한다.
- 모든 우물 용 분사 포트 A에 피펫 25 μL의 ECAR 매체; 모든 웰을위한 주입 포트 B 포도당 된 10 mM를 함유하는 25 μl의 용 ECAR 매체; 모든 18 웰 사출 포트 C에 oligomycin의 25 μM 모든 우물 주입구 D 1000 mM의 2- 데 옥시 -D- 글루코스를 함유 μL OCR 배지를 함유하는 25 μl의 용 ECAR 매체. 참고 글루코스의 최종 웰 농도가 10 μM 즉, oligomycin 2 μM 2- 데 옥시 -D- 글루코스는 100 mm로된다.
- 세포 외 플럭스 분석에 접시를 올려 놓고 실행동시에 연속 4 단계의 모든 moDCs 완료 ECAR 연구 : (포트 A에서 매체 주입 후) 기초 호흡, (포트 B에서 약물 주입 후) 해당 작용 유도하고, 해당 작용 억제 (포트 C에서 약물 주입 후) 최대 당분 유도 (후 포트 D) (22)로부터 약물.
- Tukey의 다중 비교 사후 테스트와 편도 ANOVA를 사용하여 통계적인 차이를 분석 할 수 있습니다.
결과
단핵구 정화 및 수지상 세포 분화
단핵 세포는 CD14 + 미성숙 수지상 세포를 수득하는 GM-CSF 및 IL-4의 존재 하에서 완전 배지에서 양성 선별 자기 분리 (도 1B) 배양 (이어서, 말초 혈액 (도 1a) 밀도 원심 분리 한 PBMC로부터 정제 된 도 2A). 비타민 D3 및 덱사메타손 후 GM-CSF와 IL-4를 첨가 tolerogenic moDCs (그림 2B)로 미성숙 moDCs의 분화의 결과. LPS는 성숙 (도 2D)에 대한 저항성을 확인 LPS로 자극 하였다 moDCs (도 2C) 및 tolerogenic moDCs 성숙 미성숙 moDCs의 성숙을 유도 하였다. 이 연구에 사용 된 혈액 샘플을 통보 이전에 건강한 공여자로부터 얻었다동의.
moDC 특성
유동 세포 계측법에 의해 마커 특성 표면
DC 표면 마커 분석 성숙한 moDCs은 LPS 처리 tolerogenic moDCs, tolerogenic moDCs 미숙 moDCs (그림 3)에 비해 성숙 마커 HLA-DR, CD83 및 CD86의 가장 높은 수준을 표명 것으로 나타났다. 이러한 결과는 LPS 자극 다음 미숙 moDCs에 비해 tolerogenic moDCs가 성숙에 내성이 있다고 설명했다. 또한, tolerogenic moDCs를 LPS는 처리 및 tolerogenic moDCs은 미성숙과 성숙 moDCs에 비해 CD14, BDCA3 (CD141) 및 면역 글로불린 같은 성적 증명서 (ILT) 3의 발현 증가를 표시. 우리가 여기에서 생성 된 tolerogenic moDCs 이전 보고서 (23)과 일치한다.
moDCs의 기능적 특성
성숙을위한 유도 moDCs은 면역 원성되고 CD4 + T 세포의 증식을 촉진 사이토 카인을 놓습니다. 우리는 공동 배양 된 T 세포의 증식을 측정함으로써 다양한 moDC 아형의 면역 원성을 평가 하였다. CD4 + T 세포의 낮은 alloproliferation (도 4a)에 도시 된 바와 같이 Tolerogenic moDCs는 성숙한 moDCs 비해 좋지 면역원이었다. Tolerogenic moDCs는 낮은 IFN-Γ CD4 + T 세포 (그림 4B)와 alloreaction 공동 문화, 낮은 IL-12p40, 높은 IL-10 사이토 카인 생산을 특징으로한다. 또한, 어른의 moDCs에 tolerogenic moDCs의 수를 증가 공동 배양 유도 allospecific CD4 + T 세포는 CD25 + 고 Foxp3를 조절 T 세포 (도 4C)의 주파수를 증가.
미토콘드리아 활동 분석레드 CMXRos는 moDCs의 미토콘드리아 막 전위 레벨을 분석 미토콘드리아 활성을 반영하는데 사용된다. Tolerogenic moDCs는 다른 moDC 분화 아형 (도 5a)에 비해 높은 미토콘드리아 활성을 갖는 것으로 관찰되었다. 다음에, 미토콘드리아의 산소 소모 속도 (OCR)는 bioanalyzer를 사용하여 다른 moDC 아형에 대해 평가된다. OCR 측정을 포함하지만 이에 기초 호흡, 호흡 공급 능력, 양자 누출 및 비 미토콘드리아 호흡에 한정되지 정보를 제공 대사 프로필 고해상도 통계를 허용한다. OCR의 측정은 스트레스에 반응하는 세포의 능력을 평가하는 수단을 제공한다. 세포는 대사 적으로 연속하여 세 가지 화합물의 첨가에 의해 교란된다. 첫 번째 주입은 올입니다ATP 합성을 억제하는 상기 전자 전달계 (ETC)의 복소 V 억제 igomycin (ATP 커플러). 이 단계는 ATP 합성에 소비되는 산소의 비율과 미토콘드리아 내막을 가로 질러 양성자 누설을 극복하기 위해 소비 된 산소의 비율을 구별한다. 두번째 주사는 않고, 미토콘드리아 막에 걸쳐 대신 미토콘드리아 막전위의 붕괴 에너지와 산소의 급속한 소모 리드 복합 V.의 양자 채널을 통해 수소 이온 운반에 의해 ATP 합성을 방해 FCCP (ETC 촉진제) 인 ATP의 생성. FCCP 처리는 세포의 예비 호흡 용량을 계산하는데 사용될 수있다. 스트레스 조건에서 예비 호흡 능력의 유지는 세포 생존에 중요하다. 이 용량은 등에 관여하는 효소의 기질의 가용성 및 기능 용량 등 여러 가지 요인에 의해 결정된다 세 번째 주입 로테 논하는 COMPL의 조합예 내가 억제제 및 Antimycin A, 복잡한 III 억제제. 이 조합은 미토콘드리아 호흡을 종료하고 OCR은 미토콘드리아 기능 장애 (도 5C)의 결과로서 감소하는 것으로 관찰된다. Tolerogenic moDCs 성숙한 moDCs (그림 5D)보다 더 높은 기저 OCR 수준을 표시. 또한, tolerogenic은 LPS-tolerogenic, 미숙 moDCs 성숙한 moDCs (그림 5E)에 비해 예비 호흡기 용량을 증가 보였다.
moDCs의 대사 특성
락트산 및 양성자 당분 동안 세포로부터 방출되기 때문에, 우리는 세포 외 산성화 (ECAR) (도 6b)의 속도를 실시간으로 분석을 행하여 moDCs 당분의 활성을 분석 하였다. 포도당의 존재하에 모든 moDCs의 당분 레이트와, 기저 단에 비해 증가미성숙 moDCs (그림 6D)보다 높은 당분 비율을 나타내는 성숙한 moDCs. Tolerogenic 미성숙 moDCs은 LPS 처리 moDCs (도 6b)와 비교하여 (글루코스의 존재에 의해 유도 oligomycin)보다 최대 해당 작용을 나타냈다. tolerogenic 미숙 moDCs의 당분 용량은 성숙 moDCs (그림 6E)보다 높았다. 높은 당분 속도는 대조적으로, 당분 예약 성숙한 moDCs (그림 6 층)에서 가장 낮았다.
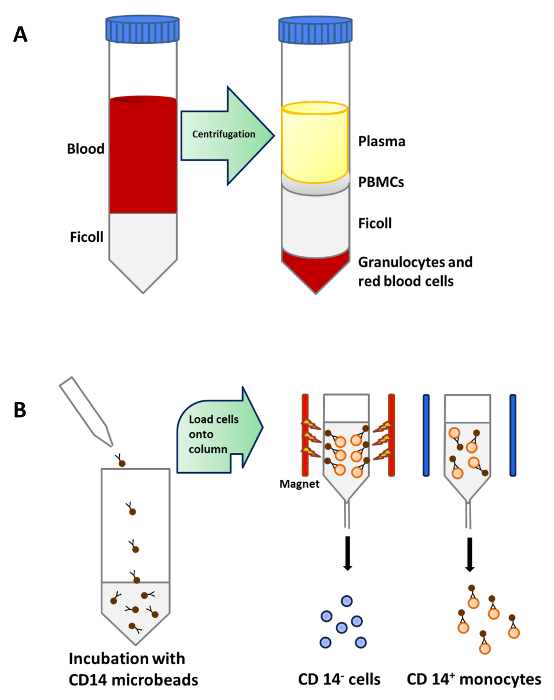
그림 1 :. 말초 혈액에서 단핵구 정제 (A)는 혈액 25 ml를 조심스럽게 원심 분리 전에 50 ML 튜브 당 피콜 15 ml의에 적층된다. PBMC를는 밀도 원심 분리 후 플라즈마 아래 층에 집중된다. (B)는 PBMC를 접속사있는 마이크로 비드와 인큐베이션 인간 CD14 항체 (이소 : 마우스의 IgG2a를) 단일 클론하는 비공 액. CD14 + 단핵 세포를 분리하는 분리기의 자기장에 배치 된 컬럼에로드 된 다음과 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
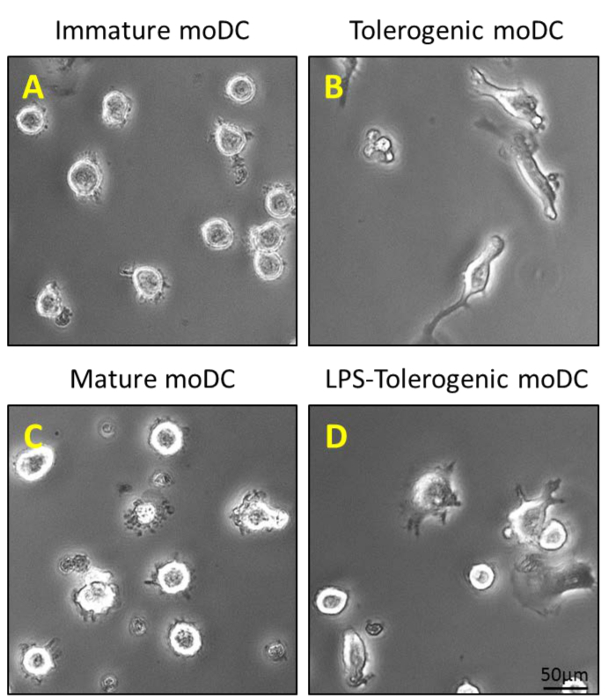
그림 2 : moDCs의 형태 학적 특성. (A) GM-CSF 및 IL-4 중에는 200ng / ㎖ 미성숙 moDCs를 생성하는 0 일, 4, 6에서 정제 CD14 + 단핵 세포에 첨가되고; 및 (B) 100 nm의 비타민 D3와 5 일에 10 나노 덱사메타손과 자극의 추가 단계는 tolerogenic moDCs를 생성합니다. 미성숙 moDCs 및 tolerogenic moDCs은 (C)를 생성 moDCs를 성숙 (D) LPS-tolerogenic moDCs하기 위해 6 일에 1 μg의 / ml의 LPS로 자극한다.ttps : //www.jove.com/files/ftp_upload/54128/54128fig2large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
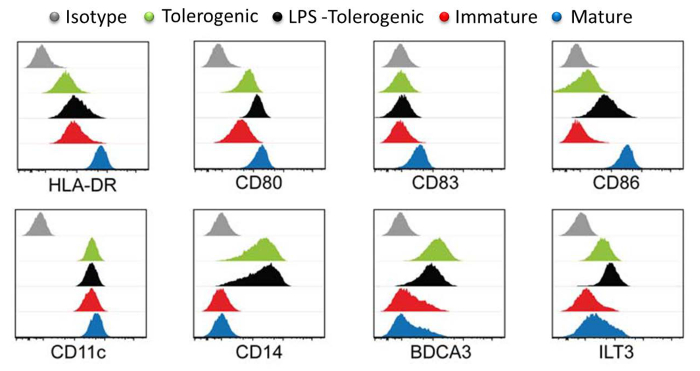
그림 3 :. 유동 세포 계측법 tolerogenic의 표면 마커 HLA-DR, CD80, CD83, CD86, CD11, CD14, BDCA3과 LT3의 발현 수준 (녹색), LPS-tolerogenic (검정), 미숙 (빨간색)에 의해 표면 마커 특성, 성숙 (파란색) moDCs. 아이소 타입 컨트롤은 회색으로 표시됩니다. 각 세포 유형에 대한 개별 히스토그램 형광 강도와의 겹쳐 X 축에 대해 로그 Y 축 세포 수를 플롯한다. 모든 히스토그램 네 번의 독립된 실험의 대표 값이다. 10.4049 / jimmunol.1303316 (2015년 6월 1일) :이 수치는 J Immunol 194 (11), 5174-5186, 도이에서 수정되었습니다. 재현 및 저작권 허가를 게시. 저작권 2015 년 미국 협회면역학, Inc.는 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
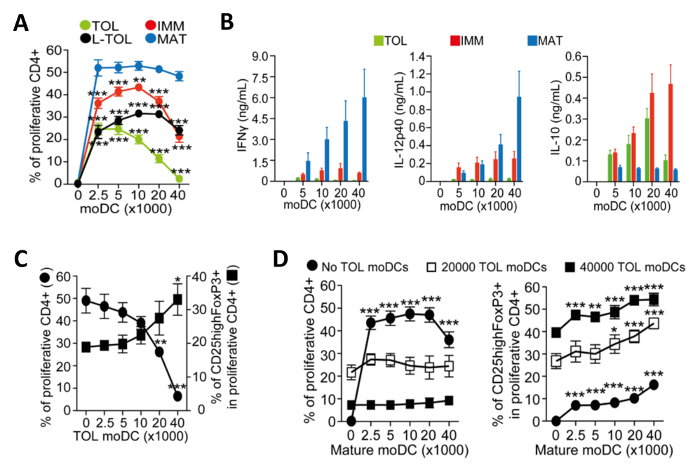
그림 4 : moDCs의 기능 특성. (A) tolerogenic의 증가 숫자와 공동 배양에 의해 유도 된 CD4 + T 세포의 alloproliferation 주파수의 정량 (TOL, 녹색), LPS-tolerogenic (L-TOL, 검정), 미숙 (IMM 적색)과 성숙 (MAT 청색) moDCs. 데이터는 네 개의 독립적 인 실험으로부터 풀링시켰다 던넷 다중 비교 사후 테스트와 양방향 ANOVA로 분석 하였다 성숙한 moDCs 대 모든 moDCs 사이 + SEM 통계의 차이를 의미한다. IFN-Γ (왼쪽 패널), IL-12p40 (가운데 패널) 및 IL-의 (B) 사이토 카인 분석 10 (오른쪽 창하나 tolerogenic (녹색), 미숙 (빨간색) 또는 성숙 (파란색) moDCs의 수를 증가 공 배양 CD4 + T 세포 사이의 alloreactions에서 상층 액에서 리터). 데이터는 여섯 독립적 인 실험에서 풀링 된되었다; ± SEM (C) CD4 + T 세포와 alloproliferation tolerogenic moDCs의 수가 증가의 존재 하에서 성숙한 moDCs와 공 배양에 의한 조절 T 세포의 확장을 의미한다. 왼쪽 Y 축, CD4 + T 세포 증식의 주파수. 오른쪽 Y 축, CD25 + Foxp3의 높은 증식 성 CD4 + T 세포 상에 게이팅 셀의 주파수. 데이터는 세 개의 독립적 인 실험으로부터 모으고; ± SEM을 던넷 다중 비교 사후 검사로 일방향 ANOVA로 분석 하였다 tolerogenic moDCs 부재 대 존재 간의 통계적 차이를 의미한다. (D) CD4 + T 세포 alloproliferation (왼쪽)와 CD25highFoxP3 + 세포의 주파수 (우) 공동에 의한 tolerogenic moDCs와 문화성숙한 moDCs의 수가 증가가 존재한다. 데이터는 세 개의 독립적 실험으로부터 모으고; 성숙한 moDCs의 부재가 던넷 다중 비교 사후 테스트와 양방향 ANOVA로 분석 하였다 대비 ± SEM에게 존재 사이의 통계적 차이를 의미한다. 10.4049 / jimmunol.1303316 (2015년 6월 1일) :이 수치는 J Immunol 194 (11), 5174-5186, 도이에서 수정되었습니다. 재현 및 면역학의 저작권 허가. 저작권 2015 년 미국 협회 게시, Inc.는 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
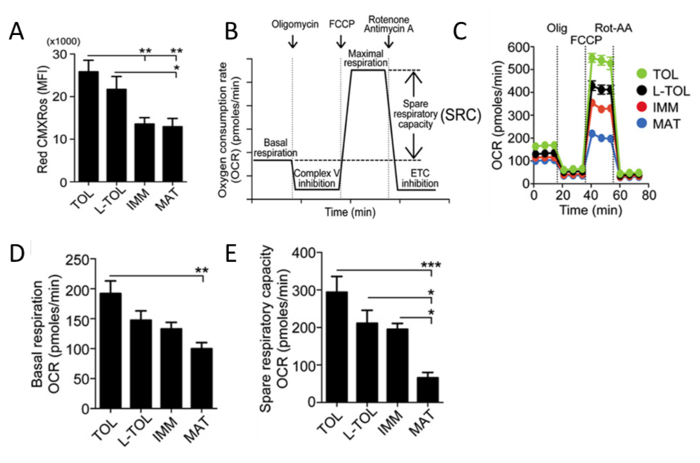
그림 5 : moDCs의 미토콘드리아 활동의 분석. (A) moDCs의 미토콘드리아 막 전위의 레벨 (적색 CMXRos)를 F로 수득낮은 세포 계측 분석. 네 개의 독립적 인 실험의 데이터를 모았다. ± SEM (B) 실시간 미토콘드리아 호흡의 도식 표현을 의미한다. 기초 호흡로부터 oligomycin의 첨가 (단지 V 억제) FCCP (최대 호흡 유도) 및 로테 논 / A 혼합물 antimycin (전자 전달계 [ETC] 억제) 후에 시작 OCR 분석. 미토콘드리아 SRC (최대 호흡에서 차감 최대 기초)는 OCR 곡선에서 파생됩니다. (C) tolerogenic의 미토콘드리아 OCR (pmol의 / 분) (녹색 TOL)의 대표 운동 연구, LPS-tolerogenic (L-TOL, 블랙) , 미숙 (IMM, 적색)과 성숙 (MAT, 파란색) oligomycin의 순차적 인 추가 (OLIG) moDCs 및 기초 호흡, FCCP 및 로테 / A (ROT-AA)를 antimycin. (D) OCR 정량을 사용하여 moDCs ( E는) moDCs의 호흡 용량을 아끼지. 데이터 다섯 독립적 인 실험에서 풀링 하였다. ± SE 평균10.4049 / jimmunol.1303316 (2015년 6월 1일) : M.이 수치는 J Immunol 194 (11), 5174-5186, 도이에서 수정되었습니다. 재현 및 면역학의 저작권 허가. 저작권 2015 년 미국 협회 게시, Inc.는 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
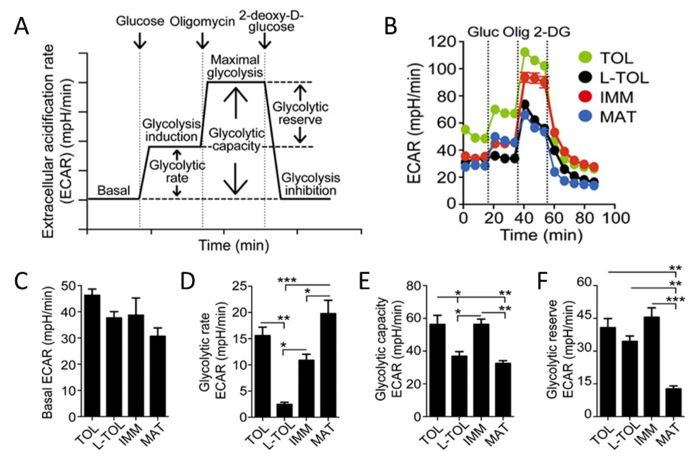
그림 6 : moDCs의 대사 특성. (A) 실시간 당분의 도식 표현. ECAR 분석 (최대 셀 당분 복잡한 V 억제를 유발한다) oligomycin, 세포를 포도당 (당분 유도)에 첨가하여 당이없는 배지에서 배양하는 기저 ECAR에서 시작하고, 마지막으로 2- 데 옥시 D- 포도당(해당 작용 억제). 당분 비율 (기초 ECAR에 대한 감산 해당 작용 유도), 당분 해 능력 (기초의 ECAR에 대한 감산 최대 당분), 및 당분 예약은 (최대 당분이 당분 유도를 위해 감산)을 ECAR 곡선에서 파생됩니다. (B)의 대표 운동 연구 당분에 의존 tolerogenic의 ECAR (MPH / 분) (녹색 TOL), LPS-tolerogenic (블랙 L-TOL), 미숙 (빨간색 IMM), 그리고 성숙 (MAT, 파랑) 포도당 (Gluc)의 순차적 인 추가를 사용하여 moDCs, oligomycin (OLIG), 2-DG. (C) 바 기저 ECAR 수준 (D) 당분 속도 (E) 당분 용량 및 (F) moDCs의 당분 예약을 보여줍니다. 데이터는 세 개의 독립적 인 실험으로부터 모으고; 6 SEM을 의미한다. 통계적인 차이점은 Tukey의 다중 비교 사후 검사로 일방향 ANOVA로 분석 하였다. 10.4049 / jimmunol :이 수치는 J Immunol 194 (11), 5174-5186, 도이에서 수정되었습니다0.1303316 (2015년 6월 1일). 재현 및 면역학의 저작권 허가. 저작권 2015 년 미국 협회 게시, Inc.는 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 논문은 단핵 세포의 미성숙 moDCs, tolerogenic moDCs 성숙한 moDCs에서 생성하는 방법을 설명합니다. 이 프로토콜의 중요한 단계들은 다음 단락에서 자세히 설명한다. 이는 인간 말초 혈액이 프로토콜 및 실시되어야 인간의 혈액 처리를위한 범용주의에서 출발 물질로서 사용하는 것이 중요하다. 그 인간 (24)에 골수 수지상 세포를 유도하기 위해 기술적으로 가능하지만, 말초 혈액에서 발견 된 세포에서 시험 관내 DC 분화 인해 골수에 비해 말초 혈중의 이용에 바람직하다. 말초 혈액에서 발견 된 세포 중에서 CD34 + 조혈 줄기 세포 및 단핵구는 일반적으로 수지상 세포의 시험 관내 생성을 위해 사용된다. 조혈 CD34는 + 세포가 다음 더 랑게르한스로 분화되어 따라 CD1a + 및 CD14 + 서브 세트를 유도하는 GM-CSF와 TNF-α와 배양 줄기세포와 수지상 세포 등을들 수있다. 반면, 단핵구는 미성숙 moDCs를 생성하는 GM-CSF 및 IL-4에서 배양한다. 여러 프로토콜은 말초 혈액에서 단핵 세포의 농축에 사용됩니다; 예를 들어, 플라스틱 접시, 세광과 분리 키트 (25), (26)을 준수하여 준수 프로토콜의 장점은 세포에 최소한의 손상이며, 상대적으로 그러나 순도가 손상 될 수 있습니다 세포 비용 효과적.; 및 추가 단계가 추가 실험을 위해 세포를 분리 할 필요가있다. 세광은 크기 및 밀도에 기초하여 세포를 분리하는 기술이다. 세광의 장점은 세포 생존하고 단핵구 쉽게 추가 실험을 위해 사용될 수있다; 그러나이 기술은 elutriator의 가용성과 유사한 침강 파라미터와 다른 세포 집단 (T 세포 및 단핵 세포)를 분리 할 수 없다는 의해 제한된다. 시판 분리 키트 중 하나를 긍정적으로 선택 자성 마이크로 비드를 이용하거나부정적인 단핵구 인구를 선택합니다. 분리 된 단핵 세포는 (마커 또는 마이크로 비드에 구속되지 않음) "그대로"남아있는 일부 프로토콜은 음의 선택을 사용 단핵구 분리를 향해 바이어스된다. 이 프로토콜에서, CD14 구슬은 PBMC를 긍정적 인 선택 인간 단핵 세포를 사용 하였다. CD14는 세포질 도메인 부족과 CD14에 항체의 결합 신호 전달을 유발하지 않습니다. 또한, 마이크로 비드는 분화 과정을 방해하지 않는, 따라서 문화 후 단핵 세포에서 분리 한 것입니다. 또한, CD14 가장 강하게 단구와 약 호중구 및 일부 골수 수지상 세포, 다른 방법 (17)보다 순도 세포 분리의 결과에 따라서,이 방법을 나타낸다.
혈액 단핵 세포는 수지상 세포 나 대 식세포로 분화 될 수 있으며, 단핵 세포의 운명은 크게 사이토 카인 환경에 따라 달라집니다. 본 논문에서는 moDCs는 (GM을 과립구 - 대 식세포 콜로니 - 자극 인자를 첨가함으로써 생성된다-CSF) 인간 말초 혈액 단핵 세포에 인터루킨 4 (IL-4). GM-CSF는 단핵구 생존 및 IL-4 마크로파지 분화 억제 활성을 나타낸다 필요; 및 단핵구에 GM-SCSF 및 IL-4의 조합 또한 개별 사이토킨 27 비교 미성숙 moDCs 높은 백분율을 얻었다. 말초 혈 단핵구 28, 29, 30, 종양 괴사 인자 알파 (TNF-α), 인터페론 알파 (IFN-α) 및 인터루킨 13 (IL-13)을 첨가하여 moDCs를 생성하는 다른 프로토콜들이있다. GM-CSF와 IL-4의 결합은 이제 면역 원성 또는 tolerogenic moDCs로 분화하고받은 Th1, TH2 또는 Th17 홍보 moDCs에 편광 플라스틱 미성숙 수지상 세포를 생성하는 허용 프로토콜을 1990 년대에 최적화되었다.
미성숙 moDCs 비타민 D3와 덱사 메사 존의 첨가에 의해 tolerogenic moDCs로 분화된다. 예를 들어 tolerogenic의 수지상 세포를 생성하는 여러 가지 프로토콜을 통해있다핵 인자 - 카파 B (NF-kB) 억제, β 카테닌의 활성 비타민 D3, 덱사메타손 및 라파 마이신 31, 32, 33, 34, 35, 9, 36, 37. 형 비타민 D3와 덱사 메사 존 모두 수지상 개별 약물을 사용하는 경우보다 더 큰 alloproliferation 억제 비타민 D3와 덱사 메사 존의 결과의 조합에 tolerogenic 효과를 유도하는 것으로보고되었지만. 따라서 tolerogenic 수지상 세포의 생성을위한 기존의 프로토콜은 비타민 D3와 덱사 메사 존의 조합으로 개질 하였다. 이 방법은 현재 치료 유틸리티 인간 tolerogenic 수지상의 모델로 인정되고있다. 재구성 비타민 D3 및 덱사메타손 짧은 수명을 가지고주의하는 것이 중요하다.
이 프로토콜에서, 리포 다당류 (LPS)는 DC 성숙 유도제로서 첨가 하였다. 미성숙 moDCs은 염증성 칵테일을 사용하여 성숙을 유도 할 수있다 :(TNF-α), 인터루킨 1 베타 (IL-1β), 인터루킨 6 (IL-6) 및 프로스타글란딘 E2) 또는 전 염증성 사이토 카인 (TNF-α 및 인터페론 감마 (IFN-Γ)). 염증성 칵테일 높은 공동 자극과 이동성 기능을 가진 성숙한 moDCs를 생성하지만 그들은 IL-12 (38)의 상대적으로 낮은 수준을 생산하고 있습니다. TNF-α 또는 IFN-Γ 단독 안정한 표현형 돌기 (39)를 유도 할 수 없다. LPS는 수신자 같은 수용체 4 (TLR4)를 자극 DC 성숙을 유도하는 NF-kB와 미토 겐 활성화 단백질 키나아제 (MAPKs)의 활성화를 매개한다. LPS에 의해 유도 DC 성숙은 DC 성숙 마커 (CD83, CD86, HLA-DR)의 업 규제를 보여주고 또한 IL-12p70의 생산되었다. 또한,이 단계는 또한 임상 암 백신 성숙한 수지상 세포를 제조 TLR3 작용제와 LPS 페어링하도록 변형 될 수있다. 본 논문에서는 tolerogenic 수지상 세포는 LPS 처리에 따라 성숙에 강한 것으로 표시됩니다. 이 DC가 면역 원성이 아니며 relea을하지 않는 것처럼 세미 - 성숙그 자체로는 염증성 사이토 카인 (40).
이 프로토콜의 제한은 분화 과정에서 거짓말. 이 과정은 높은 처리량 분석에 적용 할 수있는 어려움을 포즈 주 7 일 0 8 일이 소요됩니다. 프로토콜에서의 수정은 분화 과정을 단축 아직 다른 상태에서 실행 가능한 DC가 높은 숫자를 산출 할 필요가있다. 둘째, DC가이 프로토콜의 사이토 카인의 첨가에 의해 생성되고 이러한 사이토 카인은 오랜 기간 동안 DC 인구를 유지하지 않습니다. 또한, 사이토 카인 농도로 생체 내에서보다 훨씬 더 사용되며 생체 내 수지상 세포에 생리 학적으로 동일하지 않은 경로의 바이어스 개발 될 수 있습니다. DC 전구체의 시험 관내 배양 물, 예를 들어 생체 내에서 통상 41 DC 분화 필수적인 사이토킨 아니다 GM-CSF에 반응하는 것으로 나타났다. 그럼에도 불구하고, 사이토 카인의 자극은 유전자에 유용한 방법이 될 수 있습니다실험에 대한 시험 관내에서 DC의 높은 숫자를 평가. 이러한 면역 형광 염색 등의 분석이 프로토콜에서 발생하는 이러한 세포를 대상 유동 세포 계측법 할 수있는 능력은,여보세요 반응 연구 및 대사 연구는이 방법의 유용성을 증가시킨다. 이 시험관의 DC는 생체 내 수지상의 희귀 번호와 함께 할 이전에 어려운 DC 개발, 성숙과 항원 제시의 지식을 향상시킬 수있는 좋은 모델이 될.
허용 오차에 비해 면역 면역을 조절하는 DC의 능력은 그들에게 암과자가 면역 질환 42, 43, 44, 45에 대한 치료제의 매력적인 후보를합니다. 이 프로토콜에서 발생하는 면역 원성 수지상은 감염성 질환 및 종양에 대한 백신 접종의 효능을 향상시키기 위해 사용될 수있다; tolerogenic 수지상 원치 않는 T 세포 반응을 제어하고 다음의 이식 거부를 방지하는데 사용될 수있다. 복잡한면역 관용의 균형은 DC 분화 상태에 상당히 의존한다. DC 차별화 여러 신호 전달 경로 및 신진 대사 운명의 적용을받습니다 조정 된 셀룰러 프로그램입니다. DC의 다른 차별화 상태는 생체 에너지 및 생합성의 요구에 차이가; 상태를 휴식에 DC가 비교 예를 들어, 활성화 된 수지상 세포 생존 및 마이그레이션을위한 중요한 더 많은 에너지 대사 적응을 필요로한다. 이것은 비타민 D3, 덱사메타손 및 라파 마이신이 tolerogenic 수지상 세포를 유도하는 능력에 대해 알려진 것이 중요하다 DC 대사에 영향을 설명 하였다. 본 논문에서는 서로 다른 분화 상태에서 moDCs의 에너지 대사는 세포 외 플럭스 분석기를 사용하는 것을 특징으로하고 tolerogenic moDCs 가장 높은 신진 대사 소성 및 LPS 유발 성숙이 가소성을 감소 보였다. 이화 대사에 영향을 tolerogenic DC (46)을 기능하는 동안 근육 대사는 DC의 성숙을 지원합니다. 수지상이 프로토콜에서 생성 된 치료제에 내성 및 허용 오차를 수정하는 열쇠를 쥐고 수지상 세포의 신진 대사 상태를 변경 여부를 평가하는 데 사용할 수 있습니다. 결론적으로, 우리는 DC가 '면역 기능을 연구하는데 중요한 미성숙, tolerogenic 성숙 moDCs의 생성을위한 프로토콜을 제시했다.
공개
Open access fees for this article were provided by, Agilent Technologies.
감사의 말
이 작품은 과학 기술 (JEC에) Reasearch 핵심 자금 조달을 위해 기관에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Ficoll | GE Healthcare | 17-1440-03 | PBMC isolation |
| Syringe | Becton, Dickinson | 302832 | PBMC isolation |
| 1.5 ml centrifuge tube | Axygen | MCT-150-C | PBMC isolation |
| 15 ml falcon tube | Falcon | 352096 | PBMC isolation |
| 50 ml falcon tube | Falcon | 352070 | PBMC isolation |
| Centrifuge | Eppendorf | 5810R | PBMC isolation |
| 0.2 µm filter | Sartorius stedim biotech | 17597 | PBMC isolation |
| MACs kit | Miltenyi biotec | 130-042-201 | Monocyte enrichment |
| MiniMACS Separator | Miltenyi biotec | 130-042-102 | Monocyte enrichment |
| Cell culture grade water | Invitrogen, Life Technologies | Cell culture | |
| RPMI | Gibco, Life Technologies | 11875-093 | Cell culture |
| FBS | Hyclone | SH30070103 | Cell culture |
| Penicillin-streptomycin | Gibco, Life Technologies | 15140 | Cell culture |
| Phosphate Buffered Saline | Gibco, Life Technologies | 10010-031 | Cell culture |
| NEAA | Gibco, Life Technologies | 11140-040 | Cell culture |
| EDTA | Gibco, Life Technologies | 15575 | Cell culture |
| HEPES | Gibco, Life Technologies | 15630-080 | Cell culture |
| Sodium Pyruvate | Gibco, Life Technologies | 11360-070 | Cell culture |
| GM-CSF | Miltenyi biotec | 130-093-868 | Cell culture |
| IL-4 | Miltenyi biotec | 130-093-924 | Cell culture |
| Vitamin D3 | Sigma | D1530 | Cell culture |
| Dexamethasone | Sigma | D2915 | Cell culture |
| LPS | Sigma | l2755 | Cell culture |
| trypan blue | Gibco, Life Technologies | 15250-061 | Cell culture |
| PerCP-conjugated HLADR | BioLegend | 307628 | Cytometry |
| PE-conjugated CD80 | BD Biosciences | 557227 | Cytometry |
| PE-conjugated CD83 | BD Biosciences | 556855 | Cytometry |
| PE-conjugated CD86 | BD Biosciences | 555665 | Cytometry |
| APC-conjugated CD11c | BD Biosciences | 340544 | Cytometry |
| PE-conjugated CD14 | Miltenyi biotec | 130-091-242 | Cytometry |
| PE-conjugated BDCA3 | Miltenyi biotec | 130-090-514 | Cytometry |
| APC-conjugated ILT3 | eBioscience | 12-5139-73 | Cytometry |
| Isotype matched PerCP- conjugated Mab | BioLegend | 400250 | Cytometry |
| Isotype matched PE- conjugated Mab | Miltenyi biotec | 130-091-835 | Cytometry |
| Isotype matched APC- conjugated Mab | Miltenyi biotec | 130-091-836 | Cytometry |
| BD LSR II Flow Cytometer | BD Pharmingen | BD LSR II | Cytometry |
| cytofix/cytoperm | BD Biosciences | 554714 | Cytometry |
| APC/CY7-conjugated CD25 | BD pharmingen | 557753 | Cytometry |
| PE/CY7-conjugated CD4 | Biolegend | 300512 | Cytometry |
| PerCP-conjugated CD3 | Biolegend | 300428 | Cytometry |
| EasySep Human CD4+ T cell enrichment kit | STEMCELL Technologies | 19052 | Alloreaction study |
| EasySep magnet | STEMCELL Technologies | 18000 | Alloreaction study |
| Cell Trace CFSE cell proliferation kit | Molecular probes | C34554 | Alloreaction study |
| HBSS | Gibco, Life Technologies | 14025092 | Alloreaction study |
| Alexa Fluor 647-conjugated FoxP3 | BD Biosciences | 560889 | |
| Milliplex MAP Human Cytokine/Chemokine magnetic bead panel | Millipore | HCYTOMAG-60K | Cytokine analysis |
| 5 ml Polystyrene tube | Falcon | 352058 | Cytokine analysis |
| Luminex Sheath Fluid | Millipore | SHEATHFLUID | Cytokine analysis |
| FLEXMAP 3D system with xPONENT software | Luminex Corporation | FLEXMAP 3D | Cytokine analysis |
| MitoTracker Red CMXRos | Cell Signalling | 9082 | Mitochondrial activity |
| DMSO | Sigma Aldrich | D2650 | Mitochondrial activity |
| XF Assay Medium (OCR) | Seahorse Bioscience | 102352-000 | Metabolic adaptation |
| Glucose | Sigma Aldrich | G8769 | Metabolic adaptation |
| XF Base Medium (ECAR) | Seahorse Bioscience | 102353-100 | Metabolic adaptation |
| L-glutamine | Gibco, Life Technologies | 25030-081 | Metabolic adaptation |
| Calibrant | Seahorse Bioscience | 100840-000 | Metabolic adaptation |
| XF Cell Mito Stress kit | Seahorse Bioscience | 103015-100 | Metabolic adaptation |
| XF Glycolysis Stress kit | Seahorse Bioscience | 103020-100 | Metabolic adaptation |
| Seahorse | Seahorse Bioscience | XFe96 | Metabolic adaptation |
참고문헌
- Jolles, S. Paul Langerhans. J Clin Pathol. 55 (4), 243-24 (2002).
- Steinman, R. M., Cohn, Z. A. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J Exp Med. 137 (5), 1142-1162 (1973).
- Steinman, R. M., Swanson, J. The endocytic activity of dendritic cells. J Exp Med. 182 (2), 283-288 (1995).
- Hemmi, H., Akira, S. TLR signalling and the function of dendritic cells. Chem Immunol Allergy. 86, 120-135 (2005).
- Mueller, D. L. Mechanisms maintaining peripheral tolerance. Nat Immunol. 11 (1), 21-27 (2010).
- Inaba, K., et al. Efficient presentation of phagocytosed cellular fragments on the major histocompatibility complex class II products of dendritic cells. J Exp Med. 188 (11), 2163-2173 (1998).
- Caux, C., et al. B70/B7-2 is identical to CD86 and is the major functional ligand for CD28 expressed on human dendritic cells. J Exp Med. 180 (5), 1841-1847 (1994).
- Paavonen, J., Lehtinen, M. Interactions between human papillomavirus and other sexually transmitted agents in the etiology of cervical cancer. Curr Opin Infect Dis. 12 (1), 67-71 (1999).
- Ohtani, M., et al. Mammalian target of rapamycin and glycogen synthase kinase 3 differentially regulate lipopolysaccharide-induced interleukin-12 production in dendritic cells. Blood. 112 (3), 635-643 (2008).
- Wilde, B., et al. Dendritic cells in renal biopsies of patients with ANCA-associated vasculitis. Nephrol Dial Transplant. 24 (7), 2151-2156 (2009).
- Al-Hello, H., et al. An enterovirus strain isolated from diabetic child belongs to a genetic subcluster of echovirus 11, but is also neutralised with monotypic antisera to coxsackievirus A9. J Gen Virol. 89, 1949-1959 (2008).
- Ziegler-Heitbrock, L., et al. Nomenclature of monocytes and dendritic cells in blood. Blood. 116 (16), 74-80 (2010).
- Osugi, Y., Vuckovic, S., Hart, D. N. Myeloid blood CD11c(+) dendritic cells and monocyte-derived dendritic cells differ in their ability to stimulate T lymphocytes. Blood. 100 (8), 2858-2866 (2002).
- Reynolds, G., Haniffa, M. Human and Mouse Mononuclear Phagocyte Networks: A Tale of Two Species. Front Immunol. 6, (2015).
- Jefford, M., et al. Functional comparison of DCs generated in vivo with Flt3 ligand or in vitro from blood monocytes: differential regulation of function by specific classes of physiologic stimuli. Blood. 102 (5), 1753-1763 (2003).
- Menck, K., et al. Isolation of human monocytes by double gradient centrifugation and their differentiation to macrophages in teflon-coated cell culture bags. J Vis Exp. (91), (2014).
- Zhou, L., et al. Impact of human granulocyte and monocyte isolation procedures on functional studies. Clin Vaccine Immunol. 19 (7), 1065-1074 (2012).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Faresjo, M. A useful guide for analysis of immune markers by fluorochrome (Luminex) technique. Methods Mol Biol. 1172, 87-96 (2014).
- Baker, H. N., Murphy, R., Lopez, E., Garcia, C. Conversion of a capture ELISA to a Luminex xMAP assay using a multiplex antibody screening method. J Vis Exp. (65), (2012).
- Defawe, O. D., et al. Optimization and qualification of a multiplex bead array to assess cytokine and chemokine production by vaccine-specific cells. J Immunol Methods. 382 (1-2), 117-128 (2012).
- Nicholls, D. G., et al. Bioenergetic profile experiment using C2C12 myoblast cells. J Vis Exp. (46), (2010).
- Chunharas, A., Pabunruang, W., Hongeng, S. Congenital self-healing Langerhans cell histiocytosis with pulmonary involvement: spontaneous regression. J Med Assoc Thai. 85, 1309-1313 (2002).
- Bai, L., Feuerer, M., Beckhove, P., Umansky, V., Schirrmacher, V. Generation of dendritic cells from human bone marrow mononuclear cells: advantages for clinical application in comparison to peripheral blood monocyte derived cells. Int J Oncol. 20 (2), 247-253 (2002).
- Felzmann, T., et al. Monocyte enrichment from leukapharesis products for the generation of DCs by plastic adherence, or by positive or negative selection. Cytotherapy. 5 (5), 391-398 (2003).
- Berger, T. G., et al. Efficient elutriation of monocytes within a closed system (Elutra) for clinical-scale generation of dendritic cells. J Immunol Methods. 298 (1-2), 1-2 (2005).
- Sallusto, F., Lanzavecchia, A. Efficient presentation of soluble antigen by cultured human dendritic cells is maintained by granulocyte/macrophage colony-stimulating factor plus interleukin 4 and downregulated by tumor necrosis factor alpha. J Exp Med. 179 (4), 1109-1118 (1994).
- Pace, S. T., Gelman, B. B., Wong, B. R. Primary Langerhans cell histiocytosis of the lacrimal gland in an adult. Can J Ophthalmol. 50 (3), 40-43 (2015).
- Ravanfar, P., Wallace, J. S., Pace, N. C. Diaper dermatitis: a review and update. Curr Opin Pediatr. 24 (4), 472-479 (2012).
- Gebhardt, C., et al. A case of cutaneous Rosai-Dorfman disease refractory to imatinib therapy. Arch Dermatol. 145 (5), 571-574 (2009).
- Vazquez, P., Robles, A. M., de Pablo, F., Hernandez-Sanchez, C. Non-neural tyrosine hydroxylase, via modulation of endocrine pancreatic precursors, is required for normal development of beta cells in the mouse pancreas. Diabetologia. 57 (11), 2339-2347 (2014).
- Pellacani, G., et al. Distinct melanoma types based on reflectance confocal microscopy. Exp Dermatol. 23 (6), 414-418 (2014).
- Shi, Y., et al. Hepatic involvement of Langerhans cell histiocytosis in children--imaging findings of computed tomography, magnetic resonance imaging and magnetic resonance cholangiopancreatography. Pediatr Radiol. 44 (6), 713-718 (2014).
- Haustein, M., Terai, N., Pablik, J., Pillunat, L. E., Sommer, F. Therapy-resistant swelling of the upper eyelid in childhood. Ophthalmologe. 111 (1), 53-57 (2014).
- Haidinger, M., et al. A versatile role of mammalian target of rapamycin in human dendritic cell function and differentiation. J Immunol. 185 (7), 3919-3931 (2010).
- Macedo, C., Turquist, H., Metes, D., Thomson, A. W. Immunoregulatory properties of rapamycin-conditioned monocyte-derived dendritic cells and their role in transplantation. Transplant Res. 1 (1), 16 (2012).
- Fischer, R., Turnquist, H. R., Taner, T., Thomson, A. W. Use of rapamycin in the induction of tolerogenic dendritic cells. Handb Exp Pharmacol. 188 (188), 215-232 (2009).
- Nicolette, C. A., et al. Dendritic cells for active immunotherapy: optimizing design and manufacture in order to develop commercially and clinically viable products. Vaccine. 25, 47-60 (2007).
- Han, T. H., et al. Evaluation of 3 clinical dendritic cell maturation protocols containing lipopolysaccharide and interferon-gamma. J Immunother. 32 (4), 399-407 (2009).
- Paananen, A., et al. Molecular and biological analysis of echovirus 9 strain isolated from a diabetic child. J Med Virol. 69 (4), 529-537 (2003).
- HC, O. N., Wilson, H. L. Limitations with in vitro production of dendritic cells using cytokines. J Leukoc Biol. 75 (4), 600-603 (2004).
- Mest, H. J., et al. Glucose-induced insulin secretion is potentiated by a new imidazoline compound. Naunyn Schmiedebergs Arch Pharmacol. 364 (1), 47-52 (2001).
- Puc, J., et al. Mitochondrial activity after cold preservation of pancreatic islet cells treated with pefloxacin (PFX). Ann Transplant. 3 (1), 38-41 (1998).
- Alarcon, C., Serna, J., Perez-Villamil, B., de Pablo, F. Synthesis and differentially regulated processing of proinsulin in developing chick pancreas, liver and neuroretina. FEBS Letters. 436 (3), 361-366 (1998).
- Jekunen, A. P., Kairemo, K. J., Paavonen, T. Imaging of Hand-Schuller-Christian syndrome by a monoclonal antibody. Clin Nucl Med. 22 (11), 771-774 (1997).
- Pearce, E. J., Everts, B. Dendritic cell metabolism. Nat Rev Immunol. 15 (1), 18-29 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유