Method Article
代謝表現型が異なる未熟、熟女と寛容原性樹状細胞の生成
要約
Immature dendritic cells can be selectively differentiated into tolerogenic or mature dendritic cells to regulate the balance between immunity and tolerance. This work presents a means to generate from immature monocyte derived dendritic cells (moDCs), in vitro tolerogenic and mature moDCs that differ in metabolic phenotypes.
要約
抗原非特異的な自然免疫系および抗原特異的適応免疫系との間の複雑な相互作用から免疫応答結果。免疫系は、自己分子に対する寛容性を維持し、病原体に迅速に反応するで一定のバランスです。樹状細胞(DC)は、適応免疫系に自然免疫系をリンクし、自己と非自己の間の適応応答のバランスを取る強力なプロフェッショナル抗原提示細胞です。成熟信号に応じて、未成熟樹状細胞は、選択的に、免疫原性または寛容原性樹状細胞への分化を刺激することができます。免疫原性樹状細胞は、クローン増殖のための抗原特異的T細胞に増殖シグナルを提供します。寛容原性樹状細胞は、抗原特異的T細胞の欠失又は調節性T細胞のクローン性増殖によって耐性を調節します。これによりユニークなプロパティに、樹状細胞は非常に癌や自己免疫DISEのための治療薬として後に求められていますアーゼ。樹状細胞は、インビトロで特異的抗原を装填し、免疫原性および免疫寛容の両方特異的免疫応答をマウントするために人体に注入することができます。この作品は、表面マーカーの発現、機能および代謝表現型が異なる単球、未成熟単球由来樹状細胞(MoDCを)、寛容原性と成熟のMoDCから、in vitroで生成するための手段を提供します。
概要
ヨレス1で参照されるとプロフェッショナル抗原提示細胞2としてそれらを認識し、1973年にラルフ・スタインマンとZanvilコーンによって特徴付けられるように、DCは、最初に、19世紀後半にポールランゲルハンス(ランゲルハンス細胞)によって記述されました。 DCは(ランゲルハンス細胞として存在する)、皮膚などの外部環境にして有効鼻、肺、胃や腸のライニングにさらされている組織に特に豊富で、末梢血中と身体のほとんどの組織で発見されていますそれらは、外因性抗原に遭遇します。未成熟DCは、T細胞3を刺激するエンドサイトーシス能力が、比較的低い能力を有しています。未成熟DCは、様々なパターン認識受容体(PRR)がキャプチャ病原体関連分子パターン(PAMP)または損傷関連分子パターン(DAMPS)を4発現します。自己分子がT細胞unresponsiveneもたらしながら、活性化の危険信号は、免疫原性DCの成熟に向かっを駆動しますssのアポトーシス5。免疫原性DCはMHC分子および共刺激表面分子のアップレギュレーション及びナイーブT細胞の能力6,7 によって特徴付けられます。
未成熟DCはまた、ビタミンD3代謝物1aを、25(O)2 D 3と特定の免疫抑制剤、インターロイキン10(IL-10)のように、デキサメタゾン及び8-9ラパマイシンに応答したTreg誘導または寛容原性状態に向かって成熟することができます。寛容誘導性DCは表面受容体およびリガンドを含む免疫受容体チロシンベースの阻害モチーフ(のITIM)の発現によって特徴付けられます。 ILTファミリーメンバーを含むのITIMのシグナル伝達、寛容原性DCにおけるILT3とILT4はalloproliferationを阻害したFoxp3 + Treg細胞の拡大10,11を駆動します 。寛容原性DCのこれらのユニークな特性は、in vivoでの彼らの深い効力、すなわち移植同種移植片に耐久性の寛容を誘導する能力とsupprにつながります自己免疫疾患の発症をESS。寛容原性DCは、免疫活性化の阻害において機能成熟偏DCのサブタイプとして、従って見ることができます。
形質DCと骨髄のDC 12:現在、ヒト末梢血中の樹状細胞の二つの一般的なサブセットがあります。循環DCは、ヒト血液中の白血球の2%未満になるまれであり、これは彼らの免疫調節機能を研究するためのDCの適切な数の分離に困難をもたらします。この問題を克服するために、単球分化したDCは、樹状細胞の機能の研究のためのin vitroモデルとして使用されています。これらのインビトロ DCは、in vivoでのDCと比較して類似の受容体との機能を有しています。 in vivoでの DCのおよびin vitro生成単球由来DC(MoDCを) 内の詳細な比較は、他の研究室13、14、15によって調査されています。それはまたのMoDCとCDと報告されています図1c + DCは、抗原提示及びT細胞機能15の誘導において同等でした。
本稿では、末梢血単核球から未成熟したMoDCを生成し、その後、免疫原性と寛容誘導性樹状細胞にそれらを識別する方法について説明します。これらの単球由来樹状細胞(MoDCを)は、それらの表面マーカー、サイトカインプロファイル、免疫機能および代謝状態によって特徴付けられます。免疫原性および寛容原性樹状細胞は、同種異系T細胞又は調節性T細胞のいずれかの展開をもたらす別のサイトカインを産生します。本論文では、サイトカインプロファイリングは、多重化技術を用いたシステムを用いて行われます。細胞の増殖培地は、抗体固定化色分けされたビーズと共にインキュベートし、コンパクトな分析装置に読み込まれます。 DCの代謝状態は酸素消費速度、細胞呼吸の指標、及び解糖反映する細胞外酸性化速度を測定し、細胞外フラックス分析器を用いて分析します樹状細胞内の磁束。これらの生体エネルギー率の測定は、樹状細胞の発達と機能に不可欠である細胞代謝の変化を追跡する手段を提供します。
プロトコル
この研究は施設内倫理委員会(NUS-IRB 10〜250)によって承認されました。
末梢血単核細胞(PBMC)の単離1。
- 試薬の調製
- PBS / EDTA調製:リン酸緩衝生理食塩水(PBS)を2 mMのエチレンジアミン四酢酸(EDTA)で補います。 0.2μmのフィルターを通して濾過することにより、このソリューションを滅菌します。 4℃でPBS / EDTAを格納するために注意し、使用前に室温に温めます。
- 染色バッファを準備し、2%ウシ胎児血清(FBS)を含むリン酸緩衝生理食塩水(PBS)サプリメント、10mMの4-(2-ヒドロキシエチル)-1-ピペラジンエタンスルホン酸(HEPES)、および2mMエチレンジアミン四酢酸(EDTA)。 0.2μmのフィルターを通して濾過することにより、このソリューションを滅菌します。
- ブラッドコーンから血液を採取
注:血液コーンプレート後に採取白血球成分を含みます病院からletpheresis。血液は、ヘパリンまたはEDTAチューブに回収された場合、1にPBSで血液を希釈:1比および1.3に進みます。バフィーコートを受信した場合、1にPBSでバフィーコートを希釈:2の比率と1.3に進みます。- 血液を50 mlチューブに流出することを可能にする円錐形の2つの端部を切断します。コーンは、通常、血液の10ミリリットルが含まれていることに注意してください。
- コーンを洗浄し、50 mlチューブに収集するために、PBS / EDTAの30ミリリットルを含む平滑末端注射器を使用してください。
- 80ミリリットルの最終容量までさらにPBS / EDTAで血液を希釈します。
- 密度遠心分離 16 によるPBMCの単離
- アリコート15ミリリットル4新しい50 mlチューブにフィコールそれぞれ。
- フィコール層の上に希釈血液の20ミリリットルを追加するために25ミリリットルに血清学的ピペットを使用してください。 45角度で50mlのチューブを保持し、相間を乱さないように世話をするために注意してください。
- 30分、20°Cのためにブレーキなしで805×gでチューブを遠心。
- 削除します血漿層とちょうどパスツールピペットでプラズマ層の下に横たわっているPBMCのリングを収集します。 2 50ミリリットルチューブにPBMCの4つのチューブを兼ね備えています。 PBMCを、以下の透明層の収集を回避することができてください。
- 10分、20°Cのためにブレーキ付き548×gでのPBMCのチューブと遠心分離機あたり50 mlの最終体積にPBS / EDTAを追加します。
- 染色緩衝液の25ミリリットルと各チューブ内の上清を吸引し、ペレットを再懸濁し、1 50mlのチューブにまとめます。
- 5分、4°C用ブレーキ付き367×gで遠心分離します。
- 染色緩衝液の10ミリリットルで上清を吸引し、ペレットを再懸濁し。
磁気分離17 2.単球濃縮
- 細胞数を決定します
- PBMC細胞懸濁液20μLを取り、サイトメーター使用して、生細胞の数をカウントするためにトリパンブルーを20μlと混合。
- ブレーキ付き367×gで遠心し細胞懸濁液10分、4°Cのために。
- 染色緩衝液80μlのあたり10 7細胞の濃度に完全に上清を吸引し、再懸濁細胞ペレット。
- 磁気標識
- 、10 7個の細胞あたりのCD14マイクロビーズの20μl加えよく混ぜると2で15分間インキュベート- 8°C。
- 10分間ブレーキ付き367×gで10 7細胞および遠心分離、4°Cあたりの染色緩衝液の1ミリリットルを追加することによって、細胞を洗浄。
- 完全に上清を吸引し、染色緩衝液50μlあたり10 7細胞の濃度で再懸濁細胞ペレット。
- 磁気分離
- 2×10 8の全細胞の最大のための中型の列を使用します。
注:全細胞の数とデータシートで推奨されるCD14 +細胞の数に応じて適切な列と区切り文字を選択してください。 - 磁場Oで列を配置faの適切なセパレータと染色緩衝液500μlですすぐことにより、カラムを準備します。
- カラムにピペットで細胞懸濁液と15mlチューブにカラムを通過する非標識細胞を収集します。
- 列の下に新しい15ミリリットルチューブを交換し、染色緩衝液500μlでカラム3回洗浄します。コラムリザーバは洗浄の間に新たな染色バッファーを追加する前に空であることを確認してください。
- セパレーターから列を削除し、新鮮な15mlチューブの上に置きます。
- ピペットカラムに染色緩衝液1ml。すぐにしっかりとカラムに(キットで提供)プランジャーを押すことによって、磁気標識細胞を洗い流します。
- 繰り返しは、CD14 +細胞の純度を高めるために新しいカラム上での溶出画分を使用して、2.3.6に2.3.2を繰り返します。ビーズがステップ3.2の間に文化の中で自動的に細胞から放出されることに注意してください。
- 2×10 8の全細胞の最大のための中型の列を使用します。
別のアクティベーションSへの樹状細胞の分化3.tates
- 試薬の調製(エンドトキシンレベルは、すべての試薬 で0.1 EU / ml未満である必要があります)
- 細胞培養培地を準備する:RPMI 1640、10%ウシ胎児血清(FBS)、1%非必須アミノ酸(NEAA)および0.05 mMの2-メルカプトエタノール(2ME)を補充しました。 0.2μmのフィルターを通して濾過することにより、このソリューションを滅菌します。
- サイトカインの準備:0.25ミリグラム/無菌条件下でそれぞれmlの濃度に細胞培養グレードの水中でIL-4およびGM-CSFを再構成します。 -80℃で200μlのマイクロ遠心チューブとストアにアリコートサイトカイン。
- ビタミンD3の株式を準備します。無菌条件下で100 mMの濃度に細胞培養グレードの水にビタミンD3を再構成。一定分量のビタミンD3、-20℃で1.5 mlマイクロチューブやストアに。
- デキサメタゾンの株式を準備し、無菌条件下で10 mMの濃度に細胞培養グレードの水にデキサメタゾンを再構成します。アリコートdexamet-20℃で1.5 mlマイクロチューブにhasOneのとストア。
- LPSを準備:無菌条件下での1mg / mlの濃度に細胞培養グレードの水中のリポ多糖(LPS)を再構成します。アリコート1.5ミリリットルマイクロ遠心チューブにLPSおよび-20°Cで保存。
- 異なるたMoDCの生成
- シード0.3の濃度でCD14 +単球の4セット- GM-CSFを200 ng / mlで6ウェルプレート中のIL-4の200 ng / mlで用いて補充した細胞培養培地の0.5×10 6 / mlです。これは0日と各6ウェル中の培地の体積で2ミリリットルであることに注意してください。
- 5%CO 2で37℃組織培養インキュベーター中で細胞をインキュベートします。
- 5分、4℃、300×gで4日目と遠心で培養液から培地850μLを削除します。吸引上清および(GM-CSFを200 ng / mlで、およびIL-4の200 ng / mlで)の2倍を含有する細胞培養培地1mlで再懸濁ペレット。バックこの細胞混合物を追加します。文化へ。培地1mlバック培養物に添加した場合の濃度は、GM-CSFおよびIL-4のために加え、その2倍が1倍になるであろう注意。
- 免疫寛容誘発したMoDCを生成するために、5日目のセットのうちの2つにビタミンD3ストックと培地1ml当たりデキサメタゾンストック1μlの1μLを加えます。ビタミンD3の最終濃度は10 nMで100 nmおよびデキサメタゾンであることに注意してください。 GM-CSFおよびIL-4の添加は、5日目には必要とされません。
- 6日目に、すべてのセットにGM-CSFの200 ng / mlでおよびIL-4の200 ng / mlでを追加します。
- 成熟したMoDCを生成するために、6日目でのみ、GM-CSFおよびIL-4で処理されたセットのいずれかにLPS1μg/ mlのを追加します。
- LPS-寛容原性のMoDCを生成するために、6日目での寛容原性のMoDCの1セットにLPSを1μg/ mlのを追加します。
- フローサイトメトリーまたは他の研究のために、PBS、EDTAで培養皿を洗浄することにより7日目のMoDCの異なる種類を収穫。唯一の非接着細胞を採取することに注意してください。注意CD14 + monocからの収率%を取ります未成熟MoDCを、成熟MoDCを、寛容原性のMoDCおよびLPS寛容原性DCのytesは、それぞれ約90%、50%、60%、60%であり、血液ドナー及びFBSロット間で変化します。
4.フローサイトメトリー
- たMoDC上の細胞表面マーカーのキャラクタリゼーション
- ピペッティングにより培養皿から細胞を取り外します。 1.5ミリリットルマイクロチューブに染色緩衝液50μl当たり5×10 5細胞の濃度でPBS / EDTAを再懸濁細胞で細胞を1回洗浄します。
- PerCPを共役HLADR(1:100)で0.5×10 6細胞のアリコートをインキュベートし、PE結合CD80(1:50)、PE結合CD83(1:25)、PE結合CD86(1:50)、APC-共役のCD11c(1時50分)、PE結合CD14(1時50分)およびPE結合BDCA3(1時50分)と4℃で30分間、暗所でAPC結合ILT3(1時25分)。アイソタイプが一致したPerCPをコンジュゲートモノクローナル抗体(1時20)、PE結合モノクローナル抗体(1:11)、APC結合モノクローナル抗体(1:11)ネガティブコントロールとして機能します。
- 18フローサイトメーターを使用して、表面マーカーの発現レベルを検出します。
- たMoDCのミトコンドリア膜電位の分析
- 凍結乾燥レッドCMXRosの50μgのあたりにジメチルスルホキシド(DMSO)の94.1μLを添加することにより、1 mMのレッドクロロ-X-rosamine(CMXRos)のストック溶液を準備します。
- 15 mlのチューブ内で37℃で30分間、ハンクス平衡塩溶液(HBSS)1ml中100 nMの赤CMXRosで2×10 5のMoDCインキュベートします。
- 5分間、室温、300×gで細胞や遠心分離機にPBS / EDTAの2ミリリットルを追加します。 2回繰り返します。上清を吸引し、フローサイトメトリー分析のためにPBS、EDTA、2%FCS300μlの中に再懸濁細胞ペレット。レッドCMXRos信号を分析するために、PEチャンネルを使用するように注意してください。
- T細胞のマーカーの特徴付け
- 1.2×10 6 CFSE標識CD4 + T細胞アロ(から生成された50μlのをインキュベート200)、PE / Cy7の共役CD4(1:400)およびAPC / Cy7の抱合CD25(1:4℃で30分間、暗所で100)PerCPをコンジュゲートCD3(1とステップ5.6)。室温で1時間、暗所でのFoxp3、アレクサフルオロ647(1:50)を用いて、市販のキットを用いて染色T細胞。
5. Alloreaction研究
- 製造業者のプロトコールに従って、凍結乾燥CFSEにDMSO 18μLを添加することによって、カルボキシフルオレセインスクシンイミジルエステル(CFSE)の5mMのストック溶液を調製します。
- PBMCからCD4 + T細胞を精製
- PBMC細胞懸濁液の20μlのを取ることによって細胞数を決定し、サイトメーターを用いて、生細胞の数をカウントするためにトリパンブルーを20μlと混合。
- 10分間ブレーキ付き367×gで、4℃で遠心し細胞懸濁液。
- 完全に上清を吸引し、5ミリリットルpolystyで染色緩衝液の1ミリリットル当たり5×10 7細胞の濃度で再懸濁細胞ペレットルネチューブ。
- 50μl/ mlの細胞にヒトCD4 + T細胞濃縮カクテルを追加します。よく混合し、室温でインキュベート - 10分間(15〜25°C)。
- ボルテックス磁性粒子30秒間そして100μl/ mlの細胞で磁性粒子を追加します。よく混合し、室温で5分間インキュベートします。
- 2.5ミリリットルの全体積に細胞懸濁液に染色バッファーを追加します。 3回 - そっと2をピペッティングによりチューブ内の細胞を混ぜます。磁石にチューブを置き、5分間インキュベートします。
- チューブと反転磁石と新しい5mLのポリスチレンチューブに(T細胞を含む)、懸濁液をデカント。
- 細胞数を決定し、光から保護し、37℃で20分間、1mlのPBSに5μMのCFSEで1.2×10 6 CD4 + T細胞を培養します。
- 細胞に(ステップ3.1.1に従って調製)の細胞培養培地の5倍の染色容積を加え、5分間インキュベートします。
- Centrif75μlの当たり2×10 5の濃度で細胞培養培地中で5分間、4℃、ペレットを再懸濁し、300×gでUGE。
- 0と細胞培養培地の75μLを含む各MODC培養液に2×10 5 CFSE標識CD4 + T細胞の75μlを添加し、2.5×10 3、5×10 3、10×10 3、20×10 3と96ウェルU底プレート中で40×10 3のMoDC。 5%CO 2で37℃組織培養インキュベーター中で6日間培養。
- 5分、4℃、300×gで15ミリリットルチューブと遠心分離機にCD4 + T細胞をピペットにより収穫。サイトカイン分析のために上清を収集し、4℃で5分間、300×gで2 PBS / EDTA mlの遠心分離で細胞ペレットを再懸濁します。
6.サイトカイン分析19
- ステップ5.5で説明したようにalloreaction研究からの上清を収集します。
- ヒトサイトカイン/ Chemokinのための試薬 の調製電子磁気パネル分析
- ビーズの個々のバイアルのための抗体固定化ビーズのボトルを混合の調製のために、1分間ボルテックスを(キットに含まれます)。 (キットに含まれる)ミキシングボトルに各抗体ビーズバイアルから60μlを添加して、ビーズ希釈剤で3ミリリットルの最終容量にもたらす(提供)。
- 品質管理の調製のために、250μlの脱イオン水を用いて品質管理1及び品質管理2(キットに含まれる)を再構成します。
- 洗浄バッファーの調製のために、脱イオン水270ミリリットルで(キットに含まれる)10×洗浄緩衝液の30ミリリットルを希釈します。
- ヒトサイトカインスタンダードの調製のために、万pg / mlでの濃度を得るために、250μlの脱イオン水で(キットに含まれる)は、ヒトサイトカイン標準を再構成します。
- 2000 pg / mlでの作業標準を作るために1.5ミリリットルマイクロ遠心チューブ中(キットで提供される)アッセイ緩衝液200μlに万pg / mlでヒトサイトカインの標準の50μLを追加。 400 pg / mlでの作業標準を作るために1.5ミリリットルマイクロチューブ中(キットで提供される)アッセイ緩衝液200μlに転送2,000 pg / mlでヒトサイトカインの標準50μlの。
- 転送1.5ミリリットルマイクロ遠心チューブ中(キットで提供される)アッセイ緩衝液200μlに400 pg / mlでヒトサイトカインの標準の50μlを80 pg / mlでの作業標準を作ります。転送1.5ミリリットルマイクロ遠心チューブ中(キットで提供される)アッセイ緩衝液200μlに80 pg / mlでヒトサイトカインの標準の50μlを16 pg / mlでの作業標準を作ります。
- 転送3.2 pg / mlでの作業標準を作るために1.5ミリリットルマイクロチューブ中(キットで提供される)アッセイ緩衝液200μlに16 pg / mlでヒトサイトカインの標準50μlの。 0 pg / mlでの作業標準を1.5 mlのマイクロ遠心チューブ内のアッセイ緩衝液のみを200μlのを持っています。
- フィルタの各ウェルにアッセイ緩衝液(提供)の200μLをピペッティングすることにより(キットに含まれる)前の湿式フィルタープレートプレート。室温で10分間プレートシェーカー上にフィルタープレートをシールし、配置します。
- 吸引除去アッセイ緩衝液および適切なウェルに各標準または品質管理の25μlを添加します。
- 背景、規格および対照ウェルに(ステップ3.1.1に従って調製)細胞培養培地25μlのを追加します。
- サンプルウェルに25μLのアッセイ緩衝液を追加し、適切なサンプルウェルにサンプルの25μlを添加します。
- ボルテックス混合ボトル抗体固定化ビーズを含有し、各ウェルに混合ビーズの25μlを添加します。プレートをシールし、4℃で一晩プレートシェーカー上で攪拌しながらインキュベートします。
- 吸引し、流体および洗浄緩衝液200μl/ウェルを添加し、流体を吸引することにより、プレートを2回洗浄します。
- 各ウェルに検出抗体(提供)の25μlのを追加します。密封し、室温で1時間プレートシェーカー上で攪拌しながらインキュベートします。
- ストレプトアビジンフィコエリトリン(プロブ25μlのを追加各ウェルの検出抗体25μlのを含有することにIDED)。密封し、室温で30分間、プレートシェーカー上で攪拌しながらインキュベートします。
- ステップ6.8で説明したように吸引液および洗浄プレート。
- 150μL/ウェルの5分間プレートシェーカー上の全てのウェルを再懸濁ビーズにシース液を追加します。
- 3Dシステム20を使用して、ビーズの蛍光強度を検出します。サンプル21におけるサイトカイン/ケモカインの濃度を計算するための5つのパラメータログロジスティック曲線フィッティング法を用いて、蛍光強度中央値のデータを分析します。
7.リアルタイム酸素消費速度(OCR)および細胞外酸性化率(ECAR)の測定
- 試薬/材料の作製
- OCRの培地を調製:25mMのグルコース及び1mMピルビン酸ナトリウム(pHは7.35)を補充したアッセイ培地。 0.2μmのフィルターを通して濾過することにより、このソリューションを滅菌します。この媒体は広報であることをメモしておいてくださいFBS中の成分が複雑で、葯のロットに1ロットごとに異なるので、FBSを含まないepared。
- ECAR媒体を準備します。培地2 mMのL-グルタミン(pHは7.35)を補ったベース。 0.2μmのフィルターを通して濾過することにより、このソリューションを滅菌します。この媒体は炭酸水素塩、グルコース、ピルビン酸およびFBSなしで調製されていることに注意してください。 FBSは、緩衝能を有しており、ECARの読み取りを妨害することに注意してください。
- OCRの測定のための化合物を調製した:100μMの原液を作成し、作業濃度16μMにOCR培地で希釈するOCR媒体の630μlのオリゴマイシン再懸濁します。 100μMの原液を作成し、作業濃度4.5μMにOCR培地で希釈するOCR媒体の720μlの再懸濁シアン化カルボニル、4-(トリフルオロメトキシ)フェニルヒドラゾン(FCCP)。 50μMストック溶液を作成し、作業濃度10μMのOCR培地で希釈するOCR媒体の540μlのとロテノン/アンチマイシンAを再懸濁します。
- 準備しますECAR測定のための化合物:ECAR培地3mlで再懸濁グルコース100 mMストック溶液を作製し、80 mMの作業濃度に希釈します。 100μMの原液を作成し、作業濃度18 mMのに希釈するECAR媒体の720μlのオリゴマイシン懸濁します。 ECAR培地1.5mlで再懸濁し、2-デオキシ-D-グルコース1,000 mMのストック溶液を作製しました。
- 測定前に無CO 2 1日と37℃でのカートリッジ及び店舗の各ウェルに、較正のピペットで200μlの。
- リアルタイムのOCR測定
- 収穫したMoDCとOCR培地を150μlあたり60×10 3の濃度でOCR媒体でのMoDCの各タイプを再懸濁します。
- シード60×10 3細胞/ウェルのポリ-D-リジンでコーティングした96ウェル平底プレート中で、37℃で1時間、非CO 2インキュベーター中でインキュベートします。 1時間コートにポリ-D-リジンの50 ng / mlでプレートの50μLを使用して洗浄することに注意してください滅菌水。使用前に室温で2時間プレートをぬらさないでください。
- ピペットすべてのウェルについての注入ポートAに25μlのOCR媒体。すべてのウェルのための注入口Bにおけるオリゴマイシンの16μMを含む25μlのOCR媒体。すべてのウェルのための注入口Cと全てのウェルのための注入口D中10mMロテノン/アンチマイシンAを含む25μlのOCR培地(FCCP)の4.5μMを含む25μlのOCR媒体。オリゴマイシンの最終的なウェル濃度が2μMであることに注意してください、FCCPは0.5μMであり、ロテノン/アンチマイシンAは1μMです。
- 細胞外フラックス分析装置にプレートを置き、4つの連続した段階で同時に全てのMoDCとの完全なOCRの研究を実行します。基礎呼吸を、(ポートBから薬物注射後の)ミトコンドリア複合体V阻害、最大呼吸誘導(ポートAからの培地の注射後)(後ポートCから薬物注射)とポートDからの薬物後の電子輸送チェーンの阻害()22。 3 Cがあることにご注意ください注射と測定値の間の6分間隔の間でycles。
- リアルタイムECAR測定
- 収穫したMoDCとECAR培地を150μlあたり60×10 3の濃度でECAR媒体でのMoDCの再懸濁し、各タイプ。
- 種子6×10 4細胞/ウェルのポリ-D-リジンでコーティングした96ウェル平底プレート中で、37℃で1時間、非CO 2インキュベーター中でインキュベートします。
- すべてのウェルのための注入口Aにピペット25μlのECAR媒体。すべてのウェルについての注入ポートB中のグルコースを10mMを含有する25μlのECAR媒体。すべてのウェルのための注入口Cと全てのウェルのための注入口D 1,000 mMの2-デオキシ-D-グルコースを含む25μLOCR媒体にオリゴマイシンの18μMを含む25μlのECAR媒体。注グルコースの最終的なウェル濃度は10μMであることを、オリゴマイシンは、2μMと2-デオキシ-D-グルコースは100mmです。
- 細胞外フラックス分析装置にプレートを置き、実行4つの連続した段階で、同時にすべてのMoDCとの完全なECARの研究:基礎(ポートAからの培地注射後)呼吸、(ポートBから薬物注射後の)解糖誘導、(ポートCから薬物注射後の)最大の解糖誘導および解糖阻害(後ポートD)22からの薬剤。
- テューキーの多重比較事後テストで一方向ANOVAを用いて統計的差異を分析します。
結果
単球の精製と樹状細胞の分化
単球は、CD14 +未成熟樹状細胞を得るために、GM-CSFおよびIL-4の存在下で、完全培地中で正の選択磁気分離( 図1B)および培養(続いて、末梢血( 図1A)の密度遠心分離によりPBMCから精製しました。 図2A)。ビタミンD3とデキサメタゾン後のGM-CSFおよびIL-4の添加は、免疫寛容のMoDC( 図2B)に未熟のMoDCの分化をもたらしました。 LPSは、成熟( 図2D)に対する抵抗性を検証するために、LPSで刺激したのMoDC( 図2C)と免疫寛容誘発したMoDCを成熟する未成熟のMoDCの成熟を 誘導するために追加されました。この研究で使用された血液サンプルは、前の通知で健康なドナーから得ました同意。
MODCキャラクタリゼーション
フローサイトメトリーによってマーカーの特徴付けを表面
DC表面マーカーの分析は、成熟したMoDCは、LPS処理寛容原性のMoDC、寛容原性のMoDCおよび未成熟したMoDC( 図3)に比べて成熟マーカーHLA-DR、CD83およびCD86の最高レベルを発現したことが示されました。これらの結果は、寛容原性のMoDCは、LPS刺激後の未成熟したMoDCに比べて成熟に耐性であったことを実証しました。また、LPS処理寛容原性のMoDCと寛容原性のMoDCは未熟と成熟したMoDCに比べて増加したCD14の発現、BDCA3(CD141)および免疫グロブリン様転写物(ILT)3を表示しました。ここで生成された寛容原性のMoDCは、以前の報告23と一致しています。
のMoDCの機能解析
成熟のために誘発されたMoDCは、免疫原性となり、CD4 + T細胞の増殖を促進するサイトカインを放出します。我々は、共培養したT細胞の増殖を測定することにより、異なるMODC亜型の免疫原性を評価しました。 CD4 + T細胞の低alloproliferation( 図4A)によって示されるように免疫寛容誘発たMoDCは、成熟したMoDCに比べて免疫原性に乏しいました。寛容原性たMoDCは、それらの低いIFN-ΓCD4 + T細胞( 図4B)でalloreaction共培養において、低IL-12p40の、高IL-10サイトカイン産生によって特徴付けられます。さらに、アロ特異的CD4 + T細胞を誘導し、成熟のMoDCの共培養において寛容原性のMoDCの数を増やすとCD25 高のFoxp3 +調節性T細胞( 図4C)の頻度を増加させました。
ミトコンドリア活性の分析赤色CMXRosでのMoDCにミトコンドリア膜電位レベルを分析するためにミトコンドリア活性を反映するために使用されます。寛容原性たMoDCは、他のMODC分化亜型( 図5A)と比較してより高いミトコンドリア活性を有することが観察されました。次に、ミトコンドリアの酸素消費速度(OCR)は、バイオアナライザーを使用して異なるMODCサブタイプのために評価されます。 OCR測定は基礎呼吸、予備の呼吸容量、プロトンリーク非ミトコンドリア呼吸を含むがこれらに限定されない情報を提供する、代謝プロファイルに高解像度の洞察を可能にします。 OCRの測定は、ストレスに応答する細胞の能力を評価する手段を提供します。細胞は、代謝的に連続して三つの異なる化合物を添加することによって摂動されます。最初の注射はオルですATP合成を阻害する、電子伝達系(ETC)の複合体Vを阻害igomycin(ATPカプラー)。このステップは、ATP合成のために消費される酸素の割合とミトコンドリア内膜を横切ってプロトンリークを克服するために消費される酸素の割合を区別します。二回目の注射はせず、ミトコンドリア膜を横切っての代わりに、ミトコンドリア膜電位の崩壊はエネルギーと酸素の急速な消費につながる複合体Vのプロトンチャネルを介して水素イオンを輸送することによって、ATP合成を妨害するFCCP(ETCアクセラレータ)でありますATPの生成。 FCCPの治療は、細胞の予備の呼吸容量を計算するために使用することができます。ストレス条件下での予備呼吸容量のメンテナンスは、細胞の生存に重要です。この能力は、基板の可用性とETC.に関与する酵素の機能的能力など、いくつかの要因によって決定されます3回目の注射は、ロテノン、COMPLの組み合わせです元I阻害剤、およびアンチマイシンA、複合体III阻害剤。この組み合わせは、ミトコンドリア呼吸をシャットダウンし、OCRを損なうミトコンドリアの機能( 図5C)の結果として減少することが観察されます。寛容原性たMoDCは、成熟したMoDC( 図5D)よりも高い基礎OCRレベルを表示しました。また、寛容原性は、LPS-寛容原性、および未成熟MoDCを成熟したMoDC( 図5(e))と比較して予備の呼吸容量の増加を示しました。
たMoDCの代謝特性評価
乳酸及びプロトンが解糖の間に細胞から放出されるため、我々は、細胞外酸性化(ECAR)( 図6B)の速度のリアルタイム分析を行うことによりたMoDCの解糖活性を分析しました。グルコースの存在下では、全てのMoDCの解糖速度がで、基礎段階と比較して増加しました未熟たMoDC( 図6D)よりも高い解糖速度を示す成熟したMoDC。寛容原性および未熟たMoDCは、LPS処理のMoDC( 図6B)と比較して(グルコースの存在下でオリゴマイシンによって誘発される)、より高い最大の解糖を示しました。寛容原性および未成熟のMoDCの解糖能力は、成熟したMoDC( 図6E)より高かったです。その高い解糖速度とは対照的に、解糖準備金は、成熟したMoDC( 図 6F)で最も低かったです。
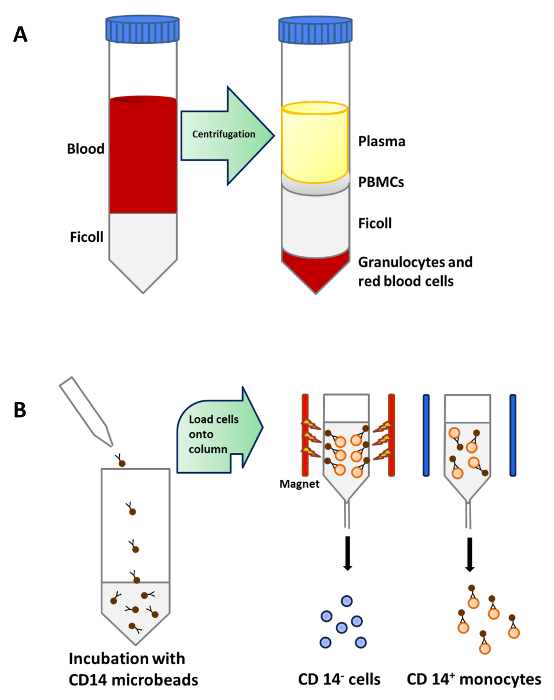
図1:末梢血からの単球の精製 (A)は 、血液25mlを慎重に遠心分離する前に、50ミリリットルのチューブ当たりフィコール15mlの上に積層されています。 PBMCを密度遠心分離後の血漿下の層に集中している。(B)PBMCをCONJされたマイクロビーズとインキュベートしますヒトCD14抗体(アイソタイプ:マウスのIgG2aを)モノクローナルするugatedした後、CD14 +単球を単離するために、セパレータの磁場に置かれているカラムにロードした。 この図の拡大版をご覧になるにはこちらをクリックしてください。
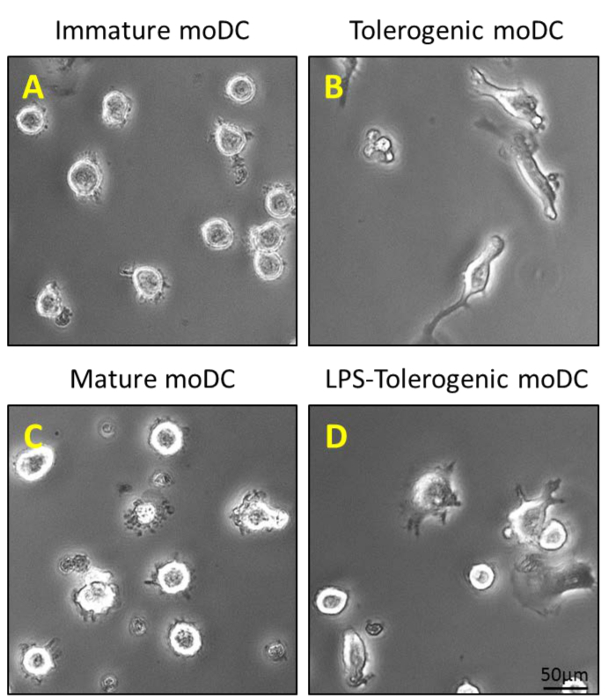
図2:のMoDCの形態学的特徴付け。 (A)GM-CSFおよびIL-4の200 ng / mlでの未成熟のMoDCを生成するために0日目、4および6の精製CD14 +単球に添加されます。そして5日目(B)100 nMのビタミンD3と10 nMのデキサメタゾンでの刺激の付加的なステップは、寛容原性のMoDCを生成します。未熟たMoDCと寛容原性のMoDCは(C)成熟したMoDCおよび(D)LPS-寛容原性のMoDCを生成するために、6日目に1μg/ mlのLPSで刺激されています。ttps://www.jove.com/files/ftp_upload/54128/54128fig2large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。
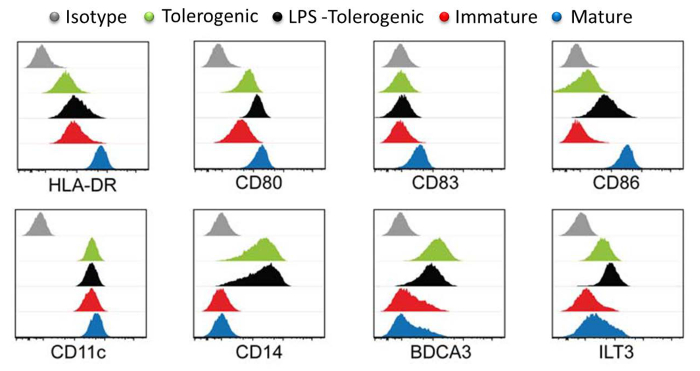
図3:フローサイトメトリー寛容原性で表面マーカーHLA-DR、CD80、CD83、CD86、CD11、CD14、BDCA3とLT3の発現レベル(緑)、LPS-寛容原性(黒)、未成熟(赤) による表面マーカーの特性評価 、成熟した(青)のMoDC。アイソタイプコントロールはグレーで表示されています。各細胞型のための個々のヒストグラムは、フルオロフォアの強度と重ねのX軸対数に対してY軸細胞数でプロットされています。すべてのヒストグラムには、4つの独立した実験の代表です。 10.4049 / jimmunol.1303316(2015年6月1日):この図は、J Immunol 194(11)、5174から5186、DOIから変更されています。再生して著作権の許可を得て再版。 著作権2015年のアメリカ協会の免疫学者、Inc.は、 この図の拡大版をご覧になるにはこちらをクリックしてください。
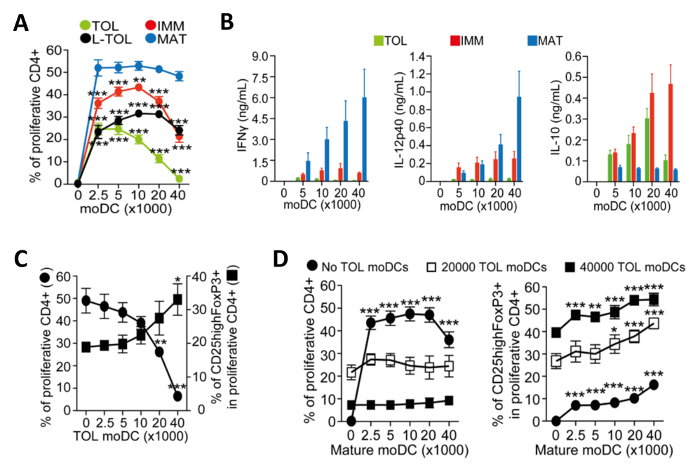
図4:のMoDCの機能解析。 (A)寛容原性の増加数との共培養により誘導されたCD4 + T細胞のalloproliferation周波数の定量(TOL;緑)、LPS-寛容原性(L-TOL;黒)、未熟(IMM;赤)と成熟(MAT ;青)のMoDC。データは、4つの独立した実験からプールしました。ダネット多重比較ポストテストとの双方向ANOVAによって分析した成熟したMoDCに対するすべてのMoDCの間+ SEMの統計的な差を意味する。IFN-Γ(左パネル)、IL-12p40の(中央のパネル)およびIL-の(B)サイトカイン分析10(右ペインいずれかの寛容原性(緑)、未成熟(赤)または成熟(青)のMoDCの数の増加と共培養したCD4 + T細胞との間のalloreactionsの上清中のL)。データは、6つの独立した実験からプールしました。 ±SEM(C)CD4 + T細胞alloproliferation及び免疫寛容のMoDCの数を増加させるの存在下で成熟したMoDCとの共培養によって誘導された調節性T細胞の拡大を意味します。左Y軸、CD4 + T細胞増殖の頻度。右側のY軸は、増殖性CD4 + T細胞上でゲーティングCD25 高のFoxp3 +細胞の頻度。データは3つの独立した実験からプールしました。 ±SEMをダネット多重比較ポストテストで一方向ANOVAによって分析した寛容原性のMoDCの不在対存在との間の統計的な差を意味する。(D)CD4 + T細胞alloproliferation(左)とCD25highFoxP3 +細胞の頻度(右)共同によって誘発されます寛容原性のMoDCと文化成熟したMoDC数の増加の存在下で実施されます。データは、2〜3の独立した実験からプールしました。成熟したMoDCの不在対存在との間に±SEMの統計的な差はダネット多重比較ポストテストとの双方向ANOVAによって分析した意味。 10.4049 / jimmunol.1303316(2015年6月1日):この図は、J Immunol 194(11)、5174から5186、DOIから変更されています。再生して著作権の許可を得て再版。 著作権免疫学者の2015年ザ・アメリカン協会、Inc.は、 この図の拡大版をご覧になるにはこちらをクリックしてください。
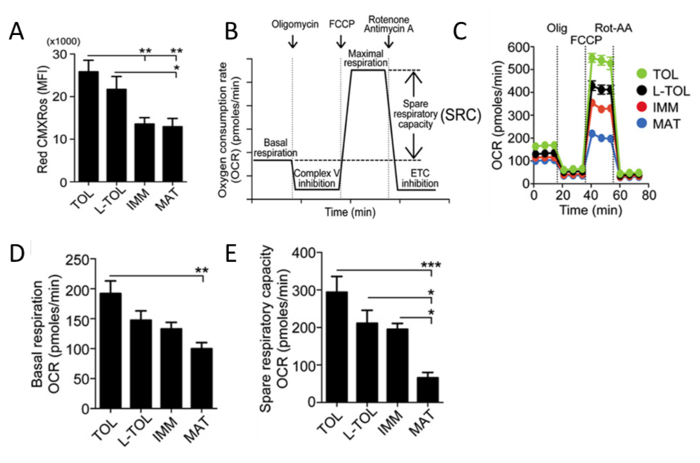
図5:のMoDCのミトコンドリア活性の分析。 (A)のMoDCにおけるミトコンドリア膜電位のレベル(赤CMXRos)はFによって得られました低いサイトメトリー分析。 4つの独立した実験のデータをプールしました。 ±SEM(B)リアルタイムミトコンドリア呼吸の模式図を意味します。 OCR解析は、基礎呼吸から始まり、オリゴマイシン(複雑なV阻害)、FCCP(最大呼吸誘導)、およびロテノン/混合物をアンチマイシン(電子伝達系[ETC]阻害)を添加した後。ミトコンドリアSRC(最大呼吸から差し引か最大の基礎)はOCR曲線から導出される。(C)寛容原性(TOL、緑)におけるミトコンドリアOCR(ピコモル/分)の代表的な動力学的研究、LPS-寛容原性(L-TOL、黒) 、未熟(IMM、赤)とのMoDCの基礎呼吸のオリゴマイシン(Olig)、FCCP、およびロテノン/アンチマイシンA(腐-AA)。(D)OCRの定量化の逐次付加を使用することによって(MAT、青)のMoDCを成熟し、(たMoDCのE)予備の呼吸容量。データは、5つの独立した実験からプールしました。平均±SE10.4049 / jimmunol.1303316(2015年6月1日):M.この図は、J Immunol 194(11)、5174から5186、DOIから変更されています。再生して著作権の許可を得て再版。 著作権免疫学者の2015年ザ・アメリカン協会、Inc.は、 この図の拡大版をご覧になるにはこちらをクリックしてください。
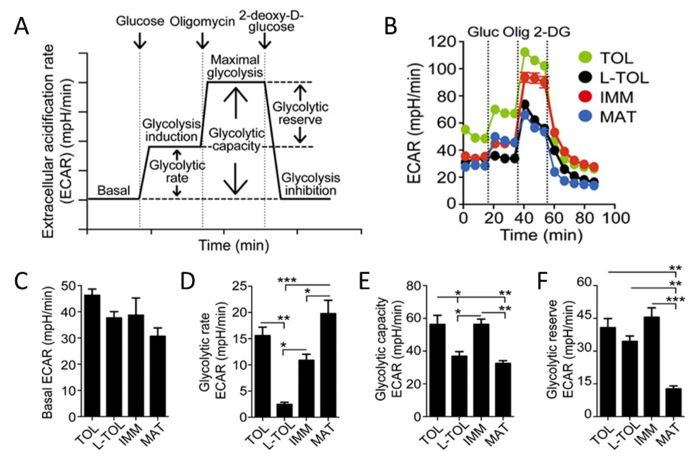
図6:のMoDCの代謝特性評価。 (A)リアルタイム解糖の略図。 ECAR分析は、(最大細胞解糖および複合体V阻害を誘導する)オリゴマイシン、細胞をグルコース(糖誘導)を添加したグルコースを含まない培地中でインキュベートされた基底ECARから開始し、最終的に2-デオキシD-グルコース(解糖阻害)。解糖依存の解糖率(解糖誘導は基礎ECARのために減算)、解糖能力(基礎ECARのために差し引か最大の解糖)、解糖リザーブ(解糖の誘導のために差し引か最大の解糖)ECAR曲線から導出される。(B)代表動力学的研究ECAR寛容原性で(MPH /分)(緑TOL)、LPS-寛容原性(黒L-TOL)、未成熟(赤IMM)、およびグルコース(Glucを)の逐次添加を使用することによって(MAT、青)MoDCを成熟、オリゴマイシン(Olig)、および2-DG。(C)バーは、基礎ECARレベル(D)を示す解糖率(E)解糖能力、および(F)のMoDCの解糖リザーブ。データは3つの独立した実験からプールしました。 6 SEMを意味します。統計的な差は、Tukeyの多重比較事後テストで一方向ANOVAによって分析しました。この図は、J Immunol 194(11)、5174から5186、DOIから変更されている:10.4049 / jimmunolを.1303316(2015年6月1日)。再生して著作権の許可を得て再版。 著作権免疫学者の2015年ザ・アメリカン協会、Inc.は、 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
本稿では、単球、未成熟MoDCを、寛容原性のMoDCと成熟したMoDCから生成する方法について説明します。このプロトコルにおける重要なステップは、以下の段落で詳細に説明します。ヒト末梢血は、このプロトコルで出発原料として使用され、ヒトの血液を処理するための普遍的な予防措置が実施されるべきであることに留意することが重要です。それは、ヒト24に骨髄からDCを導出することは技術的に可能であるが、末梢血中に見出される細胞からin vitroで DCの分化を伴う骨髄と比べて、末梢血の利用に好適です。末梢血中に見出される細胞、造血CD34 +幹細胞および単球の間で一般的にDCのin vitroでの生成のために使用されます。造血CD34 +細胞は、その後さらにランゲルハンスに分化されたCD1a +およびCD14 +サブセットを導出するために、GM-CSFおよびTNF-αと共に培養する幹細胞および樹状細胞などが挙げられます。逆に、単球を未成熟のMoDCを生成するために、GM-CSFおよびIL-4で培養されます。いくつかのプロトコルは、末梢血からの単球の濃縮のために使用されます。 。例えば、プラスチック皿、水簸および分離キット25、26への付着により付着プロトコルの利点は、細胞への最小限のダメージであり、比較的しかし、細胞の純度が損なわれる可能性があり、費用対効果。余分なステップは、さらなる実験のために細胞を剥離するために必要とされます。水簸は、それらのサイズおよび密度に基づいて細胞を分離する技術です。水簸の利点は、細胞生存率であり、単球は、容易に、さらなる実験のために使用することができます。しかし、この技術は、水簸機の利用可能性と同様の堆積パラメータを有する細胞(T細胞および単球)の異なる集団を分離することができないことによって制限されます。市販の単離キットは、いずれかの積極選択するために、磁気マイクロビーズを利用したり負の単球集団を選択します。分離された単球が(マーカーまたはマイクロビーズによって結合されていない)「そのまま」のままとして、いくつかのプロトコルは、負の選択を用いて単球の分離に偏っています。このプロトコルでは、CD14ビーズをPBMCから正の選択ヒト単球に使用されました。 CD14は細胞質ドメインを欠いており、CD14への抗体の結合は、シグナル伝達を誘発しません。また、マイクロビーズは、培養後の単球から分離させますので、分化過程を妨げません。また、CD14は強く、ほとんどの単球に弱く、好中球およびいくつかの骨髄樹状細胞、他の方法17よりも高い細胞純度の単離結果のためこの方法で発現されます。
血液単球は、DCまたはマクロファージに分化することができ、単球の運命は大きくサイトカイン環境に依存します。本論文では、MoDCをは(GMを顆粒球マクロファージコロニー刺激因子を添加することによって生成されますヒト末梢血単核球に-csf)およびインターロイキン4(IL-4)。 GM-CSFは、単球の生存のために必要とされ、IL-4はマクロファージ分化に対する阻害活性を発揮します。及び単球へのGM-SCSFおよびIL-4の組み合わせの添加は、個々のサイトカイン27に比べて未成熟のMoDCの高いパーセンテージを得ます。末梢血単核球28、29、30、腫瘍壊死因子α(TNF-α)、インターフェロンα(IFN-α)およびインターロイキン13(IL-13)を添加することによりたMoDCを生成する他のプロトコルがあります。 GM-CSFおよびIL-4の組み合わせは、現在、免疫原性または寛容原性のMoDCに分化およびTh1、Th2のか、Th17の促進のMoDCに偏光したプラスチック製の未成熟DCを生成受け入れプロトコルを1990年代に最適化しました。
未熟たMoDCは、ビタミンD3およびデキサメタゾンの添加により寛容原性のMoDCに分化されています。例えば寛容原性DCを生成するには、いくつかのプロトコルを介しがあります核因子カッパB(NF-κB)阻害は、βカテニンの活性化、ビタミンD3、デキサメタゾン及びラパマイシン31、32、33、34、35、9、36、37。単独で、ビタミンD3およびデキサメタゾンの両方は、DC、個々の薬剤を使用した場合よりもalloproliferationの高い抑制ビタミンD3およびデキサメタゾンの結果の組み合わせに寛容原性効果を誘導することが報告されています。したがって、寛容原性樹状細胞の生成のための既存のプロトコルは、ビタミンD3およびデキサメタゾンの組み合わせに変更されました。この方法は、現在、治療上の有用性を有するヒト寛容原性DCのモデルとして受け入れられています。再構成されたビタミンD3およびデキサメタゾンは、短い貯蔵寿命を有することに留意することも重要です。
このプロトコルでは、リポ多糖(LPS)は、DCの成熟誘導剤として添加しました。未熟たMoDCはまた、炎症誘発性カクテルを使用して成熟するように誘導することができます。(TNF-α)、インターロイキン1ベータ(IL-1β)、インターロイキン6(IL-6)およびプロスタグランジンE2)や炎症性サイトカイン(TNF-αおよびインターフェロンγ(IFN-Γ))。プロ炎症性カクテルは高い共刺激及び遊走機能を持つ成熟したMoDCを生成するが、それらは、IL-12 38の比較的低いレベルを生成します。 TNF-αまたはIFN-Γは、単独で安定した樹状表現型39を誘導することができません。 LPSは、Toll様受容体4(TLR4)を刺激するDCの成熟を誘導するためにNF-κB及びマイトジェン活性化プロテインキナーゼ(MAPK)の活性化を媒介します。 LPSによって誘導されるDCの成熟は、DC成熟マーカー(CD83、CD86、HLA-DR)のアップレギュレーションを示し、また、IL-12p70の産生のにつながりました。また、この工程は、さらなる臨床癌ワクチンのための成熟DCを産生するためにTLR3アゴニストとLPSをペアリングするように変更することができます。本論文では、寛容誘導性DCは、LPS処理時の成熟に耐性であることが示されています。これらの半成熟DCなどは免疫原性ではなく、releaしませんSE炎症性サイトカイン40。
このプロトコルの制限は、分化過程にあります。プロセスは、ハイスループット分析に適合させるために困難をもたらす日7に0日目から8日かかります。プロトコルにおける修正はまだ異なる状態で実行可能なDCの高い数値を得分化プロセスを短縮するために必要とされます。第二に、DCは、このプロトコル中のサイトカインを添加することによって生成され、これらのサイトカインは、長時間DC集団を維持しません。また、サイトカインは、 インビボでよりはるかに高い濃度で使用されており、in vivoでのDCに生理的に同一ではない経路のバイアスされた開発につながる可能性があります。例えば、DC前駆体のインビトロ培養物に インビボ 41 における通常のDCの分化に必須のサイトカインではないGM-CSFに応答することが示されています。それにもかかわらず、サイトカイン刺激は、遺伝子に有用な方法することができます実験のためのin vitroで DCの高い数字を評価します。アロ反応の研究および代謝研究、フローサイトメトリーは、このような免疫蛍光染色などの他の分析にこのプロトコルから生成されたこれらの細胞を供する能力は、この方法の有用性を増大させます。これらのインビトロ DCは、in vivoでの DCの希少数をどうする以前には困難であるDCの開発、成熟および抗原提示の知識を改善するための良いモデルとなります。
寛容対免疫学的免疫を調節する樹状細胞の能力は、それらの癌および自己免疫疾患42、43、44、45に対する治療における魅力的な候補になります。このプロトコルで生成された免疫原性DCは、感染症および腫瘍に対するワクチン接種の有効性を改善するために使用することができます。寛容原性DCは、望ましくないT細胞応答を制御し、移植後の拒絶反応を防止するために使用することができるが。複雑な免疫と寛容のバランスがDCの分化状態に非常に依存します。 DCの分化は、複数のシグナル伝達経路および代謝運命に支配される協調細胞プログラムです。 DCの異なる分化状態は、生体エネルギーと生合成のニーズが異なります。静止状態でのDCに比べて、例えば、活性化DCは、生存と移行のための重要な、よりエネルギッシュな代謝適応を必要とします。ビタミンD3、デキサメタゾン及びラパマイシンが寛容原性DCを誘導するそれらの能力について知られていることに留意することが重要であり、DC代謝に影響を与えることが記載されています。本論文では、異なる分化状態からのMoDCのエネルギー代謝は細胞外フラックスアナライザーを使用して特徴付けられたと寛容原性のMoDCは、最高の代謝の可塑性を示し、LPS誘発成熟は、この可塑性を減少させました。異化代謝の影響寛容原性DCが46を機能ながらアナボリック代謝は、DCの成熟を サポートしています。 DCはこのプロトコルから生成されたが治療における免疫寛容を修正するための鍵を握るDCの代謝状態を変化させるかどうかを評価するために使用することができます。結論として、我々は、DC「免疫調節機能を研究するための重要な未成熟、免疫寛容原性と成熟したMoDCの生成のためのプロトコルを提示しました。
開示事項
Open access fees for this article were provided by, Agilent Technologies.
謝辞
この作品は、科学技術(JEC)はReasearchコアファンディングのための機関によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Ficoll | GE Healthcare | 17-1440-03 | PBMC isolation |
| Syringe | Becton, Dickinson | 302832 | PBMC isolation |
| 1.5 ml centrifuge tube | Axygen | MCT-150-C | PBMC isolation |
| 15 ml falcon tube | Falcon | 352096 | PBMC isolation |
| 50 ml falcon tube | Falcon | 352070 | PBMC isolation |
| Centrifuge | Eppendorf | 5810R | PBMC isolation |
| 0.2 µm filter | Sartorius stedim biotech | 17597 | PBMC isolation |
| MACs kit | Miltenyi biotec | 130-042-201 | Monocyte enrichment |
| MiniMACS Separator | Miltenyi biotec | 130-042-102 | Monocyte enrichment |
| Cell culture grade water | Invitrogen, Life Technologies | Cell culture | |
| RPMI | Gibco, Life Technologies | 11875-093 | Cell culture |
| FBS | Hyclone | SH30070103 | Cell culture |
| Penicillin-streptomycin | Gibco, Life Technologies | 15140 | Cell culture |
| Phosphate Buffered Saline | Gibco, Life Technologies | 10010-031 | Cell culture |
| NEAA | Gibco, Life Technologies | 11140-040 | Cell culture |
| EDTA | Gibco, Life Technologies | 15575 | Cell culture |
| HEPES | Gibco, Life Technologies | 15630-080 | Cell culture |
| Sodium Pyruvate | Gibco, Life Technologies | 11360-070 | Cell culture |
| GM-CSF | Miltenyi biotec | 130-093-868 | Cell culture |
| IL-4 | Miltenyi biotec | 130-093-924 | Cell culture |
| Vitamin D3 | Sigma | D1530 | Cell culture |
| Dexamethasone | Sigma | D2915 | Cell culture |
| LPS | Sigma | l2755 | Cell culture |
| trypan blue | Gibco, Life Technologies | 15250-061 | Cell culture |
| PerCP-conjugated HLADR | BioLegend | 307628 | Cytometry |
| PE-conjugated CD80 | BD Biosciences | 557227 | Cytometry |
| PE-conjugated CD83 | BD Biosciences | 556855 | Cytometry |
| PE-conjugated CD86 | BD Biosciences | 555665 | Cytometry |
| APC-conjugated CD11c | BD Biosciences | 340544 | Cytometry |
| PE-conjugated CD14 | Miltenyi biotec | 130-091-242 | Cytometry |
| PE-conjugated BDCA3 | Miltenyi biotec | 130-090-514 | Cytometry |
| APC-conjugated ILT3 | eBioscience | 12-5139-73 | Cytometry |
| Isotype matched PerCP- conjugated Mab | BioLegend | 400250 | Cytometry |
| Isotype matched PE- conjugated Mab | Miltenyi biotec | 130-091-835 | Cytometry |
| Isotype matched APC- conjugated Mab | Miltenyi biotec | 130-091-836 | Cytometry |
| BD LSR II Flow Cytometer | BD Pharmingen | BD LSR II | Cytometry |
| cytofix/cytoperm | BD Biosciences | 554714 | Cytometry |
| APC/CY7-conjugated CD25 | BD pharmingen | 557753 | Cytometry |
| PE/CY7-conjugated CD4 | Biolegend | 300512 | Cytometry |
| PerCP-conjugated CD3 | Biolegend | 300428 | Cytometry |
| EasySep Human CD4+ T cell enrichment kit | STEMCELL Technologies | 19052 | Alloreaction study |
| EasySep magnet | STEMCELL Technologies | 18000 | Alloreaction study |
| Cell Trace CFSE cell proliferation kit | Molecular probes | C34554 | Alloreaction study |
| HBSS | Gibco, Life Technologies | 14025092 | Alloreaction study |
| Alexa Fluor 647-conjugated FoxP3 | BD Biosciences | 560889 | |
| Milliplex MAP Human Cytokine/Chemokine magnetic bead panel | Millipore | HCYTOMAG-60K | Cytokine analysis |
| 5 ml Polystyrene tube | Falcon | 352058 | Cytokine analysis |
| Luminex Sheath Fluid | Millipore | SHEATHFLUID | Cytokine analysis |
| FLEXMAP 3D system with xPONENT software | Luminex Corporation | FLEXMAP 3D | Cytokine analysis |
| MitoTracker Red CMXRos | Cell Signalling | 9082 | Mitochondrial activity |
| DMSO | Sigma Aldrich | D2650 | Mitochondrial activity |
| XF Assay Medium (OCR) | Seahorse Bioscience | 102352-000 | Metabolic adaptation |
| Glucose | Sigma Aldrich | G8769 | Metabolic adaptation |
| XF Base Medium (ECAR) | Seahorse Bioscience | 102353-100 | Metabolic adaptation |
| L-glutamine | Gibco, Life Technologies | 25030-081 | Metabolic adaptation |
| Calibrant | Seahorse Bioscience | 100840-000 | Metabolic adaptation |
| XF Cell Mito Stress kit | Seahorse Bioscience | 103015-100 | Metabolic adaptation |
| XF Glycolysis Stress kit | Seahorse Bioscience | 103020-100 | Metabolic adaptation |
| Seahorse | Seahorse Bioscience | XFe96 | Metabolic adaptation |
参考文献
- Jolles, S. Paul Langerhans. J Clin Pathol. 55 (4), 243-24 (2002).
- Steinman, R. M., Cohn, Z. A. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J Exp Med. 137 (5), 1142-1162 (1973).
- Steinman, R. M., Swanson, J. The endocytic activity of dendritic cells. J Exp Med. 182 (2), 283-288 (1995).
- Hemmi, H., Akira, S. TLR signalling and the function of dendritic cells. Chem Immunol Allergy. 86, 120-135 (2005).
- Mueller, D. L. Mechanisms maintaining peripheral tolerance. Nat Immunol. 11 (1), 21-27 (2010).
- Inaba, K., et al. Efficient presentation of phagocytosed cellular fragments on the major histocompatibility complex class II products of dendritic cells. J Exp Med. 188 (11), 2163-2173 (1998).
- Caux, C., et al. B70/B7-2 is identical to CD86 and is the major functional ligand for CD28 expressed on human dendritic cells. J Exp Med. 180 (5), 1841-1847 (1994).
- Paavonen, J., Lehtinen, M. Interactions between human papillomavirus and other sexually transmitted agents in the etiology of cervical cancer. Curr Opin Infect Dis. 12 (1), 67-71 (1999).
- Ohtani, M., et al. Mammalian target of rapamycin and glycogen synthase kinase 3 differentially regulate lipopolysaccharide-induced interleukin-12 production in dendritic cells. Blood. 112 (3), 635-643 (2008).
- Wilde, B., et al. Dendritic cells in renal biopsies of patients with ANCA-associated vasculitis. Nephrol Dial Transplant. 24 (7), 2151-2156 (2009).
- Al-Hello, H., et al. An enterovirus strain isolated from diabetic child belongs to a genetic subcluster of echovirus 11, but is also neutralised with monotypic antisera to coxsackievirus A9. J Gen Virol. 89, 1949-1959 (2008).
- Ziegler-Heitbrock, L., et al. Nomenclature of monocytes and dendritic cells in blood. Blood. 116 (16), 74-80 (2010).
- Osugi, Y., Vuckovic, S., Hart, D. N. Myeloid blood CD11c(+) dendritic cells and monocyte-derived dendritic cells differ in their ability to stimulate T lymphocytes. Blood. 100 (8), 2858-2866 (2002).
- Reynolds, G., Haniffa, M. Human and Mouse Mononuclear Phagocyte Networks: A Tale of Two Species. Front Immunol. 6, (2015).
- Jefford, M., et al. Functional comparison of DCs generated in vivo with Flt3 ligand or in vitro from blood monocytes: differential regulation of function by specific classes of physiologic stimuli. Blood. 102 (5), 1753-1763 (2003).
- Menck, K., et al. Isolation of human monocytes by double gradient centrifugation and their differentiation to macrophages in teflon-coated cell culture bags. J Vis Exp. (91), (2014).
- Zhou, L., et al. Impact of human granulocyte and monocyte isolation procedures on functional studies. Clin Vaccine Immunol. 19 (7), 1065-1074 (2012).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Faresjo, M. A useful guide for analysis of immune markers by fluorochrome (Luminex) technique. Methods Mol Biol. 1172, 87-96 (2014).
- Baker, H. N., Murphy, R., Lopez, E., Garcia, C. Conversion of a capture ELISA to a Luminex xMAP assay using a multiplex antibody screening method. J Vis Exp. (65), (2012).
- Defawe, O. D., et al. Optimization and qualification of a multiplex bead array to assess cytokine and chemokine production by vaccine-specific cells. J Immunol Methods. 382 (1-2), 117-128 (2012).
- Nicholls, D. G., et al. Bioenergetic profile experiment using C2C12 myoblast cells. J Vis Exp. (46), (2010).
- Chunharas, A., Pabunruang, W., Hongeng, S. Congenital self-healing Langerhans cell histiocytosis with pulmonary involvement: spontaneous regression. J Med Assoc Thai. 85, 1309-1313 (2002).
- Bai, L., Feuerer, M., Beckhove, P., Umansky, V., Schirrmacher, V. Generation of dendritic cells from human bone marrow mononuclear cells: advantages for clinical application in comparison to peripheral blood monocyte derived cells. Int J Oncol. 20 (2), 247-253 (2002).
- Felzmann, T., et al. Monocyte enrichment from leukapharesis products for the generation of DCs by plastic adherence, or by positive or negative selection. Cytotherapy. 5 (5), 391-398 (2003).
- Berger, T. G., et al. Efficient elutriation of monocytes within a closed system (Elutra) for clinical-scale generation of dendritic cells. J Immunol Methods. 298 (1-2), 1-2 (2005).
- Sallusto, F., Lanzavecchia, A. Efficient presentation of soluble antigen by cultured human dendritic cells is maintained by granulocyte/macrophage colony-stimulating factor plus interleukin 4 and downregulated by tumor necrosis factor alpha. J Exp Med. 179 (4), 1109-1118 (1994).
- Pace, S. T., Gelman, B. B., Wong, B. R. Primary Langerhans cell histiocytosis of the lacrimal gland in an adult. Can J Ophthalmol. 50 (3), 40-43 (2015).
- Ravanfar, P., Wallace, J. S., Pace, N. C. Diaper dermatitis: a review and update. Curr Opin Pediatr. 24 (4), 472-479 (2012).
- Gebhardt, C., et al. A case of cutaneous Rosai-Dorfman disease refractory to imatinib therapy. Arch Dermatol. 145 (5), 571-574 (2009).
- Vazquez, P., Robles, A. M., de Pablo, F., Hernandez-Sanchez, C. Non-neural tyrosine hydroxylase, via modulation of endocrine pancreatic precursors, is required for normal development of beta cells in the mouse pancreas. Diabetologia. 57 (11), 2339-2347 (2014).
- Pellacani, G., et al. Distinct melanoma types based on reflectance confocal microscopy. Exp Dermatol. 23 (6), 414-418 (2014).
- Shi, Y., et al. Hepatic involvement of Langerhans cell histiocytosis in children--imaging findings of computed tomography, magnetic resonance imaging and magnetic resonance cholangiopancreatography. Pediatr Radiol. 44 (6), 713-718 (2014).
- Haustein, M., Terai, N., Pablik, J., Pillunat, L. E., Sommer, F. Therapy-resistant swelling of the upper eyelid in childhood. Ophthalmologe. 111 (1), 53-57 (2014).
- Haidinger, M., et al. A versatile role of mammalian target of rapamycin in human dendritic cell function and differentiation. J Immunol. 185 (7), 3919-3931 (2010).
- Macedo, C., Turquist, H., Metes, D., Thomson, A. W. Immunoregulatory properties of rapamycin-conditioned monocyte-derived dendritic cells and their role in transplantation. Transplant Res. 1 (1), 16 (2012).
- Fischer, R., Turnquist, H. R., Taner, T., Thomson, A. W. Use of rapamycin in the induction of tolerogenic dendritic cells. Handb Exp Pharmacol. 188 (188), 215-232 (2009).
- Nicolette, C. A., et al. Dendritic cells for active immunotherapy: optimizing design and manufacture in order to develop commercially and clinically viable products. Vaccine. 25, 47-60 (2007).
- Han, T. H., et al. Evaluation of 3 clinical dendritic cell maturation protocols containing lipopolysaccharide and interferon-gamma. J Immunother. 32 (4), 399-407 (2009).
- Paananen, A., et al. Molecular and biological analysis of echovirus 9 strain isolated from a diabetic child. J Med Virol. 69 (4), 529-537 (2003).
- HC, O. N., Wilson, H. L. Limitations with in vitro production of dendritic cells using cytokines. J Leukoc Biol. 75 (4), 600-603 (2004).
- Mest, H. J., et al. Glucose-induced insulin secretion is potentiated by a new imidazoline compound. Naunyn Schmiedebergs Arch Pharmacol. 364 (1), 47-52 (2001).
- Puc, J., et al. Mitochondrial activity after cold preservation of pancreatic islet cells treated with pefloxacin (PFX). Ann Transplant. 3 (1), 38-41 (1998).
- Alarcon, C., Serna, J., Perez-Villamil, B., de Pablo, F. Synthesis and differentially regulated processing of proinsulin in developing chick pancreas, liver and neuroretina. FEBS Letters. 436 (3), 361-366 (1998).
- Jekunen, A. P., Kairemo, K. J., Paavonen, T. Imaging of Hand-Schuller-Christian syndrome by a monoclonal antibody. Clin Nucl Med. 22 (11), 771-774 (1997).
- Pearce, E. J., Everts, B. Dendritic cell metabolism. Nat Rev Immunol. 15 (1), 18-29 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved