Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Identificación de los ácidos grasos en la
En este artículo
Resumen
We propose a protocol to identify fatty acids without the need to purify them. It combines information on the retention times with the mass spectra of three types of fatty acid derivatives: fatty acid methyl esters (FAMEs), 4,4-dimethyl oxazoline derivatives (DMOX), and 3-pyridylcarbinyl esters (picolinyl).
Resumen
Las especies de Bacillus contienen ácidos grasos insaturados (FAS) de cadena y ramificados con diversas posiciones de la rama de metilo (iso o anteiso) y del doble enlace. Los cambios en la composición de la FA juegan un papel crucial en la adaptación de las bacterias a su entorno. Estas modificaciones implican un cambio en la relación de iso frente anteiso ramificada AF, y en la proporción de insaturados AF en relación con las AF saturado, con dobles enlaces creados en posiciones específicas. Identificación precisa del perfil de AG es necesario entender los mecanismos de adaptación de la especie Bacillus.
Muchos de los conjuntos combustibles de Bacillus no están disponibles comercialmente. La estrategia propuesta en el presente documento identifica conjuntos combustibles mediante la combinación de la información sobre el tiempo de retención (mediante el cálculo de la longitud de cadena equivalente (ECL)) con los espectros de masas de los tres tipos de derivados FA: ésteres metílicos de ácidos grasos (FAMEs), 4,4-dimetil oxazolina derivados (DMOX), yéster 3-pyridylcarbinyl (picolinilo). Este método puede identificar los conjuntos combustibles sin la necesidad de purificar el desconocido AF.
La comparación de los perfiles cromatográficos de FAME preparado a partir de Bacillus cereus con una mezcla comercial de estándares permite la identificación de cadena lineal saturado Fas, el cálculo de la ECL, y las hipótesis sobre la identidad de la otra AF. FAMEs de ramificado, saturado Fas, iso o anteiso, muestre un cambio negativo constante en la ECL, en comparación con AF saturados lineales con el mismo número de carbonos. FAMEs de FAs insaturados pueden ser detectados por la masa de sus iones moleculares, y dan como resultado un cambio positivo en la ECL en comparación con los conjuntos combustibles saturados correspondientes.
La posición de ramificación de conjuntos combustibles y la posición doble enlace insaturado de conjuntos combustibles pueden ser identificados por los espectros de masas de ionización de electrones de derivados picolinilo y DMOX, respectivamente. Este enfoque identifica toda la rama saturado desconocidaed AF, insaturados de cadena lineal AF y AF ramificados insaturados del extracto de B. cereus.
Introducción
cromatografía Fatty ácido metil éster (FAME) de gases (GC) es un método esencial para la caracterización de los lípidos. Se separa rápidamente y cuantifica los diversos ácidos grasos (FAS) de una muestra después de una etapa de extracción corto. Los derivados de ésteres metílicos son muy volátiles, estable e inerte hacia la columna cromatográfica, evitando así los picos con cola. Su identificación es bastante sencillo cuando la muestra sea de conjuntos combustibles conocidos porque los perfiles cromatográficos se publican o se pueden comparar con los estándares tampoco. Además, no se requiere la inyección repetida de patrones de calibración para la cuantificación de varios conjuntos combustibles, dada su respuesta casi constante a la detección de ionización de llama (FID) 1.
Además de la FID, la espectrometría de masas (MS) de detección proporciona un conjunto de información complementaria para confirmar FAME. Sin embargo, cuando se pagan FAME usando ionización electrónica (EI), los espectros resultantes no siempre permiten THe identificación de estructura fina FA. Por ejemplo, la posición de ramificación (es decir, un grupo metilo ramificado) es difícil de predecir debido a que los iones de diagnóstico son difíciles de detectar 1 y el cambio característico en la abundancia de iones objetivo es dependiente de la máquina, evitando el uso de bibliotecas de espectros de masa 2. Otro reto consiste en identificar la posición de doble enlace, porque IE provoca la migración del doble enlace. Por lo tanto, los isómeros FA con diferentes posiciones de doble enlace no pueden ser diferenciadas por sus espectros de masas. Afortunadamente, otros se han desarrollado herramientas para la identificación FA. Por ejemplo, la presencia y la posición de ramificación o de dobles enlaces en las AF pueden conjeturaron mediante el cálculo de la longitud de cadena equivalente (ECL) 3.
Otros métodos de derivatización resultan en diferentes espectros de masa, dependiente de la localización de un doble enlace o un grupo metilo ramificado. 4,4-dimetil derivados de oxazolina (DMOX) 4 permiten a EASy la identificación de la posición de los dobles enlaces de ácidos grasos monoinsaturados. 3-pyridylcarbinyl éster (éster picolinilo) derivados permiten la identificación inequívoca de la ubicación de metilo ramificado AF 5. La combinación de la retención cromatográfica (ECL) y espectros de masas (DMOX y picolinilo) información permite la identificación de la mayoría de las AF sin la necesidad de utilizar métodos complejos de purificación, como se requiere para la resonancia magnética nuclear espectro (NMR), el método incontestable para la caracterización estructural 1 .
Las bacterias del género Bacillus, que incluyen algunos agentes patógenos humanos y animales, son capaces de colonizar muy diversos nichos y por lo tanto están ampliamente distribuidos en el medio ambiente 6. Entre el género Bacillus, composición FA está influenciada por el nicho ecológico de las especies con las modulaciones en los patrones de FA para adaptarse a una amplia gama de cambios ambientales (por ejemplo, medio de crecimiento, temperatura,pH, etc.) 7-9. Debido a la homogeneidad relativa de la pauta FA través de las especies del género Bacillus durante el crecimiento en condiciones estandarizadas, determinación de la composición FA es uno de los criterios esenciales utilizados para definir las especies de Bacillus. Un atributo único del género Bacillus es la abundancia de las AF de cadena ramificada que contienen 12-17 átomos de carbono 10-12 con la relación entre la ISO y anteiso isómeros son un determinante clave de la adaptación a las condiciones ambientales. Especies de Bacillus también se adaptan a las fluctuaciones ambientales mediante la alteración de la proporción de ácidos grasos insaturados. En algunas especies, tales como Bacillus cereus, dos desaturasas de ácidos grasos crean enlaces dobles en diferentes posiciones de la cadena de alquilo 13 con diferentes roles en la adaptación 9. El ejemplo del género Bacillus ilustra la importancia de identificar con precisión la posición de doble enlace y FA ramificación. Recogervamente, la identificación de patrones de Bacillus FA tiene varias aplicaciones útiles. En este documento, se propone un nuevo enfoque de GC-MS para la identificación de patrones de Bacillus FA que supera las limitaciones inherentes de un análisis clásico GC-MS.
Este enfoque innovador puede ser utilizado directamente en crudo material biológico, y consiste en una combinación de técnicas existentes: información sobre los tiempos de retención (ECL) y los espectros de masas de los diferentes derivados de Fas (FAME, DMOX y picolinilo-éster).
Usamos la siguiente nomenclatura FA. i, a, y n indican iso, anteiso metilo ramificado, y el ácido graso de cadena lineal, respectivamente. FAs insaturados fueron nombrados por C: d donde C es el número de átomos de carbono en el ácido graso y d es el número de dobles enlaces. Δ x indica la posición del doble enlace, donde se encuentra el doble enlace en el enlace carbono-carbono de orden x, contando desde el extremo ácido carboxílico.
Protocolo
1. Los cultivos bacterianos
- Preparar un césped de las bacterias (Bacillus cereus cepa ATCC 14579) mediante la difusión de 100 l de un cultivo nocturno de la cepa se incubó a 30 ° C en LB (medio Luria-Bertani), sobre la superficie de una placa de medio de agar LB. Se incuba la placa durante la noche a 30 ° C.
2. ECL: Longitud Equivalente Cadena
- Calcular ECL como sigue:
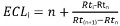 con:
con:
i, el soluto de interés;
n, el número de carbonos del éster metílico de ácido graso saturado de cadena lineal de elución antes de soluto I;
n + 1, el número de carbonos del éster metílico de ácido graso saturado de cadena lineal, eluyendo después de soluto I;
Rti, Rtn, Rt (n + 1) los tiempos de retención de los picos de FAME descritos anteriormente.
NOTA: Obtener los tiempos de retención de los ésteres de ácidos grasos saturados de cadena recta de metilo mediante la inyección de una mezcla de estándares (BAME).
3. Preparación y análisis FAME
- Con el fin de obtener los ácidos grasos de lípidos, células bacterianas cosecha raspando colonias de la placa de agar y la transferencia de 40 mg (peso en fresco, el equivalente a 10 9 células viables) de las bacterias en un tubo de vidrio de 10 ml con tapones de rosca y juntas de PTFE.
- Realizar transesterificación mediante el método de enlace de éster de 14,15 detalla a continuación.
- Añadir 5 ml de 0,2 M de KOH en metanol a las células bacterianas fresco y se incuba a 37 ° C durante 1 hr. Esta reacción consiste en metanólisis alcalina, rompiendo el enlace éster en el lípido y la producción de ésteres metílicos de ácidos grasos.
- Añadir 1 ml de ácido acético 1 M para bajar el pH a 7,0. Comprobar el pH con tiras de prueba de pH.
- Añadir 3 ml de hexano para extraer FAMEs.
- Transferir el sobrenadante (fase orgánica) en tubos limpios y se concentra por evaporación a temperatura ambiente bajo un flujo continuo de nitrógeno para obtener aproximadamente 200 lde extracto. Transferir la muestra en un vial GC con parte.
- Inyectar extractos en una espectrometría de masa de cromatografía de gas del sistema (GC-MS).
4. Condiciones GC / MS
- Inyectar muestras FAME en un instrumento de GC-MS equipado con una columna capilar ZB-WAX (longitud, 30 m; diámetro, 0,25 mm; espesor de la película, 0,25 m).
- Ajuste el puerto de inyección (en el modo sin división) la temperatura a 250 ° C. Utilice el helio como gas portador, con una velocidad lineal de 37 cm / seg. Mantenga la temperatura del horno a 50 ° C durante 1 min, aumentar a 190 ° C a una velocidad de 20 ° C / min, y aumentar aún más a una temperatura final de 230 ° C a una velocidad de 2 ° C / min.
- Para la MS, registrar los espectros de masas de ionización por electrones (IE) a 70 eV, y establecer la adquisición de la corriente de iones total de entre 50 y 400 unidades de masa atómica (UMA) (2 scans / seg).
- Cuando sea necesario, inyectar derivados DMOX y picolinilo bajo la misma condición except el horno programa de temperatura como sigue:
DMOX: 50 ° C (1 min), 20 ° C / min hasta 210 ° C y 2 ° C / min hasta 240 ° C (5 min);
Picolinilo: 6 ° C (1 min), 20 ° C / min hasta 220 ° C y 2 ° C / min hasta 250 ° C (20 min).
5. picolinilo Ester Preparación a partir de 16 FAME
- Evaporar el extracto de FAME de la sección 3 con un flujo de nitrógeno (al menos 10 mg de material seco) y se disuelve en 1 ml de diclorometano seco.
- Preparar una solución 1,0 M de ter t-butóxido potásico en tetrahidrofurano.
- Agregar el extracto de FAME y 0,2 ml de 3 piridinametanol a 0,1 ml de solución hechas en el paso 5.2.
- Se calienta la solución a 40 ° C durante 30 min en un vial cerrado.
- Después de enfriar a temperatura ambiente, añadir agua desionizada purificada (2 ml, véase Materiales Tabla) y hexano (4 ml). Mezclar con un vórtice, permiten fase para separar y recoger la fase orgánica.
- Dry mediante la adición de sulfato de sodio anhidro hasta que la fase orgánica es perfectamente claro. Transferirlo a un tubo limpio. Entonces se evapora hasta 200 l. Transferir la muestra en un vial GC con parte.
6. DMOX Preparación a partir de 17 FAME
- Evaporar el extracto de FAME de la sección 3 con un flujo de nitrógeno (material seco de al menos 10 mg).
- Para el extracto seco FAME, añadir 250 mg de 2-amino-2-metil-1-propanol. Enjuague el recipiente con nitrógeno, añadir un tapón, y lo coloca en un bloque de calentamiento durante la noche a 190 ° C.
- Después de enfriar a temperatura ambiente, añadir 3 ml de diclorometano al tubo, y 5 ml agua purificada desionizada (Ver Tabla de Materiales).
- Agitar durante la separación de fases y extraer la fase acuosa.
- Se lava la fase orgánica con 5 ml de agua. Agitar durante la separación de fases y extraer la fase acuosa.
- En seco mediante la adición de sulfato de sodio anhidro hasta que la fase orgánica es perfectamente clara ytransferirlo a un tubo limpio. Se evapora bajo una corriente de nitrógeno hasta alcanzar un volumen de 200 l. Transferir la muestra en un vial GC con parte.
Resultados
La estrategia de identificación FA a partir de células bacterianas se presenta en la Figura 1. Cada paso proporciona información espectral complementaria o información acerca de la retención cromatográfica. Paso 1 consiste en la identificación preliminar FA utilizando una solución estándar. Paso 2 permite la interpretación de FAME EI espectros y su ECL, con el fin de identificar provisionalmente los productos. Paso 3 identifica la ubicación exacta de ramificac...
Discusión
Los perfiles cromatográficos FAs mostrados en la Tabla 1 corresponden a B. cereus ATCC 14579 crecido en una superficie de la placa de agar. Se obtuvieron perfiles similares cuando la bacteria se cultivó en medio líquido aireado a la misma temperatura 8. En el caso de bacterias cultivadas en medio líquido, la biomasa bacteriana se recoge por centrifugación del medio de crecimiento y se puede lavar de acuerdo con los protocolos descritos anteriormente dependiendo de las condicione...
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
Los autores agradecen a Thomas Mison por su apoyo técnico, y para Rachel Kopec para la revisión del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| GC/MS | Shimadzu | QP2010 | |
| capillary column ZB WAX | Phenomenex | 7HG-G007-11 | 30 m x 0.25 mm x 0.25 µm |
| Methanol Lichrosolv | VWR | 1.06018.2500 | |
| potassium hydroxide | Aldrich | P1767 | |
| THF | Hipersolv Chromanorm | 28559.320 | |
| Dichloromethane | Hipersolv Chromanorm | 23373.320 | |
| Hexane | Hipersolv Chromanorm | 24575.320 | |
| 3-pyridinemethanol | Aldrich | P6-680-7 | |
| potassium tertiobutoxide | Aldrich | 156671 | |
| 2-amino-2-methyl-1-propanol | A-9879 | ||
| MilliQ Academic | Millipore | ZMQS50001 | |
| Bacterial Acid Methyl Ester (BAME) Mix | Sigma-Aldrich | 47080-U Supelco |
Referencias
- Christie, W. W., Han, X. . Lipid Analysis 4th Edition. , (2010).
- HÜbschmann, H. -. J. . Handbook of GC-MS: fundamental and application. Third edition. , (2015).
- Sasser, M. Identification of Bacteria by Gas Chromatography of Cellular Fatty Acids. MIDI Technical note. 101, 1-6 (1990).
- Spitzer, V. Structure analysis of fatty acids by gas chromatography - Low resolution electron impact mass spectrometry of their 4,4-dimethyloxazoline derivatives - A review. Prog Lipid Res. 35 (4), 387-408 (1996).
- Harvey, D. J., Christie, W. W. . Advances in lipid methodology. Volume 1. , 19-80 (1992).
- Diomande, S. E., Nguyen-The, C., Guinebretière, M. -. H., Broussolle, V., Brillard, J. Role of fatty acids in Bacillus environmental adaptation. Front Microbiol. 6, (2015).
- Brillard, J., et al. Identification of Bacillus cereus Genes Specifically Expressed during Growth at Low Temperatures. Appl Environ Microbiol. 76 (8), 2562-2573 (2010).
- de Sarrau, B., et al. Influence of Anaerobiosis and Low Temperature on Bacillus cereus Growth, Metabolism, and Membrane Properties. Appl Environ Microbiol. 78 (6), 1715-1723 (2012).
- Diomandé, S. E., et al. Involvement of the CasK/R two-component system in optimal unsaturation of the Bacillus cereus fatty acids during low-temperature growth. Int J Food Microbiol. 213, 110-117 (2015).
- Berkeley, R. C. W., Heyndrickx, M., Logan, N., De Vos, P., Berkeley, R. C. W. . Applications and Systematics of Bacillus and Relatives. , 1-7 (2002).
- Kämpfer, P. Limits and Possibilities of Total Fatty Acid Analysis for Classification and Identification of Bacillus Species. System. Appl. Microbiol. 17 (1), 86-98 (1994).
- Kaneda, T. Fatty-acids of genus bacillus - example of branched-chain preference. Bacteriol Rev. 41 (2), 391-418 (1977).
- Chazarreta Cifre, L., Alemany, M., de Mendoza, D., Altabe, S. Exploring the Biosynthesis of Unsaturated Fatty Acids in Bacillus cereus ATCC 14579 and Functional Characterization of Novel Acyl-Lipid Desaturases. Appl Environ Microbiol. 79 (20), 6271-6279 (2013).
- Sasser, M., et al. Identification of Bacillus anthracis from culture using gas chromatographic analysis of fatty acid methyl esters. J AOAC Int. 88 (1), 178-181 (2005).
- Schutter, M. E., Dick, R. P. Comparison of fatty acid methyl ester (FAME) methods for characterizing microbial communities. Soil Sci Soc Am J. 64 (5), 1659-1668 (2000).
- Destaillats, F., Angers, P. One-step methodology for the synthesis of FA picolinyl esters from intact lipids. J Am Oil Chem Soc. 79 (3), 253-256 (2002).
- Fay, L., Richli, U. Location of double-bonds in polyunsaturated fatty-acids by gas-chromatography mass-spectrometry after 4,4-dimethyloxazoline derivatization. J Chromatogr. 541 (1-2), 89-98 (1991).
- Zhang, J. Y., Yu, Q. T., Liu, B. N., Huang, Z. H. Chemical modification in mass spectrometry IV-2-alkenyl-4,4-dimethyloxazolines as derivatives for the double bond location of long-chain olefinic acids. Biol Mass Spect. 15 (1), 33-44 (1988).
- de Sarrau, B., et al. Unsaturated fatty acids from food and in the growth medium improve growth of Bacillus cereus under cold and anaerobic conditions. Food Microbiol. 36 (2), 113-122 (2013).
- Miwa, T. K., Mikolajczak, K. L., Earle, F. R., Wolff, I. A. Gas chromatographic characterization of fatty acids.Identification constants for mono- and dicarboxylic methyl esters. Anal Chem. 32 (13), 1739-1742 (1960).
- van Den Dool, H., Kratz, P. A generalization of the retention index system including linear temperature programmed gas-liquid partition chromatography. J Chromatogr A. 11, 463-471 (1963).
- Stransky, K., Jursik, T., Vitek, A. Standard equivalent chain length values of monoenic and polyenic (methylene interrupted) fatty acids. J High Res Chromatogr. 20 (3), 143-158 (1997).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados