Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Identification des acides gras dans
Dans cet article
Résumé
We propose a protocol to identify fatty acids without the need to purify them. It combines information on the retention times with the mass spectra of three types of fatty acid derivatives: fatty acid methyl esters (FAMEs), 4,4-dimethyl oxazoline derivatives (DMOX), and 3-pyridylcarbinyl esters (picolinyl).
Résumé
Les espèces de Bacillus contiennent la chaîne et des acides gras insaturés (AF) ramifiés avec des positions diverses de la branche de méthyle (iso ou anteiso) et de la double liaison. Changements dans la composition FA jouent un rôle crucial dans l'adaptation des bactéries à leur environnement. Ces modifications entraînent un changement dans le rapport des iso contre anteiso ramifié AF, et la proportion de insaturée AF par rapport à saturé AF, avec des doubles liaisons créées à des positions spécifiques. L' identification précise du profil FA est nécessaire de comprendre les mécanismes d'adaptation des espèces de Bacillus.
Bon nombre des AF de Bacillus ne sont pas disponibles dans le commerce. La stratégie proposée ici identifie AC en combinant des informations sur le temps de rétention (par le calcul de la longueur de chaîne équivalente (ECL)) avec les spectres de masse des trois types de dérivés FA: des esters méthyliques d'acides gras (FAME), 4,4-diméthyl oxazoline dérivés (DMOX), etester 3-pyridylcarbinyl (picolinyle). Cette méthode permet d'identifier les AF sans la nécessité de purifier l'inconnu AF.
En comparant les profils chromatographiques de FAME préparé à partir de Bacillus cereus avec un mélange commercial de normes permet l'identification de chaîne droite saturée AF, le calcul de la ECL, et les hypothèses sur l'identité de l'autre AF. FAME de ramifiés saturés AF, iso ou anteiso, afficher un décalage négatif constant dans la ECL, contre linéaires saturés avec AF le même nombre de carbones. FAME de insaturée AF peuvent être détectés par la masse de leurs ions moléculaires, et se traduisent par un changement positif dans la ECL par rapport aux AF saturés correspondants.
La position de branchement des AF et la position de double liaison insaturée d'AF peuvent être identifiés par l'ionisation d'électrons spectres de masse des picolinyle et DMOX dérivés, respectivement. Cette approche identifie toutes les branches saturée inconnueed AF, insaturé linéaire AF et AF ramifiés insaturés de l'extrait B. cereus.
Introduction
l'acide gras Chromatographie ester méthylique (FAME) de gaz (GC) est une méthode essentielle pour la caractérisation des lipides. Il se sépare rapidement et quantifie les différents acides gras (AF) d'un échantillon après une courte étape d'extraction. Les produits dérivés d'esters méthyliques sont très volatils, stable et inerte vers la colonne chromatographique, ce qui évite des pics de résidus. Leur identification est assez simple lorsque l'échantillon est constitué d'AF bien connus parce que les profils chromatographiques sont soit publiés ou par rapport aux normes. En outre, l'injection répétée de normes d'étalonnage pour la quantification des différents AF est pas nécessaire, compte tenu de leur réponse presque constante à la détection à ionisation de flamme (FID) 1.
En plus de la FID, la spectrométrie de masse (MS) de détection fournit un ensemble complémentaire d'informations pour confirmer FAME. Toutefois, lorsque FAME sont facturés en utilisant l'ionisation électronique (EI), les spectres obtenus ne permettent pas toujours eidentification e de FA structure fine. Par exemple, la position de branchement (ie, un groupe méthyle ramifié) est difficile à prévoir parce que les ions de diagnostic sont difficiles à détecter 1 et le changement caractéristique de l'abondance des ions cible est dépendant de la machine, ce qui empêche l'utilisation de bibliothèques de spectres de masse 2. Un autre défi consiste à identifier la position de double liaison, car l'assurance-emploi provoque migration de la double liaison. Ainsi, les isomères FA avec diverses positions de doubles liaisons ne peuvent pas être différenciés par leurs spectres de masse. Heureusement, d'autres outils ont été développés pour l'identification FA. Par exemple, la présence et la position de ramification ou de doubles liaisons dans AF peuvent être conjecturé en calculant la longueur de chaîne équivalente (ECL) 3.
D'autres méthodes de dérivatisation se traduisent par des spectres de masse différente, en fonction de la localisation d'une double liaison ou d'un groupe méthyle ramifié. 4,4-diméthyl dérivés de l' oxazoline (DMOX) 4 permettent de easidentification y de la position de l'acide gras monoinsaturé doubles liaisons. 3-pyridylcarbinyl dérivés ester (ester de picolinyle) permettent d'identifier sans ambiguïté de l'emplacement de ramification méthyle AF 5. La combinaison de rétention chromatographique (ECL) et les spectres de masse (DMOX et picolinyle) l' information permet l'identification de la plupart des autorités fédérales , sans la nécessité d'utiliser des méthodes complexes de purification, tel que requis pour la résonance magnétique nucléaire (RMN), la méthode incontestable pour la caractérisation structurale 1 .
Les bactéries du genre Bacillus, qui comprennent certains agents pathogènes humains et animaux, sont capables de coloniser très diverses niches et sont donc largement distribués dans l'environnement 6. Parmi genre Bacillus, la composition FA est influencée par la niche écologique de l'espèce avec des modulations dans les modèles FA adapter à un large éventail de changements environnementaux (par exemple, le milieu de croissance, la température,pH, etc.) 7-9. En raison de la relative homogénéité du modèle FA entre les espèces du genre Bacillus au cours de la croissance dans des conditions normalisées, la détermination de la composition en acides gras est l' un des critères essentiels permettant de définir les espèces de Bacillus. Un attribut unique du genre Bacillus est l'abondance de Fas à chaîne ramifiée contenant 12-17 atomes de carbone 10-12 avec le rapport entre iso et Anteiso isomères étant un déterminant clé de l' adaptation aux conditions environnementales. Bacillus species adaptent également aux fluctuations environnementales en modifiant la proportion d'acides gras insaturés. Chez certaines espèces, telles que Bacillus cereus, deux désaturases d'acides gras et de créer des doubles liaisons dans des positions différentes de la chaîne alkyle 13 ayant des rôles différents dans l' adaptation 9. L'exemple du genre Bacillus illustre l'importance d'identifier précisément la position de double liaison et FA ramification. Collecteivement, l' identification des motifs Bacillus FA a plusieurs applications utiles. Ici, nous proposons une nouvelle approche GC-MS pour Bacillus FA identification de motif qui surmonte les limitations inhérentes à une analyse GC-MS classique.
Cette approche innovante peut être utilisée directement sur le matériel biologique brut, et se compose d'une combinaison de techniques existantes: des informations sur les temps de rétention (ECL) et les spectres de masse des différents dérivés (AF FAME, DMOX et picolinyle-ester).
Nous utilisons la nomenclature FA suivante. i, a et n indiquent iso, anteiso ramification méthyle, et de l'acide gras à chaîne droite, respectivement. AC insaturées ont été désignés par C: D où C est le nombre d'atomes de carbone dans l'acide gras et d est le nombre de doubles liaisons. Δ x indique la position de la double liaison, où la double liaison est située sur la liaison xième carbone-carbone, en comptant à partir de la fin de l' acide carboxylique.
Protocole
1. Cultures bactériennes
- Préparer une pelouse des bactéries (Bacillus cereus souche ATCC 14579) en étalant 100 ul d'une culture de nuit de la souche en incubation à 30 ° C dans du milieu LB (milieu Luria-Bertani), sur la surface d'une plaque de milieu LB gélose. Incuber la plaque pendant une nuit à 30 ° C.
2. ECL: chaîne Longueur équivalente
- Calculer ECL comme suit:
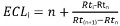 avec:
avec:
i, le soluté d'intérêt;
n, le nombre de carbone de l'ester méthylique de la chaîne d'acides gras saturés à chaîne droite en éluant avant soluté I;
n + 1, le nombre de carbone de l'ester méthylique saturé à chaîne d'acide gras linéaire en éluant après soluté I;
Rti, Ret, Tr (n + 1), les temps de rétention des pics de FAME décrits ci-dessus.
NOTE: Obtenir les temps de rétention des droites esters chaîne d'acides gras saturés de méthyle par injection d'un mélange de normes (BAME).
3. FAME Préparation et analyse
- Afin d'obtenir des acides gras des lipides, des cellules bactériennes récolte en grattant les colonies de la plaque d' agar et transférer 40 mg (poids frais, ce qui équivaut à 10 9 cellules viables) de bactéries dans un tube en verre de 10 ml avec des bouchons à vis et des joints d' étanchéité en PTFE.
- Effectuer une transestérification par l' intermédiaire de l'ester 14,15 procédé de liaison décrit ci - dessous.
- Ajouter 5 ml de KOH 0,2 M dans le methanol, les cellules bactériennes fraîches et incuber à 37 ° C pendant 1 heure. Cette réaction consiste en une méthanolyse alcaline, la rupture de la liaison ester dans le lipide et pour produire des esters méthyliques d'acides gras.
- Ajouter 1 ml d'acide acétique 1 M pour abaisser le pH à 7,0. Vérifier le pH avec des bandelettes de test de pH.
- Ajouter 3 ml d'hexane pour extraire FAME.
- Transférer le surnageant (phase organique) dans des tubes propres et on concentre par évaporation à température ambiante sous un courant continu d'azote pour obtenir environ 200 ulde l'extrait. Transférer l'échantillon dans un flacon de GC avec insert.
- Injecter extraits dans une chromatographie-spectrométrie de masse de gaz du système (GC-MS).
4. GC / MS Conditions
- Injecter les échantillons de FAME dans un appareil GC-MS équipé d'une ZB-WAX colonne capillaire (longueur 30 m, diamètre 0,25 mm, épaisseur du film 0,25 pm).
- Définir l'orifice d'injection (en mode splitless) de température à 250 ° C. Utiliser l'hélium comme gaz porteur, à une vitesse linéaire de 37 cm / s. Maintenir la température du four à 50 ° C pendant 1 min, augmenter à 190 ° C à une vitesse de 20 ° C / min, et encore augmenter pour atteindre une température finale de 230 ° C à une vitesse de 2 ° C / min.
- Pour les MS, enregistrer les spectres de masse par ionisation électronique (EI) à 70 eV, et définir l'acquisition du courant ionique total entre 50 et 400 unités atomiques de masse (uma) (2 scans / sec).
- Au besoin, injecter DMOX et picolinyle dérivés sous la même condition except le four programme de température comme suit:
DMOX: 50 ° C (1 min), 20 ° C / min jusqu'à 210 ° C et 2 ° C / min jusqu'à 240 ° C (5 min);
Picolinyle: 6 ° C (1 min), 20 ° C / min jusqu'à 220 ° C et 2 ° C / min jusqu'à 250 ° C (20 min).
5. picolinyle Ester Préparation à partir de FAME 16
- Evaporer l'extrait de FAME de la section 3 avec un flux d'azote (au moins 10 mg de matière sèche) et dissoudre dans 1 ml de dichlorométhane sec.
- Préparer une solution à 1,0 M de potassium ter t-butoxyde dans du tétrahydrofuranne.
- Ajouter l'extrait de FAME et 0,2 ml 3-pyridineméthanol à 0,1 ml de solution faites à l'étape 5.2.
- Chauffer la solution à 40 ° C pendant 30 min dans un flacon fermé.
- Après refroidissement à température ambiante, on ajoute de l' eau déionisée purifiée (2 ml, voir le tableau des matériaux) et de l' hexane (4 ml). Mélanger avec un vortex, permet de séparer la phase, et de recueillir la phase organique.
- Dry en ajoutant du sulfate de sodium anhydre jusqu'à ce que la phase organique est parfaitement claire. Transférer dans un tube propre. Ensuite, on évapore à 200 pi. Transférer l'échantillon dans un flacon de GC avec insert.
6. DMOX Préparation à partir de FAME 17
- Evaporer l'extrait de FAME de la section 3 avec un flux d'azote (matière sèche d'au moins 10 mg).
- L'extrait sec FAME, ajouter 250 mg de 2-amino-2-méthyl-1-propanol. Rincer le récipient avec de l'azote, ajouter un bouchon, et le placer dans un bloc chauffant pendant une nuit à 190 ° C.
- Après refroidissement à température ambiante, ajouter 3 ml de dichlorométhane au tube, et 5 ml d' eau purifiée déminéralisée (voir le tableau Materials).
- Agiter pour la séparation de phase, puis retirer la phase aqueuse.
- Laver la phase organique avec 5 de l'eau. Agiter pour la séparation de phase, puis retirer la phase aqueuse.
- Sec en ajoutant du sulfate de sodium anhydre jusqu'à ce que la phase organique est parfaitement claire etle transférer dans un tube propre. S'évaporer sous un courant d'azote jusqu'à atteindre un volume de 200 ul. Transférer l'échantillon dans un flacon de GC avec insert.
Résultats
La stratégie d'identification des cellules bactériennes FA est présenté sur la figure 1. Chaque étape fournit des informations ou des informations sur la rétention chromatographique spectrale complémentaire. L'étape 1 consiste d'identification FA préliminaire en utilisant une solution standard. Étape 2 permet l'interprétation des spectres EI FAME et de leur ECL, afin d'identifier provisoirement les produits. Étape 3 identifie l'emplace...
Discussion
Les profils chromatographiques FAs présentés dans le tableau 1 correspondent à B. cereus ATCC 14579 cultivée sur une surface de la plaque de gélose. Des profils similaires ont été obtenus lorsque la bactérie a été cultivée dans un milieu liquide aéré à la même température 8. Dans le cas des bactéries cultivées en milieu liquide, la biomasse bactérienne est recueillie par centrifugation du milieu de croissance et peut être lavée selon des protocoles décrits préc...
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
Les auteurs sont reconnaissants à Thomas Mison pour son soutien technique, et de Rachel Kopec pour la révision du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| GC/MS | Shimadzu | QP2010 | |
| capillary column ZB WAX | Phenomenex | 7HG-G007-11 | 30 m x 0.25 mm x 0.25 µm |
| Methanol Lichrosolv | VWR | 1.06018.2500 | |
| potassium hydroxide | Aldrich | P1767 | |
| THF | Hipersolv Chromanorm | 28559.320 | |
| Dichloromethane | Hipersolv Chromanorm | 23373.320 | |
| Hexane | Hipersolv Chromanorm | 24575.320 | |
| 3-pyridinemethanol | Aldrich | P6-680-7 | |
| potassium tertiobutoxide | Aldrich | 156671 | |
| 2-amino-2-methyl-1-propanol | A-9879 | ||
| MilliQ Academic | Millipore | ZMQS50001 | |
| Bacterial Acid Methyl Ester (BAME) Mix | Sigma-Aldrich | 47080-U Supelco |
Références
- Christie, W. W., Han, X. . Lipid Analysis 4th Edition. , (2010).
- HÜbschmann, H. -. J. . Handbook of GC-MS: fundamental and application. Third edition. , (2015).
- Sasser, M. Identification of Bacteria by Gas Chromatography of Cellular Fatty Acids. MIDI Technical note. 101, 1-6 (1990).
- Spitzer, V. Structure analysis of fatty acids by gas chromatography - Low resolution electron impact mass spectrometry of their 4,4-dimethyloxazoline derivatives - A review. Prog Lipid Res. 35 (4), 387-408 (1996).
- Harvey, D. J., Christie, W. W. . Advances in lipid methodology. Volume 1. , 19-80 (1992).
- Diomande, S. E., Nguyen-The, C., Guinebretière, M. -. H., Broussolle, V., Brillard, J. Role of fatty acids in Bacillus environmental adaptation. Front Microbiol. 6, (2015).
- Brillard, J., et al. Identification of Bacillus cereus Genes Specifically Expressed during Growth at Low Temperatures. Appl Environ Microbiol. 76 (8), 2562-2573 (2010).
- de Sarrau, B., et al. Influence of Anaerobiosis and Low Temperature on Bacillus cereus Growth, Metabolism, and Membrane Properties. Appl Environ Microbiol. 78 (6), 1715-1723 (2012).
- Diomandé, S. E., et al. Involvement of the CasK/R two-component system in optimal unsaturation of the Bacillus cereus fatty acids during low-temperature growth. Int J Food Microbiol. 213, 110-117 (2015).
- Berkeley, R. C. W., Heyndrickx, M., Logan, N., De Vos, P., Berkeley, R. C. W. . Applications and Systematics of Bacillus and Relatives. , 1-7 (2002).
- Kämpfer, P. Limits and Possibilities of Total Fatty Acid Analysis for Classification and Identification of Bacillus Species. System. Appl. Microbiol. 17 (1), 86-98 (1994).
- Kaneda, T. Fatty-acids of genus bacillus - example of branched-chain preference. Bacteriol Rev. 41 (2), 391-418 (1977).
- Chazarreta Cifre, L., Alemany, M., de Mendoza, D., Altabe, S. Exploring the Biosynthesis of Unsaturated Fatty Acids in Bacillus cereus ATCC 14579 and Functional Characterization of Novel Acyl-Lipid Desaturases. Appl Environ Microbiol. 79 (20), 6271-6279 (2013).
- Sasser, M., et al. Identification of Bacillus anthracis from culture using gas chromatographic analysis of fatty acid methyl esters. J AOAC Int. 88 (1), 178-181 (2005).
- Schutter, M. E., Dick, R. P. Comparison of fatty acid methyl ester (FAME) methods for characterizing microbial communities. Soil Sci Soc Am J. 64 (5), 1659-1668 (2000).
- Destaillats, F., Angers, P. One-step methodology for the synthesis of FA picolinyl esters from intact lipids. J Am Oil Chem Soc. 79 (3), 253-256 (2002).
- Fay, L., Richli, U. Location of double-bonds in polyunsaturated fatty-acids by gas-chromatography mass-spectrometry after 4,4-dimethyloxazoline derivatization. J Chromatogr. 541 (1-2), 89-98 (1991).
- Zhang, J. Y., Yu, Q. T., Liu, B. N., Huang, Z. H. Chemical modification in mass spectrometry IV-2-alkenyl-4,4-dimethyloxazolines as derivatives for the double bond location of long-chain olefinic acids. Biol Mass Spect. 15 (1), 33-44 (1988).
- de Sarrau, B., et al. Unsaturated fatty acids from food and in the growth medium improve growth of Bacillus cereus under cold and anaerobic conditions. Food Microbiol. 36 (2), 113-122 (2013).
- Miwa, T. K., Mikolajczak, K. L., Earle, F. R., Wolff, I. A. Gas chromatographic characterization of fatty acids.Identification constants for mono- and dicarboxylic methyl esters. Anal Chem. 32 (13), 1739-1742 (1960).
- van Den Dool, H., Kratz, P. A generalization of the retention index system including linear temperature programmed gas-liquid partition chromatography. J Chromatogr A. 11, 463-471 (1963).
- Stransky, K., Jursik, T., Vitek, A. Standard equivalent chain length values of monoenic and polyenic (methylene interrupted) fatty acids. J High Res Chromatogr. 20 (3), 143-158 (1997).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon